1 UNIVERSITE DE PICADIE JULES VERNE
FACULTE DE MEDECINE 2017
THESE POUR LE DIPLOME D’ETAT
DE DOCTEUR EN MEDECINE
L’intensité du signal T2 à l’IRM initiale :
marqueur d’agressivité des macroprolactinomes ?
N° 2017 -112
Endocrinologie, diabétologie, maladies métaboliques
Présentée et soutenue publiquement le 02/10/2017 A la salle des thèses
Par Ornella RAAD
_______________
JURY
Président :
Monsieur le Professeur Jean-Daniel LALAU Assesseurs :
Monsieur le Professeur Hervé DERAMOND Monsieur le Professeur Patrick TOUSSAINT Madame le Docteur Hélène VREL
Directeur de Thèse :
2
Monsieur le Professeur Jean-Daniel LALAU
Professeur des Universités-Praticien Hospitalier (Nutrition)
Chef du Service Endocrinologie, maladies métaboliques et nutrition
Pôle "Médico-chirurgical digestif, rénal, infectieux, médecine interne et endocrinologie" (D.R.I.M.E)
Vous me faites l’honneur de présider mon jury de thèse.
Je vous remercie de m’avoir accueillie au sein de votre service et pour l’attention que vous m’avez accordée durant ces années d’internat.
3
Monsieur le Professeur Hervé DERAMOND
Professeur des Universités-Praticien Hospitalier (Radiologie et imagerie médicale)
Chevalier dans l’Ordre des Palmes Académiques
C’est pour moi un grand honneur que vous ayez accepté de juger ce travail. Je vous remercie pour les conseils que vous m’avez prodigués.
4
Monsieur le Professeur Patrick TOUSSAINT
Professeur des Universités-Praticien Hospitalier (Neurochirurgie)
Vous me faites l’honneur de siéger à mon jury de thèse et de juger mon travail. Recevez mes plus sincères remerciements et ma profonde gratitude.
5
Madame le Professeur Rachel DESAILLOUD
Professeur des Universités-Praticien Hospitalier
(Endocrinologie, Diabétologie et Maladies Métaboliques)
Je vous remercie de m’avoir proposé ce sujet de thèse, qui a permis de renforcer les liens existant entre l’endocrinologie et la radiologie.
Merci de m’avoir enseigné l’endocrinologie, et ce toujours avec patience et dans la bonne humeur.
6
Madame le Docteur Hélène VREL
Chef de clinique des universités
(Endocrinologie, Diabétologie et Maladies Métaboliques)
Je te remercie d’avoir accepté de juger ce travail.
Je te suis reconnaissante d’avoir été une chef de clinique proche de tes internes, à l’écoute et d’une grande patience.
7
A ma famille
- A ma chère maman qui m’a encouragée et accompagnée dans toutes les étapes qui m’ont menée jusqu’à ce jour J. Tu as toujours su trouver les mots réconfortants dans les moments de doute. Je ne te remercierai jamais assez pour ton soutien, ton oreille attentive et pour tout l’amour que tu me donnes. Si je suis ici aujourd’hui c’est grâce à toi.
- A mon cher papa qui a toujours une solution ingénieuse en cas de problème. Merci pour tes conseils précieux (« règles d’or ») et ton soutien indéfectible. Je ne serais pas parvenue jusqu’ici aujourd’hui sans toi.
- A mon frère aîné (d’une petite année) Jalal : je suis fière de ce que tu es devenu, un homme plein de charisme et de convictions, et de plus un professeur apprécié de tous ses élèves. Merci de m’avoir encouragée durant toutes ses années.
- A mon petit frère Naji : notre second radiologue dans la famille ! La force tranquille et tellement bienveillant. Je suis si fière de toi. Merci pour ton soutien.
- A nonno et nonna : vous êtes des grands-parents en or. Je vous suis reconnaissante pour tout ce que vous avez fait pour moi depuis ma plus tendre enfance.
- A tonton Rocco, tata Sandrine, tata Vincente, tonton Olivier : merci pour les moments de joie partagés et pour avoir toujours pris soin de moi.
- A François, Anthony, Laura, Enzo, Rocco, Oriana : merci pour tous les souvenirs joyeux d’enfance que je partage avec chacun d’entre vous.
- A Mehdi : merci de m’avoir soutenue lors de mon tout premier stage d’interne - A mes nombreux oncles et tantes et cousins et cousines du Liban et d’Italie : j’ai de la
chance d’avoir une famille si grande et unie. Merci pour tous les beaux moments passés ensemble, et les souvenirs mémorables que vous m’avez laissés. Vous me manquez.
- A mes beaux-parents (Claudie et Bruno), ma belle-sœur Anaël, mon beau-frère Jean-François et ma nièce Laure : merci de m’avoir si gentiment accepté dans votre superbe famille et pour tous les instants de bonheur partagés.
- A Ayman et Catherine : vous m’avez vu grandir ! je me souviens très bien, quand j’étais plus jeune, des journées tant attendues à venir vous rendre visite sur Amiens. Vous faites partie de la famille
- A Teta, à Jeddo, à Hamoudi, à Mahdi : j’ai une pensée émue pour vous. Vous êtes dans ma mémoire et mon cœur.
8
A Raphaël
Après avoir survécu à notre première année de médecine ensemble, puis passé les ECN ensemble, cette fois je t’ai devancé d’une courte tête pour la thèse ! Seulement c’est toujours ensemble que nous avons passé cette étape. Merci pour tout ce temps que tu m’as consacré (et en particulier devant une console de radio) ! Sans toi cette thèse n’aurait pas été possible. Je mesure chaque jour la chance que j’ai d’être avec toi. Je t’aime.
A mes chefs et collègues
- Mesdames les docteurs Agnès Vaidie, Marie Saraval, Salha Fendri : merci pour vos enseignements de qualité, votre disponibilité et votre bienveillance. Les internes ont de la chance de vous avoir auprès d’eux dans le service d’endocrinologie.
- Mesdames les docteurs Iléana De Lameth, Mathilde Coppin et Hélène Vrel : vous avez été des supers chefs, merci pour vos partages de connaissance et votre bonne humeur.
- Aux médecins qui m’ont formée tout au long de mon parcours d’interne, en vous remerciant pour tout ce que vous m’avez enseigné : Dr Haddad, Dr Chiah, Dr Hourdin, Dr Cimino, Dr Anne-Lyse Gugenheim, Dr Amel Marouf, Dr Jaureguy Maïte, Dr Caroline Lecaque, Dr Xiaoli Xu, Dr Eleonore Desert, Dr Coralie Poulain, Dr Claire Presne, Dr Makdassi, Dr Heyman
- A l’équipe d’endocrinologie du CHU d’Amiens : d’HDJ (Jocelyne et Christine), d’hospitalisation (avec une attention particulière pour Nathalie, Corinne et Karine qui ont soigneusement mis de côté pour mon travail de thèse les IRM que je recevais des patients), de pansement (Annick et Nathalie) et de consultation : merci pour ces semestres passés à travailler à vos côtés dans une ambiance chaleureuse.
- A l’équipe de réadaptation cardiaque et de SSR nutritionnel de Corbie et à l’équipe d’endocrinologie du CH de Saint Quentin : merci pour l’accueil que vous m’avez réservé durant ces semestres passés dans vos services.
- A l’équipe de cardiologie d’Abbeville : un grand merci en particulier aux IDE et secrétaires pour m’avoir guidée et aidée lors de mes débuts en tant qu’interne
- A mes cointernes mais aussi amis, d’endocrinologie, de néphrologie ou d’ailleurs : Marine (ma chère binôme), Camille (ma gynéco préférée), Amina, Soumaya, Angie, Franklin, Julie, Nacera, Noémie, Imane, Thomas, Inès, Anne-Charlotte, Guillaume,
9 Victor, Harmony, Justine, Clémence, Aline, Alexis, Pauline, Gauthier, Hélène. Vous êtes extras, ça a été un plaisir de travailler avec vous tous !
A mes amis
- Maryam, je te remercie encore mille fois pour toute l’aide que tu m’as apportée durant ce travail de thèse. Tu as quand même réussi à m’apprendre à faire des statistiques en un temps record ! Merci pour ta relecture et tes très nombreux conseils. Ce travail de thèse n’en serait pas là sans toi. Tu es si brillante et généreuse ! Je suis plus que chanceuse de te compter parmi mes amis.
- Mathilde, mon chou, tu es une amie, une vraie ! sincère, entière et sur qui on peut compter. Merci pour ton grain de folie, ta bienveillance et tes conseils durant ce travail de thèse.
- Jérémie, merci d’avoir trouvé un long créneau pour moi (dans ton agenda) pour la relecture assidue de ma thèse. Tu es quelqu’un de foncièrement humain ! (PS : vivement la cueillette des champignons)
- Justine, ma plus ancienne amie et confidente. J’aimerais pouvoir te voir plus souvent ! - Aux amis du lycée : Bruch, Valentin, Cyril, Coralie, Romain, Guillaume, Thibaut,
Minimoi, Adrien, Nicolas. J’ai grandi et partagé tant de rires et de moments de joie avec vous. Vous êtes pour la plupart maintenant aux quatre coins du globe ou pour certains aux quatre coins de la France. Nos retrouvailles sont chaque fois des moments de pur bonheur ! Vous me manquez !
- Aux amis de l’après-lycée et aux amis de l’après-fac : Thomas, Sharon, Antoine, Martine, Chdel, Amaury, François, Victor, J-C, Pierre Rose, Anthony, Lina, Jiji, Elodie, Guillaume, Mathieu. Je n’ai malheureusement pas assez de place pour vous dire tour à tour à quel point vous comptez pour moi ! Je ne détaillerai pas non plus tous les moments de folie passés ensemble, et vous savez déjà à quel point je vous aime !
- Aux collègues de Raphaël : Riyad, Le joker, Kevin, Francis, Elodie, Héloïse, Arnaud, Sophie, Rani, Aurélien, avec qui j’ai le plaisir de passer des soirées endiablées.
10
Résumé
Introduction : Des études récentes ont démontré que l’intensité du signal T2 des adénomes
somatotropes était corrélée à leur réponse thérapeutique sur le plan hormonal et tumoral. En faisant un parallèle avec ces données de la littérature, notre étude a analysé les caractéristiques initiales clinico-biologiques et à l’IRM des macroprolactinomes et leur réponse thérapeutique en fonction de l’intensité du signal T2 initial.
Méthodes : L’intensité du signal T2 à l’IRM a été définie par la méthode de Heck en
mesurant le signal au sein de la tumeur, de la substance grise et de la substance blanche temporale. Le volume tumoral total et corrigé après soustraction des portions non tissulaires, le taux de prolactine et l’invasion des structures adjacentes par la tumeur au diagnostic et durant un suivi variant de 3 à 18 mois ont été relevés.
Résultats : Vingt-six patients atteints de macroprolactinome ont été inclus dans cette étude
rétrospective. 7,7% des patients étaient classés dans le groupe hyposignal T2, 26,9% dans le groupe isosignal T2, et 65,4% dans le groupe hypersignal T2. La réduction du volume tumoral corrigé à la fin du suivi ne différait pas significativement dans le groupe iso/hyposignal T2 par rapport au groupe hypersignal T2 (62% (IQR=44,1) vs 38,1% (IQR=43), p=0,36). La réduction du taux de prolactine était similaire entre les deux groupes (96,7% (10,7) vs 97,5% (7,15), p=0,71). Les macroprolactinomes en hypersignal T2 tendaient à être des tumeurs plus envahissantes au niveau des sinus caverneux et sphénoïdaux (11,1% versus 41,2%, p=0,19 dans les deux cas).
Conclusion : Les macroprolactinomes en hypersignal T2 tendaient de façon non significative
à être plus invasifs que ceux en iso/hyposignal T2. Un lien significatif n’a pas pu être établi entre intensité du signal T2 et réponse tumorale ou hormonale. L’hétérogénéité et la présence de portions nécrotico-kystiques et hémorragiques de ces adénomes représentent un frein à l’analyse de l’intensité de leur signal T2.
Mots-clés : Adénome hypophysaire, Prolactinome, Imagerie par résonance magnétique, IRM, Intensité du signal T2, Agonistes dopaminergiques
11
Table des matières
Résumé ... 10
Table des matières ... 11
Table des illustrations ... 12
1. Introduction ... 14 1.1. Généralités ... 14 1.2. Contexte ... 17 1.3. Objectifs de l’étude ... 19 2. Patient et Méthodes ... 19 2.1. Population d’étude ... 19 2.2. Données recueillies ... 20 2.3. Mesures en imagerie ... 21 2.4. Paramètres étudiés ... 23 2.5. Analyse statistique ... 24 3. Résultats ... 24
3.1. Caractéristiques initiales de la population ... 25
3.2. Caractéristiques initiales de la population selon l’intensité du signal T2 évaluée par la méthode de Heck ... 29
3.3. Réponse hormonale et tumorale selon l’intensité du signal T2 évaluée par la méthode de Heck ... 31
3.4. Caractéristiques initiales à l’imagerie et réponse hormonale et tumorale selon l’intensité du signal T2 évaluée par la méthode de rapport ... 33
3.5. Corrélation entre ratio du signal T2 « adénome (ROI 1) / substance grise (ROI 3) » et réponse au traitement ... 34
3.6. Caractéristiques des patients en fonction de leur degré de réponse au traitement ... 34 4. Discussion ... 37 5. Conclusion ... 43 Références bibliographiques ... 44 Annexes ... 48
12
Table des illustrations
Figures
Figure 1 - Positionnement des ROI sur une IRM hypophysaire ... 22 Figure 2 - Volume 3D tumoral obtenu après contourage du macroprolactinome ... 22 Figure 3 - Diagramme de flux ... 25 Figure 4 - Répartition des patients selon l’intensité du signal T2 par la méthode de Heck
... 25 Figure 5 - Corrélation entre le volume corrigé initial et le taux de prolactine initiale .... 28
Tableaux
Tableau 1 - Caractéristiques cliniques et biologiques initiales des patients ... 27 Tableau 2 - Caractéristiques radiologiques initiales des patients ... 28 Tableau 3 - Traitement initial et données histologiques des patients ... 29 Tableau 4 - Caractéristiques clinico-biologiques des patients au diagnostic de
macroprolactinome selon l’intensité du signal T2 à l’IRM initiale évaluée par la méthode de Heck ... 30 Tableau 5 - Caractéristiques radiologiques, histologiques et génétiques des patients au
diagnostic de macroprolactinome selon l’intensité du signal T2 à l’IRM initiale évaluée par la méthode de Heck ... 31 Tableau 6 - Réponse hormonale et tumorale selon l’intensité du signal T2 à l’IRM
initiale évaluée par la méthode de Heck ... 33 Tableau 7 - Caractéristiques tumorales initiales et réponse hormonale et tumorale selon
l’intensité du signal T2 à l’IRM initiale évaluée par méthode de rapport ... 34 Tableau 8 - Caractéristiques des patients en fonction de leur niveau de réponse au
13
Glossaire et abréviations
ACTH : Hormone adrénocorticotrope
AIP : Aryl hydrocarbon receptor Interacting Protein CHU : Centre Hospitalier Universitaire
FIPA : Familial Isolated Pituitary Adenomas FSH : Hormone folliculo-stimulante
GH : Hormone de croissance
IGF-1 : Insulin-like growth factor-1 IQR : Interquartile range
IRM : Imagerie par Résonance Magnétique LH : Hormone lutéinisante
OMS : Organisation Mondiale de la Santé
PACS : Picture Archiving and Communication System PRL : Prolactine
ROI : Region of Interest
14
1. Introduction
GénéralitésLes tumeurs hypophysaires représentent 14% des tumeurs cérébrales d’après les registres cancérologiques des Etats-Unis 1, ce qui en fait la 3ème tumeur la plus fréquente après les méningiomes et les gliomes. L’adénome hypophysaire, longtemps considéré comme une pathologie rare, a vu sa prévalence augmenter au cours de ces dix dernières années. Elle est évaluée à environ 1/1000 habitants dans les plus récentes études cliniques belges et anglaises 2,3, avec une incidence de 4/100 000 habitants/an 4. Ce chiffre s’élève encore dans les séries autopsiques et radiologiques, estimé respectivement à 14,4% et 22,5% dans la méta-analyse de Ezzat en 2004 5 ; s’expliquant en partie par la détection de picoadénomes sans traduction clinique. Parmi les adénomes hypophysaires, environ 40% mesurent plus d’un centimètre de plus large diamètre 2,3,4,6. La prévalence de ces macroadénomes est ainsi chiffrée à 0,4/1000 dans l’étude clinique belge de Daly 2 confirmée par Gruppetta 6, et entre 0,16 7,8 et 0,3 % 9 dans les études de recherche d’incidentalomes à l’imagerie par résonance magnétique (IRM).
Les tumeurs hypophysaires sont majoritairement bénignes, les tumeurs agressives étant rares et les carcinomes, définis par la présence de métastases, exceptionnels. Ces derniers représentent moins de 0,5% des tumeurs hypophysaires 10,11.
La genèse des adénomes hypophysaires aurait lieu en 2 étapes : une étape d’initiation secondaire à des modifications génétiques et épigénétiques héréditaires ou acquises, puis une étape de promotion liée à des changements génétiques, des facteurs de croissance, hormonaux et environnementaux, entraînant l’expansion monoclonale d’une cellule modifiée 12.
Les tumeurs agressives ou carcinomes hypophysaires se développeraient à partir d’adénomes bénins, secondairement à de nouvelles modifications génétiques et épigénétiques. La plupart des carcinomes sont fonctionnels et sécrètent majoritairement de la prolactine (PRL) et de l’hormone adrénocorticotrope (ACTH) 13.
La singularité de ces tumeurs considérées dans leur majorité comme bénignes, réside pour un nombre non négligeable d’entre elles, dans leur potentiel à devenir hautement invasives, engageant à la fois le pronostic vital et fonctionnel en infiltrant les structures adjacentes. Les risques de complications sont alors nombreux : hypopituitarisme, compression des voies optiques, infiltration des sinus caverneux, compression des nerfs crâniens, hypertension intracrânienne, brèche méningée.
15 Les adénomes hypophysaires sont sporadiques dans 95% des cas 14. Dans certains cas, ils s’intègrent dans des syndromes endocriniens de survenue sporadique ou familiale, ce sont : la néoplasie endocrinienne multiple de type 1, le complexe de Carney et le syndrome congénital de Mac Cune Albright. Les mutations génétiques MEN1, PRKAR1A, CDKN1B sont respectivement associées à chacun de ces syndromes. D’autres adénomes hypophysaires familiaux sont isolés et sont regroupés sous le terme anglais « Familial Isolated Pituitary Adenomas » (FIPA). Pour ces derniers, une mutation du gène AIP (Aryl hydrocarbon receptor Interacting Protein) est retrouvée dans 15% des cas 15. La mutation AIP est également observée chez 4% des adénomes sporadiques. Les adénomes sont alors majoritairement des prolactinomes, plus agressifs, et survenant chez des patients plus jeunes 16.
De nombreux auteurs se sont attelés à classer ces adénomes en fonction de leurs caractéristiques cliniques, radiologiques ou histologiques. Les plus employées de ces classifications sont les suivantes :
- la classification radiologique de Hardy différenciant les adénomes enclos de moins et plus d’1 cm (grade I et II respectivement), des adénomes invasifs localisés et diffus (grade III et IV respectivement), et spécifiant leur caractère symétrique ou non.
- la classification clinique, immunohistochimique et histologique de l’Organisation mondiale de la santé (OMS) en 2004, distinguant les adénomes fonctionnels et non fonctionnels, et en fonction de leur sécrétion les adénomes à prolactine (PRL), hormone de croissance (GH), hormone adrénocorticotrope (ACTH), hormone folliculo-stimulante (FSH) / hormone lutéinisante (LH), hormone thyréostimulante (TSH). L’histologie différencie les adénomes à PRL et à GH à granularité faible ou dense, mais aussi les adénomes mammosomatotropes, à cellules souches acidophiles, mixtes somatolactotropes et pluri-hormonaux.
- la classification clinico-radio-histologique de Trouillas 17 (Annexe 1) rangeant les adénomes selon leur taille tumorale à l’IRM (micro < 1 cm, macro entre 1 et 4 cm, et géant > 4 cm), selon leur type sécrétoire à l’immunohistochimie (PRL, GH, ACTH, FSH/LH, TSH) et en grade tumoral selon leur caractère invasif (invasion des sinus caverneux ou sphénoïdaux radiologique ou histologique) et prolifératif (marqueurs de prolifération histologiques).
Les prolactinomes sont les plus courants des adénomes hypophysaires, comptant pour la moitié 3,4 à deux tiers 2 de ces tumeurs selon les études, avec une prévalence de 0,66/1000 2.
16 Les microprolactinomes représentent 70 à 80% des adénomes à prolactine 2,3,4, et en l’absence de traitement seuls 5 à 10% de ceux-ci progresseront en taille 18.
Les prolactinomes touchent plus souvent la femme avec un sex-ratio allant de 4 à 8 dans les études épidémiologiques les plus récentes 2,3,4. Cependant, chez 45 à 75% des hommes atteints de prolactinome, la tumeur mesure plus d’un centimètre de grand axe 2,4.
La gravité de ces tumeurs dépend principalement de leur taille ; les microprolactinomes posant quasi exclusivement un problème endocrinien avec le risque de développer une insuffisance gonadotrope fonctionnelle. Les macroprolactinomes, quant à eux, tendent à se compliquer par envahissement des structures voisines, comme décrit précédemment.
Le traitement en première intention des prolactinomes repose sur l’utilisation des agonistes dopaminergiques 19, et ce quelle que soit leur taille 20,21. La réponse hormonale au traitement médical est néanmoins meilleure pour les tumeurs de moins d’un centimètre de grand axe 22,23.
Parmi les agonistes dopaminergiques, la cabergoline s’est imposée comme le traitement de choix, de par sa grande efficacité, par rapport à la bromocriptine 24,25 et au quinagolide 26,27, avec un effet dose-dépendant 28,29. La cabergoline reste également le traitement à privilégier en cas d’administration d’autres agonistes dopaminergiques après échec thérapeutique de ceux-ci. Son efficacité serait néanmoins supérieure si le patient est naïf de tout traitement 30. Outre sa grande efficacité, l’autre avantage de la cabergoline est la plus faible survenue d’effets secondaires. L’arrêt du traitement pour intolérance survient chez moins de 5% des patients 22,24,31.
La problématique du traitement de ces adénomes par les agonistes dopaminergiques repose sur la nécessité d’une prise au très long cours, voire à vie. Cependant, l’étude récente de Colao et al., a examiné la possibilité d’un arrêt de la cabergoline pour les prolactinomes en rémission biologique et radiologique, après une durée de traitement en moyenne de 42 mois. Dans ce cas, une récidive de l’hyperprolactinémie, dans les 2 à 5 années de suivi, était retrouvée chez 32,6 % des microadénomes et 43,3 % des macroadénomes, sans aucune croissance tumorale 32.
Bien que les agonistes dopaminergiques occupent une place prépondérante dans le traitement des prolactinomes, la chirurgie n’en reste pas moins indispensable dans certains cas. Les patients peuvent avoir recours à la chirurgie en cas d’intolérance ou de résistance aux agonistes dopaminergiques, d’absence d’amélioration de déficits visuels, d’apoplexie et de
17 macroprolactinomes kystiques avec signes neurologiques, ces derniers étant peu sensibles au traitement par agonistes dopaminergiques 19.
La chirurgie des microprolactinomes entraîne une normalisation de la prolactine dans près de 75% des cas en post-opératoire 19, avec cependant des taux de récidive importants dans les 3 premières années de suivi 33,34. Pourtant, dans l’étude de Thomson et al. publiée en 2002, alors que 20% des récidives d’hyperprolactinémie sont survenues durant les premières années de suivi post-opératoire, seuls 4,5% des patients présentaient une hyperprolactinémie persistante après 20 ans de suivi 35.
La chirurgie de « debulking » ou chirurgie de réduction tumorale est à envisager pour les patients avec macroprolactinomes invasifs, résistants ou intolérants au traitement médicamenteux, à visée non pas curative, mais afin de permettre un meilleur contrôle sur le plan tumoral et sécrétoire, ce qui est obtenu pour une proportion d’environ 30% des macroprolactinomes opérés 36,37,38.
Le recours à la radiothérapie (radiothérapie stéréotaxique et radiochirurgie) est souvent limité aux tumeurs agressives ou résistantes au traitement classique et aux rares carcinomes. Les études disponibles sur le sujet sont de faible niveau de preuve, et font état d’un contrôle tumoral après radiothérapie pour plus de 90% des prolactinomes, avec un suivi moyen allant de 37,4 à 75 mois 39. Ses risques ne sont pas négligeables : hypopituitarisme, troubles visuels, radionécrose, tumeurs secondaires et accidents vasculaires cérébraux. Son efficacité reste discutée : une étude rétrospective de 684 patients atteints d’un adénome hypophysaire traités par chirurgie initiale entre 1982 et 1996 et comprenant 33% de patients ayant bénéficié de radiothérapie, n’a pas montré d’efficacité de la radiothérapie sur les prolactinomes 40.
Dans les données plus récentes, le temozolomide, agent alkylant antinéoplasique utilisé pour les glioblastomes, a fait ses preuves dans le traitement des adénomes agressifs et des carcinomes hypophysaires 41,42,43 classiquement résistants au traitement conventionnel, avec une réponse tumorale pour près de 40% d’entre eux 44, prolongeant ainsi la survie.
Contexte
Le problème des prolactinomes résistants à la cabergoline, définis par le recours à des doses de cabergoline supérieures à 1,5-2 mg/semaine 36,45, se pose en pratique courante car il n’existe pas de marqueur spécifique pour les identifier. La résistance au traitement serait plus
18 fréquente chez les hommes et en cas d’invasion du sinus caverneux 45. Parmi ces tumeurs résistantes, le risque d’évolution vers une tumeur agressive voire vers un carcinome est plus élevé, évalué respectivement à 4,3 et 3,3% dans l’étude de Vroonen et al. 36.
Les tumeurs agressives sont à différencier des tumeurs invasives. Le caractère invasif d’une tumeur est défini par l’envahissement du sinus caverneux ou sphénoïdal décelable par le radiologue, chirurgien ou anatomopathologiste. L’agressivité d’une tumeur est clinique, correspondant à une tumeur à croissance rapide, résistant aux traitements médicaux, récidivant précocement en l’absence de résidu tumoral post-chirurgical, ou avec récidives multiples 46. Cette définition implique un suivi du patient et ne permet de qualifier une tumeur d’agressive qu’à posteriori.
La classification des tumeurs hypophysaires en grade tumoral, proposée par Trouillas et al. en 2013, repose sur l’identification des marqueurs pronostiques que sont la taille tumorale, l’invasion des sinus caverneux (définie par le grade de Knosp 47 (Annexe 2)) et du sinus sphénoïdal, et les marqueurs de prolifération (nombre de mitoses, index Ki67 > 3%, expression de p53). La valeur pronostique de cette classification a été validée par une étude récente. Les tumeurs de grade 2b ont une probabilité augmentée d’un facteur 12 de progression ou de récidive tumorale, comparativement aux tumeurs de grade 1a 17.
Si l’identification des marqueurs de prolifération histologiques est importante dans cette classification, elle n’est pas toujours possible. Pour les prolactinomes en particulier, le traitement de première intention étant médical, il sera impossible de recourir à ces marqueurs pronostiques histologiques au début de la prise en charge, empêchant ainsi d’isoler les tumeurs de mauvais pronostic. L’enjeu est donc d’identifier d’autres marqueurs clinico-biologiques ou d’imagerie afin d’améliorer leur prise en charge dès le diagnostic établi. Durant ces dernières années, un marqueur radiologique prédictif de la réponse thérapeutique a été mis en évidence pour les adénomes somatotropes. L’étude de Hagiwara et al., a constaté que les adénomes à GH étaient plus souvent hypointenses en signal T2 que les autres adénomes hypophysaires. En effet, 40% des adénomes somatotropes étaient hypointenses en T2 et correspondaient quasi exclusivement à des adénomes à forte densité granulaire sur le plan histologique 48. Par la suite, l’étude de Potorac a démontré que les adénomes à GH hypointenses en T2 étaient plus sécrétants, plus petits et envahissaient moins les sinus caverneux ou le chiasma optique que les adénomes iso ou hyperintenses en T2 49. La relation entre l'intensité du signal T2 et la réponse au traitement par analogues de la somatostatine a été initialement étudiée dans une série de patients acromégales non guéris par
19 la chirurgie 50. Les adénomes hypointenses en T2 présentaient une meilleure réponse hormonale, avec une normalisation des taux d’ « insulin-like growth factor-1 » (IGF-1) dans 62% des cas à 1 an, contre 20% pour les adénomes hyperintenses en T2. Cette meilleure réponse hormonale a été confirmée dans d’autres études, qui ont de plus constaté une réduction du volume tumoral plus importante dans le groupe hypointense en T2 51,52.
Les prolactinomes, de la même façon que les adénomes somatotropes, ont une intensité de signal T2 sur l’IRM initiale variable, avec toutefois une prédominance d’adénome en hypersignal T2 53. Sur le plan histologique, les prolactinomes sont, de façon similaire aux adénomes somatotropes, différenciés par leur densité en grains de sécrétion qui peut être faible ou riche 54.
L’hypothèse avancée est que, comme pour les adénomes somatotropes, le signal T2 à l’IRM initiale des prolactinomes pourrait être corrélé à leur granularité sur le plan histologique, et par extension à leur réponse au traitement.
Objectifs de l’étude
L’objectif de ce travail était d’étudier les caractéristiques initiales clinico-biologiques et à l’imagerie des macroprolactinomes et la réponse hormonale et tumorale au traitement en fonction de l’intensité du signal initial sur la séquence pondérée T2 à l’IRM.
2. Patient et Méthodes
Population d’étudeLa population d’étude était constituée d’une cohorte de patients atteints d’un macroprolactinome, suivis dans le service d’endocrinologie adulte du Centre Hospitalier Universitaire (CHU) d’Amiens sur la période du 01/01/2008 au 01/09/2017.
20 Les critères d’inclusion étaient :
- patients atteints d’un macroprolactinome (prolactine initiale > 150 ng/ml et volume tumoral > 1 cm3)
- âgés de plus de 16 ans - de sexe féminin ou masculin
- avec un suivi minimal biologique par dosage de la prolactine et par IRM à 3 mois - ayant bénéficié d’une IRM hypophysaire initiale avant le début de tout traitement et
d’une ou de deux IRM de contrôle réalisées respectivement entre les 3ème et 9ème mois et les 12ème et 18ème mois de suivi
- suivis sur la période du 01/01/2008 au 01/09/2017
Les critères d’exclusion étaient : - sécrétion mixte de l’adénome
- prise de traitement hyperprolactinémiant - grossesse au diagnostic ou durant le suivi
Les informations cliniques, biologiques et radiologiques ont été recueillies, de façon rétrospective, à partir des dossiers cliniques et informatiques du CHU d’Amiens et des centres hospitaliers en périphérie d’Amiens ou avec l’aide des patients. Les patients ont été sollicités afin de récupérer les CD des IRM initiales ou de suivi n’ayant pas été réalisées ni enregistrées au CHU d’Amiens et non archivées dans le centre d’imagerie où elles avaient eu lieu.
Données recueillies
Les données collectées au sujet des patients comprenaient : -Les caractéristiques sociodémographiques des patients : âge, sexe
-Les caractéristiques cliniques initiales des patients au diagnostic de macroprolactinome : - délai entre le début des premiers symptômes et le diagnostic
- trouble du cycle menstruel ou trouble de la libido/érectile - galactorrhée et/ou gynécomastie
- baisse de l’acuité visuelle ou atteinte du champ visuel
- premiers symptômes présentés par le patient parmi ceux cités ci-dessus
-Les données biologiques initiales des patients : insuffisance gonadotrope, corticotrope, thyréotrope, somatotrope
21 -Les taux de prolactine au moment du diagnostic, lors du premier et du deuxième contrôle et à 1 an de suivi
-Les traitements administrés au patient : type d’agoniste dopaminergique et posologie lors du premier, du deuxième contrôle et à 1 an de suivi ; chirurgie et radiothérapie
-Les données histologiques : marqueurs de prolifération (Ki67 et p53) -Les résultats génétiques : présence de mutation génétique AIP ou NEM 1 -Les données radiologiques tumorales :
- intensité du signal de la portion tissulaire tumorale sur la séquence coronale pondérée T2 à l’IRM initiale
- caractère hétérogène de la portion tissulaire tumorale
- portion nécrotico-kystique et/ou hémorragique intra-tumorale - invasion des sinus caverneux évaluée par le grade de Knosp 47 - atteinte du chiasma optique (par contact ou refoulement)
- volume tumoral total, volume de la portion nécrotico-kystique et hémorragique, volume corrigé (volume tumoral total auquel a été soustrait le volume de la portion nécrotico-kystique et hémorragique) pour l’IRM initiale et les IRM de contrôle
La réponse tumorale au traitement était définie par le pourcentage de réduction du volume corrigé à la fin du suivi, par rapport au volume corrigé initial. Les patients étaient classés en trois groupes : mauvais répondeurs (en cas de réduction tumorale < 30%), répondeurs intermédiaires (en cas de réduction tumorale comprise entre 30 et 50%) et bons répondeurs (en cas de réduction tumorale > 50%).
La réponse hormonale au traitement était définie par le pourcentage de réduction du taux de prolactine à 1 an et à la fin du suivi par rapport au taux de prolactine initiale.
Mesures en imagerie
Les images hypophysaires ont été obtenues à partir d’IRM 1,5 Tesla ou 3 Tesla. L’analyse du signal des macroprolactinomes a été réalisée sur des consoles Advantage Windows (v4.6 et 4.7, General Electric®). Le signal était analysé sur la séquence en pondération T2, en coupe coronale, en positionnant trois régions d’intérêt « Regions of Interest » (ROI) sur une même coupe : la première (ROI 1) au sein de la portion tissulaire de l’adénome, la seconde (ROI 2) au niveau de la substance blanche temporale droite et la dernière (ROI 3) au niveau de la substance grise temporale droite.
22 La coupe choisie pour positionner les ROI était celle permettant l’analyse la plus juste du signal tumoral : portion tissulaire de taille suffisante, en dehors de toute zone nécrotique, kystique ou hémorragique afin de ne pas fausser l’analyse du signal. A l’aide des autres séquences morphologiques disponibles (par exemple les séquences T1 avec et sans injection de produit de contraste), les portions nécrotico-kystiques ou hémorragiques et les portions tissulaires ont été mises en évidence. La valeur du signal de chaque ROI ainsi que la déviation standard du signal au sein de la ROI 1 (ROI de la tumeur) étaient relevées. La valeur de la déviation standard avait pour but d’apprécier objectivement l’hétérogénéité de certains adénomes.
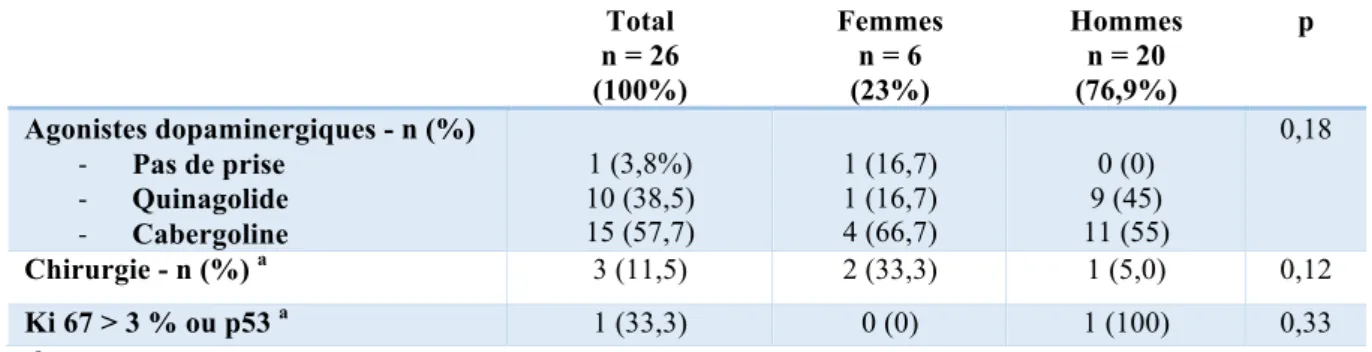
La tumeur était considérée en hypersignal lorsque son signal était supérieur à celui de la substance grise (ratio ROI 1/ROI 3 > 1), en hyposignal si celui-ci était inférieur à celui de la substance blanche (ratio ROI 1/ROI 2 < 1) et en isosignal dans le reste des cas, d’après la méthode de Hagiwara 48, reprise par Heck 51 (Figure 1).
La méthode de rapport 55 : ratio du signal « adénome (ROI 1)/substance grise (ROI 3) » a également été employée pour ne pas méconnaître des différences de résultats potentiellement engendrées par la définition choisie pour classer les adénomes selon leur intensité en T2. En cas de ratio ROI 1/3 > 1,2, la tumeur était considérée en hypersignal T2, et en cas de ratio ROI 1/3 < 0,8, la tumeur était considérée en hyposignal T2. Dans le reste des cas, la tumeur était classée dans le groupe isosignal T2.
Figure 1 - Positionnement des ROI sur une IRM hypophysaire en coupe coronale en séquence pondérée T2
ROI 1 au sein du macroprolactinome
ROI 2 au sein de la substance blanche temporale droite ROI 3 au sein de la substance grise temporale droite
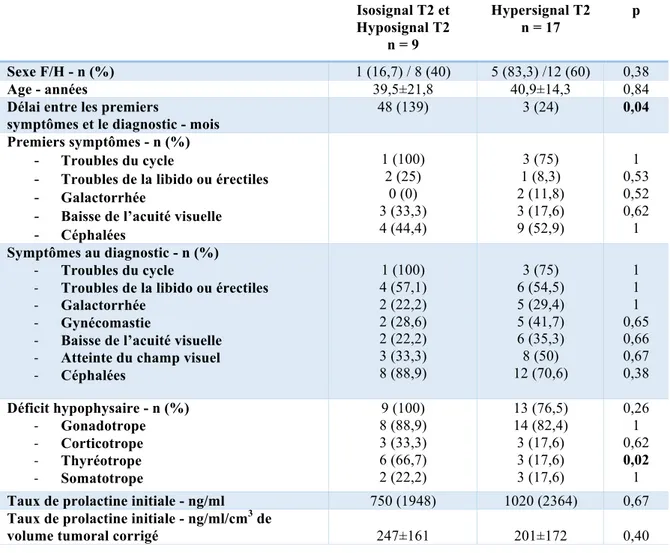
Figure 2 - Volume 3D tumoral obtenu après contourage du macroprolactinome
23 L’analyse du volume a été effectuée sur une console Advantage Windows par contourage et remplissage de la tumeur à l’aide d’un outil de type pinceau sur chacune des coupes de la séquence (épaisseur de coupes de 2 à 5 mm). Le volume était extrapolé automatiquement par la console d’imagerie après contourage de l’ensemble des coupes et sélection du volume obtenu (Figure 2).
Dans un second temps, le volume des portions nécrotico-kystiques et/ou hémorragiques était mesuré puis soustrait au volume total afin d’obtenir un volume corrigé, correspondant au volume de la portion tissulaire de l’adénome. Ces mesures étaient répétées sur les deux ou trois IRM disponibles pour chaque patient. L’ensemble des séquences morphologiques a permis d’analyser de façon précise les contours lésionnels et les portions de nécrose et d’hémorragie. Le contourage a été réalisé sur la séquence où la mesure était jugée la plus aisée (le plus souvent la séquence T1 avec injection pour le volume global et la séquence T2 ou T1 respectivement en cas de présence de portion nécrotique/kystique ou hémorragique).
L’invasion des structures adjacentes a été établie sur l’IRM initiale et les IRM de contrôle : l’envahissement des sinus caverneux évaluée par le grade de Knosp, l’envahissement du sinus sphénoïdal et l’atteinte du chiasma optique.
L’ensemble des mesures ont été réalisées en aveugle, en collaboration avec un médecin radiologue junior (interne de radiologie de 8ème semestre).
Paramètres étudiés
Le paramètre principal étudié était la réponse hormonale (pourcentage de réduction de prolactine) et tumorale (pourcentage de réduction du volume corrigé) à la fin du suivi, selon l’intensité du signal T2 à l’IRM initiale évaluée par la méthode de Heck.
Les paramètres secondaires étaient :
-la réponse hormonale et tumorale à la fin du suivi, selon l’intensité du signal T2 à l’IRM initiale évaluée par la méthode de rapport
-la corrélation entre les rapports d’intensité ROI 1/ROI 3 et la réponse hormonale et tumorale à la fin du suivi
24 -l’analyse des caractéristiques clinico-biologiques et à l’IRM des patients en fonction de leur degré de réponse tumorale à la fin du suivi (en classant les patients en trois groupes : bons, intermédiaires et mauvais répondeurs)
Analyse statistique
Les statistiques descriptives ont été calculées pour toutes les variables d’intérêt. Les tests de normalité utilisés étaient : le test de Shapiro-Wilk et le test de Kolmogorov-Smirnov. En cas de distribution normale, les moyennes et les écarts type ont été utilisés pour décrire les variables continues. Dans le cas contraire, les résultats ont été décrits avec la médiane et l’écart interquartile (IQR).
Les moyennes ont été comparées par le test t de Student en cas de distribution normale, dans le cas contraire les distributions des variables quantitatives ont été comparées par le test de Mann-Whitney. Les fréquences ont été comparées par un test exact de Fisher.
Pour les échantillons supérieurs à 2, les moyennes ont été comparées à l’aide d’un test d’analyse de variance en cas de distribution normale, et dans le cas contraire la distribution des variables quantitatives a été étudiée à l’aide d’un test de Kruskal Wallis. La corrélation entre deux paramètres quantitatifs a été analysée à l’aide d’un test de corrélation de Pearson. Une valeur p inférieure à 0,05 était considérée comme statistiquement significative pour l’ensemble des tests. L’analyse statistique a été réalisée à l’aide du logiciel IBM SPSS Statistics®.
3. Résultats
Vingt-huit patients avec un macroprolactinome ont été étudiés en imagerie par résonance magnétique. Les IRM de deux patients n’ont finalement pas pu être exploitées devant l’absence de portion tissulaire analysable (adénome entièrement kystique ou hémorragique). (Figure 3)
25
Caractéristiques initiales de la population
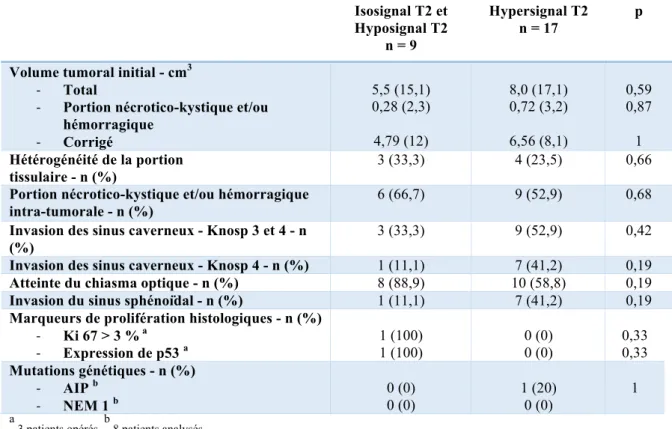
Sur les vingt-six patients inclus finalement dans l’étude, 17 patients présentaient un hypersignal T2 tumoral à l’IRM, 7 patients un isosignal T2 et 2 patients un hyposignal T2, d’après la méthode de Heck (Figure 4).
Figure 4 - Répartition des patients selon l’intensité du signal T2 par la méthode de Heck
26 La population de patients était à prédominance masculine (20 hommes, soit 76,9% de la population), avec une moyenne d’âge au diagnostic de macroprolactinome de 40,4 ±16,9 ans. Le délai médian entre l’apparition des premiers symptômes et le diagnostic de macroprolactinome était de 8,5 mois (IQR=49). Les premiers symptômes se manifestaient pour 80% des femmes par des troubles du cycle. Dans les deux sexes, les céphalées étaient révélatrices de la maladie dans la moitié des cas, alors que la galactorrhée était rarement un mode de révélation. Entre la survenue des premiers symptômes et le diagnostic, la baisse d’acuité visuelle était apparue chez 2 patients et les troubles de la libido/érectiles chez 7 hommes.
Au diagnostic, la galactorrhée était de façon significative plus souvent observée chez les femmes que chez les hommes (66,7% versus 15%, p=0,02). Trente-cinq pour cent des hommes présentaient une gynécomastie. L’atteinte du champ visuel était présente dans 44% des cas et les céphalées dans 76,9% des cas tous sexes confondus, ce qui classait ces symptômes comme étant les deux plus fréquents au moment du diagnostic. Quatre-vingt-quatre pour cent des adénomes étaient compliqués d’insuffisance hypophysaire, dont autant d’insuffisance gonadotrope, 23,1% d’insuffisance corticotrope partielle ou complète, 34,6% d’insuffisance thyréotrope et 19,2% d’insuffisance somatotrope. Le taux moyen de prolactine initiale en ng/ml/cm3 de volume tumoral corrigé était similaire dans les deux sexes (217±131, 213±127, p=0,93). Sur huit patients analysés, une seule mutation du gène AIP a été mise en évidence, chez un homme. (Tableau 1)
27
Tableau 1 - Caractéristiques cliniques et biologiques initiales des patients
Total n = 26 (100%) Femmes n = 6 (23%) Hommes n = 20 (76,9%) p Age - années 40,4±16,9 33,8±12,9 42,4±17,7 0,28
Délai entre les premiers
symptômes et le diagnostic - mois
8,5 (49) 24 (52) 5 (53) 0,69 Premiers symptômes - n (%) - Troubles du cycle - Troubles de la libido ou érectiles - Galactorrhée - Gynécomastie
- Baisse de l’acuité visuelle - Céphalées - - 2 (7,6) - 6 (23,1) 13 (50) 4 (80) - 1 (16,7) - 1 (16,7) 3 (50) - 3 (15) 1 (5) 3 (15) 5 (25) 10 (50) 0,41 1 1 Symptômes au diagnostic - n (%) - Troubles du cycle - Troubles de la libido ou érectiles - Galactorrhée - Gynécomastie
- Baisse de l’acuité visuelle - Atteinte du champ visuel - Céphalées - - 7 (26,9) - 8 (30,8) 11 (44) 20 (76,9) 4 (80) - 4 (66,7) - 2 (33,3) 2 (40) 6 (100) - 10 (50) 3 (15) 7 (35) 6 (30) 9 (45) 14 (70) 0,02 1 1 0,28 Déficit hypophysaire - n (%) - Gonadotrope - Corticotrope - Thyréotrope - Somatotrope 22 (84,6) 22 (84,6) 6 (23,1) 9 (34,6) 5 (19,2) 5 (83,3) 5 (83,3) 1 (16,7) 2 (33,3) 2 (33,3) 17 (85) 17 (85) 5 (25) 7 (35) 3 (15) 1 1 1 1 0,55 Taux de prolactine initiale - ng/ml 1110 (1907) 468 (2900) 1313 (1868) 0,26 Taux de prolactine initiale - ng/ml/cm3
de volume tumoral corrigé
217±131 213±127 218±136 0,93 Mutations génétiques - n (%)
- AIP a
- NEM 1 a 1 (12,5)0 (0) 0 (0) 0 (0) 1 (14,3) 0 (0) 1
a
8 patients analysés (1 femme et 7 hommes)
Concernant les caractéristiques radiologiques, l’hétérogénéité de la portion tissulaire était plus souvent notée chez les hommes que chez les femmes (35% versus 0%, p=0,14), sans que ces valeurs n’atteignent la significativité. Les hommes avaient tendance à présenter plus fréquemment un envahissement des sinus caverneux (55% versus 16,7%, p=0,17). Cinquante-sept pour cent des adénomes étaient en partie nécrotico-kystique et/ou hémorragique, sans différence de genre notable. Le volume tumoral corrigé apparaissait, de façon proche de la significativité, plus faible chez les femmes que chez les hommes (3,43 cm3 versus 6,93 cm3, p=0,12). (Tableau 2)
28
Tableau 2 - Caractéristiques radiologiques initiales des patients
Total n = 26 (100%) Femmes n = 6 (23%) Hommes n = 20 (76,9%) p
Signal tumoral initial - n (%) selon Heck - Hyperintense T2 - Isointense T2 - Hypointense T2 17 (65,4) 7 (26,9) 2 (7,7) 5 (83,3) 0 (0) 1 (16,7) 12 (60) 7 (35) 1 (5) 0,22 ROI 1/3 1,09±0,24 1,20±0,31 1,06±0,23 0,23
Volume tumoral initial - cm3 - Total - Portion nécrotico-kystique et/ou hémorragique - Corrigé 6,90 (14,9) 0,71 (2,8) 5,01 (9,3) 4,89 (16,9) 1,21 (3,2) 3,43 (14,4) 7,46 (15,1) 0,49 (2,7) 6,93 (9,6) 0,32 0,74 0,12 Hétérogénéité de la portion tissulaire - n (%) 7 (26,9) 0 (0) 7 (35) 0,14 Portion nécrotico-kystique et/ou
hémorragique - n (%)
15 (57,7) 3 (50) 12 (60) 1 Invasion des sinus caverneux -
Knosp 3 et 4 - n (%)
12 (46,2) 1 (16,7) 11 (55) 0,17 Atteinte du chiasma optique - n (%) 18 (69,2) 4 (66,7) 14 (70) 1 Invasion du sinus sphénoïdal - n (%) 8 (30,8) 3 (50) 5 (25) 0,33
A noter que le taux de prolactine initiale était corrélé au volume tumoral initial (total et corrigé). En effet plus le volume tumoral était important plus le taux de prolactine était élevé (r=0,59, p=0,01). (Figure 5)
Figure 5 - Corrélation entre le volume corrigé initial et le taux de prolactine initiale
29 Concernant la thérapeutique instaurée, une seule patiente n’a pas pu bénéficier d’un traitement médical compte tenu d’une intolérance aux agonistes dopaminergiques. Un patient a reçu un traitement par cabergoline introduit prudemment à faible dose à 0,25mg/semaine durant un mois sur les trois mois de suivi, compte tenu d’un risque de brèche méningée liée à une invasion majeure du sinus sphénoïdal. Tous les autres patients ont reçu un traitement par agonistes dopaminergiques durant la totalité du suivi.
Trois patients ont été opérés durant le suivi : deux d’entre eux dès la découverte dans un contexte de troubles visuels avec tableau d’apoplexie pour l’un et de méningoencéphalite sur brèche méningée pour le second, une patiente dans les premiers mois du suivi devant une intolérance aux agonistes dopaminergiques ayant nécessité leur suspension.
Un des trois patients opérés durant le suivi présentait des marqueurs de prolifération élevés : Ki67 > 3%, et expression de p53. (Tableau 3)
Tableau 3 - Traitement initial et données histologiques des patients
Total n = 26 (100%) Femmes n = 6 (23%) Hommes n = 20 (76,9%) p Agonistes dopaminergiques - n (%) - Pas de prise - Quinagolide - Cabergoline 1 (3,8%) 10 (38,5) 15 (57,7) 1 (16,7) 1 (16,7) 4 (66,7) 0 (0) 9 (45) 11 (55) 0,18 Chirurgie - n (%) a 3 (11,5) 2 (33,3) 1 (5,0) 0,12 Ki 67 > 3 % ou p53 a 1 (33,3) 0 (0) 1 (100) 0,33 a 3 patients opérés
Caractéristiques initiales de la population selon l’intensité du signal T2 évaluée par la méthode de Heck
Les patients en iso et hyposignal T2 ont été réunis dans un même groupe pour réaliser l’analyse statistique. Cette répartition des patients en deux groupes d’intensité (groupe iso/hyposignal T2 et groupe hypersignal T2) a été rendue nécessaire par le faible effectif du groupe hyposignal T2 comptant 2 patients.
La répartition de la population était identique en terme de sexe et d’âge dans les deux groupes iso/hyposignal T2 et hypersignal T2. Le délai médian entre les premiers symptômes et le diagnostic était significativement plus important dans le groupe iso/hyposignal T2 que dans le groupe hypersignal T2 (48 mois (IQR=139) versus 3 mois (IQR=24), p=0,04). Les
30 symptômes révélateurs de la maladie ou au diagnostic ne différaient pas entre les deux groupes.
Le taux d’insuffisance hypophysaire était similaire dans le groupe iso/hyposignal T2 par rapport au groupe hypersignal T2 (100% versus 76,5%, p=0,26). L’insuffisance thyréotrope était significativement plus fréquente dans le groupe iso/hyposignal T2 (66,7% versus 17,6%, p=0,028). Le taux initial de prolactine en ng/ml/cm3 de volume corrigé était superposable dans les deux groupes, avec cependant un intervalle interquartile plus important dans le groupe iso/hyposignal T2. (Tableau 4)
Tableau 4 - Caractéristiques clinico-biologiques des patients au diagnostic de macroprolactinome selon l’intensité du signal T2 à l’IRM initiale évaluée par la méthode de Heck Isosignal T2 et Hyposignal T2 n = 9 Hypersignal T2 n = 17 p Sexe F/H - n (%) 1 (16,7) / 8 (40) 5 (83,3) /12 (60) 0,38 Age - années 39,5±21,8 40,9±14,3 0,84
Délai entre les premiers
symptômes et le diagnostic - mois
48 (139) 3 (24) 0,04 Premiers symptômes - n (%)
- Troubles du cycle
- Troubles de la libido ou érectiles - Galactorrhée
- Baisse de l’acuité visuelle - Céphalées 1 (100) 2 (25) 0 (0) 3 (33,3) 4 (44,4) 3 (75) 1 (8,3) 2 (11,8) 3 (17,6) 9 (52,9) 1 0,53 0,52 0,62 1 Symptômes au diagnostic - n (%) - Troubles du cycle
- Troubles de la libido ou érectiles - Galactorrhée
- Gynécomastie
- Baisse de l’acuité visuelle - Atteinte du champ visuel - Céphalées 1 (100) 4 (57,1) 2 (22,2) 2 (28,6) 2 (22,2) 3 (33,3) 8 (88,9) 3 (75) 6 (54,5) 5 (29,4) 5 (41,7) 6 (35,3) 8 (50) 12 (70,6) 1 1 1 0,65 0,66 0,67 0,38 Déficit hypophysaire - n (%) - Gonadotrope - Corticotrope - Thyréotrope - Somatotrope 9 (100) 8 (88,9) 3 (33,3) 6 (66,7) 2 (22,2) 13 (76,5) 14 (82,4) 3 (17,6) 3 (17,6) 3 (17,6) 0,26 1 0,62 0,02 1 Taux de prolactine initiale - ng/ml 750 (1948) 1020 (2364) 0,67 Taux de prolactine initiale - ng/ml/cm3 de
volume tumoral corrigé 247±161 201±172 0,40
31 Le volume tumoral, l’hétérogénéité de la portion tissulaire et la présence de portions nécrotico-kystiques et/ou hémorragiques étaient semblables entre les groupes. L’invasion des sinus caverneux établie avec certitude par le grade de Knosp 4, et l’invasion du sinus sphénoïdal, avaient tendance à être plus souvent retrouvées dans le groupe hypersignal T2 (11,1% versus 41,2% p=0,19 dans les deux cas). Par contre, l’atteinte du chiasma optique (par contact ou refoulement) apparaissait de façon non significative plus fréquente dans le groupe iso/hyposignal T2 (88,9% versus 58,8%, p=0,19). (Tableau 5)
Tableau 5 - Caractéristiques radiologiques, histologiques et génétiques des patients au diagnostic de macroprolactinome selon l’intensité du signal T2 à l’IRM initiale évaluée par la méthode de Heck
Isosignal T2 et Hyposignal T2 n = 9 Hypersignal T2 n = 17 p
Volume tumoral initial - cm3 - Total
- Portion nécrotico-kystique et/ou hémorragique - Corrigé 5,5 (15,1) 0,28 (2,3) 4,79 (12) 8,0 (17,1) 0,72 (3,2) 6,56 (8,1) 0,59 0,87 1 Hétérogénéité de la portion tissulaire - n (%) 3 (33,3) 4 (23,5) 0,66 Portion nécrotico-kystique et/ou hémorragique
intra-tumorale - n (%)
6 (66,7) 9 (52,9) 0,68 Invasion des sinus caverneux - Knosp 3 et 4 - n
(%)
3 (33,3) 9 (52,9) 0,42 Invasion des sinus caverneux - Knosp 4 - n (%) 1 (11,1) 7 (41,2) 0,19 Atteinte du chiasma optique - n (%) 8 (88,9) 10 (58,8) 0,19 Invasion du sinus sphénoïdal - n (%) 1 (11,1) 7 (41,2) 0,19 Marqueurs de prolifération histologiques - n (%)
- Ki 67 > 3 % a - Expression de p53 a 1 (100) 1 (100) 0 (0) 0 (0) 0,33 0,33 Mutations génétiques - n (%) - AIP b - NEM 1 b 0 (0) 0 (0) 1 (20) 0 (0) 1 a
3 patients opérés, b 8 patients analysés
Réponse hormonale et tumorale selon l’intensité du signal T2 évaluée par la méthode de Heck
Le taux de prolactine initiale, à la fin du suivi toutes durées confondues et à 1 an, ainsi que le pourcentage de diminution de prolactine à la fin du suivi toutes durées confondues et à 1 an étaient identiques entre les deux groupes. La réduction du volume tumoral corrigé à la fin du
32 suivi ne différait pas de façon significative dans le groupe iso/hyposignal T2 par rapport au groupe hypersignal T2 (62% (IQR=44,1) versus 38,1% (IQR=43), p=0,36).
Pour l’analyse statistique, les traitements par agonistes dopaminergiques ont été regroupés en trois catégories, en fonction du type et de la posologie administrés :
-catégorie 1 : quinagolide de 75 à 150 mg/jour ou cabergoline de 0,25 à 1 mg/semaine
-catégorie 2 : quinagolide > 150 mg et ≤ 300 mg/jour ou cabergoline > 1 mg/semaine et ≤ 2 mg/semaine
-catégorie 3 : cabergoline > 2 mg/semaine
Il existait une différence significative entre les deux groupes d’intensité en terme d’administration du traitement par agonistes dopaminergiques, réparti en trois catégories, à la fin du suivi (p=0,04), et proche de la significativité à 1 an de suivi (p=0,06). Les catégories 2 et 3 d’agonistes dopaminergiques étaient plus fréquentes dans le groupe iso/hyposignal T2. La durée moyenne de suivi, en mois, était équivalente entre les deux groupes (13,6±6,4 versus 12,4±6, p=0,64). (Tableau 6)
33
Tableau 6 - Réponse hormonale et tumorale selon l’intensité du signal T2 à l’IRM initiale évaluée par la méthode de Heck
Isosignal T2 et Hyposignal T2 n= 9 Hypersignal T2 n= 17 p
Prolactine à la fin du suivi - ng/ml 59 (271) 20 (204) 0,87 Diminution de prolactine à la fin du suivi - % 96,7 (10,7) 97,5 (7,1) 0,71 Diminution du volume à la fin du suivi - % 50 (38,7) 38 (44,7) 0,79 Diminution du volume corrigé à la fin du suivi - % 62 (44,1) 38,1 (43) 0,36 Agonistes dopaminergiques à la fin du suivi - n (%)
- Pas de prise - Quinagolide - Cabergoline 0 (0) 3 (33,3) 6 (66,7) 1 (5,9) 7 (41,2) 9 (52,9) 0,79
Type et dose d’agonistes dopaminergiques à la fin du suivi - n (%) - Pas de prise - Catégorie 1 - Catégorie 2 - Catégorie 3 0 (0) 3 (33,3) 5 (55,6) 1 (11,1) 1 (5,9) 13 (76,5) 3 (17,6) 0 (0) 0,04 Prolactine à 1 an - ng/ml 26,5 (308) 22 (170) 0,63 Diminution de prolactine à 1 an - % 98,6 (13,5) 96 (9,0) 0,50 Diminution du volume C2 - % 50,4 (26) 37,8 (56) 0,90
Diminution du volume corrigé C2 - % 67 (38) 35,9 (44) 0,26 Type et dose d’agonistes dopaminergiques à 1 an - n
(%) - Pas de prise - Catégorie 1 - Catégorie 2 - Catégorie 3 0 (0) 2 (25,0) 4 (50) 1 (12,5) 1 (6,7) 11 (73,3) 3 (20) 0 (0) 0,06 Chirurgie - n (%) 1 (11,1) 2 (11,8) 1
Durée du suivi - mois 13,6 ± 6,4 12,4 ± 6,0 0,64
C2 : Contrôle 2 entre 12 et 18 mois de suivi
Caractéristiques initiales à l’imagerie et réponse hormonale et tumorale selon l’intensité du signal T2 évaluée par la méthode de rapport
La méthode dite « de rapport » a également été utilisée pour classer les adénomes selon leur intensité de signal T2 à l’IRM initiale. Trois adénomes (11,5%) appartenaient au groupe hyposignal T2, 13 (50%) au groupe isosignal T2 et 10 (38,5%) au groupe hypersignal T2 en utilisant cette méthode.
Le taux de prolactine initiale en ng/ml/cm3 de volume tumoral corrigé semblait majoré dans le groupe iso/hyposignal T2 (247±134 ng/ml/cm3 vs 167±116 ng/ml/cm3, p=0,13). L’invasion du sinus sphénoïdal était de façon significative plus fréquente dans le groupe hypersignal T2 (12,5% vs 60%, p=0,02), et l’invasion du sinus caverneux (grade 4 de Knosp) tendait à être plus importante dans ce même groupe (18,8% versus 50%, p=0,18). Il
34 n’apparaissait cependant pas de différence significative en terme de réduction du volume tumoral et de la prolactine dans les deux groupes. A noter que les groupes ne différaient pas en terme de durée du suivi, de type et de posologie d’agonistes dopaminergiques administrés et de réalisation ou non d’un geste chirurgical. (Tableau 7)
Tableau 7 - Caractéristiques tumorales initiales et réponse hormonale et tumorale selon l’intensité du signal T2 à l’IRM initiale évaluée par méthode de rapport
Isosignal T2 et Hyposignal T2 (n=16) (Rapport) Hyper signal T2 (n=10) (Rapport) p Prolactine initiale - ng/ml 1073 (1884) 1110 (1858) 0,85 Prolactine initiale - ng/ml/cm3 de volume tumoral
corrigé
247±134 167±116 0,13 Diminution de prolactine à la fin du suivi - % 94,7 (7,5) 97 (7,1) 0,31 Volume tumoral initial - cm3
- Total - Corrigé 6,15 (16,2) 4,4 (10,5) 9,01 (18,3) 7,6 (17,4) 0,39 0,33 Diminution du volume corrigé à la fin du suivi - % 43,7 (49,2) 50,2 (34,5) 0,85
Knosp grade 3 et 4 initial - n (%) 6 (37,5) 6 (60) 0,42
Knosp grade 4 initial - n (%) 3 (18,8) 5 (50) 0,18
Invasion du sinus sphénoïdal - n (%) 2 (12,5) 6 (60) 0,02
Durée de suivi - mois 13,3±5,9 12,1±6,5 0,66
Corrélation entre ratio du signal T2 « adénome (ROI 1) / substance grise (ROI 3) » et réponse au traitement
Aucune corrélation n’a été mise en évidence entre le ratio ROI 1/ROI 3 et la réduction du volume tumoral corrigé (r=0,025, p=0,90) ou la réduction du taux de prolactine (r=0,096, p=0,63) à la fin du suivi.
Caractéristiques des patients en fonction de leur degré de réponse au traitement
Les patients ont été classés en trois groupes selon leur réponse tumorale : mauvais répondeurs (en cas de réduction du volume tumoral corrigé à la fin du suivi < 30%),
35 répondeurs intermédiaires (en cas de réduction tumorale comprise entre 30 et 50%) et bons répondeurs (en cas de réduction tumorale > 50%).
L’invasion des sinus caverneux était plus souvent retrouvée chez les mauvais répondeurs (71,4%), tandis que l’atteinte du chiasma optique était plus fréquemment observée chez les bons répondeurs (84,6%), de façon non significative. Le volume tumoral corrigé initial en cm3 avait tendance à être plus élevé chez les mauvais répondeurs plutôt que chez les répondeurs intermédiaires et bons répondeurs (9,19(IQR=16,9) vs 3,44(IQR=6,5) vs 5,23(IQR=9,9), p=0,28). Les traitements administrés ne différaient pas entre les groupes. Le seul patient porteur de la mutation AIP comptait parmi les mauvais répondeurs. L’unique patient présentant des marqueurs histologiques de prolifération élevés appartenait également au groupe des mauvais répondeurs. (Tableau 8)
36
Tableau 8 - Caractéristiques des patients en fonction de leur niveau de réponse au traitement Bons répondeurs n = 13 Répondeurs intermédiaires n = 6 Mauvais répondeurs n = 7 p Sexe F/H - n (%) 3(50)/10(50) 2(33,3)/4(20) 1(16,7)/6(30) 0,84 Age - années 38±14 41,5±21 43±19 0,85
Durée médiane de suivi - mois 12,3 (10) 17,6 (12) 13,5 (16) 0,55 Intensité du signal T2 - ROI1/ROI3 1,05±0,24 1,22±0,32 1,07±0,12 0,38 Intensité du signal T2 selon la
méthode de Heck - n (%) - Hypo et isosignal T2 - Hypersignal T2 6 (66,7) 7 (41,2) 1 (11,1) 5 (29,4) 2 (22,2) 5 (29,4) 0,56
Intensité du signal T2 selon la méthode de rapport - n (%) - Hypo et isosignal T2 - Hypersignal T2 8 (50,0) 5 (50) 3 (18,8) 3 (30) 5 (31,3) 2 (20) 0,87
Délai entre les premiers
symptômes et le diagnostic - mois 24 (66) 3 (19) 12 (84) 0,27 Symptômes au diagnostic - n (%)
- Galactorrhée
- Baisse de l’acuité visuelle - Atteinte du champ visuel - Céphalées 4 (30,8) 5 (38,5) 6 (50) 9 (69,2) 2 (33,3) 1 (16,7) 3 (50) 6 (100) 1 (14,3) 2 (28,6) 2 (28,6) 5 (71,4) 0,72 0,85 0,67 0,40 Déficit hypophysaire - n (%) - Gonadotrope - Corticotrope - Thyréotrope - Somatotrope 11 (84,6) 12 (92,3) 4 (30,8) 6 (46,2) 3 (23,1) 5 (83,3) 5 (83,3) 2 (33,3) 1 (16,7) 1 (16,7) 6 (85,7) 5 (71,4) 0 2 (28,6) 1 (14,3) 1 0,53 0,29 0,56 1 Taux de prolactine initiale - ng/ml 1200 (2806) 610 (1743) 1420 (1873) 0,79 Taux de prolactine initiale -
ng/ml/cm3 172,5 (201) 214,8 (251) 169,2 (243) 0,60
Diminution du taux de prolactine à la fin du suivi - %
97,5 (6,2) 94,3 (21,6) 89,4 (76,9) 0,20 Volume tumoral initial - cm3
- Total - Nécrotico-kystique et /ou hémorragique - Corrigé 6,8 (13,5) 0,17 (3,04) 5,23 (9,9) 4,9 (9,9) 1,04 (4,97) 3,44 (6,5) 9,1 (16,9) 0,71 (2,91) 9,19 (16,6) 0,46 0,57 0,28 Hétérogénéité tissulaire - n (%) 4 (30,8) 1 (16,7) 2 (28,6) 1 Portion nécrotico-kystique et/ou
hémorragique - n (%)
6 (46,2) 5 (83,3) 4 (57,1) 0,35 Invasion des sinus caverneux -
Knosp 3 et 4 - n (%)
5 (38,5) 2 (33,3) 5 (71,4) 0,39 Atteinte du chiasma optique - n (%) 11 (84,6) 4 (66,7) 3 (42,9) 0,18 Invasion du sinus sphénoïdal - n (%) 3 (23,1) 2 (33,3) 3 (42,9) 0,75 Type et dose d’agonistes
dopaminergiques à la fin du suivi - Pas de prise - Catégorie 1 - Catégorie 2 - Catégorie 3 0 7 (53,8) 5 (38,5) 1 (7,7) 1 (16,7) 4 (66,7) 1 (16,7) 0 (0) 0 5 (71,4) 2 (28,6) 0 (0) 0,73 Chirurgie - n (%) a 3 (23,1) 1 (11,1) 1 (14,3) 1 a
37
4. Discussion
Cette étude rétrospective a analysé vingt-six cas de macroprolactinomes dont deux en
hyposignal T2, sept en isosignal T2 et dix-sept en hypersignal T2, d’après la méthode de Heck. Compte-tenu d’un faible effectif de patients dans le groupe hyposignal T2, les adénomes en isosignal et hyposignal T2 ont été rassemblés au sein d’un même groupe pour l’analyse statistique. Ce regroupement correspond à une logique sur le plan histologique : dans une étude Heck avait démontré que parmi 34 adénomes somatotropes, ceux qui étaient faiblement granulés présentaient tous un hypersignal T2 et ceux densément granulés correspondaient pour la majorité à des adénomes en iso ou hyposignal T2 51.
Dans notre étude, l’intensité du signal T2 des prolactinomes a été étudiée par la méthode de Heck 51. Cette méthode a été choisie car Heck avait démontré dans une étude princeps concernant les adénomes somatotropes non traités préalablement par chirurgie, que ceux en hyposignal T2 étaient associés à une meilleure réponse à l’octréotide (analogue de la somatostatine) comparé aux adénomes en iso ou hypersignal T2. Ces adénomes hypointenses étaient aussi plus petits et plus sécrétants que les adénomes hyperintenses en T2, car correspondant à des adénomes plus riches en grains de sécrétion sur le plan histologique 51.
Les recherches à ce sujet se sont multipliées ces cinq dernières années. En 2015, Potorac et al. 49 a étudié 297 adénomes somatotropes, dont 52.9% étaient hypointenses en T2. Cette étude a permis de confirmer que ces derniers étaient plus petits, plus sécrétants que les adénomes iso et hyperintenses en T2, et qu’ils envahissaient également moins fréquemment les sinus caverneux et le chiasma optique. Dans l’étude de Potorac, contrairement à celle de Heck, le signal tumoral T2 a été comparé par méthode visuelle à celui de l’hypophyse saine ou lorsque celle-ci n’était pas visible, à la substance grise du lobe temporal (dont le signal est proche de celui de l’hypophyse). Toutefois, Potorac concluait que l’évaluation par ROI de ces deux structures (hypophyse et lobe temporal) comparée à celle de la tumeur était concordante dans 93% des cas avec l’évaluation visuelle pour classer ces adénomes selon leur intensité. En 2016, le même auteur a mené une étude multicentrique chez 120 patients acromégales, démontrant que plus le signal T2 initial tumoral était faible, meilleure était la réponse tumorale et hormonale au traitement médical par analogue de la somatostatine 52
. Cette corrélation entre intensité du signal T2 et réponse au traitement a été confirmée dans une seconde étude menée par Heck 56