INFORMATION TO USERS
This manuscript has been reproduced from the microfilm master. UMI films the text diredly from the original or copy submitted. Thus, some thesis and dissertation copies are in typewriter face, while others may be from any type of computer printer.
The quallty of this reproduction is dependent upon the quallty of the copy submltted. Broken or indistinct print, colored or poor quality illustrations and photographs, print bleedthrough, substandard margins, and improper alignment can adversely affect reproduction.
ln the unlikely event that the author did not send UMI a complete manuscript and there are missing pages, these will be noted. Also, if unauthorized copyright material had to be removed, a note will indicate the deletion.
Oversize materials (e.g., maps, drawings, charts) are reproduced by sectioning the original, beginning at the upper left-hand corner and continuing from left to right in equal sections with small overtaps.
Photographs induded in the original manuscript have been reproduced xerographically in this copy. Higher quality
a·
x g• black and white photographie prints are available for any photographs or illustrations appearing in this copy for an additional charge.Contact
UMI direcUy to order.ProQuest Information and Leaming
300 North Zeeb Road, Ann Arbor, Ml 48106-1346 USA 800-521-0600
NOTE TO USERS
Université de Sherbrooke
Régulation de la survie chez les cellules de la
crypte intestinale humaine.
Charlène Harnois
Département d'anatomie et biologie cellulaire
Mémoire présenté à la Faculté de médecine
En vue de l'obtention du grade de maître ès sciences (M.Sc.) en Biologie cellulaire
l+I
National Libraryof Canada Bi>liothèque nationale du Canada Acquisitions and Acquisitions et
Bibliographie Services services bibliographiques
385 Welinglon Street 395, rue Welington
Olawa ON K1A ON4 Ollalll8 ON K1A ON4
canada c.-.
The author bas granted a
non-exclusive licence allowing the
National
Ltbrary
of Canada to
reproduce, loan, distnl>ute or sell
copies of this thesis
in
microform,
paper or electronic
formats.
The author retains ownership of the
copyright in this thesis. Neither the
thesis nor substantial extracts from it
may be printed or otherwise
reproduced without the author's
pemnss1on.
0-612-67281-6
Cana
dl
L'auteur a accordé une licence non
exclusive permettant
à
la
Bibliothèque nationale du Canada
de
reproduire,
prêter,
distribuer ou
vendre des copies
de
cette thèse sous
la
forme
de
microfiche/fiJm, de
reproduction sur papier ou sur format
électronique.
L'auteur conserve
la
propriété du
droit d'auteur qui protège cette thèse.
Ni
la
thèse ni des extraits substantiels
de celle-ci ne doivent être imprimés
ou autrement reproduits sans son
autorisation.
TABLE DES MATIÈRES
Liste des illustrations ... VI Liste des abréviations ... IX Liste des publications ... XII Résumé ... XIII
CHAPITRE/- INTRODUCTION
1. Le modèle intestinal. ... l
2. Mort cellulaire programmée ... .5
2.1. Apoptose ... 5
2.1.1. Phases du processus apoptotique ... 6
2.1.2. Morphologie caractéristique de l'apoptose ... 8
2.1.3. Centre de régulation: Homologues Bcl-2 ... 9
2.1.4. Machinerie effectrice: Caspases ... 12
2.2. Apoptosome ... 15
3. Signalisation dans la régulation de l'apoptose ... 17
3.1. Survie cellulaire: suppression de l'apoptose ... 17
3.2. Principales voies de survie ... 17
3.2.1. MAPKs ... 17 3.2.1.1. MAPKs p42/p44 ... 19 3.2.1.2. MAPKs p38/JNK ... 20 3.2.1.3. MAPKs p38 ... 22 3.2.2. Phosphatidylinositol 3-kinase (P13-K) ... 22 3.2.3. Adhésion cellulaire ... 24 Il
3.2.4. Les membres de la famille Src ... 25
4. Objectifs du projet de recherche ... 25
CHAPITRE 2- MATÉRIEL ET MÉTHODES l. Culture cellulaire ... 28
l. l. Les cellules HIEC ... 28
2. Niveaux d'expression ... 31
2. l. Lysats cellulaires ... .31
2.2. SOS-PAGE ... 31
a) Minigel. ... .31
b) Grand gel ... 32
2.3. Détection des protéines par immunobuvardage ... 33
2.4. Deshybridation des membranes ... .34
2.5. Quantification des bandes ... .34
3. Évaluation morphologique ... .37
3.1. Microscopie appliquée à contraste de phase ... .37
3.2. Imagerie digitale ... .37
4. Évaluation de l'apoptose ... 38
5. Évaluation de la transcription des isoformes des MAPKs p38 ... .39
5. l. Extraction de l 'ARN ... 39
5.2. RT-PCR ... 40
5.3. Amplification des échantillons par PCR ... .40
5.4. Quantification des bandes de PCR ... 42
6. Présentation des résultats ... .42
CHAPITRE 3- RÉSULTATS
l. Survie chez les cellules de la crypte intestinale humaine ... .43
l .l. Morphologie cellulaire ... .43
1.2. Dégradation d'ADN intemucléosomique ... .46
1.3. Homologues Bcl-2 ... 48
2. Influence des MAPKs p38 dans la survie des cellules de la crypte intestinale humaine ... 51
2.1. Morphologie cellulaire ... 52
2.2. Dégradation d' ADN intemucléosomique ... 54
2.3. Caspase 3 et PARP ... 56
2.4. Homologues Bcl-2 ... 59
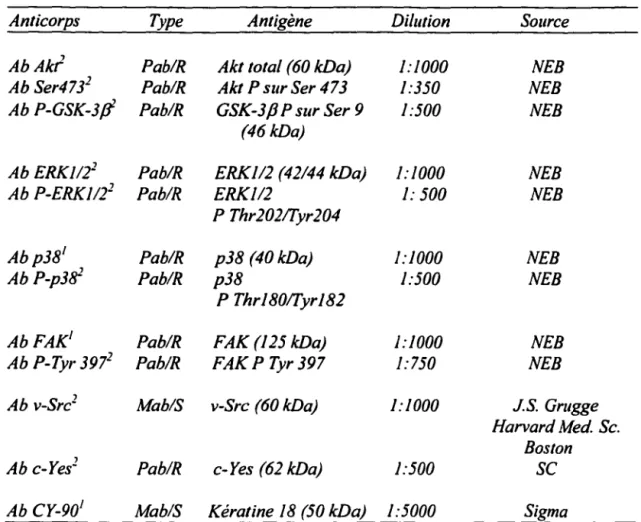
3. Molécules de signalisation impliquées dans la survie ... 62
3.1. MAPKs p42/p44 ... 62
3.2. AKT et GSK-3p ... 64
3.3. Kinase d'adhésion focalisée (FAK) ... 64
3.4. MAPKs p38 ... 67
4. Implications des MAPKs p38 avec les molécules impliquées dans la survie des cellules indifférenciées ... 70
5. À la recherche des isoformes p38 chez les cellules de la crypte intestinale humaine ... 70
CHAPITRE 4- DISCUSSION l. Régulation différentielle des homologues Bcl-2 par les voies de transduction de signaux chez les cellules HIEC ... 73
2. Voies intracellulaires impliquées dans la survie des cellules de la crypte
intestinale humaine ... 77
2.1. La phosphatidylinositol 3-kinase (PI3-K) ... 78
2.2. La kinase d'adhésion focalisée (FAK) ... 80
2.3. Les MAPKs p38 ... 82
3. Implication différentielle des trois isoformes p38 chez les cellules de la crypte intestinale humaine ... 83
4. Conclusions et perspectives ... 84
REMERCIEMENTS ... .... 90 BIBLIOGRAPHIE ... 9 l
LISTE DES ILLUSTRATIONS
CHAPITRE/- INTRODUCTION
Figure J. Axe crypte-villosité de l'épithélium intestinal.. ... 2
Figure 2. Apoptose au niveau de l'axe crypte-villosité ... .4
Figure 3. Phases du processus apoptotique ... ? Figure 4. Les homologues Bcl-2 ... .10
Figure 5. Les caspases ... 13
Figure 6. Apoptosome ... 16
Figure 7. Voies de signalisation intracellulaire ... 18
Figure 8. Voies de signalisation intracellulaire des MAPKs p38 ... 21
Figure 9. Compartimentalisation des homologues Bcl-2 le long de l'axe crypte-villosité du jéjunum fœtal humain ... 25
CHAPITRE 2- MATÉRIEL ET MÉTHODES Figure JO. Structure moléculaire de p38 avec son inhibiteur, SB 203580 ... 29
CHAPITRE 3- RÉSULTATS Figure J J. Effets des divers inhibiteurs de voies et/ou de molécules de survie sur la morphologie cellulaire des cellules de la crypte intestinale humaine après 24 heures ... 44
Figure J 2. Effets des divers inhibiteurs de voies et/ou de molécules de survie sur la morphologie cellulaire des cellules de la crypte intestinale humaine après 48 heures ... 45
Figure 13. Dégradation del' ADN intemucléosomique chez les cellules HIEC lorsque mises en traitement avec divers inhibiteurs de voies et/ou de molécules de survie ... .47 Figure 14. Modulation des niveaux relatifs d'expression des homologues Bcl-2
anti-apoptotiques chez les cellules HIEC après 24 heures ... .49 Figure 15. Modulation des niveaux relatifs d'expression des homologues Bcl-2
pro-apoptotiques chez les cellules HIEC après 24 heures ... .
50
Figure 16. Effets des divers inhibiteurs seuls et/ou combinés avec le SB 203580 sur la morphologie des cellules HIEC après 48 heures ... 53 Figure 17. Dégradation de I' ADN intemucléosomique chez les cellules HIEC
lorsque mises en présence de divers inhibiteurs seuls et/ou combinés avec le SB 203580 après 48 heures ... ..
55
Figure 18. Activation de la caspase 3 chez les cellules HIEC ... 57 Figure 19. Inactivation de l'enzyme PARP chez les cellules HIEC ... .58 Figure 20. Modulation des niveaux relatifs d'expression des homologues Bcl-2
anti-apoptotiques Bcl-2 et Mcl-1 chez les cellules HIEC après 48 heures .... 60 Figure 21. Modulation des niveaux relatifs d'expression de l'homologue Bcl-2
pro-apoptotique Bad chez les cellules HIEC après 48 heures ... 61 Figure 22. Niveaux relatifs d'activation des MAPKs p42/p44 chez les cellules
HIEC ... 63 Figure 23. Niveaux relatifs d'activation d'AKT chez les cellules HIEC ... 65 Figure 24. Niveaux relatifs d'activation de la GSK-3~ chez les cellules
HIEC ... 66 Figure 25. Niveaux relatifs d'activation de la FAK chez les cellules HIEC ... 68
Figure 26. Niveaux relatifs d'activation des MAPKs p38 chez les cellules
HIEC ... 69 Figure 27. Isoformes p38 chez les modèles« in vitro» et les tissus humains ... 71
CHAPITRE 4. DISCUSSION
Figure 28. Schéma des voies de transduction de signal qui seraient impliquées dans la survie des cellules HIEC ... 86
LISTE DES ABRÉVIATIONS
ADNc: ADN complémentaire AIF: apoptosis-inducing factor
Apaf-1: apoptotic protease-activating factor-1 ARNm: ARN messager
ASKI: apoptosis signal-regulating kinase l BH: domaine d'homologie à Bcl-2
BPB: bleu de bromophénol BSA: albumine de sérum bovin
CAD: caspase-activated deoxyribonuclease CASP-3: caspase-3
Cyto: cytochalasine D
DMEM: milieu d' Eagle modifié de Dulbecco dNTPs: déoxynucléotides triphosphates EGF: facteur de croissance épidermique ERK: extracellular-regulated kinase EtBr: Bromure d'éthidium
FAK: kinase d'adhésion focalisée FBS: sérum de bovin fœtal Gen: génistéine
GSK-3~: glycogen synthase kinase 3 HA: herbimicyne A
HIEC: cellules épithéliales intestinales humaines
1: insuline
ICAD: inhibiteur de la CAD JNK: c-Jun N-terminal Kinase Ly: Ly 294002
MAPKKK.: MAP kinase kinase kinase MAPKK: MAP kinase kinase
MAPK: mitogen-activated protein kinase MEK: MAPK/extracellular-regulated kinase mTOR: mammalian target of rapamycin PARP: poly(ADP)-ribose polymerase pb: paire de base
PBS: tampon phosphate salin
PCR: réaction de polymérisation en chaîne PD: PD 98059
POK: 3-phosphoinositide-dependent protein kinase Pl3K: phosphatidylinositol-3 kinase
PKB: protéine kinase B Rap: rapamycine SB 580: SB 203580 SB 190: SB 202190
SOS: sulfate de sodium dodécyl
SOS-PAGE: électrophorèse sur gel de polyacrylamide dénaturant ss: sans sérum
+S: avec sérum
TAK.I: TGFf3-activated protein kinase 1 TNF: tumor necrosis factor
LISTE DES PUBLICATIONS
Harnois C., Beaulieu J.F., Vachon P.H. Regulation ofhuman crypt cell survival. En préparation.
Gauthier R., Harnois C., Drolet J.-F., Reed J.C., Vézina A., Vachon P.H. Human intestinal epithelial cell survival; Differentiation state-specific control mechanisms. Am. J. Physio/., sous presse.
Gauthier R., Laprise P., Cardin É., Harnois C., Plourde A., Reed J.C., Vézina A., Vachon P.H. Differential sensitivity to apoptosis between the human small and large intestinal mucosae; linkage with segment-specific regulation of Bcl-2 homologs and involvement of signaling pathways. J. Cel/. Biochem., sous presse.
Vachon P.H., Cardin É., Harnois C., Reed J.C., Plourde A., Vézina A. Early acquisition ofbowel segment-specific Bcl-2 homolog expression profiles during development of the human ileum and colon. Histol. Histopatho/., sous presse. Vachon P.H., Cardin É., Harnois C., Reed J.C., Vézina A. (2000) Early
establishment of epithelial apoptosis in the developing human small intestine. /nt. J. Dev. Bio/. 44: 891-898.
Régulation de la survie chez les cellules de la crypte intestinale
humaine.
Charlène Harnois
Département d'anatomie et de biologie cellulaire, Faculté de médecine, Université de Sherbrooke.
L'apoptose est une forme de mort cellulaire programmée importante dans la morphogénèse, le renouvellement et le maintien des tissus chez les mammifères. Au niveau de l'épithélium intestinal, l'apoptose se retrouve à l'apex des villosités et de façon spontanée à la base des cryptes, permettant l'élimination des cellules endommagées. La médiation de l'apoptose ou de la survie se fait via des voies intracellulaires de transmission de signal, qui vont par la suite régulariser, entre autre, les homologues Bcl-2. Les homologues Bcl-2 participent
à
l'interprétation des stimuli concernant la décision de survie ou d'apoptose. L'établissement d'une compartimentalisation différentielle des homologues Bcl-2 le long de l'axe crypte-villosité a été déterminé lors de travaux précédents, et suggère des mécanismes de régulation différentielle de l'apoptose le long de l'axe crypte-villosité de l'épithélium intestinal humain.Dans le but de mieux caractériser les différences potentielles dans la régulation de la survie cellulaire le long de l'axe crypte-villosité, mon projet de recherche consistait à analyser la régulation de la survie des cellules de la crypte intestinale humaine. Pour ce faire, les analyses ont été effectuées chez les cellules cryptales normales HIEC (Human Intestinal Epithelial Cell), et ce, par l'inhibition de voies et/ou de molécules de signalisation telle que les MAPKs p42/p44, PI3-K (phosphatidylinositol 3-kinase), les MAPKs p38 et F AK (kinase d'adhésion focalisée). Suite à ces inhibitions, nous avons analysé la présence ou l'absence d'apoptose, ainsi que les niveaux relatifs d'expression des homologues Bcl-2. Ainsi, nous avons analysé les homologues Bcl-2 au niveau des cellules indifférenciées de la crypte. Nous avons observé une modulation différentielle des niveaux relatifs d'expression des homologues, cette modulation variant selon les voies de transduction inhibées. Par exemple, les niveaux relatifs d'expression de l'homologue anti-apoptotique Mcl-l sont augmentés par l'inhibition de la FAK, tandis que ceux de Bax ne sont pas affectés.
Plusieurs voies sont impliquées dans la médiation des signaux de survie et nous avons identifié lesquelles étaient importantes chez les cellules indifférenciées de l'épithélium intestinal. Premièrement, nous avons observé que les MAPKs p42/p44 ne semblaient pas impliquées dans la survie contrairement à la PI3-K et l'adhésion cellulaire via la F AK. Dans la voie de la PI3-K, AKT serait indépendante de la P13-K puisque ses niveaux relatifs d'activation ne variaient pas en fonction de l'inhibition de la PI3-K, de même que la F AK et les tyrosines kinases. Ceci nous suggérait, de plus, qu' AKT ne serait pas impliquée dans la survie des cellules HIEC. Les MAPKs p38 auraient un double rôle, car elles seraient impliquées dans l'apoptose lors de l'inhibition de la PI3-K et de la FAK, et dans la survie avec les membres des tyrosine
kinases Src. Cette complexité suggère l'implication différentielle des isoformes p38. Quatre isoformes sont connues (a,
p,
y et B), toutefois nos analyses par RT-PCRindiquent que seulement trois (a,
p
et y) sont présentes chez les cellules HIEC. D'ailleurs, il a été précédemment démontré chez les myocytes cardiaques que l'activation de ('isoformea
favorisait l'apoptose etp,
la survie. Ainsi, les trois isoformes p38 pourraient jouer des rôles différents chez les cellules indifférenciées de l'épithélium intestinal.En conclusion, ce travail nous a permis de démontrer que les homologues Bcl-2 sont modulés de façon significative par les différentes voies de signalisation. Il a aussi permis de démontrer l'importance de deux voies de transduction de signal dans la survie des cellules HIEC soit, l'adhésion cellulaire via l'activation de la FAK, et la PI3-K. La voie des MAPKs p38 est aussi importante pour la survie, de même que pour l'apoptose. Ce double rôle des MAPKs p38 suggère une régulation différentielle des isoformes p38 (a,
p,
y) chez les cellules HIEC.CHAPITRE J
INTRODUCTION
J. Le modèle intestinalDès 18-20 semaines de gestation, l'apparence morphologique de l'intestin grêle est très semblable à celle de l'intestin adulte (Ménard, 1989) et l'axe crypte-villosité est pleinement établi (Ménard et Beaulieu, l 994).
L'axe crypte-villosité représente l'unité fonctionnelle de l'intestin (figure 1). Il possède une morphologie et des propriétés fonctionnelles particulières. Au niveau de la crypte, l'on retrouve les cellules souches (faiblement différenciées), les cellules prolifératives ainsi qu'un petit nombre de cellules de Paneth (cellules sécrétrices différenciées), tandis que l'on retrouve les cellules d'absorption (entérocytes) ainsi que les cellules caliciformes au niveau de la villosité (Pageot et al., 2000). La différenciation de chaque type cellulaire (sauf les cellules de Paneth) s'effectue au cours de la migration des cellules le long de la crypte (Leblond, 198 l) pour être pleinement différenciées à l'atteinte de la villosité. Les cellules différenciées vont par la suite continuer leur migration pour finalement être expulsées dans la lumière intestinale.
Le renouvellement de l'épithélium intestinal est rapide et constant. Le processus de génération cellulaire, de migration et de différenciation
à
partir de la base des cryptes jusqu'au sommet des villosités, où les cellules seront expulsées, prend environ trois à cinq jours (Babyatsky et Podolsky, l 999).Figure J. Axe crypte-villosité de /'épithélium intestinal.
(Tiré et modifié de Alberts et al., 1995; Yamada et al., 1999) Légende: TG signifie le temps de génération
cellules caliciformes \
\
cellules ; absorbantes 1\J
cellules épithéliales -crypte (250 cellules) migration cellulaire HIEC \-
-•
cellules quiescentes différenciées•
extrusion dans la lumière intestinale (Apoptose)("\
\ 1
1~
- -villosité'l
/1·~
~
,1 1.1
1
·-~.---ç)~
·~· =1-' ~\ (~ ~ ~'J
~~~:i\l
~ • 1~ "H
z!.F ti·ssu ~.,~ _____:::__ __ conjonctif I cellules quiescentes différenciées cellules à division rapide (TG = 11 heures) lâchecellules souches à division lente (TG = 24 heures)
L'extrusion des cellules au sommet des villosités est principalement due au processus de mort cellulaire programmée, aussi appelé apoptose. Ce processus est majoritairement observé au sommet des villosités (figure 2A) mais il est quelque fois perceptible au niveau des cryptes où il se produit de façon spontanée, permettant l'élimination des cellules prolifératives endommagées ainsi que le renouvellement des cellules de Paneth (Ménard, 1989; Ménard et Beaulieu, 1994; Gordon et Hermiston, 1994; Potten, 1992; 1997).
L'épithélium de la muqueuse intestinale représente un modèle de choix pour l'analyse de la coordination entre la prolifération, la migration, la différenciation ainsi que la mort cellulaire au cours de son développement et de son maintien (Ménard, 1989). Il n'en demeure pas moins que les modèles cellulaires intestinaux sont importants pour l'analyse des propriétés cellulaires. En 1996, un modèle cellulaire a été établi représentant des cellules épithéliales normales de la crypte intestinale humaine, les cellules HIEC (Human Intestinal Epithelial Cell), qui ont été isolées à partir d'intestins grêles fœtaux âgées de 17 à 19 semaines (Perreault et Beaulieu, 1996). Les cellules HIEC constituent des souches cellulaires exhibant des caractéristiques morphologiques et fonctionnelles qui s'apparentent fortement aux cellules absorbantes immatures (indifférenciées) des cryptes (Pageot et al., 2000; Perreault et Beaulieu, 1996). C'est le seul modèle disponible actuellement pour l'étude des cellules cryptales normales. Bien que cela ne fasse pas l'objet du présent travail, d'autres modèles existent pour l'étude de la différenciation de l'épithélium intestinal ainsi que ses mécanismes de régulation. Un de ces modèles est la lignée cellulaire d'adénocarcinomes de colon humain Caco-2. Cette lignée cellulaire a la
Figure
1. Apoptose au niveau de l'axe crypte-villosité. (Tiré de Vachon et al., sous presse)En A, on retrouve des entérocytes en apoptose, indiqués par des flèches, situés à l'apex des villosité de l'épithélium intestinal. En B, il n'y a aucune cellule apoptotique visible au niveau des cryptes. Légende: V signifie villosité, C signifie crypte, M singnifie mésenchyme. Le petit pointillé délimite l'épithélium du mésenchyme.
A. B. 1
I
1 1 1 1 1 11
11
\\
,/\
1/)
1Il
c
1
1 \ 'v\
) ( 1 >-. ~ J l)c
particularité d'entamer le processus de différenciation à l'atteinte de la confluence et possède des caractéristiques similaires à celles retrouvées chez l'épithélium intestinal fœtal humain (Ménard et Beaulieu, 1994; Rousset, 1986; Zweibaum et Chantret, 1989). Ce modèle est toutefois limité de part la nature cancéreuse des cellules et leur origine du côlon. Il n'existe pas encore de modèle cellulaire représentant les cellules pleinement différenciées de l'épithélium intestinal. Toutefois, il est possible de séparer l'épithélium du mésenchyme par l'utilisation de matrisperse (Perreault et Beaulieu, 1998) et d'obtenir par cette méthode les entérocytes pleinement différenciés. Ceux-ci peuvent être maintenus en culture primaire de 10 à 12jours.
2. Mort cellulaire programmée
La mort cellulaire programmée est un processus physiologique qui correspond à l'élimination des cellules endommagées, infectées ou indésirables (sculpture tissulaire). Elle est utilisée dans trois situations particulières: le développement, l'homéostasie et le renouvellement tissulaire.
2.1. Apoptose
Il existe deux formes de mort cellulaire programmée: l'apoptose et l'anoïkose. Ce sont des processus associés avec la régulation tissulaire et n'impliquant qu'une seule cellule à la fois (Cohen, 1996). Ces processus exigent la participation active des enzymes endogènes dans la médiation de la mort, avant que les membranes perdent leur intégrité. Les membranes des cellules apoptotiques restent quasi intactes jusqu'aux dernières phases du suicide métabolique permettant aux cellules avoisinantes de les phagocyter et de les éliminer avant que leur contenu ne soit
relâché et n'engendre de réponse inflammatoire locale (Cohen, 1996; Hale et al.,
1996; Jacobson et al., 1997; Jones et Gores, 1997; Saini et Walker, 1998). Aucune différence fondamentale ne distingue ces deux processus à part le fait que c'est la perte de contact entre la cellule et sa matrice extracellulaire qui correspond à l'anoïkose. L'anoïkose est un mot dérivé du grec et signifiant «sans abris». Ce contact cellule-matrice, dans la majorité des types cellulaires, se fait via des intégrines qui sont les récepteurs majeurs de la matrice extracellulaire in vivo (Beaulieu, 1997; 1999; Frisch et Ruoslahti, 1997).
2.J.l. Phases du processus apoptotique
L'apoptose se déroule en trois phases précises et chronologiques (figure 3). La première phase, la phase d'induction, consiste en la perception d'un ou de plusieurs stimulus provenant de l'extérieur ou de l'intérieur de la cellule. Les stimuli captés de l'extérieur de la cellule seront délivrés à l'intérieur via des récepteurs de surface, permettant ainsi l'activation de différentes voies de transduction de signal puis, l'interprétation de ces signaux par les homologues Bcl-2, centre de régulation critique de l'apoptose (Jacobson et al., 1997; Kroemer et al., 1995; Vaux et Strasser, 1996). Si la balance des homologues Bcl-2 favorise les homologues pro-apoptotiques, la cellule entamera la deuxième phase, la phase effectrice. La cellule atteint alors un point de non-retour vers la mort cellulaire. C'est durant cette phase que les caspases, des cystéines protéases, sont activées. Leurs activations permet à la cellule d'entamer la dernière phase, la phase de dégradation. Les structures ainsi que les fonctions vitales sont détruites durant cette phase, amenant une morphologie
Figure 3. Phases du processus apoptotique.
(Tiré et modifié de Saini et Walker, 1998)
Le processus apoptotique se déroule en trois phases: la phase d'induction (perception du stimulus), la phase effectrice (activation de la machinerie effectrice) et la phase de dégradation (corpuscules apoptotiques ).
Agents toxiques, Cytokines, Stress, Dommage à l 'ADN ... 1° Phase d 'Induction
•
3° Phase de Dégradation Décision: Apoptose? Survie? Homologues Bcl-2:Pro-apoptotiques (Bax, Bak, Bad)
Anti-apoptotiques (Bcl-2, Mcl-1, Bel-XL) 2° Phase Effectrice
•
Caspases: Inductrices et Effectrices Caractéristiques de l'apoptose Dégradation d 'ADN et de protéines Condensation de chromatineCytolyse douce
apoptotique visible au niveau du cytoplasme, de la membrane plasmique et du noyau. La chromatine se condense et 1 'ADN se dégrade en fragments de 180-200 pb (Cohen, 1996; Hale et al., 1996; Jacobson et al., 1997; Jones el Gore, 1997; Vaux et Strasser,
1996). La cellule subit par la suite une cytolyse douce et forme des corpuscules apoptotiques, qui seront phagocytés par d'autres cellules.
2.1.2. Morp/10/ogie caractéristique de l'apoptose
L'apoptose amène des changements morphologiques caractéristiques. Le premier changement morphologique observé au cours du processus apoptotique est la condensation de la chromatine nucléaire en masses denses ayant la forme de croissants accolés à la membrane nucléaire, qui vont par la suite se fragmenter. La cellule perd un tiers de son volume, sa densité cellulaire augmente, son réticulum endoplasmique se dilate et ses organelles s'organisent en formes compactes pour ainsi permettre la formation de gonflements membranaires, qui vont par la suite former les corpuscules apoptotiques. Au cours de ces transformations, la cellule diminue rapidement sa synthèse d' ARN et de protéines, pour ensuite les dégrader. Simultanément, les cellules apoptotiques se détachent des cellules avoisinantes ou de la matrice extracellulaire et les structures spécialisées de surface, comme les microvillosités, disparaissent.
La fragmentation de I 'ADN est l'événement le plus caractéristique de l'apoptose et sert comme marqueur biochimique. Elle se réalise en deux parties. La première partie est très rapide et se retrouve chez la majorité des cellules en apoptose. Elle consiste en la fragmentation de l' ADN en fragments de 30-50 et/ou 200-300 kb qui serait dû à l'activation de l'enzyme AIF (apoptosis-inducing factor) (Daugas et
al., 2000; Susin et al., 1999). La deuxième partie est plus tardive et consiste au clivage de l' ADN double brin au niveau intemucléosomique, donc en fragments de multiples de 180-200 pb. Cette fragmentation d' ADN serait dû à l'activation de la CAD (caspase-activated deoxyribonuclease) via l'inactivation de son inhibiteur, l'ICAD (Enari et al., 1998; Sakahira et al., 1998). La détection de la fragmentation d' ADN en multiples de 180 pb est une technique couramment utilisée dans l'analyse de l'apoptose et se fait par électrophorèse sur gel d'agarose. Toutefois, il ne faut pas oublier que dans certains types cellulaires, il peut y avoir présence d'apoptose en absence de fragmentation d' ADN (Cohen, 1996; Hale et al., 1996; Jacobson et al., 1997; Kroemer et al., 1995), car l'absence de fragmentation d'ADN n'empêche pas les changements cytoplasmiques de se produire.
2.1.3. Centre de régulation: Homologues Bcl-2
Deux familles de protéines ont démontré leurs rôles importants dans la régulation de l'apoptose (Lindenboim et al., 2000). La première famille est celle des homologues Bcl-2 (figure 4). Les homologues Bcl-2 sont divisés en 2 classes, soit les anti-apoptotiques régularisant de façon négative l'apoptose, et les pro-apoptotiques favorisant l'apoptose. Les homologues Bcl-2 sont aussi divisés en trois sous-familles selon leur structure (figure 4). Ces protéines ont des séquences homologues parmi quatre régions appelées domaine d'homologie Bcl-2 (BH) identifiés BH l à BH4. Ces régions conservées contrôlent l'habileté de ces protéines à dimériser et sont responsables de leur fonction pro-/anti-apoptotique (Chao et Korsmeyer, 1998). Le domaine BH3 serait nécessaire pour la fonction pro-apoptotique (Chittenden et al.,
Figure 4. les homologues Bcl-2.
(Tiré et modifié de Adams et Cory, 1998; Tsujimoto et Shimizu, 2000) Dessin schématique des homologues Bcl-2 et des protéines qui leurs sont reliées. Il y a trois sous-familles: la sous-famille Bcl-2 favorisant la survie cellulaire et les sous-familles Bax et BH3 favorisant l'apoptose. Les domaines d'homologie Bcl-2 BHl à BH4 sont des domaines conservés et le domaine transmembranaire n'est pas présent chez tous les homologues Bcl-2.
Bcl-2 Bcl-2 Bel-XL Boo Mcl-1 Bcl-w Al (BH-1) Bax Bax Bak Bad Mtd (Bok) Diva BH3 Bik Bid Bim Hrk (DP5) Blk Bnip3, Bnip3L Noxa dimérisation
1995; Conradt et Horvitz, 1998) tandis que le domaine BH4, qui est restreint aux membres anti-apoptotiques, serait essentiel pour la répression de l'activité de mort cellulaire (Huang et al., 1998). La première sous-famille est la sous-famille Bcl-2 possédant les domaines BHI à BH4. Elle comprend entre autre Bcl-2, Bel-XL et Mcl-1. La deuxième sous-famille est la sous-famille Bax possédant tous les domaines sauf BH4. Elle comprend entre autre Bax, Bak et Bad. La troisième sous-famille est la sous-sous-famille BH3 et ne possède que le domaine BH3. Elle comprend entre autre Bik, Bid et Bim (Adams et Cory, 1998; Chao et Korsmeyer, 1998; Tsujimoto et Shimizu, 2000).
L'expression des homologues Bcl-2 peut être régularisée tant par des modifications transcriptionnelles que post-traductionnelles. Par exemple, plusieurs gènes anti-apoptotiques sont induits par certaines cytokines et des gènes pro-apoptotiques, comme Bax, sont induits par des dommages à I' ADN (Adams et Cory, 1998). Ensuite, il y a le titrage des fonctions anti- et pro-apoptotiques par homo- ou hétérodimérisation des homologues Bcl-2. Par exemple, lorsque Bax est hétérodimérisé avec Bcl-2, c'est la fonction anti-apoptotique de Bcl-2 qui prédomine (Reed et al., 1996; Yin et al., 1994). Ces interactions entre les membres des
homologues Bcl-2 établissent un seuil de mort cellulaire, même si ceux-ci peuvent aussi agir de façon indépendante (Knudson et Korsmeyer, 1997; Kroemer, 1997), face à une grande variété de signaux apoptotiques. Le seuil apoptotique varie beaucoup selon le type cellulaire ainsi que le stade de développement et de différenciation (Dragovich et al., 1998). Un autre moyen de régulation des
homologues Bcl-2 se fait au niveau de leurs ARN messagers, qui peuvent subir un épissage alternatif modifiant l'activité primaire des homologues. L' épissage
alternatif de Bel-XL en Bcl-Xs est un bon exemple, car l'épissage transforme son activité anti-apoptotique en activité pro-apoptotique (Boise et al., 1993). Des clivages protéolytiques amènent aussi des changements fonctionnels, de même que la phosphorylation. Par exemple, l'homologue Bid sous sa forme inactive est retrouvé dans le cytoplasme et lorsque clivé, il devient actif et transloque aux membranes des mitochondries (Green, 1998). Pour ce qui est de l'homologue pro-apoptotique Bad, lorsqu'il est phosphorylé, il devient inactif et est recruté par la protéine chaperone 14-3-3 pour ensuite être dégradé (Zha et al., 1996).
Plusieurs des membres de la famille Bcl-2 possèdent un domaine transmembranaire (TM) près de la région C-terminale, leur permettant de se localiser au niveau de la face cytoplasmique de la membrane extérieure des mitochondries, du réticulum endoplasmique ainsi que de l'enveloppe nucléaire. Ils pourraient ainsi enregistrer les dommages fait à ces compartiments et affecter leurs réactions en modifiant le flux des petites protéines (Adams et Cory, l 998). Les autres homologues Bcl-2 sont retrouvés dans le cytosol.
2.1.4. Maclrinerie effectrice: Caspases
La deuxième famille de protéines importantes dans le processus apoptotique est la famille des caspases (figure 5). Les caspases peuvent être divisées en deux groupes selon leur fonction initiatrice ou effectrice, ainsi qu'en trois sous-groupes selon leur homologie et leur spécificité tétrapeptidique (DXXD). La spécificité tétrapeptidique peut altérer leur spécificité de substrat (Chao et Korsmeyer, 1998). Il
y
14 caspases connues jusqu'à présent chez les mammifères et elles ne sont pas toutes nécessaires à la mort cellulaire. Certaines d'entre elles sont plus importantesFigure 5. les cas pas es.
(Tiré et modifié de Thornberry et Lazebnik, 1998)
La forme précurseure des caspases correspond à l'état inactif. Elle est composée de deux sous-unités: la longue et la petite. C'est dans la petite sous-unité que l'on retrouve le site catalytique (triangle rouge). L'enzyme active correspond à un hétérotétramère formé de deux petites et de deux longues sous-unités.
précurseur pro-domaine
•
aspÎx aspÎx enzyme active sites catalytiquesque d'autres (Cohen, 1997) et cela dépend de leurs substrats. Par exemple, la caspase 3 et la caspase 7 sont importantes de par leur capacité à cliver l'enzyme P ARP (poly(ADP)-ribose polymerase) pour la rendre inactive et empêcher la réparation de I' ADN (Cohen, 1997). Les caspases existent sous forme de pro-caspases inactives et sont séquestrées dans divers compartiments cellulaires restreignant ainsi leur activation et les séparant de leurs substrats (figure 5) (Porter, 1999). Les pro-caspases (30 à 50 kDa) sont constituées d'un pro-domaine en N-terminal suivi d'une longue et d'une petite sous-unité (figure 5). Le pro-domaine est important dans la régulation de l'apoptose parce qu'il permet la reconnaissance des molécules adaptatrices ainsi que la régulation de l'activation des caspases. Pour être actives, les pro-caspases doivent s'homodimériser, ce qui va permettre leur autoclivage et former un hétérotétramère composé de deux petites et deux longues sous-unités (Cohen, 1997; Thomberry et Lazebnik, 1998). L'hétérotétramère constitue la caspase active (figure 5). L'activation des caspases initiatrices permet l'activation des caspases effectrices et crée une boucle d'amplification. Ce sont les caspases effectrices qui amènent les nombreux changements morphologiques caractéristiques de l'apoptose par le clivage de leurs divers substrats (Bossy-Wetzel et Green, 1999). Plusieurs de leurs substrats « performent » leurs fonctions exclusivement au noyau, par exemple, les lamines qui sont clivées par la caspase 6, ainsi que la polymérase poly(ADP-ribose), pRb, ADN topoisomérase l qui sont clivés par la caspase 3. Les caspases vont régulariser indirectement les structures cellulaires par le clivage de plusieurs protéines impliquées dans la régulation du cytosquelette, incluant la gelsoline (Kothakota et al., 1997) et la FAK (Wen et al., 1997). Le clivage de ces protéines
résulte en la dérégulation de leur activité (Thomberry et Lazebnik, 1998) amenant les changements morphologiques caractéristiques de l'apoptose.
z.z.
ApoptosomeL'apoptose est initié par trois types de stimuli chez les cellules de mammifères. Deux des stimuli est le retrait de facteurs de croissance du milieu environnant ou la perte d'adhésion cellulaire. Ce retrait ou cette perte empêche l'activation de voies de transduction de signal importantes dans la survie, celles-ci régularisant positivement des homologues Bcl-2 anti-apoptotiques et négativement des pro-apoptotiques. Des observations in vitro ont démontré que certains homologues Bcl-2 seraient capables de former des pores au niveau des membranes des organelles où ils se retrouvent comme les mitochondries (Bossy-Wetzel et Green, 1999; Brenner et al., 2000; Chao et Korsmeyer, 1998; Dragovich et al., 1998; Tsujimoto et Shimizu, 2000). Il est démontré que l'ouverture de pores dans la membrane des mitochondries résulte en le relâchement de cytochrome c. Le cytochrome c relâché dans le cytosol va s'associer à Apaf-1 ( apoptotic protease-activating factor-1) en présence d 'A TP et induit un changement de sa conformation. Ce complexe oligomérique peut à son tour recruter deux pro-caspases initiatrices (comme la caspase 9) via une interaction domaine CARO-domaine CARD (Srinivasula et al., 1998) et permettre leur autoclivage et activation. Le complexe cytochrome c, Apaf-1 et pro-caspase 9 s'appelle apoptosome (figure 6). L'activation de la caspase initiatrice amène ainsi l'activation de caspases effectrices et provoque une boucle d'amplification irréversible.
Une autre façon d'induire l'apoptose est via la signalisation des récepteurs de mort cellulaire comme le TNF (Tumor Necrosis Factor) ou le Fas. L'interaction de
Figure 6. Apoptosome.
(Tiré et modifié de Adams et Cory, 1998)
L'apoptosome se forme en présence d'ATP. Il comprend Apaf-l lié avec le cytochrome c relâché des mitochondries, ce qui amène un changement de conformation permettant le recrutement de deux pro-caspases initiatrices via le domaine CARO.
domaine CARD pro-caspase 9 petite petite cytochrome c caspase 9
ces récepteurs avec des molécules adaptatrices permet le recrutement et l'activation d'une cascade de caspases. Les dommages à l' ADN initient aussi le processus apoptotique. Ce type de stimulus apoptotique est toutefois le moins caractérisé (Dragovich et a/., 1998).
3. Signalisation dans la régulation de l'apoptose 3.1. Survie cellulaire: suppression de l'apoptose
Le destin de chaque cellule est de mourir. Toutefois, il est crucial pour la survie de l'organisme que la mort cellulaire programmée soit régularisée (Jarpe et al.,
1998). Ainsi, les signaux de survie perçus à l'extérieur de la cellule, comme les facteurs de croissance et l'adhésion cellulaire, sont importants pour maintenir la survie et supprimer l'apoptose.
3.2. Principales voies de survie
Il existe plusieurs voies de transduction de signal importantes pour la survie cellulaire (figure 7). Celles-ci varient selon le type cellulaire ainsi que les récepteurs stimulés. Les voies les plus importantes sont l'adhésion cellulaire via l'activation de la kinase d'adhésion focalisée (FAK), la voie Pl3-K (Phosphatidylinositol 3-Kinase), la voie des MAPKs (Mitogen-Activated Protein Kinases) p42/p44 et celles des MAPKs p38/JNK (c-Jun N-terminal Kinase).
3.2.J. MAPKs
La cascade de signalisation des MAPKs est conservée de façon remarquable au cours de l'évolution remarquable. Elle est composée de trois protéines kinases: les
Figure 7. Voies de signalisation intracellulaire.
Schématisation des principales voies de transduction de signal impliquées dans la survie dont, la voie PI3-K (rose), la voie de la F AK (vert), les MAPKs p42/p44 (blanc) et les MAPKs de stress p38/JNK (orange et jaune). Ces voies permettent la régulation de l'expression des gènes impliqués dans les réponses cellulaires, incluant la prolifération, la différenciation, la survie et l'apoptose. Légende: RTK signifie récepteur tyrosine kinase, a.~ signifie les récepteurs intégrines. Les ronds présents au niveau de la paroi droite latérale constituent les produits lipidiques de la PI3-K (Ptdlns(3)P, Ptdlns(3,4 )P2, Ptdlns(3,4,5)P3), Ptdlns signifiant phosphatidylinositol.
Lame basale
MAP kinases (MAPK), les MAPK kinases (MAPKK) et finalement des MAPKK kinases (MAPKKK) (Schaeffer et Weber, 1999). Les MAPKKKs phosphorylent et activent les MAPKKs qui vont à leur tour activer par phosphorylation les MAPKs. Les MAPKs activées régularisent l'activité de certains facteurs de transcription ainsi que de quelques kinases en aval par phosphorylation. Elles contrôlent ainsi l'expression de gènes et les fonctions cellulaires (lchijo, 1999).
3.2.1. J. MAPKs p42/p44
La voie des MAPKs p42/p44 (figure 7) est activée par de nombreux stimuli, dont les facteurs de croissance, qui seront perçus par des récepteurs à activité tyrosine kinase, qui vont recruter via des protéines adaptatrices et des facteurs d'échanges, la petite protéine G Ras. Ras active raf, une sérine/thréonine kinase, qui va ensuite activer MEK (MAPK/ERK kinase). MEK activée, va phosphoryler les MAPKs p42/p44 qui vont alors transloquer au noyau et transactiver divers facteurs de transcription. L'expression de certains gènes sera affectée pour promouvoir la croissance, la différenciation ou la mitose (Tibbles et Woodgett, 1999). La voie des MAPKs p42/p44 peut mener à l'activation de la kinase p90rsk-l, qui va phosphoryler Bad, un homologue Bcl-2 pro-apoptotique (Frodïn et Gammeltoft, 1999; Nebreda et Gavin, 1999). De plus, Bag-1, une protéine associée aux homologues, peut activer Raf-1, qui va par la suite phosphoryler Bcl-2, un anti-apoptotique, le stabilisant et amplifiant sa fonction (Wang et al., 1993). Les MAPKs p42/p44 peuvent aussi régulariser les niveaux d'expression de mcl-1, un anti-apoptotique (Townsend et al., 1998) et de CREB. La voie p42/p44 permet ainsi de moduler positivement
l'expression des homologues Bcl-2 en faveur des anti-apoptotiques pour favoriser la survie (Bonni et al., 1999).
3.2.J.2. MAPKs p38/JNK
Les voies des MAPKs p38 et des JNKs (figure 7) sont activées par une très grande variété de stimuli extracellulaires. Les stimuli les plus importants sont les cytokines, comme l'interleukine l (IL-1) et le TNFa, de même que les stress cellulaires tels les chocs thenniques et osmotiques ainsi que les rayons UV (Nebreda et Porras, 2000). La majorité des stimuli activant p38/JNK sont pro-apoptotiques, toutefois, le destin cellulaire dépend énonnément, du degré de stimulation, du type cellulaire ainsi que de son contexte (lchijo, 1999). Ainsi, ces kinases peuvent être impliquées autant dans la survie que dans l'apoptose. Certaines observations ont été établies concernant les voies de ces deux kinases de stress (Tibbles et Woodgett, 1999). Les JNKs sont phosphorylées par les MAPKK.s MKK4 et MKK7, qui sont activées par MEKKl (MAPKKK) (Dérigard et al., 1995; Han et al., 1996; Lu et al., 1997; Moriguchi et al., 1997). Les MAPKs p38 (figure 8) sont phosphorylées par
MKK.3 et MKK6. MKK3 et 6 sont phosphorylées par plusieurs kinases en amont dont, ASKl, MTKI et TAKI (lchijo et al., 1997; Tibbles et Woodgett, 1999). Il existe une grande quantité de MAPKKKs pouvant activer ces deux voies, dont la majorité sont encore inconnues (Deacon et Blanlc, 1999; Garrington et Johnson,
1999; Ichijo, 1999).
Figure 8. Voies de signalisation intracellulaire des MAPKs p38.
Légende: PAK signifie p21-activated kinase, MAPKAP-K2/3 signifie MAPK activated protein kinase 2/3, HSP27 signifie heat shock protein 27, ATF2 signifie activating transcription factor 2.
3.1.J.3. MAPKs p38
Il existe quatre isoformes de p38 jusqu'à maintenant: a.,
13,
y
eto
(Cuenda et al., 1997; Han et al., 1994; Jiang et al., 1996; Lechner et al., 1996; Li et al., 1996; Mertens et al., 1996; Rouse et al., 1994; Stein et al., 1997; Wang et al., 1997). Ces isoformes possèdent une distribution différentielle: a. et13
sont retrouvées de façon ubiquitaire, y est retrouvée préférentiellement au niveau du muscle squelettique et ô se situe majoritairement dans les glandes endocrines et exocrines (Wang et al., 1997). Les MAPKs p38 sont impliquées dans la survie et l'apoptose selon les types cellulaires ainsi que le stimulus (Berra et al., 1998; Kummer et al., 1997; Xia et al., 1995; Zechner et al., 1998). MKK3 phosphoryle de façon spécifique les isoformes a.,y
eto
tandis que MKK.6 active les quatres isoformes (figure 9). Il a aussi été démontré in vitro que MKK4 et MKK7, des MAPKKs impliquées dans la voie des JNKs pourraient activer p38a. spécifiquement (Hu et al., 1999; Jiang et al., l 999). De plus, les MAPKs p38 régularisent l'activité de plusieurs substrats, dont divers facteurs de transcription (ATF-2, p53, CHOP), par phosphorylation (Hazzalin et al., 1996; Huang et al., l 999; Raingeaud et al., 1995).3.1.1. P/1osphatidylinosito/ 3-kinase (P/3-K)
Une des voies les plus connues impliquées dans la survie cellulaire est la voie de la PI3-K (figure 7). Cette voie est générallement activée par des stimuli induisant l'activité tyrosine kinase cellulaire, celle-ci pouvant provenir des récepteurs à activité tyrosine kinase, des tyrosines kinases comme la famille Src, ou par des récepteurs couplés aux protéines G hétérotrimériques (Vanhaesebroeck et Alessi, 2000). La PI3-K est un hétérodimères constitué d'une sous-unité catalytique d'environ 110 kDa
ainsi que d'une sous-unité régulatrice/adaptatrice. Elle catalyse la conversion de phosphatidylinositol (Ptdlns), Ptdlns(4)P et Ptdlns(4,5)P2 en Ptdlns(3)P, Ptdlns(3,4)P2 et Ptdlns(3, 4, 5)PJ. Il existe de multiples isoformes de PI3-K diviser en trois classes, toutefois, seulement la classe l active AKT chez les cellules. Ainsi, les produits lipidiques de la PI3-K peuvent activer directement AKT via une liaison avec son domaine PH (pleckstrin homology) ou localiser et activer la PDK qui va, par la suite, phosphoryler et activer AKT/PKB (Vanhaesebroeck et Alessi, 2000). Il y a trois membres connus de la famille AKT (AKT-1, AKT-2 et AKT-3) qui sont exprimés différentiellement aux niveaux de l'ARNm et des protéines (Datta et al.,
1999). La p57AKT est nécessaire et suffisante pour conférer des signaux de survie PI3-K-dépendante aux cellules (Berra et al., 1998; Datta et al., 1999) et possède
plusieurs cibles, incluant Bad, caspase 9, mTOR et GSK-313 (Datta et al., 1999;
Stambolic et al., 1999; Tee et Proud, 2000). Bad est phosphorylé par AKT puis
recruté par la protéine chaperone 14-3-3 qui va le dissocier de Bel-XL et permettre à ce-dernier d'exercer ses fonctions anti-apoptotiques (Datta et al., 1999; Downward,
1998; Vanhaesebroeck et Alessi, 2000; Xing et al., 2000). L'activation de la PI3-K
mène à une augmentation de l'expression de Mcl-l, un anti-apoptotique (Wang et al., 1999). La caspase 9, une caspase initiatrice de la cascade de caspases, est phosphorylée in vitro par AKT (Stambolic et al., 1999). Cette phosphorylation
inhibe l'activité protéase de cette caspase, réduisant ainsi la capacité cellulaire d'induire l'activation protéolytique de certaines caspases en aval. mTOR (mammalian target of rapamycin), un autre substrat d' AKT, peut être inhibé par la rapamycine (Brown et al., 1994; Tee et Proud, 2000). Cette kinase régularise des
événements impliqués dans le contrôle de la phase d'initiation de la traduction, dont
p70S6K et 4E-BPI (eucaryotic initiation factor 4E-binding protein l) (Alessi et Downes, 1998; Tee et Proud, 2000). La p70S6K, dont le substrat majeur est la protéine ribosomale S6, et S6 phosphorylée seraient importantes dans la régulation de la traduction d' ARN ms encodant des protéines ribosomales et des facteurs de transcription d'élongation (Tee et Proud, 2000). mTOR serait aussi impliquée comme un des médiateurs de la progression en phase G l du cycle cellulaire chez les cellules de mammifères (Brown et al., 1994). L'inhibition de mTOR induit l'apoptose via l'inactivation de p70S6K (Brenneisen et al., 2000). La GSK-3f3 (glycogen synthase kinase 3) est une des autres cibles d' AKT. Sa phosphorylation par AKT la rend inactive, ce qui permet l'activation de la synthèse de glycogène. Cette kinase est aussi impliquée dans la régulation de plusieurs voies de signalisation intracellulaire, incluant le contrôle des facteurs de transcription AP- l et CREB (cyclic AMP response element binding protein) et la voie winglesslf3-caténine durant le développement de la mouche (Cross et al., 1995; Downward, 1998). Il a même été démontré que sa surexpression pouvait induire l'apoptose (Pap et Cooper, 1998). Ainsi, AKT pourrait propager des signaux de survie via la phosphorylation (active mTOR, inactive GSK-3f3) et la régulation coordonnée d'une variété de régulateurs apoptotiques (ex: Bad).
3.2.3. Adhésion cellulaire
Comme déjà mentionné, toute perturbation dans l'adhésion cellulaire induit l'anoïkose. Cette perturbation est perçue par les intégrines, qui médient leurs actions par le recrutement et l'activation de la kinase d'adhésion focalisée (FAK), formant par la suite un complexe avec les membres tyrosine kinases de la famille Src
(Schlaepfer et al., 1999). Ce complexe peut ensuite activer différentes voies de signalisation comme les voies MAPKs p42/p44, MAPKs p38/JNK et majoritairement celle de la PI3-K (figure 7) (Schlaeper et al., 1999). La F AK joue ainsi un rôle important dans la suppression de l'apoptose. Des travaux ont d'ailleurs démontré que sa surexpression empêchait l'anoïkose (Frisch et al., 1996) et que son inhibition induisait I' anoïkose (Hungerford et al., 1996).
3.2.4. les membres de la famille Src
Les membres de la famille Src (52-62 kDa) sont des tyrosine kinases qui ont des rôles importants dans le contrôle de la croissance, la prolifération et la différenciation (Thomas et Brugge, 1997). Les membres c-Src, Y es et Fyn sont nécessaires, entre autre, pour la signalisation médiée par les intégrines en réponse à ! 'adhésion cellulaire à la matrice extracellulaire (Klinghoffer et al., 1999). Elles peuvent former un complexe avec la F AK et activer, entre autre, deux kinases en aval impliquées dans la survie, soit la PI3-K et les MAPKs p42/p44 (Johnson et al., 2000) et ainsi protéger les cellules de l'anoïkose.
4. Objectifs du projet de rec/1erche
Des études réalisées dans notre laboratoire ont démontré l'établissement d'une compartimentalisation différentielle des homologues Bcl-2 le long de l'axe crypte-villosité à 18-20 semaines de gestation (figure 9). Ceci avait aussi été observé dans l'intestin adulte de rongeurs (Jones et Gores, 1997; Moss et Holt, 1996; Potten, 1997) et humain (Hockenbery et al., 1991; Krajewski et al., l 994b; 1995; 1996; Lu et al.,
1993). Cet établissement de compartimentalisation coïncide avec la maturation des 25
Figure 9. Compartimentalisation des homologues Bcl-2 le long de l'axe crypte-villosité dujéjunumfœtal humain.
Les signes+ signifient que les homologues sont présents et les± signifient qu'ils sont présents faiblement dans ces régions de l'axe crypte-villosité.
types cellulaires de l'épithélium intestinal et nous suggére des mécanismes distincts de régulation de l'apoptose entre la crypte et la villosité. D'ailleurs, l'administration de produits chémothérapeutiques chez les rongeurs induit une quantité importante d'apoptose chez les cellules des cryptes, sans affecter les cellules villositaires (Jones et Gores, 1997; Potten, 1997).
Par conséquent, dans le but de mieux caractériser ces différences potentielles dans la régulation de la survie cellulaire le long de l'axe crypte-villosité, mon projet de recherche consistait à analyser la régulation de la survie des cellules de la crypte intestinale humaine. Pour ce faire, les analyses ont été effectuées chez les cellules normales HIEC, et ce, par l'inhibition de voies et/ou de molécules de signalisation telle que p42/p44, PI3-K, p38 et F AK. Suite à ces inhibitions, nous avons analysé la présence ou l'absence d'apoptose, ainsi que les niveaux d'expression de six homologues Bcl-2, dont trois anti-apoptotiques (Bcl-2, Mcl-1, Bel-XL) et trois pro-apoptotiques (Bax, Bak, Bad).
CHAPITRE2
MATÉRIEL ET MÉTHODES
l. Culture cellulairel.J. Les cellules HJEC
Les cellules HIEC ont été cultivées à 37°C sous une atmosphère humide composée de 5% C02 et 95% d'air en pétri de plastique de 100 mm (Falcon,
Becton-Dickenson Labware) dans le milieu DMEM (Dulbecco's modified Eagle's medium, Gibco BRL, Burlington, Ontario) contenant 5% de sérum de bovin fœtal (FBS) ICN CELLect Gold (ICN Biomedicals, Aurora, Ohio), 4 mM de glutamine (Gibco BRL), IO mM de Hepes (Gibco BRL), 5 ng/ml de facteur de croissance épidermique (EGF) (Gibco BRL), un mélange d'antibiotiques comprenant 100 U/ml de pénicilline et 100 µg/ml de streptomycine (Gibco BRL), ainsi que de 0.2 Ul/ml d'insuline humaine (Connaught Novo Biomedicals, Mississauga, Ontario). Les milieux ont été renouvelés aux quarante-huit heures avec l 0 ml de milieu frais (Perreault et Beaulieu, 1996).
Pour les traitements, les cellules ont été rincées puis cultivées dans du DMEM sans sérum (DMEM additionné d'un mélange d'antibiotiques ainsi que de Hepes et de glutamine). Les cellules ont été traitées avec IO µg/ml d'insuline (Gibco BRL) ou les inhibiteurs de voies et/ou de molécules de signalisation suivants : 150 µM génistéine (Sigma-Aldrich, Oakville, Ontario) permettant l'inhibition des tyrosine kinases à large spectre (Maulik et al., 1999; McCubrey et al., 2000); l µM cytochalasine D (Sigma-Aldrich) permettant l'inhibition de la kinase d'adhésion focalisée à cette concentration (Wary et al., 1998; van Deurs et al., 1996); l µM
herbimicyne A (Sigma-Aldrich) permettant l'inhibition des membres p60src et p59fyn de la famille des tyrosine kinases Src (Parsons et Parsons, 1997; Xu et al., 1998); 20 ng/ml rapamycine (Sigma-Aldrich) permettant l'inhibition de la p70S6K via l'inhibition de mTOR (Chung et al., 1992; Daly et al., 1999), une kinase effectrice de la PIJ-K; 5 µM Ly 294002 (Calbiochem, Mississauga, Ontario) permettant l'inhibition directe de la Pl3-K (Vlahos et al., 1994; Vanhaesebroeck et Alessi, 2000); 20 µM PD 98059 (Calbiochem) permettant l'inhibition des MAPKs p42/p44 par l'inhibition directe de MEKl, la kinase activatrice en amont (Alessi et al., 1995; Dudley et al., 1995); 20 µM SB 202190 (Calbiochem) et SB 203580 (Calbiochem et Upstate Biotechnology, Lake Placid, NY) permettant l'inhibition directe des MAPKs p38 a et ~ (Young et al., 1997; Rousseau et al., 2000) (figure 10). La durée des traitements était de vingt-quatre ou quarante-huit heures selon les expériences effectuées.
Tableau
J.Inhibiteurs pl1armacologiques
Inhibiteurs Génistéine (Gen) Herbimicyne A (HA) Cytochalasine D (Cyto) Ly 294002 (Ly) Rapamycine (Rap) SB 203580 (SB 580) SB 202190 (SB 190) PD 98059 (PD) Action
Inhibition des tyrosine kinases à large spectre Inhibition des tyrosine kinases de la famille Src
Inhibition de la kinase d'adhésion focalisée (FAK) ainsi que la dépolymérisation des filaments d'actines
Inhibition de la sous-unité catalytique de la PI3-K Inhibition de mTOR
Inhibition de p38 a et ~ Inhibition de p38 a et ~
Inhibition des kinases MAP p42/p44 par l'inhibition de la kinase kinase (MEK l)
Figure JO. Structure moléculaire de p38a avec son inhibiteur, SB 203580. (Tiré et modifié de Wang Z et al., 1998)
p38
2. Niveaux d'expression 2.1. Lysais cellulaires
Les cellules ont été récoltées vingt-quatre ou quarante-huit heures après la mise en traitement. Les cultures ont été rincées deux fois au PBS lX puis lysées dans du tampon Laemmli lX (62.5 mM Tris-HCI pH 6.8, 2.3% [p/v] SOS, 10% [v/v] glycérol, l
mM
PMSF, 0.001 % [p/v] bleu de bromophénol et 5% [ v/v] 2-~ mercaptoéthanol). Les échantillons cellulaires ont par la suite été soniqués avec un sonicateur de type Ultrasonic Processor XL (Mandel Scientific Company Ltd.) à intensité 2, chauffés à 105°C durant 5 minutes dans un chauffe-module (VWR) tout en vortexant, puis microcentrifugés durant 5 minutes à vitesse maximale.La concentration protéique de chacun des lysats cellulaires a été détenninée par la méthode modifiée de Lowry (Peterson, 1977). Les dosages ont été réalisés en duplicata et une courbe standard a été établie à chaque dosage avec l'albumine de sérum bovin (BSA) (Sigma). Une quantité équivalente de chaque échantillon a par la suite été séparée par SOS-PAGE (sodium dodecyl sulfate-polyacrylamide gel electrophoresis ).
2.2. SDS-PAGE
Deux méthodes de séparation des protéines ont été utilisées. A-Minigel
45 µg de protéines ont été séparées sur gel de polyacrylamide Tris-HCl (BioRad, Hercule, CA) dénaturant 15% ou avec un gradient linéaire de 4-15% selon les protéines à observer. Les échantillons ont été chauffés dans un chauffe-module durant 5 minutes à 105°C, microcentrifugés, puis déposés dans les puits. La
séparation s'effectuait durant 5 minutes à l 70 volts puis durant 120 minutes à 100 volts . Un marqueur de poids moléculaire coloré de 6.8-209 kD (BioRad) était ajouté à chacun des gels effectués permettant d'évaluer le poids moléculaires des protéines analysées.
Après la migration, les gels ont été équilibrés durant 15 minutes dans du tampon de transfert (glycine 1.4%, tris 0.3% complété avec de l'eau et 20% de méthanol). Chacun des gels a été monté en sandwich avec une membrane de nitrocellulose (Supported NitroCellulose-1, Life Technologies/Gibco BRL) sur laquelle ont été transférées les protéines durant une heure à 1 OO volts. Après le transfert, les membranes ont été lavées avec de l'eau bidistillée, puis les protéines ont été colorées au rouge de Ponceau (Towbin et
al.,
1979) afin d'évaluer la qualité du transfert pour ensuite être décolorées au PBS-Tween 0.05%.B-Grandgel
30 µg de protéines ont été séparées sur gel de polyacrylamide dénaturant. Le gel de séparation était de type Thomas et Komberg (Thomas et Komberg, 1975) de 15% [p/v] contenant 0.75 M de Tris-HCI pH 8.8 et 1% de SOS. Le gel d'entassement était de 4% [p/v] contenant 0.25 M de Tris-HCI pH 6.8 et 0.1 % de SOS. Avant d'être déposés dans les puits, les échantillons ont été chauffés durant 5 minutes à l05°C et microcentrifugés. La séparation des protéines s'est effectuée au cours de la nuit à température pièce à un voltage de 60 volts dans un tampon d'électrophorèse contenant 0.1% SOS, 7.2% glycine et l.5% Tris. Un marqueur de poids moléculaire coloré 6.8-209 kD (BioRad) est ajouté à chacun des gels effectués permettant d'évaluer le poids moléculaire des protéines analysées.
À la fin de la migration, les gels ont été équilibrés pendant 30 minutes dans du tampon de transfert (glycine l.4%, tris 0.3% complété avec de l'eau et 20% de méthanol). Chacun des gels a été monté en sandwich avec une membrane de nitrocellulose sur laquelle ont été transférées les protéines durant 30 minutes à 20 volts puis durant 75 minutes à 100 volts. Après le transfert, les membranes ont été lavées avec de l'eau nanopure, puis colorées au rouge de Ponceau afin d'évaluer la qualité du transfert et de tailler les membranes. Elles ont par la suite été décolorées avec du PBS-Tween 0.05%.
2.3. Détection des protéines par immunobuvardage
Les membranes de nitrocellulose ont été bloquées une heure ou toute la nuit dans une solution de blotto l 0% ( l 0% de lait écrémé en poudre dans du PBS-Tween 0.05%). À la fin du blocage, les membranes ont été incubées l h avec l'anticorps primaire monoclonal ou polyclonal à température pièce ou toute la nuit à 4°C (selon l'anticorps utilisé) avec une agitation constante. Par la suite, les membranes ont été lavées avec du PBS-Tween 0.05% durant 4 lavages de l 0 minutes, puis incubées avec l'anticorps secondaire couplé
à
la HRP (horseradish peroxidase) durant une heure à la température ambiante avec une agitation constante. Les membranes ont ensuite été lavées 3 fois 10 minutes avec du PBS-Tween 0.05%, puis un dernier lavage de IO minutes avec du PBS IX permettant d'équilibrer le pH de la membrane. Les bandes immunoréactives ont été révélées par chémiluminescence (ECL system; Amersham/Pharmacia Biotech., Baie d'Urfé, Qc) en utilisant les films Hyperfilm ECL (ECL, Amersham).2.4. Deshybridation des membranes
Dans certains cas, les membranes ont été deshybridées après la révélation ECL. Elles sont rincées avec de l'eau bidistillée, lavées avec du PBS-Tween 0.05% durant 5 minutes puis lavées durant 20 minutes dans la solution de deshybridation (glycine 0.1 M pH 2.9). Par la suite, deux lavages dans du PBS l X de l 0 minutes sont effectués afin de permettre l'équilibration du pH de la membrane. Cette deshybridation permet la réutilisation des membranes avec les protéines déjà transférées.
2.5. Quantification des bandes
L'intensité des bandes a été déterminée avec le logiciel Scionlmage (Scion Corporation). Pour chaque traitement, les niveaux relatifs d'expression des protéines analysées ont été évalués en comparaison avec le témoin sans sérum (ss) en déterminant les aires totales sous les courbes. Le ratio traitement/ss a été établi pour les homologues Bcl-2 et protéine phosphorylée/protéine totale pour les molécules impliquées dans la signalisation intracellulaire. La normalisation de l'intensité des bandes a été établie en comparaison avec la cytokératine 18, une protéine du cytosquelette qui n'est pas affectée par les divers traitements utilisés.
Tableau 2. Caractéristiques des anticorps utilisés pour la détection des
antigènes pour les analyses par immunobuvardage concernant /'apoptose.
Anticorps Type Antigène Dilution Source
Ab 1701 Pab/R Bc/-2 (30 k.Da) 1:1500 Krajewski et al., 1994a Ab 1695 Pab/R Bel-XL (33 k.Da) 1: 1000 Krajewski et al., 1994b
AbK20 Pab/R Mel-/ (30 kDa) 1:200 SC
Ab 1-19 Pab/R Bax(25 k.Da) 1:200 SC
Ab 1764 Pab/R Bak(28 kDa) J: 1000 Krajewska et al., 1996 Krajewski et al., 1996
Ab48 Mab!S Bad(23 kDa) 1:250 TL
AbE-8 Mab/S Pro-caspase 3 1:500 SC
(32 k.Da)
Ab 966/S Pab!R Caspase 3 1:1000
NEB
(19-17 kDa)
Ab C2-JO Mab!S PARP /:JO 000 G. G. Poirier
entier: 116kDa Univ. Laval
clivé: 89 kDa Qc
Légende:
Les anticorps monoclonaux de souris et polyclonaux de lapin sont identifiés par Mab/S et Pab/R, respectivement, et ils reconnaissent tous la forme humaine de l'antigène. Tous les anticorps mentionnés sont utilisés dans du blotto l 0% et proviennent de collaborateurs ou des compagnies suivantes: New England Biolabs (NEB), Santa Cruz Biotechnologies (SC) et Transduction Laboratories (TL).