HAL Id: dumas-01911269
https://dumas.ccsd.cnrs.fr/dumas-01911269
Submitted on 2 Nov 2018
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Focus sur la prise en charge des AVC ischémiques chez
les patients de plus de 75 ans au CHU de Bordeaux :
quels sont les facteurs liés à l’absence d’admission dans
l’unité neurovasculaire dans cette population ?
Lucie Jomain
To cite this version:
Lucie Jomain. Focus sur la prise en charge des AVC ischémiques chez les patients de plus de 75 ans au CHU de Bordeaux : quels sont les facteurs liés à l’absence d’admission dans l’unité neurovasculaire dans cette population ?. Médecine humaine et pathologie. 2018. �dumas-01911269�
HAL Id: dumas-01911269
https://dumas.ccsd.cnrs.fr/dumas-01911269
Submitted on 2 Nov 2018
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Focus sur la prise en charge des AVC ischémiques chez
les patients de plus de 75 ans au CHU de Bordeaux :
quels sont les facteurs liés à l’absence d’admission dans
l’unité neurovasculaire dans cette population ?
Lucie Jomain
To cite this version:
Lucie Jomain. Focus sur la prise en charge des AVC ischémiques chez les patients de plus de 75 ans au CHU de Bordeaux : quels sont les facteurs liés à l’absence d’admission dans l’unité neurovasculaire dans cette population ?. Médecine humaine et pathologie. 2018. <dumas-01911269>
1
UNIVERSITÉ DE BORDEAUX
U.F.R DES SCIENCES MÉDICAL
ANNÉE 2018
THÈSE POUR L’OBTENTION DU DIPLÔME D’ÉTAT DE DOCTEUR EN
MÉDECINE n°137
Présentée et soutenue publiquement le 17 Octobre 2018
Par
Lucie JOMAIN
Née le 18 Juin 1991 à Saint Nazaire
Focus sur la prise en charge des AVC ischémiques chez les patients de plus de 75 ans
au CHU de Bordeaux : Quels sont les facteurs liés à l’absence d’admission dans
l’unité neurovasculaire dans cette population ?
Directrice de thèse
Dr Marie FLOCCIA
JURY
M. le Professeur Igor SIBON Président et Rapporteur
Mme le Professeur Nathalie SALLES Juge
M. le Professeur Philippe CASTERA Juge
M. le Docteur Cédric GIL JARDIN Juge
M. le Docteur François ROUANET Juge
2
Remerciements
Aux Membres du Jury,À Monsieur le Professeur Igor SIBON,
Professeur des universités et praticien hospitalier
Vous me faites l’honneur de présider ce jury et d’en être le rapporteur. Je vous remercie pour l’attention que vous portez à ce travail. Veuillez trouver ici l’expression de toute ma gratitude et mon profond respect.
À Monsieur le Docteur Cédric GIL JARDIN, Praticien hospitalier
Merci de ton aide tout au long de la réalisation de cette thèse : tes avis à toutes les étapes de ce travail ont permis d’améliorer le travail que je rends aujourd’hui. C’est grâce à toi que j’ai pu réaliser l’analyse statistique des données.
À Madame le Professeur Nathalie SALLES, Professeur des universités et praticien hospitalier
Merci d’avoir accepté d’être membre de ce jury. Je vous suis très reconnaissante de m’avoir permis de réaliser mon projet professionnel pour mon dernier semestre.
À Monsieur le Professeur Philippe CASTERA,
Professeur associé de Médecine Générale chargé d’enseignement et maître de stage
Vous me faites l’honneur de participer au jury de cette thèse, veuillez trouver ici l’expression de mon plus grand respect. Merci pour vos enseignements lors de ces trois années d’internat.
À Monsieur le Docteur François ROUANET, Praticien hospitalier
Je suis reconnaissante de pouvoir vous compter parmi les membres de mon jury. Je suis honorée de pouvoir bénéficier de vos compétences en neurologie. Recevez l’expression de mon profond respect.
À ma directrice de thèse,
À Madame le Docteur Marie FLOCCIA, Praticien hospitalier
J’ai eu l’honneur que tu acceptes d’être ma directrice de thèse. Je te remercie pour ta gentillesse, ta disponibilité et tes remarques qui m’ont permis d’avancer sereinement tout au long de cette thèse. Tu as été une directrice formidable.
3
Aux médecins rencontrés durant mon internat, tout particulièrement :
To Andy, you are the one that showed me, all those years ago, what being a Doctor meant ; I wanted to do just like you !
À Joanne qui a planté la graine de l’envie d’être compétente dans le domaine de la cicatrisation, l’arbre qui a bien grandi maintenant.
À Carine qui m’a montré que le fait d’être médecin généraliste ne ferme aucune porte, qu’il suffit simplement d’oser l’ouvrir. Merci à toi.
À tous mes séniors (Nicolas, M. Lataste, les urgentistes de Pellegrin, l’équipe de la maternité de Bagatelle) qui m’ont tellement appris sur l’exercice de la médecine et de la manière dont je souhaite l’exercer.
À mes praticiens (Paul Antoine, Laurence et Pascal) qui m’ont révélé la beauté de la médecine générale libérale : j’en ferai un jour, c’est sûr.
À Thalie, Patrick et Pascal, merci de partager ainsi votre savoir dans le domaine des plaies et de m’avoir aussi bien intégrée dans votre équipe pendant 6 mois.
À toutes les équipes paramédicales avec lesquelles j’ai travaillé : vous m’avez appris l’importance du travail en collaboration, de la communication. Merci!
À ma famille,
À tous ceux qui ont fait la P1 avec moi : Papa, Maman, Alicia, Nadra et Mamone, je ne l’aurais jamais eu sans vous!
À mes parents, qui m’ont donné goût aux voyages et à la montagne et qui m’ont inculqué l’importance d’essayer d’être le mieux que l’on peut au quotidien.
À ma Maman, qui a toujours été là pour moi et qui a toujours cru en moi. À mon Papa, qui m’a donné la passion de faire les choses jusqu’au bout. À Sigolène, mon Word gourou.
À Alicia, à ta présence tout au long de mes études.
À Timothée, toujours à mes côtés, toujours à me faire rire… Je t’aime
À mes amis,
À tous mes copains grenoblois, j’ai passé un externat en or grâce à vous !!!
À Clouchette et Chloé, nous ne sommes plus dans la même ville mais on est toujours partantes pour de nouvelles aventures !
4
À Andréa, ma première copine Bordelaise, merci de m’avoir prise sous ton aile au début de l’internat.
À Camille Wei, Camille, Chloé, Claire, Céline, Lucie, Pauline, j’ai de la chance d’avoir un groupe de copines aussi formidable que vous.
À Antoine, Marine, Bastien et Mathilde pour tous les bons moments et repas passés ensemble. À toute la clique de Périgueux, vous êtes devenus mes amis, j’espère pour encore de nombreuses années…
À tous mes co-internes, merci pour tous ces bons moments ! À Eugénie et Jean Benoît, à quand la prochaine pause-café ?
5
Table des matières
Table des matières 5
LISTE DES ABRÉVIATIONS 10
LISTE DES ILLUSTRATIONS 11
Figures 11 Tableaux 12 RÉSUMÉ 13 ABSTRACT 14 INTRODUCTION 15 PRÉ-REQUIS 16 I. Gériatrie 16
A . Epidémiologie des sujets âgés en France 16
B . Hétérogénéité de la population gériatrique 16
1. Notion de fragilité 16
2. Comorbidités 17
3. Autonomie 17
C . Âgisme 18
II. L’accident vasculaire cérébral 18
A . Généralités sur les AVC 18
B . Epidémiologie de l’AVC ischémique en France 19
C . Bilan initial de l’AVC 20
D . Unité neuro-vasculaire 21
E . Thrombolyse et thrombectomie 22
F . Nouveautés dans le domaine neuro-vasculaire 22
G . Quelle place pour la thrombolyse et la thrombectomie dans la population gériatrique? 23 H . Stratégie thérapeutique de l’AVC ischémique hors délais 24
I . AVC et Âgisme 24
MÉTHODES 26
I. Schéma d’étude 26
II. Population étudiée 26
III. Lieu de l’étude 26
IV. Sources des données 26
V. Aspect éthique 27
VI. Recueil des données 27
6
1. Données démographiques 27
2. Comorbidités 28
B . Critères liés à la prise en charge 29
1. Type d’imagerie 29
2. Avis auprès du neurovasculaire 29
3. Traitement spécifique 29
4. Service d’hospitalisation et durée de séjour 29
5. Devenir du patient 29
VII. Analyse statistique 30
A . Objectifs 30
1. Objectif principal 30
2. Objectifs secondaires 30
B . Critère de jugement principal 30
C . Analyse statistique 30 RÉSULTATS 31 I. Description de la population 31 A . Caractéristiques de l’échantillon 31 1. Données sociodémographiques 31 2. Données anamnestiques 31 a) Autonomie 31
b) Type de domiciliation et mode de vie 32
c) Comorbidités 32
3. Bilan de la prise en charge de l’AVC ischémique à la phase aigüe 33
a) Type d’imagerie cérébrale 33
b) Avis neurovasculaire 33
c) Traitement spécifique 33
d) Lieu d’hospitalisation 34
e) Devenir du patient 34
B . Caractéristiques des patients n’ayant pas été admis en UNV 35
1. Données sociodémographiques 35
2. Données anamnestiques 35
a) Autonomie 35
b) Type de domiciliation et mode de vie 36
c) Comorbidités 36
Le taux de comorbidité dans le groupe non admis en UNV est important, avec plus de la moitié des patients ayant des troubles neurocognitifs majeurs diagnostiqués. 36 3. Bilan de la prise en charge de l’AVC ischémique à la phase aigüe 37
7
b) Avis neurovasculaire 37
c) Traitement spécifique 37
d) Lieu d’hospitalisation 38
d) Devenir du patient 38
C . Caractéristiques des patients admis en UNV 38
1. Données sociodémographiques 38
2. Données anamnestiques 39
a) Autonomie 39
b) Type de domiciliation et mode de vie 40
c) Comorbidités 40
3. Bilan de la prise en charge de l’AVC ischémique à la phase aiguë 41
a) Type d’imagerie cérébrale 41
b) Avis neurovasculaire 41
c) Traitement spécifique 41
d) Lieu d’hospitalisation 41
e) Devenir du patient 41
D . Caractéristiques des patients institutionnalisés par rapport aux patients vivant à domicile 41
1. Données sociodémographiques 41
2. Données anamnestiques 42
a) Autonomie 42
b) Type de domiciliation et mode de vie 43
c) Comorbidités 43
3. Bilan de la prise en charge de l’AVC ischémique à la phase aigüe 44
a) Type d’imagerie cérébrale 44
b) Avis neurovasculaire 44
c) Traitement spécifique 44
d) Lieu d’hospitalisation 44
e) Devenir du patient 45
E . Caractéristiques des patients n’ayant pas bénéficié d’avis neurovasculaire 45
1. Données sociodémographiques 45
2. Données anamnestiques 46
a) Autonomie 46
b) Type de domiciliation et mode de vie 46
c) Comorbidités 46
3. Bilan de la prise en charge de l’AVC ischémique à la phase aigüe 47
a) Type d’imagerie cérébrale 47
8
c) Traitement spécifique 47
d) Lieu d’hospitalisation 48
e) Devenir du patient 49
II. Analyse multivariée 49
A . Critère de jugement principal : Admission dans l’unité neurovasculaire 49 B. Critère de jugement secondaire : Caractéristiques des patients institutionnalisés versus ceux
vivant à domicile admis pour un AVC ischémique 54
C . Critère de jugement secondaire : Caractéristiques des patients n’ayant pas eu d’avis
neurovasculaire par rapport à ceux ayant bénéficié d’un avis 54
DISCUSSION 56
I. Analyse des résultats principaux 56
A . Rappel des résultats importants 56
B . Description de la population 56
1. Admission dans l’unité neurovasculaire 56
2. Sexe et Âge 56
3. Autonomie 57
4. Type de domiciliation et mode de vie 58
5. Comorbidités 59
6. Imagerie réalisée aux Urgences 59
Détails sur les patients n’ayant pas bénéficié de scanner cérébral injecté ou d’IRM
cérébrale 59
7. Accès aux traitements spécifiques : anti-agrégation et anticoagulation 60 8. Accès aux traitements spécifiques : thrombolyse et thrombectomie 60 9. Détails des patients n’ayant pas bénéficié de traitement spécifique 61
10. Devenir du patient 62
a) Décès 62
b) Durée moyenne de séjour hospitalier 62
C . Caractéristiques des patients institutionnalisés comparés à ceux vivant à domicile 62
1. Âge et sexe 63
2. Dépendance 63
3. Comorbidités 63
4. Accès à l’imagerie et aux traitements spécifiques 63
5. Devenir des patients 64
D . Caractéristiques des patients n’ayant pas bénéficié d’un avis neurovasculaire 64
E . La prise en charge est elle teintée d'âgisme ? 64
F. Démence et admission en UNV 66
II. Faiblesses et forces de l’étude 66
9
1) Limite inhérente au schéma de l’étude 66
2) Manque de données concernant les antécédents 67
3) Manque d’accessibilité à l’IRM cérébrale aux urgences 67
B . Forces 68
III. Perspectives générales 68
Impact des nouvelles recommandations de 2018 68
Accessibilité à l’unité de neurovasculaire 69
CONCLUSION 70
RÉFÉRENCES 71
ANNEXES 79
Article soumis à publication 92
10
LISTE DES ABRÉVIATIONS
ADL: Activities of Daily Living ACM: Artère Cérébrale Moyenne
AIT: Accident vasculaire Ischémique Transitoire AVC: Accident Vasculaire Cérébral
ASPECTS: Alberta Stroke Program Early CT Score CHU : Centre Hospitalier Universitaire
ECG: Electrocardiogramme
EHPA: Etablissement d’Hébergement pour Personnes Agées
EHPAD : Etablissement d’Hébergement pour Personnes Agées Dépendantes ICA: Artère Cérébrale Antérieure
INR: International Normalized Ratio
LATA : Limitation et/ou Arrêt des Thérapeutiques Actives M1: Segment M1 de l’artère cérébrale antérieure
MMS: Mini Mental Status
mRS: Echelle de Rankin modifiée
NIHSS: National Institutes of Health Stroke Scale NFS: Numération Formule Sanguine
RPA: Résidence pour Personne Âgée Autonome RSA: Résumés de Sortie Anonymes
TNCM : Troubles NeuroCognitifs Majeurs TP: Taux de Prothrombine
TSA: Troncs Supra Aortiques UNV: Unité NeuroVasculaire
11
LISTE DES ILLUSTRATIONS
Figures
Figure 1 : Répartition des scores ADL de l’échantillon (96% de l’échantillon)
Figure 2: Pourcentage de patients ayant un score ADL =0, > à 6 dans l’échantillon et >/ 10 (96% de l’échantillon)
Figure 3 : Répartition des comorbidités dans l’échantillon
Figure 4 : Répartition des patients de l’échantillon hospitalisés (85% de l’échantillon)
Figure 5 : Répartition des scores ADL dans le groupe non admis à l’UNV (87% du groupe UNV -) Figure 6 : Pourcentage de patients ayant un score ADL : 0, >6 et ≥ à 10 dans le groupe non admis à UNV (87% du groupe UNV -)
Figure 7 : Répartition des comorbidités dans le groupe non admis dans l’UNV
Figure 8 : Répartition des patients hospitalisés dans le groupe non admis en UNV (46% du groupe UNV -)
Figure 9 : Répartition des scores ADL dans le groupe admis dans l’UNV (99% du groupe)
Figure 10 : Pourcentage de patients ayant un score ADL< 6, >6 et ≥ à 10 dans le groupe admis en UNV (99% du groupe)
Figure 11 : Répartition des comorbidités des patients dans le groupe admis en UNV
Figure 12 : Répartition du nombre de femmes et l’âge moyen dans l’échantillon, le groupe vivant à domicile et en institution
Figure 13 : Répartition des scores ADL entre le groupe institutionnalisé (90% du groupe) versus le groupe vivant à domicile (97% du groupe)
Figure 14 : Répartition des comorbidités des patients institutionnalisés versus le groupe vivant à domicile
Figure 15 : Différence d’accès aux traitements spécifiques entre l’échantillon, le groupe institutionnalisé et le groupe vivant à domicile
Figure 16 : Lieu d’hospitalisation chez les patients institutionnalisés et vivant à domicile
Figure 17 : Répartition des scores ADL dans la population n'ayant pas eu d'avis (100% du groupe) versus ceux ayant eu un avis neurovasculaire (95% du groupe)
Figure 18 : Répartition des comorbidités des patients ayant et n'ayant pas bénéficié d'un avis neurovasculaire
Figure 19 : Différence d’accès aux traitements spécifiques entre l’échantillon, le groupe ayant eu un avis neurovasculaire et le groupe sans avis
Figure 20 : Lieu d’hospitalisation chez les patients ayant eu ou non un avis neurovasculaire
Figure 21 : Taux de femmes, de troubles neurocognitifs majeurs et l’âge moyen dans l’échantillon, le groupe UNV - et UNV +
Figure 22 : Répartition des scores ADL ( ADL = 0, >6 et ≥ à 10) dans l’échantillon, le groupe UNV - et UNV +
Figure 23 : Accès à l’imagerie cérébrale dans l’échantillon, le groupe UNV - et UNV +
Figure 24 : Répartition de l'accès aux traitements spécifiques dans l’échantillon, groupe UNV- et UNV +
Figure 25 : Répartition des taux d’hospitalisation, de sortie précoce, de transfert et de décès dans l’échantillon, le groupe UNV - et UNV +
12
Tableaux
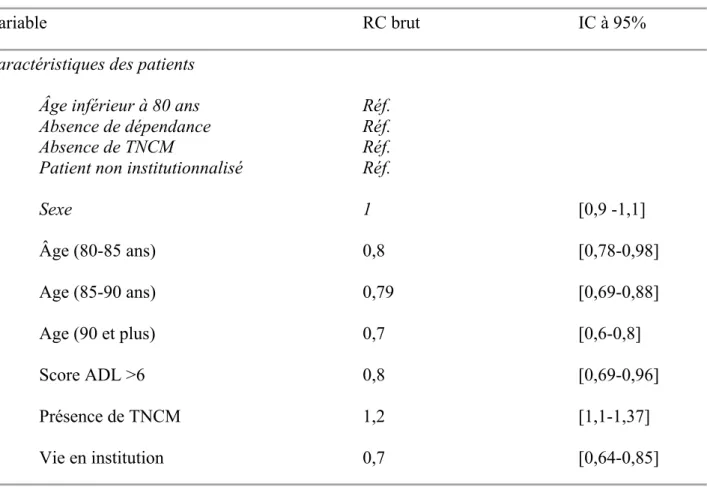
Tableau 1 : Analyse multivariée des facteurs prédictifs de l’admission dans l’unité de neurovasculaire. Rapports de cote brut et intervalles de confiance
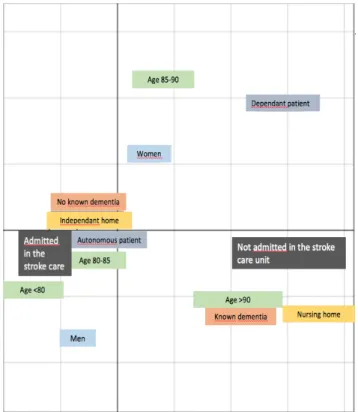
Tableau 2 : Nuage des variables selon l’analyse des correspondances multiples des caractéristiques des patients selon l’admission ou non en UNV
13
RÉSUMÉ
Objectif : L’accident vasculaire cérébral ischémique (AVC ischémique) est une pathologie
fréquente, grave, handicapante, avec une prise en charge à la phase aigüe bien codifiée. Cette prise en charge spécifique, dont l’admission dans une unité neurovasculaire, permet une amélioration du pronostic fonctionnel, dans tous les groupes d’âge. Il a été décrit une moindre admission dans les unités neurovasculaires chez les patients âgés ayant un AVC ischémique à la phase aigüe.
Nous avons donc mené une étude descriptive et rétrospective afin d’identifier quels étaient les facteurs de non admission dans l’unité neurovasculaire, chez les patients de 75 ans et plus.
Matériel et méthodes : Les données démographiques et anamnestiques ont été recueillies pour
chaque patient de 75 ans et plus, admis aux urgences de Pellegrin du CHU de Bordeaux, avec un diagnostic d’AVC ischémique, entre le 1er Janvier et le 31 Juin 2017. Ces données proviennent de la base nationale des hospitalisations du Programme de médicalisation des systèmes d’information en médecine, chirurgie et obstétrique (PMSI-MCO). Le critère de jugement principal a été l’admission ou non dans l’unité neurovasculaire.
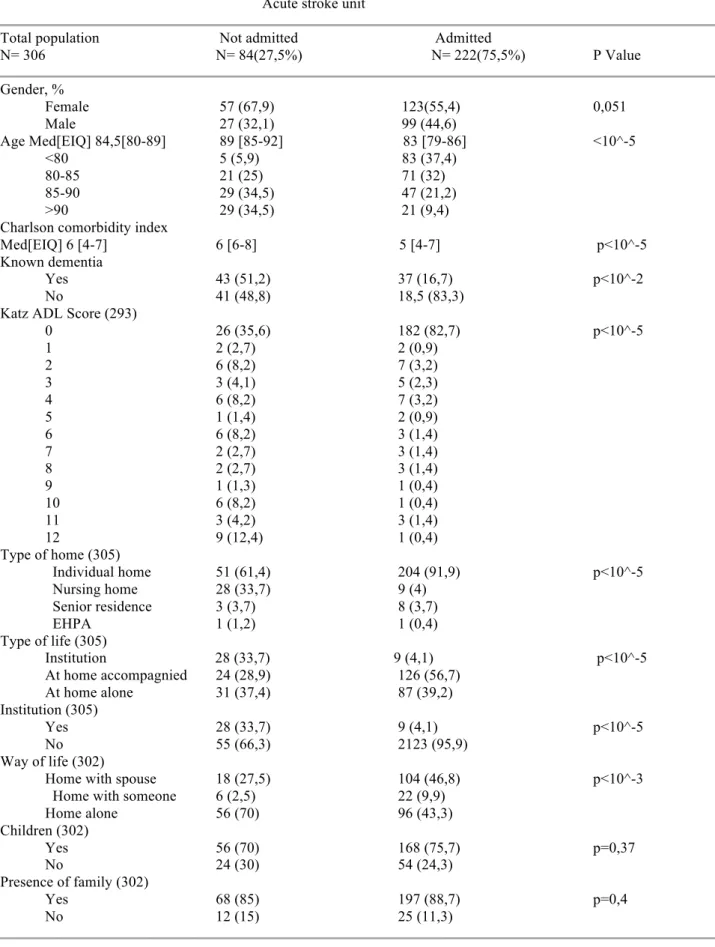
Résultats : Sur les 306 patients inclus, uniquement 27,5% (84) n’ont pas été admis dans l’unité
neurovasculaire. L’âge moyen était de 84,5 ans [80-89] dans l’échantillon et de 89 [85-92] dans le groupe non admis, avec 68,9% de la population âgée de plus de 85 ans.
Il ressort que les patients non admis dans l’UNV étaient plus âgés (89 versus 83, p<10^-5), avec plus de troubles neurocognitifs majeurs diagnostiqués 2) et un Charlson plus élevé (p<10^-5). Ces patients étaient également moins autonomes que ceux admis en UNV, avec 36% versus 82,7% ayant un ADL = 0 (p<10^-5).
Une différence statistiquement significative est présente concernant le lieu de vie, avec une population institutionnalisée nettement plus importante dans le groupe non admis (p<10^-5).
Les conséquences de l’absence d’admission dans l’UNV sont les taux moindre d’avis neurovasculaire (p<10^-5), d’imagerie spécifique de type IRM cérébrale (p<10^-5) et de traitement spécifique (thrombolyse p<10^-3, thrombectomie p<10^-2).
Conclusion : La finalité de cette étude est d’identifier les facteurs menant à la non admission dans
l’unité neurovasculaire. Ces facteurs, indissociables entre eux, sont l’âge dès 80 ans et encore plus au-delà de 90 ans, un score ADL > 6 témoignant d’une dépendance et la vie en institution. Ainsi, il n’existe pas de sélection due spécifiquement liée à l’âge mais plutôt à l’ensemble de ces facteurs.
14
ABSTRACT
Background : Despite strong evidence to guide best-practice care for all stroke patients, many
elderly patients do not receive recommended care. Less than optimal care can lead to poor stroke outcomes. It is therefore essential to understand why care varies so that clinical quality improvement initiatives can be effectively targeted, by identifying which factors impact the absence of admission in a stroke unit, meaning evidence based care, for elderly patients.
Methods : This is a monocentric, retrospective and descriptive study that includes patients aged 75
and above, admitted in the General hospital of Pellegrin in Bordeaux with an acute ischaemic stroke diagnosis, between January 1st and June 31st of 2017. Multivariable analysis was performed using logistic regression. We assessed for evidence that some patient characteristics were associated to the non admission in a stroke unit.
Results : 306 patients aged above 75 were included and only 27,5% (84) were not admitted in the
stroke unit. Mean age (SD) was 84,5 [80-89] in the total population and 89 [85-92] in the group non admitted in the stroke center, with 68,9% aged above 85.
The patients not admitted in the stroke unit were more likely to be older (89 versus 83, p<10^-5), with known dementia (p<10^-2) and with a higher Charlson index (p<10^-5). They also had poorer autonomy than those admitted in the stroke unit, with 36% having an ADL : 0 versus 82,7% (p<10^-5).
Not being admitted in the stroke unit impacted optimal stroke care, with lesser rates of neurovascular physician assessment (p<10^-5), MRI imaging (p<10^-5) and specific treatment like thrombolysis (p<10^-3) or thrombectomy (p<10^-2).
Conclusion : The goal of this study was to determine which factors were associated to the absence
of admission in a stroke unit. These factors, all linked together, are age starting above 80 and increasing above 90, being dependant with a ADL score above 6 and life in a nursing home.
15
INTRODUCTION
L’AVC est une pathologie fréquente, affectant environ 400 000 patients en France [1], avec une incidence de 150 000 nouveaux cas par an. C’est la première cause de mortalité chez les femmes [2], la troisième pour les hommes et la première cause de handicap [3] acquis, puisque 75% des survivants ont des séquelles. Environ 80% des AVC sont d’origine ischémique, avec une incidence croissante avec l’âge. Environ 57,7% des AVC ischémiques ont eu lieu chez des patients de plus de 75 ans, avec une incidence croissante notable [1] (+ 32,8%).
Cette augmentation massive de patients âgés ayant un AVC ischémique va très certainement impacter les structures de soins et par conséquent, les soins délivrés.
Un traitement rapide est essentiel pour le sauvetage du tissu cérébral ischémié mais non infarci, selon le principe du “Time is Brain” [4]. Le but de la prise en charge de l’AVC ischémique à la phase précoce [5] est d’améliorer le pronostic vital et fonctionnel grâce à une recanalisation artérielle rapide, efficace et sans risque, afin de restaurer le flux sanguin cérébral.
Les recommandations internationales s’accordent toutes sur le fait que le pronostic fonctionnel croît avec la même intensité, qu’importe l’âge, lors d’une prise en charge standardisée de l’AVC ischémique, bien codifiée actuellement [6][7][8]. Le choix du traitement spécifique de l’AVC ischémique relève du domaine du neurovasculaire, et est basé sur l'administration d’une thrombolyse intraveineuse associé ou non à une thrombectomie, ainsi que l’admission en unité de soins intensifs de neurovasculaire. L’introduction d’un traitement antiagrégant ou anticoagulant sera également envisagé.
Il a été démontré que les patients âgés admis pour un AVC ischémique à la phase aigüe avaient un pronostic fonctionnel et vital plus sombre que les plus jeunes [9]. Des différences en termes de nombre accru de comorbidités, de facteurs de risque d’AVC et la sévérité des AVC peuvent expliquer cette variation liée à l’âge.
Cependant, plusieurs études émettent l’hypothèse que le pronostic fonctionnel défavorable chez les patients âgés est lié à une qualité de soins inférieure par rapport aux patients plus jeunes [10]. La réalisation ou non d’une prise en charge recommandée de l’AVC ischémique à la phase aigüe a été analysée et plusieurs facteurs liés à une prise en charge non optimale ont été identifiés. Un de ces facteurs est l’âge du patient, illustré par le concept de l'âgisme [11] [12] [13].
Peut-on soupçonner l’impact de l'âgisme dans nos pratiques quotidiennes hospitalières ?
L’objectif de l’étude est d’identifier les facteurs qui déterminent la prise en charge d’un AVC ischémique à la phase aigüe, dans la population gériatrique.
Notre hypothèse est que les patients vivant en EHPAD, donc en institution, ne bénéficient pas d’un passage dans l’unité de neurovasculaire, ni même d’une prise en charge hospitalière.
Après rappel de quelques généralités concernant les spécificités sociodémographiques de la population âgée, ainsi que l’accident vasculaire ischémique et sa prise en charge spécifique à la phase aigüe, nous exposerons la méthodologie adoptée et présenterons les résultats avant de les discuter.
16
PRÉ-REQUIS
I.
Gériatrie
A . Epidémiologie des sujets âgés en France
La gériatrie est une discipline médicale qui prend en charge les personnes âgées malades. Elle touche tous les domaines de la médecine puisque le vieillissement est un processus complexe et multifactoriel.
La vieillesse connait plusieurs définitions : l'OMS a choisi arbitrairement l'âge du départ à la retraite dans les pays développés en 1950, soit 65 ans, comme limite pour définir les personnes âgées et plus de 80 ans pour définir les personnes très âgées. Cependant, actuellement, il est usuel en médecine et en gériatrie de considérer une personne âgée à partir de 75 ans, âge donné par la société Française de Gériatrie et Gérontologie (SFGG). Dans les institutions pour personnes âgées, l’âge moyen retrouvé est d’environ 85 ans.
La prise en charge de cette population âgée doit être au centre des priorités car elle devient de plus en plus prépondérante. En effet, le vieillissement de la population française ne cesse de s’accentuer : alors que 20,8% de la population vivant en France métropolitaine avait 60 ans ou plus en 2005, les prévisions sont de l’ordre de 30,6% en 2035 et 31,9% en 2050 [14].
En 2060, 23,6 millions de personnes seraient âgées de plus de 60 ans soit une personne sur trois et on pourrait compter environ 200 000 centenaires.
Selon les projections de l’INSEE, si les tendances démographiques observées jusqu’ici se maintiennent, l’âge moyen de la population résidant en France métropolitaine passerait à 45 ans en 2060, contre 41,2 ans en 2016. Cette augmentation de la population âgée est en corrélation avec la pyramide des âges actuelle, puisque les personnes qui atteindront 60 ans dans les années 2050 sont déjà nées. L’allongement de la durée de vie ne fait qu’accentuer ce phénomène. Même si l’espérance de vie se stabilise, le nombre de personnes âgées de 60 ans ou plus augmenterait quand même de 50% entre 2005 et 2050.
B . Hétérogénéité de la population gériatrique 1. Notion de fragilité
Le vieillissement, qu’il soit physiologique ou pathologique, est caractérisé par une diminution des réserves fonctionnelles de l’organisme, entraînant une moindre capacité d’adaptation face aux situations d’agression. En cas de vieillissement physiologique, les capacités d’adaptation vont diminuer, mais sans atteindre le seuil d’insuffisance, contrairement au vieillissement pathologique. Il aboutit, à l’échelle d’une population, à la formation d’un groupe hétérogène d’un point de vue médical et fonctionnel. Schématiquement, trois catégories de personnes âgées peuvent être individualisées en fonction de leur état de santé après 75 ans [15]:
- Les personnes dites « vigoureuses » : en bon état de santé, indépendantes et bien intégrées socialement, c’est-à-dire autonomes d’un point de vue décisionnel et fonctionnel qui sont assimilables aux adultes plus jeunes ;
17
- Les personnes dites « malades » : dépendantes, en mauvais état de santé en raison d’une poly pathologie chronique évoluée génératrice de handicaps et d’un isolement social ;
- Les personnes dites « fragiles » : à l’état de santé intermédiaire et à risque de basculer dans la catégorie des malades. Elles sont décrites comme une population vulnérable, avec des limitations fonctionnelles motrices et cognitives et une baisse des capacités d’adaptation. La fragilité est définie dans les études comme un facteur prédictif de mortalité, d’entrée en institution ou de diminution de l’autonomie.
L’étude de la fragilité se base (entre autres, car il n’existe pas de consensus) sur le modèle du phénotype de fragilité issu de l’étude américaine Cardiovascular Health Study (CHS), qui a étudié une cohorte de 5317 sujets de 65 ans et plus suivis pendant 4 à 7 ans et qui a permis d’individualiser 5 critères classant en trois états : fragile, pré-fragile ou robuste.
Ces cinq critères extraits de l’article de Fried [16] sont les suivants : - Perte de poids involontaire au cours de la dernière année, - Vitesse de marche lente,
- Faiblesse/ fatigue ressentie,
- Activités physiques réduites, sédentarité, - Faible force de préhension.
Les sujets présentant au moins 3 critères sont considérés fragiles, ceux n’ayant qu’un ou deux critères sont dits pré-fragiles et les sujets ne présentant aucun critère sont considérés robustes. Cette étude a montré que la fragilité, définie selon ces critères, était un facteur prédictif indépendant de mortalité, de risque de chute, d’aggravation de la dépendance et d’hospitalisation.
2. Comorbidités
En 1987, l’équipe de M.E. Charlson [17] valide un score de comorbidité (Annexe 1) établi en pondérant les risques relatifs de mortalité à 1 an de 4 groupes de pathologies regroupant 19 pathologies différentes, à l’aide d’une étude longitudinale prospective de 559 patients hospitalisés en médecine interne. Ces 19 comorbidités sont : insuffisance cardiaque, trouble neurocognitif majeur, pathologies pulmonaires chroniques, maladie de système, hépatopathies peu sévères à sévères, diabète avec ou sans complications, hémiplégie, antécédent d’AVC ou d’AIT, néphropathie, cancer, tumeur maligne métastatique, VIH. Au delà de 40 ans, 1 point est donné par dizaine d’année supplémentaire, signifiant que dans la population gériatrique, âgée de plus de 75 ans, le score est forcément supérieur ou égal à 3.
Il existe plusieurs déclinaisons du score de Charlson Comorbidity index (Annexe 2), avec des cotations plus ou moins précises des pathologies, permettant une utilisation dans la pratique courante. Ce score est validé dans l’étude des AVC ischémiques [18].
De nombreuses études ont dichotomisé le score de Charlson en peu de comorbidités (score à 0 ou 1) versus élevé [19][20] (score >/ 2 ou 3) mais n’ont pas toutes pondérées le nombre de comorbidités à l’âge.
Il existe d’autres scores permettant d’évaluer les comorbidités, et dans le domaine de la gériatrie, l’autre échelle utilisée est le Cumulative illness rating scale geriatric (CIRS G), selon Miller [21]. 3. Autonomie
La dépendance et donc l’autonomie de la personne âgée est évaluée grâce aux ADL (Activities of Daily Living) et aux IADL (Instrumental Activities of Daily Living). L’échelle la plus répandue est
18
celle de Katz [22][23] pour les ADL, qui définit le besoin d’aide pour la réalisation de la toilette, de l’habillement, de l’alimentation, des déplacements et de la continence (Annexe 3).
Les critères évalués sont : - La marche
- L’hygiène corporelle - L’habillement - La continence - L’alimentation
- La capacité d’aller aux toilettes
L’indépendance fonctionnelle est très souvent évaluée dans le domaine du neuro-vasculaire, grâce au score de Rankin modifiée, mRS, basé sur l’échelle de Rankin [24]. Le but de cette échelle était d’évaluer le pronostic fonctionnel dans une des premières unités neurovasculaires.
L’échelle modifiée de Rankin est quand à elle destinée à évaluer le pronostic fonctionnel et recommandée dans le cadre d’une étude centrée sur l’accident vasculaire cérébral [25]. Son intérêt est sa rapidité de réalisation et sa reproductivité (Annexe 4).
C . Âgisme
Il y a environ 50 ans, Dr Robert Butler [13] a introduit le concept d’âgisme, basé sur la constatation de préjudices faits à un groupe d’âge par rapport aux autres groupes d’âge. Ces travaux ont entraîné de multiples études dans différents domaines de la santé (psychologie [26], psychiatrie [27], rééducation [28], etc).
De nos jours, l’évidence de l'âgisme dans le domaine de la santé, mais également dans de nombreux autres domaines, est prouvée scientifiquement [29]. Le rapport du Economist Intelligence Unit, publié en 2009, souligne l’évidence d’un âgisme dans le domaine médical à travers le monde [30], et d’autres études le confirment au niveau national [31].
La prise en charge médicale teintée d'âgisme a des conséquences directes sur les patients gériatriques car des études ont révélé un sur-risque d’handicap [32] et même de mortalité [33]. Au vu de ces potentiels effets néfastes, le sujet de l’âgisme prend de l’importance au niveau politique. En 2012, l’European Network or Equality Bodies (Equinet) [34] a déclaré qu’il était nécessaire de combattre l'âgisme afin de promouvoir un vieillissement réussi [35].
II. L’accident vasculaire cérébral
A . Généralités sur les AVC
L’accident vasculaire cérébral (AVC ou stroke en anglais) est un déficit neurologique focal de survenue soudaine (apparition en moins de 2 minutes) en relation avec une lésion du parenchyme cérébral par infarctus ou par hémorragie. Les AVC ischémiques sont les plus fréquents (80 à 85%). Le terme accident ischémique cérébral regroupe les AVC par infarctus cérébraux et les accidents ischémiques transitoires (AIT).
L'AIT est un épisode bref de dysfonctionnement neurologique dû à une ischémie focale cérébrale ou rétinienne, dont les symptômes cliniques durent typiquement moins d’une heure, sans preuve d’infarctus aigu à l’imagerie cérébrale.
19
- D’origine artériels :
○ Macroangiopathie : Athérosclérose (sténose, thrombose ou embolie à partir d’une plaque d’athérome), dissection artérielle
○ Embolie d’origine cardiaque (cardiopathie fonctionnelle type fibrillation auriculaire ou morphologique type endocardite)
○ Maladie des petites artères
○ Causes rares : coagulopathies acquises ou congénitales, hémopathies, maladies métaboliques (mitochondiropathie)
- D’origine veineux : thrombose veineuse cérébrale (0.5 à 1% des AVC)
Les AVC hémorragiques regroupent les hémorragies primitivement intracérébrales (environ 15% des AVC) et les hémorragies cérébro-méningées (environ 5% des AVC). Ils résultent de la rupture d’une malformation vasculaire ou d’une petite artère et sont favorisés par l’hypertension artérielle et les traitements anti- thrombotiques.
Etant donné les différences étiologiques et de prise en charge entre les AVC ischémiques et hémorragiques, cette étude évaluera uniquement les AVC ischémiques, en excluant les AVC hémorragiques. Les AIT ne seront également pas évalués à cause de la différence dans l’attitude thérapeutique comparée aux AVC ischémiques.
B . Epidémiologie de l’AVC ischémique en France
Les accidents vasculaires cérébraux sont des pathologies fréquentes, graves et handicapantes, qui touchent en France environ 400 000 patients, dont environ 150 000 nouveaux cas par an [1]. 80% des AVC sont d'origine ischémique [1] provoqués par une occlusion artérielle, d'artère à artère ou d'un embol d'origine cardiaque.
En France, ils constituent la première cause de mortalité chez les femmes, avec 18 343 décès en 2013, la troisième chez les hommes, avec 13 003 décès, et sont une cause majeure de handicap moteur non traumatique acquis et de trouble neurocognitif majeur [2] [3] [36] [37].
L’AVC est ainsi un facteur de risque majeur de dépendance. Selon l’enquête Handicap-Santé-Ménages en 2008 [38], pour un tiers des patients déclarant avoir eu un AVC, la présence de séquelles fonctionnelles a entraîné des difficultés pour les activités de la vie quotidienne.
Le coût financier de l’AVC est également élevé avec, en 2013, près de 3,5 milliards d’euros remboursés par l’Assurance Maladie, tous régimes confondus, au titre de la prise en charge médicale d’un AVC, soit presque autant que pour les cardiopathies ischémiques [39].
La relative stabilité de l’incidence, tous âges confondus, couplée au vieillissement de la population est aujourd’hui problématique. En effet, le nombre de patients à prendre en charge au moment de la phase aigüe, puis en soins de suite et de réadaptation, et pour le restant de la vie du patient en cas de séquelles fonctionnelles, ne cesse de croître.
Ainsi, comparativement à 2008, plus de 10 000 personnes supplémentaires de 65 ans ou plus ont été prises en charge en 2014 [1]. En effet, l’incidence des AVC augmente nettement avec l’âge, avec 57,7% des AVC ischémiques chez les patients de plus de 75 ans. Entre 2008 et 2014, le nombre d’hospitalisation pour un AVC ischémique ou hémorragique a augmenté de 13,7%, allant de 97 151 à 110 438, avec une hausse notable des AVC ischémiques (+ 32,8%) [1].
Les patients âgés de plus de 80 ans ont également plus de facteurs de risque de fragilité associé à de multiples comorbidités, et sont plus à risque d’avoir un AVC ischémique massif, rendant leur prise
20
en charge plus complexe [40].
Dans les années 2000, face au poids de l’AVC, la France s’est progressivement dotée d’une politique de santé spécifique et s’est pourvue, au sein des hôpitaux, d’unités neuro-vasculaires (UNV) dédiées spécifiquement à la prise en charge des AVC. Plus récemment, le plan d’actions national AVC (2010-2014) a encouragé et renforcé les actions précédemment engagées en matière de prévention (primaire, secondaire et tertiaire) et de prise en charge [41].
L’amélioration des séquelles fonctionnelles de l’AVC est donc un enjeu de santé publique grandissant au vu du vieillissement de la population générale.
C . Bilan initial de l’AVC
La prise en charge de l'AVC ischémique est basée sur le principe du « Time is Brain » [4] , qui dit que plus la revascularisation se fait de manière précoce, plus on augmente les chances de sauver du parenchyme cérébral potentiellement viable [42]. Ce tissu en souffrance mais encore viable s'appelle la zone de pénombre [4].
Une revascularisation artérielle rapide, efficace et à faible risque permettant de restaurer un flux cérébral afin de limiter les séquelles est donc l'objectif principal de la prise en charge d'un AVC ischémique lors des premières heures [5].
Tout patient admis aux urgences pour une suspicion d'AVC récent doit bénéficier d’une batterie d'examen standardisée, faisant partie de l'évaluation de l'AVC à la phase aigüe [6] [7]. Les buts de cette évaluation à la phase initiale sont :
- Diagnostic positif de l’AVC ischémique,
- Recherche de signes de gravité neurologiques, hémodynamiques et respiratoires, - Elimination des diagnostics différentiels [43]
- Déterminer l'éligibilité à une thrombolyse ou à une thrombectomie en recherchant les contre-indications [44] (Annexe 5).
L’élément primordial à recueillir lors de l’anamnèse est l’heure du début des symptômes. Cette heure est définie comme le dernier moment où le patient était à son état de base, asymptomatique. Pour les patients ne pouvant pas donner cette information ou qui ont eu un AVC dont les symptômes sont constatés au réveil, l’heure de début est définie comme la dernière fois où le patient a été vu asymptomatique ou “ normal” [45].
L’examen clinique initial doit être rapide, concis et peut être réalisé par tout médecin [7], avec la réalisation d’un ECG et le calcul du score de NIHSS [46] [47], National Institutes of Health Stroke Scale, (Annexe 6) composé de 11 items, allant de 0 à 42. Le score de NIHSS à l’admission est corrélé aux conséquences de l’AVC [48] [49] et son emploi est recommandé pour tous les patients admis pour une suspicion d’AVC [6].
Le bilan biologique standardisé lors d’une suspicion d’AVC, également nommé “Bilan pré thrombolyse” au CHU de Bordeaux consiste en une glycémie veineuse, NFS-plaquettes, Ionogramme urée créatinine, bilan hépatique complet, alcoolémie, troponine, pro BNP, TP, INR, aPTT (activated partial thromboplastin time) et les béta HCG sanguin.
Tout patient admis pour une suspicion d’AVC doit bénéficier d’une imagerie cérébrale en urgence, par une IRM cérébrale ou à défaut un scanner cérébral sans injection, avec évaluation concomitante des troncs supra aortiques, afin d’éliminer en priorité une hémorragie intracérébrale comme cause du déficit, d’identifier la lésion vasculaire responsable de l’ischémie cérébrale [6] et chercher des
21
signes précoces d’ischémie.
La recommandation Française insiste sur la supériorité de l’IRM pour détecter des signes d’ischémie récente et donc son utilisation privilégiée, avec des protocoles courts incluant les séquences de diffusion, FLAIR et écho de gradient.
En cas d'inaccessibilité de l’IRM cérébrale, il est préconisé d’utiliser le score ASPECTS [50] qui est un outil de quantification des signes précoces d’ischémie au scanner cérébral, en évaluant l’atténuation de contraste au niveau du parenchyme cérébral.
Le score est établi à partir de deux plans de coupes scanographiques axiaux standards : - Le premier passant par le thalamus et les noyaux lenticulaires ;
- Le deuxième passant par les ventricules latéraux et adjacents au bord supérieur des ganglions de la base, de telle sorte que ceux-ci ne sont pas vus.
Entre ces deux plans de coupe, le territoire de l’artère cérébrale moyenne est divisé en 10 régions, chacune valant un point. Trois points sont attribués pour les structures sous-corticales et 7 pour les parties corticales. Un point est soustrait pour chaque région où l’on note un changement ischémique précoce :
- Un score ASPECTS de 10 signifie un scanner normal ;
- Un score ASPECTS de 0 signifie une ischémie diffuse à tout le territoire de l’ACM.
D . Unité neuro-vasculaire
Tout patient victime d’un AVC ischémique ou hémorragique, devrait bénéficier d’un séjour dans une unité spécialisée neuro-vasculaire et devrait être hospitalisé dans cette unité, d’après les recommandations Françaises [7], Européennes [8] et Américaines [6]. De nombreuses études observationnelles [51] [52] [53] ont démontré que les patients, admis dans une unité spécialisée dans la prise en charge des AVC ischémiques et hémorragiques, ont plus de chance d’être en vie, autonomes et vivants à domicile comparés aux patients admis dans un service conventionnel. Ces effets bénéfiques durent au moins une décennie [54] [55].
Les caractéristiques d’une unité de soins intensifs neuro-vasculaire ou d’une unité neuro-vasculaire varient entre les centres hospitaliers et les pays [56] [57] mais les grandes lignes sont dictées dans le Brain Attack Coalition [58], via des recommandations de fonctionnement, afin de synchroniser les prises en charge.
L’unité neuro-vasculaire est donc un service hospitalier spécialisée dans la prise en charge des AVC ischémique et hémorragique. Elle se caractérise par des lits scopés permettant une thrombolyse intraveineuse avec sa surveillance et d’une équipe médicale composée de neurologues spécialisés en neuro-vasculaire. L’équipe paramédicale est faite d’infirmiers, de kinésithérapeutes et d’orthophonistes ayant une formation particulière dans ce domaine.
L’autre particularité de cette unité est l’accès privilégié au plateau technique hospitalier : IRM cérébrale, scanner cérébral injecté, écho-doppler des troncs supra aortiques, doppler transcrânien, l’échographie cardiaque transthoracique et transoesophagienne.
Les neurovasculaires collaborent également avec les chirurgiens et radiologues spécialisés dans le neuro-interventionnel dans la décision d’une éventuelle thrombectomie.
Suite à une hospitalisation en unité de neuro-vasculaire, une admission dans un centre de soins et de rééducation post AVC est possible, afin d’améliorer le pronostic fonctionnel.
Le bénéfice d’un séjour en unité neurovasculaire est noté pour toutes les tranches d’âge par rapport à une hospitalisation dans un service conventionnel [59] [60] [61].
22
L’augmentation importante de la proportion de patients hospitalisés en UNV observée entre 2008 et 2014 est corrélée au développement de ces unités en France (33 en 2007, 100 en 2010, 135 en 2015). Leur répartition sur le territoire national est cependant inégale et le nombre de lits limité [62].
E . Thrombolyse et thrombectomie
Jusqu’à ces dernières années, le seul traitement ayant une AMM dans la prise en charge d’un AVC ischémique était la thrombolyse intraveineuse avec le r-tPA, activateur recombinant de plasminogène. L’efficacité de ce traitement était inégalée dans le domaine de l’AVC ischémique et le nombre de patients à traiter était d’environ inférieur à 9 pour l’amélioration de séquelles fonctionnelles [63]. La thrombolyse intraveineuse est indiquée, en France, pour les patients ayant un AVC ischémique datant de moins de 4 heures 30 sans limite d’âge et respectant les critères d’inclusion et d’exclusion [6] [7] (Annexe 5).
Les recommandations américaines elles, réduisent les indications de thrombolyse chez les patients âgés puisqu’elle est recommandé uniquement dans un délai inférieur à 3 heures chez les patients de plus de 80 ans. la prise en charge par thrombolyse chez les patients de plus de 80 ans peut être envisagée en cas de prise en charge inférieure à 3 heures.
Malgré l’efficacité indéniable de la thrombolyse, ses effets sont moindres chez les patients ayant une occlusion large ou proximale de l’artère carotidienne ou basilaire, dû à un échec fréquent de revascularisation (moins de 30%) [64]. Le manque d’efficacité de la thrombolyse pour ces types d’occlusion artérielles a engendré de nombreuses études recherchant une technique permettant de traiter les larges occlusions.
Depuis novembre 2014, plusieurs études contrôlées, randomisées, sur la thrombectomie intra vasculaire ont été publiées [65] [66] [67] [68] entraînant une révolution dans la prise en charge des AVC ischémiques dus à une large occlusion artérielle proximale [69] .
En 2015, les recommandations Américaines [6] préconisaient un geste endovasculaire grâce à un stent retriever, si le patient remplissait tous les critères cités ci-dessous :
- mRS en pré AVC de 0 à 1,
- Éligibilité à la thrombolyse IV dans les 4,5 heures après le début des symptômes, - Occlusion de la ICA ou de la M1 proximale,
- Age ≥18,
- Score de NIHSS ≥6, - ASPECTS of ≥6,
- Délai entre le début des symptômes et le début de l’intervention inférieur à 6 heures.
En 2016, des recommandations Européennes [70] ont également encadré le traitement endovasculaire dans l’AVC ischémique à phase aigüe, avec les mêmes critères que les recommandations Américaines.
F . Nouveautés dans le domaine neuro-vasculaire
Début 2018, deux études ont montré l’intérêt, chez certains patients ayant des critères précis d’inclusion, d’une thrombectomie jusqu’à 16 [76] et 24 heures [77] après l’apparition des symptômes, permettant de révolutionner la prise en charge des AVC ischémiques du réveil.
23
[78], le nombre de patients âgés de plus de 90 ans inclus dans les études est très faible, rendant le bénéfice dans ce groupe d’âge incertain.
Des recommandations Américaines [79] ont été publiées en 2018 suite aux résultats de ces deux études citées ci dessus (à noter que la France ne se base pas sur ces recommandations Américaines) :
- La thrombolyse IV est uniquement indiquée pour les patients de plus de 80 ans si le délai entre l’apparition des symptômes et l’administration de la thrombolyse est inférieur à 3 heures. Au delà, l’âge supérieur à 80 ans reste une contre indication.
- Les critères d'éligibilité à la thrombectomie restent les mêmes qu’en 2015.
En effet, les patients devraient bénéficier d’une thrombectomie intravasculaire grâce à un stent retriever s’ils remplissent tous ces critères : âge supérieur à 18 ans, score de NIHSS>/ 6, un score pré AVC mRS de 0 ou 1, ASPECTS >/6, une occlusion de la carotide interne ou du segment M1 et l’initiation du traitement dans les 6 heures après le début des symptômes. - La thrombectomie peut également être discutée en cas d’occlusion proximale de M2, M3 et
des artères cérébrales postérieures.
G . Quelle place pour la thrombolyse et la thrombectomie dans la population gériatrique ?
En 2017, les recommandations internationales détaillent peu quelle stratégie adopter face à un AVC ischémique dans la population gériatrique. En effet, il est même stipulé que la thrombolyse n’est pas indiquée chez les patients de plus de 80 ans.
La recommandation Européenne [7] déclare que l’âge n’est pas un critère en lui-même d’exclusion à la thrombectomie mais ne donne pas plus de précision et la recommandation Américaine ne parle pas des spécificités de la population gériatrique.
Ces lacunes sont liées à l’absence de preuves scientifiques montrant l’intérêt de la thrombectomie dans cette population, à cause de la faible inclusion de patients de plus de 80 ans dans les études gériatriques [71] [72], le caractère récent de la technique de thrombectomie et le faible taux d’études sur la gérontologie dans le domaine neurovasculaire…
Afin de pallier au manque de précisions dans les recommandations, l’article de la revue Geriatrics [73] a réalisé une synthèse des données disponibles sur la prise en charge de l’AVC ischémique dans la population gériatrique : l’admission dans une unité de neurovasculaire pour tout patient ayant un AVC ischémique à la phase précoce, qu’importe l’âge, améliore le pronostic fonctionnel et vital.
L’administration d’une thrombolyse IV dans les 4,5 heures du début de symptômes est liée à une amélioration de l’état post AVC, qu’importe l’âge et la sévérité de l’AVC, malgré un sur risque létal d’hémorragie intra cérébrale dans les premiers jours post thrombolyse [63].
Les auteurs précisent que la thrombolyse montre clairement un bénéfice pour les patients âgés pouvant être inclus dans les études cliniques, mais une part non négligeable de ces patients ont des comorbidités majeures et des TNCM, rendant le rapport bénéfice/risque pour la thrombolyse moins net. En effet, la présence de troubles neurocognitifs majeurs ou de dépendance sont systématiquement des critères d’exclusion dans les études.
Les études cliniques sur la thrombectomie n’ont pas défini de limite supérieure d’âge et les effets bénéfiques semblent être égaux dans tous les groupes d’âge, malgré le manque de données actuelles chez les patients âgés de plus de 75 ans.
24
H . Stratégie thérapeutique de l’AVC ischémique hors délais
En cas d’AVC ischémique pris en charge hors délais ou ayant une contre-indication à la thrombolyse ou à la thrombectomie, il est recommandé de réaliser le même bilan initial que décrit précédemment.
La stratégie thérapeutique initiée par les neurovasculaires dépend de l’étiologie de l’AVC et l’absence d’anticoagulation curative au préalable :
- Une sténose artérielle intracrânienne indique une bi-antiagrégation plaquettaire pendant 90 jours suivi d’un traitement antiagrégant au long cours.
- Une sténose carotidienne doit bénéficier d’une revascularisation carotidienne (endartériectomie ou stent) suivie d’une antiagrégation au long cours.
- Une maladie des petites artères ou une origine cryptogénique doit bénéficier d’un traitement antiagrégant au long cours.
- Toute autre étiologie (dissection carotidienne, vascularite etc.) doit avoir un traitement adapté.
- Origine cardio-embolique provoqué par une fibrillation auriculaire : la stratégie thérapeutique dépend de l’étendue de l’AVC et la complication hémorragique.
○ En cas d’AVC ischémique sans complication hémorragique, chez un patient non éligible à la thrombolyse ou à la thrombectomie, il est recommandé de débuter sans délai un traitement par aspirine [74], conjointement à la réalisation d’un bilan étiologique.
○ En cas de découverte de fibrillation auriculaire associée à un AVC non étendu et sans remaniement hémorragique, un traitement par anticoagulation curative peut être débuté dans les 24-48 heures.
○ En cas d’AVC étendu sans remaniement hémorragique, le traitement anticoagulant peut être débuté au bout de une à deux semaines, en relais de l’aspirine débuté immédiatement [75].
○ En cas de remaniement hémorragique, l’attitude préconisée est l'abstention thérapeutique médicamenteuse transitoire, avec introduction après imagerie cérébrale de contrôle.
Lors d’un AVC ischémique chez un patient déjà sous traitement anticoagulant, l’urgence est d’arrêter l’anticoagulant afin de limiter le risque de remaniement hémorragique.
- En cas d’AVC non étendu et sans remaniement hémorragique, le traitement anticoagulant peut être à partir de 24-48 heures post AVC si le patient est stable.
- En cas d’AVC étendu sans remaniement hémorragique, il est préconisé de débuter un traitement par aspirine puis reprendre un traitement anticoagulant seul au bout d’une à deux semaine si le patient est stable.
- En cas d’AVC avec remaniement hémorragique, l’attitude préconisée est l’arrêt provisoire de l’anticoagulation et de l’antiagrégant.
I . AVC et Âgisme
Plusieurs études, réalisées sur la prise en charge des AVC chez les sujets âgés, révèlent également l’impact de l'âgisme sur le pronostic fonctionnel [10] et vital de ces patients.
Il est décrit, lors du bilan initial d’un AVC ou d’un AIT chez les patients âgés, une sous prescription d’imagerie cérébrale et un sous traitement de lésions carotidiennes décelées [11].
25
en unité de neurovasculaire et également moins sujette à un séjour en centre de rééducation suite à un AVC [12] [80] [81] [82].
26
MÉTHODES
L’objectif principal de notre étude était d’identifier les facteurs prédictifs de la non admission en UNV chez les patients de 75 ans et plus, admis dans le service des Urgences adultes Pellegrin du Centre Hospitalier Universitaire (CHU) de Bordeaux.
I.
Schéma d’étude
Il s’agit d’une étude descriptive et rétrospective, des données d’une population de patients admis dans le service des Urgences Pellegrin du CHU de Bordeaux.
II. Population étudiée
Ont été inclus dans cette étude les patients : - De 75 ans et plus,
- Admis dans le service d’urgences de l'hôpital Pellegrin du CHU de Bordeaux, - Avec un diagnostic d’AVC ischémique à l’imagerie cérébrale.
N’ont pas été inclus les patients : - De moins de 75 ans,
- Ayant un diagnostic d’AVC hémorragique, d’hémorragie sous arachnoïdienne ou d’AIT.
III. Lieu de l’étude
Il s’agit d’une étude monocentrique qui s’est déroulée au sein du service d’Urgences adultes Pellegrin du CHU de Bordeaux. L’un des plus importants secteurs d’activité des urgences de Pellegrin concerne la prise en charge des pathologies neurovasculaires. En effet, le CHU de Pellegrin bénéficie d’une unité neurovasculaire depuis 2008, la première créée en Aquitaine, associée à un service de neuroradiologie qui fonction 24h/24.
Le service est organisé en quatre secteurs différents : l’accueil, les consultations, les soins d’urgences et l’unité d’hospitalisation de courte durée (UHCD). Accolée se trouve l’unité de déchocage, permettant la prise en charge des patients instables, nécessitant une prise en charge réanimatoire ou neurovasculaire. La thrombolyse faite aux urgences se réalise dans l’unité de déchocage.
IV. Sources des données
Les patients sélectionnés pour l’étude ont été hospitalisés dans le service d’Urgence du 1er Janvier au 30 Juin 2017.
27
Les données d’hospitalisation ont été extraites de l’analyse rétrospective du Programme de médicalisation des systèmes d’information en médecine, chirurgie, obstétrique (PMSI-MCO), qui code la prise en charge des patients hospitalisés.
Tous les résumés de sortie anonymes (RSA) de patients comportant en diagnostic principal l’un des codes relatifs à l’AVC ischémique de la 10e révision de la Classification internationale des maladies (CIM-10) ont été sélectionnés : I630, I631, I632, I633, I634, I635, I639, G451, G450 et G809. En cas d’erreur d’affectation de diagnostic principal constatée à la lecture du dossier médical (AVC hémorragique, AIT, HSA, ictus amnésique etc.), le dossier est exclu de l’analyse.
Les caractéristiques pré hospitalières des patients ont été notées : âge, sexe, le type de domiciliation, la présence familiale, comorbidités, degré d’autonomie et statut tabagique.
Le choix des critères évalués afin de définir une prise en charge standardisée des patients s’est basé sur ceux définis par la méta-analyse en 2011 [83] :
- Bilan biologique initial avec une fonction rénale, - Réalisation d’une imagerie cérébrale,
- Avis du neurovasculaire,
- Création d’un dossier neurovasculaire, - Admission dans l’unité de neurovasculaire, - Administration d’un traitement spécifique, - Devenir du patient.
V. Aspect éthique
Il s’agit d’une étude descriptive, rétrospective et non interventionnelle, par analyse des données recueillies dans le cadre de soins courants du centre hospitalier universitaire de Pellegrin.
L’ensemble des informations recueillies l’ont été dans un but d’une optimisation de la prise en charge du patient. Ces données ne rentrent donc pas dans le cadre de la Loi Jardé.
Aucune information spécifique n’a été fournie aux patients inclus. Néanmoins, les données ont été anonymisées conformément à l’éthique médicale.
VI. Recueil des données
A. Caractéristiques pré hospitalières
Les caractéristiques pré hospitalières des patients ont été recueillies. 1. Données démographiques
- Sexe
- Age : analyse par sous-groupe d’âge : ○ 75 à 80 ans
○ 80 à 85 ans ○ Plus de 85 ans - Type de domiciliation :
28
○ Institution : EHPAD/EHPA - Mode de vie :
○ Présence d’une famille ○ Présence d’enfants ○ Vit seul à domicile
○ Vit accompagné par son époux/épouse ○ Vit accompagné par une autre personne 2. Comorbidités
- Diabète, compliqué ou non - Insuffisance cardiaque - Insuffisance rénale chronique - Troubles neurocognitifs majeurs
- Néoplasie datant depuis moins de 5 ans (incluant les hémopathies) - Pathologie vasculaire périphérique
- Infarctus du myocarde - Statut VIH
L’index de Charlson Comorbidity est utilisé pour quantifier les comorbidités, avec prise en compte de l’âge (Annexe 1).
Les antécédents de maladies de système, de pathologies hépatiques et pulmonaires chroniques, d’AIT et d’AVC ont également été pris en compte lors du calcul du Charlson mais n’ont pas été détaillés dans le tableau des caractéristiques.
Les distinctions diabète compliqué ou non et cancer avec ou sans métastases ont également été identifiés, afin d’obtenir le score le plus représentatif des comorbidités du patient.
Afin de limiter le risque d’erreur, les calculs du score de Charlson ont été réalisés sur le site internet RDPLF (Annexe 2).
La présence de TNCM est notée dès qu’il y a une trace écrite dans le dossier médical : - Dans la partie Antécédents du logiciel DxCare,
- Relaté dans l’observation médicale par un interrogatoire de la famille ou du médecin traitant.
L’absence de TNCM est noté en cas de renseignement clair sur l’absence de TNCM.
L’absence de renseignement sur l’état cognitif est également noté et le patient est considéré comme ne présentant pas de TNCM.
Le MMS est relevé dès que ce renseignement paraît dans l’observation médicale.
Le calcul du score de Katz ADL a été réalisé dès que cela était possible pour définir l’autonomie pré AVC (Annexe 3).
En cas d’informations incomplètes, le calcul du score de Katz ADL n’a pas été réalisé. Le statut tabagique est recherché :
- Tabagisme actif, - Tabagisme sevré, - Absence de tabagisme,
29
B. Critères liés à la prise en charge
La réalisation ou non du bilan biologique, avec dosage de la créatinine, est recherchée dans l’onglet biologie du logiciel DXcare et dans les observations médicales (notamment lors de la prise en charge d’un patient transféré d’un autre centre hospitalier).
1. Type d’imagerie
Le type d’imagerie cérébrale dont les patients ont bénéficié est étudié : - Scanner cérébral non injecté,
- Scanner cérébral injecté avec analyse des troncs supra aortiques, - IRM cérébral avec analyse des troncs supra aortiques.
Tous les patients inclus dans l’analyse ont bénéficié d’une imagerie cérébrale puisque le diagnostic principal en dépend.
2. Avis auprès du neurovasculaire
La demande d’avis auprès d’un médecin neurovasculaire est recherchée et toute trace signalant la demande d’avis est considérée comme un avis neurovasculaire :
- Création d’un onglet “avis de spécialité”,
- Création d’un onglet “consultation interne” dans le dossier des urgences,
- Retransmission écrite dans le dossier des urgences d’une conduite à tenir proposée par un neurovasculaire.
La création d’un dossier neurovasculaire est notée également. 3. Traitement spécifique
La réalisation d’un traitement spécifique par thrombolyse et/ou thrombectomie est recherchée, ainsi que l’introduction ou majoration d’un traitement antiagrégant ou anticoagulant durant le séjour hospitalier.
4. Service d’hospitalisation et durée de séjour
Le service d’hospitalisation à la phase précoce de l’AVC est documenté : - Unité de neurovasculaire,
- Unité de neurologie conventionnel, - Service de gériatrie,
- Service de post urgence,
- Service de de chirurgie vasculaire ou autre.
La durée d’hospitalisation intra-hospitalier est calculée en nombre de jours. La durée de séjour aux urgences est calculée en nombre d’heures.
5. Devenir du patient
Le devenir du patient est étudié : transfert vers un autre centre hospitalier, sortie précoce de l’hôpital (définie par une sortie administrative moins de 48 heures après l’admission) et le décès.
30
VII. Analyse statistique
A. Objectifs 1. Objectif principal
Pour rappel, l’objectif principal de l’étude est d’étudier les facteurs prédictifs de la non admission en UNV des patients âgés de plus de 75 ans ayant un AVC ischémique.
2. Objectifs secondaires Les objectifs secondaires sont :
- Evaluation des caractéristiques des patients institutionnalisés,
- Evaluation des caractéristiques des patients n’ayant pas eu d’avis neurovasculaire.
B. Critère de jugement principal
Le critère de jugement principal était l’admission ou non dans l’unité de neurovasculaire, à la phase aigüe d’un AVC ischémique.
Le choix de ce critère est basé sur le principe qu’un patient admis dans l’unité de neurovasculaire profite de la prise en charge la plus optimale possible, en fonction de l’état général du patient.
C. Analyse statistique
Le test de Fisher a été utilisé pour comparer les variables qualitatives, alors que le test de Mann-Whitney Wilcoxon a été utilisé pour les variables quantitatives. Un p<0.2 dans l’analyse univariée a été choisi comme seuil pour développer ces modèles. Les facteurs ayant ce degré de significativité ont été inclus dans l’analyse multivariée. Le modèle final inclut les variables ayant un résultat statistiquement significatif, avec un p<0.05, associé au paramètre évalué.
L’admission ou non dans l’unité neurovasculaire est la principale variable, permettant de définir quels sont les facteurs ayant un impact statistique sur la décision d’admission dans l’unité.
Les analyses ont été réalisées au moyen du logiciel R 2011, version 1.1.423, RStudio, Inc. L’ensemble des statistiques ont été réalisées par le Docteur Cédric GIL JARDIN.