UNIVERSITÉ MOHAMMED V – AGDAL
FACULTÉ DES SCIENCES
Rabat
THÈSE DE DOCTORAT
N° d‘ordre : 2475
Présentée par
Mme. Ouadghiri Mouna
Discipline : Biologie
Spécialités : Microbiologie et Biologie Moléculaire
Biodiversité des bactéries lactiques dans le lait cru et
ses dérivés « Lben » et « Jben » d’origine marocaine
Soutenue le 23 décembre 2009 devant le jury :
Président :
M. Mohamed Saghi : Professeur à l‘Université Mohammed V- Agdal, Rabat
Examinateurs :
M. El Bekkay Berraho : Professeur à la Faculté des Sciences de Rabat
M. My Mustapha Ennaji: Professeur à la Faculté des Sciences et Techniques de Mohammedia M. Houssine Azeddoug : Professeur à la Faculté des Sciences Aîn Chock, Casablanca
M. M’hamed Tijane : Professeur à la Faculté des Sciences de Rabat
M. Mohamed Amar : Professeur au Centre National pour la Recherche Scientifique et
Dédicaces
Je dédie ce travail à
Mon pére Mr. Ouadghiri Mohamed
Tu es un pilier solide et incontournable pour ma personne et mon parcours, que
Dieu te donne santé et longue vie
Ma mére Mme. Latifa ElFilali
Que ce travail soit pour toi le témoignage de mon infinie reconnaissance pour ton
aide précieuse et toutes ces années de compréhension
A ma sœur Asmae et son mari Abderrahim Tarek et leur petit Mohammed
Ma sœur Ilhame et son mari Hicham Rahou
Mon chér frére Nabil
pour ta compréhension et ton aide précieuse dans les moments difficiles
Ma chère sœur Naoual et Mon chèr frére Mehdi
À mes chérs oncles : Mamoun, Mustapha, Ghali et Hassan ainsi que leur famille
Mon chér mari Mr. Youssef Khayati
Pour ton soutien et ta compréhension
A mon bébé Ismaîl né au cours de la préparation de cette thése et qui a illuminé
ma vie
A ma belle mére Fatima Khayati
Mes deux belles sœurs Badiaa et Malika
AVANT PROPOS
Les travaux présentés dans cette thèse ont été effectués au Laboratoire de Biochimie et Immunologie de la Faculté des Sciences de Rabat en collaboration avec le Laboratoire de Microbiologie et Biologie Moléculaire (LMBM) relevant du Centre National pour la Recherche Scientifique et Technique (CNRST) Rabat.
L‘encadrement scientifique de ce travail a été assuré par le Prof. M‘hamed Tijane, Professeur de Biochimie et responsable du Laboratoire de Biochimie et Immunologie de la Faculté des Sciences de Rabat (UFR : Biodiversité et Aquaculture, SV01/01) et le Prof. Mohamed Amar, Professeur de Microbiologie et Biologie Moléculaire et responsable du Laboratoire de Microbiologie et Biologie Moléculaire, CNRST, Rabat.
Tout d‘abord, je tiens à remercier infiniment le Professeur M‘hamed Tijane qui non seulement a été mon professeur de Biochimie à la Faculté des Sciences de Rabat mais m‘a aussi aidé à choisir une thématique porteuse qui est la biologie moléculaire et la bioinformatique. Je tiens à lui exprimer ma reconnaissance et ma gratitude pour avoir choisi pour moi le LMBM/CNRST, Rabat comme laboratoire d‘acceuil.
Je tiens vivement à exprimer ma profonde reconnaissance et gratitude au Professeur Mohamed Amar pour m'avoir accueilli au laboratoire et m'avoir donné les moyens de mener à bout cette étude, pour sa disponibilité, sa patience, sa compréhension et l‘intérêt porté pour mon sujet de recherche.
Mes remerciements les plus chaleureux et respectueux au président du jury, le Professeur Mohamed Saghi, Professeur de Microbiologie de l‘Université Mohammed V- Agdal, Rabat.
Mes remerciements vont aussi au Prof. El Bekkay Berraho, Professeur à la Faculté des Sciences de Rabat, d‘avoir accepté, malgré ses préoccupations et ses tâches d‘enseignement et d‘encadrement, de lire et de juger ce travail. Qu‘il trouve ici mes sincères sentiments de gratitude et de respect.
Je tiens à remercier également Prof. Moulay Mustapha Ennaji, Professeur à la Faculté des Sciences et Techniques de Mohammedia, d‘avoir eu l‘amabilité d‘accepter volontairement et aimablement de critiquer et de juger ce travail.
Mes remerciements vont aussi au Prof. Houssine Azeddoug, Professeur à la Faculté des Sciences, Aîn Chock, Casablanca, d‘avoir pris de son temps malgré les responsabilités qui lui incombent pour juger et critiquer ce travail. Je suis particulièrement reconnaissante et honorée par sa participation au jury de cette thèse.
Mes sentiments les plus profonds et remerciements infinis à mes collègues et amis du Laboratoire de Microbiologie et Biologie Moléculaire du CNRST pour les relations amicales, conviviales, fraternelles et professionnelles qu‘ils ont su tisser au sein du laboratoire. Je tiens à exprimer ma profonde gratitude spécialement à Mme Najat Bouachik qui a lu et corrigé cette thèse, Mlle Imane Berrada, Mr. Tarik Aaniz et Mr. Chajar Noureddine.
Mes très spéciaux remerciements reviennent à mes amies : Mme Naima Amaamaa, Mme. Naima Lachhab, Mme. Amina ElBassami, Mme. ElKhedri Hanane, Mme. Fatima Zahra Raziki, Mlle. Zaynab Fadli, Mlle. Siham Amanou, Mlle. Ettahiri Wafae, Mme. Nihal Abitiu et Mme. Joumana ElTurk pour tous les moments partagés ensemble, pour leur soutien et leurs mots encourageants et pour leur amitié sincère.
Un remerciement spécial et chaleureux à mon amie Mlle Amina Radgui, pour son soutien sans faille, sa compréhension et ses encouragements.
Production scientifique
Ce travail s‘inscrit dans le cadre de l‘étude de la biodiversité des bactéries lactiques dans le lait cru d‘origine marocaine et ses dérivés traditionnels (« Jben » et « Lben »). Il a bénéficié du soutien financier de la part :
- du programme de participation de l‘UNESCO (project: pp04-27222505),
- de l‘Administration Générale de la Coopération Belge (AGCB - projet: FRAB ⁄ 2005),
- du Centre National pour la Recherche Scientifique et Technique, Rabat, Maroc (project: PROTARS P2T3 ⁄ 28).
Les travaux effectués au cours de cette Thèse ont contribué aux publications et communications orales et affichées suivantes:
Publications:
Ouadghiri, M., Vancanneyt, M., Amar, M. and Swings, J. (2005). Biodiversity of lactic acid bacteria in Moroccan soft white cheese (jben). FEMS Microbiology Letters. 251: 267–271.
Ouadghiri, M., Vancanneyt, M., Vandamme, P., Naser, S., Gevers, G., Lefebvre, K., Swings, J. and Amar, M. (2009). Identification of lactic acid bacteria in Moroccan raw milk and traditionally fermented skimmed milk ‗lben‘. Journal of Applied Microbiology. 106 : 486– 495
Communications affichées:
- Ouadghiri, M., Abitiu, N. And Amar, M. Quatrième salon de l‘innovation, de la recherche et développement et de la technologie, en présentant un poster traçant les différents activités et services du Laboratoire de Microbiologie et Biologie Moléculaire - CNRST, organisé au parc des expositions de l‘office des changes à Casablanca du 6 au 9 octobre 2004.
- Abitiu, N., Ouadghiri, M. And Amar, M. Moroccan Coordinated Collections of Microorganisms – CCMM : National tool for promoting scientific interest and investigation in microbial biodiversity, Tenth International Congress for Culture Collections – ICCC-10, Tsukuba – Japan du 10 au 15 Octobre 2004.
- Ouadghiri, M., Vancanneyt, M., Vandamme, P., Naser, S., Gevers, G., Lefebvre, K., Swings, J. and Amar, M. Identification of lactic acid bacteria in Moroccan raw milk and traditionally fermented skimmed milk ‗Lben‘. Journée Nationale de Microbiologie sous le thème: Microbiologie et santé, Université Hassan II Mohammedia, Faculté des Sciences et Techniques, Mohammedia, 23 mai 2007.
Communications orales:
- Ouadghiri M., Amar M. « Biodiversité des bactéries lactiques dans le Jben marocain ». Journées Nationales de Microbiologie, Université Mohamed Premier, Faculté des Sciences, Oujda, 27 et 28 mai 2005.
Résumé
Un total de 54 échantillons de produits laitiers (lait cru (29), Jben (8) et Lben (17)) provenant de différentes fermes et régions marocaines ont fait l‘objet d‘une analyse microbiologique pour déterminer leur diversité en bactéries lactiques.
300 bactéries lactiques ont été isolées et identifiées par des méthodes biochimiques (API50 CHL), moléculaires (SDS-PAGE) et génotypiques ((GTG)5-PCR et séquençage du
gène codant pour l‘ARNt phenylalanine synthase PheS). Cette étude a montré que l‘identification fiable des 300 isolats a nécessité l‘utilisation d‘une approche polyphasique incluant des techniques moléculaires de pointes et des logiciels bioinformatiques utilisant de larges bases de données.
Cette étude montre que la biodiversité du lait cru marocain est caractérisée par des entérocoques, des lactobacilles, des lactocoques, des leuconostocs et des Weissella. Les bactéries lactiques les plus fréquentes appartiennent aux espèces Lactococcus lactis,
Leuconostoc pseudomesenteroides, Leuconostoc mesenteroides et Lactobacillus plantarum.
Les bactéries lactiques dominantes dans le « Jben » marocain appartiennent au genre
Lactobacillus (34%), Lactococcus (22%), Leuconostoc (27%) et Enterococcus (10%). Au
niveau de l‘espèce, Leuconostoc pseudomesenteroides est présente dans tous les échantillons examinés. L‘espèce Lactobacillus plantarum est présente d‘une façon dominante dans la quasi-totalité des échantillons examinés.
Le ―Lben‖ est typiquement dominé par les espèces Lactococcus lactis (41%),
Leuconostoc pseudomesenteroides (36%) et Lactobacillus plantarum (15%). Leuconostoc mesenteroides a été trouvé moins fréquemment (5%).
Le lait cru et les produits laitiers traditionnels marocains sont caractérisés par une riche biodiversité en bactéries lactiques. Cependant, sa prévalence est fonction des fermes, de la région, des pratiques courantes des producteurs et du mode de production.
Mots clés : lait cru, produits laitiers traditionnels, biodiversité, bactéries lactiques,
Summary
A total of 54 samples of dairy products (raw milk (29), ―Jben‖ (8) and ―Lben‖ (17)) sampled from different Moroccan regions and farms have been investigated for their lactic acid bacteria microbial diversity.
300 lactic acid bacteria have been isolated and identified using biochemical (API501CHL), molecular (SDS-PAGE) and genotypic methods ((GTG)5-PCR and
sequencing of the gene coding for phenylalanine tRNA synthase). It has been shown that reliable identification of the isolates required the use of a polyphasic approach including molecular techniques and bioinformatic software with large databases.
This study shows that biodiversity of Moroccan raw milk is characterized by enterococci, lactobacilli, lactococci, leuconostocs and Weissella. The most frequent species of lactic acid bacteria belong to Lactococcus lactis, Leuconostoc pseudomesenteroides,
Leuconosto mesenteroides and Lactobacillus plantarum.
The dominant lactic acid bacteria in "Jben" belong to the genera Lactobacillus (34%),
Lactococcus (22%), Leuconostoc (27%) and Enterococcus (10%). At the species level, Leuconostoc pseudomesenteroides is present in all analyzed samples. The species Lactobacillus plantarum is present in almost all analyzed samples.
The "Lben is typically dominated by the species Lactococcus lactis (41%),
Leuconostoc pseudomesenteroides (36%) and Lactobacillus plantarum (15%). Leuconostoc mesenteroides was found less frequently (5%).
Moroccan raw milk and traditional dairy products are characterized by a rich biodiversity of lactic acid bacteria. However, its occurrence depends on the farms, the region, the practices of farmers and the process of production.
Keywords: raw milk, traditionnel dairy products, biodiversity, lactic acid bacteria, (GTG)5-PCR, sequencing, bioinformatics.
Liste des abbréviations
ADN : Acide DéoxyriboNucléiqueARN : Acide RiboNucléique ADNr: ADN ribosomal ARNt: ARN de transfert
AFLP: Amplified Fragment Length Polymorphism AFNOR: Association Française de Normalisation ADP: Adénosine Diphospahte
API: Analytic Programme Index ATP: Adénosine Triphosphate
BCCM: Belgian Coordinated Collections of Microorganimsms BSA : Bovine Sérum Albumine
Carno: Carnobacterium
CCMM: Collections Coordonnées Marocaines de Microorganismes cm : centimètre
CNRST: Centre National pour la Recherche Scientifique et Technique CO2: dioxyde de carbone
°C: Degré celsus
dATP:Désoxyadénosine Triphosphate dCTP: Désoxycitidine Triphosphate
DGGE: Denaturing Gradient Gel Electrophoresis dGTP: Désoxyguanosine Triphosphate
DMSO : Diméthylsulfoxyde
dNTP : Désoxyribonucléotides Triphosphate DO: Densité Optique
dTTP: Désoxythimidine Triphosphate °D: Degré dornic
EDTA : Ethylène Diamine Tétraacétique Acid Ent. : Enterococcus
FAO/OMS: Food and Agriculture Organization / Organisation Mondiale de la Santé g : gramme
h: heure
HCl : Acide chlorhydrique Kv : kilovolt
l.: litre
L.: Lactococcus
LAB: Lactic Acid Bacteria
Lact.: Lactobacillus Leuc.: Leuconostoc
LMBM: Laboratoire de Microbiologie et Biologie Moléculaire LMG: Laboratoire de Microbiologie de Gand
M : Molaire mA : milliampère mg: milligramme MgCl2 : Chlorure de Magnésium min: minute ml: millilitre mM : millimolaire mol : mole
MRS: Man Rogosa Sharp N : Normalité
NaCl : Chlorure de sodium
NAD: Nicotinamide Adénine Dinucléotide Na2HPO4 : phosphate disodique
NaOH : Hydroxyde de sodium nb. : nombre
ng. : nanogramme
(NH4)SO4 : sulfate d‘ammonium
Ped.: Pediococcus
Pb : Paire de base
PFGE: Pulsed Field Gel Electrophoresis
Phe S: Phenylalanine Synthase
PheS F: Phenylalanine Synthase Forward PheS R : Phenylalanine Synthase Reverse
pH: potentiel Hydrogène qsp: quantité suffisante pour
RAPD: Random Amplified Polymorphic DNA rpm: rotation par minute
RFLP: Restriction Fragment Length Polymorphism
rep-PCR: repétitive extragénic palindromique – Polymerase Chain Reaction sec: seconde
SDS-PAGE: Sodium Dodecyl Sulfate- PolyAcrilamide Gel Electrophoresis SDS : Sodium Dodecylsulfate
Sp. : espèce non précisée
Spp. : plusieurs espèces non précisée STET : Saccharose, Tris, EDTA, Triton Subsp.: Sous esépce
T°: Température T: Type
TAE: Tris Acétate EDTA Taq : de Thermus aquaticus TE: TrisEDTA
TEMED: Tétraméthyléthylènediamine TES : Tris EDTA Saccharose
TCA : Acide Trichloroacétique
STET : Saccharose Tris EDTA Triton TE : Tris EDTA
U : unité
UFC: unité formant colonie
UNESCO : Organisation des Nations Unies pour l‘Education, la Science et la Culture UPMGA: Unweight Pair Group Method with Arithmetic mean
USA : United States of America V : volt
W.: Weissella
µl: microlitre µM : micromolaire µg : microgramme
LISTE DES FIGURES
Figure 1 : Schéma de fabrication des produits laitiers traditionnels marocains ……..….…. 28 Figure 2 : Dégradation du glucose par les bactéries lactiques ……….………….…… 36 Figure 3: Arbre phylogénétique des bactéries Gram positives basé sur la comparaison des séquences de l‘ARNr 16S ……….……….…… 38 Figure 4 : Gel d‘électrophorése des produits de la (GTG)5-PCR des isolats identifiés par API
50CHL comme des L. lactis ……….…. 62
Figure 5 : Dendrogramme et profils (GTG)5-PCR des bactéries lactiques du gel de la figure 4
……….... 62
Figure 6 : Gel d‘électrophorése des produits de la (GTG)5-PCR des isolats identifiés par API
50CHL comme des Leuc.mesenteroides ……….... 64
Figure7 : Dendrogramme et profils (GTG)5-PCR des bactéries lactiques du gel de la figure 6
……… 64
Figure 8 : Gel d‘électrophorèse des produits de la (GTG)5-PCR de 7 isolats (identifiés
différemment par API 50CHL) ………...… 65
Figure 9: Dendrogramme et profils (GTG)5-PCR de bactéries lactiques du gel de la figure 8
……….. 65
Figure 10: Dendrogramme et profils (GTG)5-PCR de bactéries lactiques, isolées du lait cru,
incubé et pasteurisé, groupés et identifiées au niveau de l‘espèce par (GTG)5-PCR ………. 66
Figure 11 : Dendrogramme basé sur l‘analyse numérique des profils protéiques des souches
représentatives de chaque groupe identifié après l‘analyse SDS-PAGE ……… 68
Figure 12: Dendrogramme et profils (GTG)5-PCR de bactéries lactiques, isolées du Jben,
groupés et identifiées au niveau de l‘espèce par (GTG)5-PCR ………..…. 75
Figure 13: Dendrogramme et profils (GTG)5-PCR de bactéries lactiques, isolées du « Lben »,
LISTE DES TABLEAUX
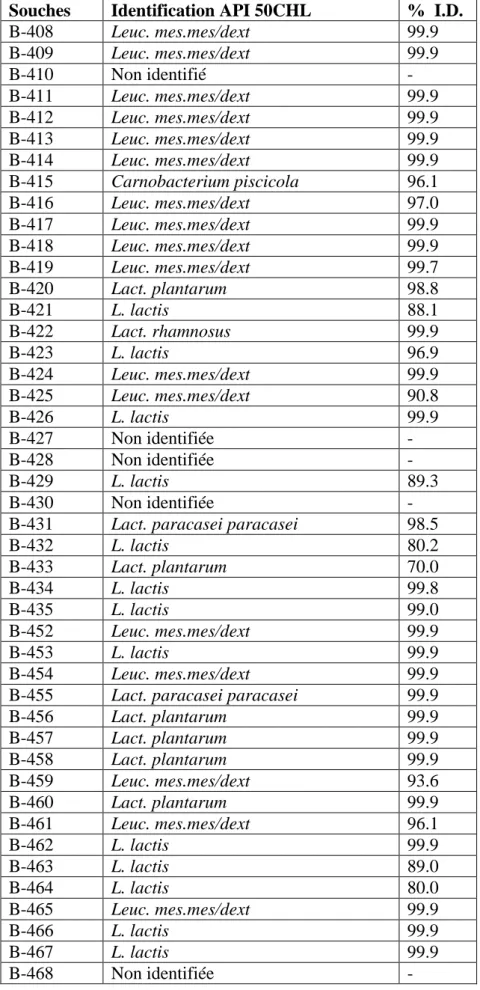
Tableau 1: Incidence des bactéries lactiques dans le lait cru marocain et le lait pasteurisé .. 58 Tableau 2 : Résultats des identifications par API 50CHL ……….. 60 Tableau 3 : Comparaison des résultats des identifications par API 50CHL et identification
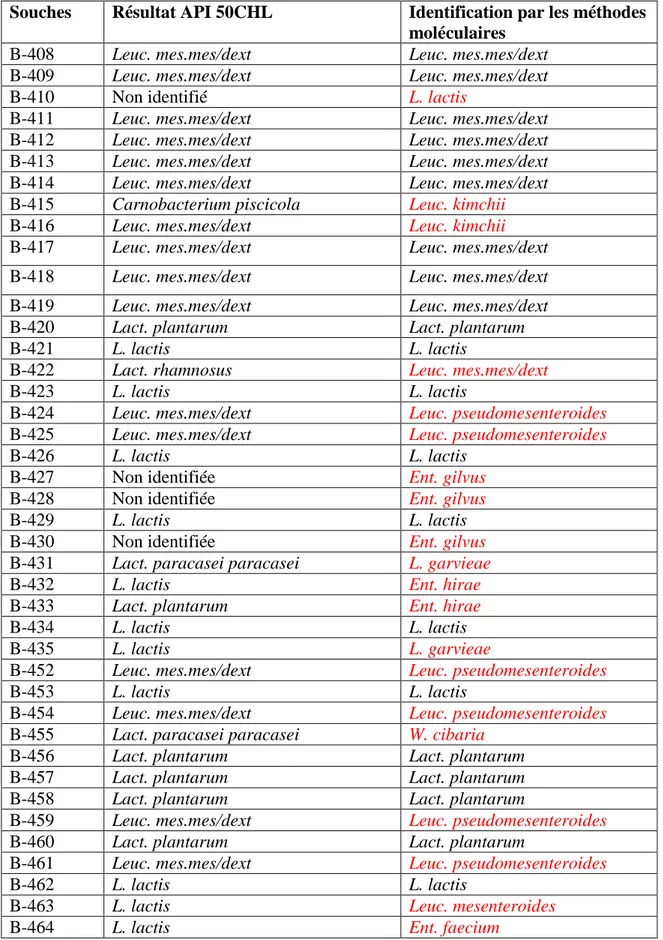
par (GTG)5-PCR, SDS-PAGE et pheS ……… 70
Tableau 4 : Incidence des bactéries lactiques dans le « Jben » marocain ……….. 77 Tableau 5 : Incidence des bactéries lactiques dans le « Lben » marocain ………. 79
LISTE DES ANNEXES
Annexe 1 : Composition des milieux MRS et M17 ………..….. 106 Annexe 2 : Coloration de Gram ………..… 107 Annexe 3 : Les tampons et solutions utilisés pour SDS-PAGE ……….. 108 Annexe 4 : Les tampons et solutions nécessaires à l‘extraction d‘ADN …………..…….. 110 Annexe 5 : Les solutions nécessaires pour la réaction (GTG)5-PCR ……… 112
Annexe 6 : Les gels d‘eléctrophorése des produits de PCR en utilisant (GTG)5 comme
Sommaire
Dedicaces
Avant propos
Production scientifique
Résumé
Summary
Liste des abbréviations
Liste des figures
Liste des tableaux
Liste des annexes
Introduction générale ………..….…… 19
Partie I : Revue bibliographique …...……….………... 22
I- Le lait et ses dérivés ……….. 23
1- Le lait cru ……… 23
2- Les laits fermentés ………..…… 24
3- Le fromage frais ……….……. 26
II- Consommation des produits laitiers au Maroc ………. 29
III- Composition physico-chimique du lait cru et ses dérivés ……….. 29
1- Lait cru ………...………… 29
2- Lait fermenté écrémé ……… 30
3- Fromage frais « Jben » ………. 30
IV- Microbiologie du lait cru et ses dérivés ……… 31
1- Lait cru ……… 31
2- Lait fermenté écrémé ……….…. 32
3- Fromage frais ……….…. 32
V- Découverte et application industrielle des bactéries lactiques ………. 33
1- Découverte des bactéries lactiques ……… 33
2- Application industrielle des bactéries lactiques ………...… 33
2.1- Les ferments lactiques naturels ………...…. 33
VI- Caractéristiques, classification et identification des bactéries lactiques ………..…. 34
1- Caractéristiques principales des bactéries lactiques ……….…. 34
2- Classification des bactéries lactiques ……….….. 37
3- Identification et tyage des bactéries lactiques ……… 39
3.1- Méthodes phénotypiques ………... 39
3.2- Méthodes génotypiques ………. 40
3.2.1- Le ribotypage ………... 40
3.2.2- Le profil plasmidique ……… 41
3.2.3- Méthodes des empreintes digitales (fingerprinting) ………. 41
3.2.3.1- L‘électrophorèse en champs pulsé de l'ADN chromosomique digéré (Puled Field Gel Electrophoresis) ………... 41
3.2.3.2- Random Amplified Polymorphic DNA (RAPD) ………...… 41
3.2.3.3- Amplified Fragment Length Polymorphism (AFLP) ……… 41
3.2.3.4- repetitive extragenic palindromic- Polymerase Chain Reaction (rep-PCR) ……… 42
Partie II : Matériel et méthodes ...……… 43
I- Protcole général de l’étude des différents produits laitiers marocains (lait cru, « Jben » et « Lben ») ……… 44
1- Échantillonnage et isolement des bactéries lactiques ……….…. 44
1.1- Echantillonnage ……… 44
1.1.1- Lait cru ………. 44
1.1.2- Lait fermenté écrémé marocain « Lben » ………. 44
1.1.3- Fromage frais traditionnel marocain « Jben » ……….. 44
1.2- Analyse des échantillons et isolement des bactéries lactiques …………. 44
1.2.1- Analyse des échantillons ………..……. 44
1.2.2- Isolement des bactéries lactiques ……….……. 44
2- Analyse préliminaire des isolats ………. 45
2.1- Coloration de Gram ………... 45
2.2- Test de la catalase ………... 45
2.3- Test d’oxydase ……… 45
II- Identification des isolats de bactéries lactiques ………...… 46
1- Identification biochimique et phénotypique ………. 46
1.2- Identification moléculaire par les protéines totales de la cellule (SDS-PAGE)
……… 47
1.2-.1- Préparation des protéines totales ………. 47
1.2.2- Assemblage de la cassette (plaques de verre et le support) et préparation des gels de concentration et de séparation ……….. 47
1.2.3- L‘électrophorèse ……… 48
1.2.4- Décoloration ………..… 49
2- Etude genotypique ………..…. 49
2.1- La réaction (GTG)5-PCR ……….. 49
2.1.1- Extraction de l‘ADN ……… 49
a- Préparation des cellules ……….. 50
b- Rinçage ……… 50
c- Lyse des cellules ……….. 50
d- Purification de l‘ADN ………. 50
e- Précipitation de l‘ADN ……… 50
f- Rinçage et séchage de l‘ADN ……….. 51
g- Resuspension de l‘ADN ………..……… 51
h- Vérification de la qualité de l‘ADN ………..……….. 51
2.1.2- La réaction (GTG)5-PCR ………..……….…… 51
2.1.2.1- Réaction et programme d‘amplification ……….…… 51
2.1.3- Electrophorèse des produits de la réaction PCR ……….……….. 52
2.1.4- Le logiciel Gel Compar II ……….… 53
2.1.5- Traitement des gels ………...… 53
2.1.6- Les souches de références utilisées dans (GTG)5-PCR ………. 53
2.2- Séquençage du gène Phenylalanyl-tRNA synthase (pheS) ………. 54
2.2.1- Extraction de l‘ADN ……….… 54
2.2.2- Amorces et réaction PCR ……….. 54
Partie III : Résultats et discussion ………...……… 56
I- Etude du lait cru d’origine marocaine ……….. 57
1- Composition physico-chimique des échantillons ……….. 57
2- Dénombrement, isolement et identification des bactéries lactiques ……… 57
3- Bactéries lactiques dans le lait cru ……….. 69
1- Dénombrement, isolement et identification des bactéries lactiques ……… 74
2- Bactéries lactiques dans le « Jben » marocain ……….. 74
III- Etude du Lben d’origine marocaine ……… 79
1- Composition physico-chimique des échantillons ……… 79
2- Dénombrement, isolement et identification des bactéries lactiques ………. 79
3- Bactéries lactiques dans le « Lben » ……… 82
Partie IV : Conclusions et perspectives ……….….. 83
Conclusions ……… 84 Perspectives ……… 85
Références bibliographiques ………...………. 86
Annexes ………..………. 105
Annexe 1 ………...……… 106 Annexe 2 ………...……… 107 Annexe 3 ………...……… 108 Annexe 4 ………...……… 110 Annexe 5 ………...……… 112 Annexe 6 ………...……… 113Depuis l‘antiquité, les bactéries lactiques ont été utilisées pour la fabrication et la conservation d‘aliments. La découverte de leur action sur le lait fut probablement accidentelle mais leur utilisation fut perpétuée sous forme de levains naturels (Chammas et al., 2006 ; Zamfir et al.,2006).
La microflore microbienne du lait cru, composée essentiellement de bactéries lactiques, participe de façon importante à l‘élaboration des caractéristiques organoleptiques des produits laitiers fermentés (lait fermenté, fromage). De nombreuses études scientifiques montrent que les produits laitiers préparés traditionnellement à partir du lait cru ont des saveurs typiques et des qualités nutritionnelles de plus en plus recherchées par le consommateur (Chammas et al., 2006 ; Patrignani et al., 2006).
Au Maroc, peu d‘auteurs ont cherché à caractériser la flore microbienne du lait cru et ses dérivés. Les seuls travaux qui ont été effectués dans ce sens et qui apportent des informations plus ou moins globales concernent des études faites par Boubekri et al., 1984 ; Tantaoui-Elaraki et El Marrakchi 1987,, Hamama 1997, Benkerroum et Tamime 2004 et Srairi et al., 2005. Dans leurs travaux, ces auteurs ont utilisé uniquement des méthodes physiologiques et biochimiques pour l‘identification des souches de bactéries lactiques isolées à partir des produits laitiers. Ces méthodes, bien qu‘elles donnent une idée sur la flore microbienne du lait cru et ses dérivés mais elles ne permettent pas une identification fiable des isolats. En plus, toute l‘information sur les produits laitiers date des années 90 et les résultats obtenus, bien qu‘ils soient publiés, néanmoins, ils n‘ont jamais été exploités.
Plusieurs études ont montré que la systématique ne se limite pas aux méthodes biochimiques et phénotypiques. Dans ce travail, nous nous proposons d‘étudier la flore microbienne du lait cru et ses deux dérivés (« Jben » et « Lben ») et l‘identifier en utilisant des méthodes phénotypiques et génotypiques. Pour ce faire, nous allons utiliser les techniques suivantes : API 50CHL, SDS-PAGE, (GTG)5-PCR et séquençage du géne (PheS).
L‘objectif global de ce travail est :
- l‘identification de la flore microbienne du lait cru et ses dérivés Les objectifs spécifiques sont :
- connaître la biodiversité des bactéries lactiques des différents produits laitiers marocains,
- étudier la variabilité de la composition microbiologique des différents produits traditionnels marocains selon les régions, les fermes, et le procédé de fabrication , - déterminer, avec précision, les espèces bactériennes qui sont le plus fréquemment rencontrées dans les produits laitiers traditionnels,
- déposer les souches isolées et identifiées dans les Collections Coordonnées Marocaines de Microorganismes pour préserver la biodiversité marocaine en vue de son utilisation par les générations futures ou dans des applications biotechnologiques.
Partie I
I-
Le lait et ses dérivés:
1- Le lait cru :
Le lait est un aliment nutritif pour les êtres humains, il constitue un milieu propice pour la croissance de nombreux micro-organismes, en particulier les bactéries pathogènes (Chye et al., 2004). C‘est un aliment de base pour l'homme. Indispensable pour le nouveau-né, il s'avère très bénéfique pour l'adulte.
Traditionnellement, le lait de vache a été considéré comme un aliment de base dans de nombreux régimes alimentaires. C‘est une boisson saine puisque sa consommation est associée à une alimentation de qualité. Il fournit une matrice facilement accessible, riche en une grande variété de nutriments essentiels : des minéraux, des vitamines et des protéines faciles à digérer. Il est par conséquent essentiel à l'ensemble des fonctions du corps (Steijns, 2008). Avec les céréales, les viandes, les légumes et les fruits, les produits laitiers sont considérés comme des aliments riche en nutriments, ils fournissent de nombreux éléments nutritifs à teneur relativement faible en énergie et indispensables à la santé tout au long du cycle de vie (Drewnowski, 2005 ; Miller, Jarvis et McBean, 2007). La consommation des produits laitiers est également associée à des effets bénéfiques sur la santé en plus de leurs valeurs nutritionnelles (Takahiro et al., 2007)
Le lait et les produits laitiers ont également servi de vecteurs d‘ingrédients alimentaires fonctionnels (phytostérols, les acides gras et différentes sortes de bactéries probiotiques) et de source riche pour le développement d'une grande variété d‘ingrédients novateurs de promotion de la santé qui trouvent leur voie sur le marché (suppléments diététiques) (Schaafsma et Steijns, 2000 ; Steijns and van Hooydonk, 2000 ; Steijns, 2001a, 2003; Michaelidou et Steijns, 2006 ; Steijns, 2008). Enfin, les protéines laitières sont préférentiellement introduites dans des formules de nutrition spéciales comme la (re) construction des tissus et la masse musculaire chez les nourrissons, les personnes hospitalisées, les athlètes, et les personnes âgées (Steijns, 2001b). Aujourd'hui, les recommandations diététiques reconnaissent la contribution des produits laitiers à une alimentation saine, et pourtant il est souvent recommandé d‘utiliser préférentiellement la gamme des produits pauvres en matière grasse (produit écrémé) à cause de la quantité relativement forte d‘acides gras saturés contenus dans le lait et leur impact « supposé » sur le
risque de développer des maladies cardiovasculaires (Programme mixte FAO / OMS d'experts Consultation, 2003).
Au Maroc, la production laitière jouit d‘un statut très particulier dans les plans de développement du secteur agricol car en plus de la création de revenus et d‘opportunités de travail, elle contribue aussi à l‘approvisionnement d‘une population en plein essor démographique et dont les habitudes alimentaires évoluent vers davantage de produits de qualité, en protéines alimentaires (Srairi et al., 2005).
2- Les laits fermentés :
Divers types de produits laitiers fermentés existent à travers le monde (Tamime, 1997 ; Stanely, 1998). Leur nature dépend du type de lait utilisé, le prétraitement, les conditions de fermentation et le traitement ultérieur. La fermentation du lait implique principalement les bactéries lactiques (LAB), mais les Micrococcus, les corynéformes, les levures et les moisissures peuvent également jouer un rôle (Zamfir et al., 2006). Historiquement, les produits laitiers fermentés ont été produits pour prolonger la durée de conservation du lait. Ces aliments traditionnels ont persisté au cours des siècles et ils ont souvent évolué d‘un niveau artisanal et traditionnel à la fabrication à grande échelle industrielle avec production utilisant des cultures spécifiques (starter) et équipements modernes (Cogan, 1996 ; Oberman, 1998). L'utilisation de starters a amélioré la qualité technologique des produits laitiers, mais en même temps, a limité leur biodiversité ainsi que les caractéristiques organoleptiques et la variabilité du produit fini (Wouters, 2002 ; Leroy, 2004,). Par conséquent, il existe une demande croissante en nouvelles souches pouvant avoir des caractéristiques recherchées au niveau du produit fini. Les produits laitiers traditionnels sont une source indéniable d'un tel genre de organismes (Leroy, 2004). En effet, la fermentation du lait par des micro-organismes particuliers induit des changements dans le goût, la texture, la couleur, la saveur, et les propriétés nutritives du lait. Elle fournit toute une gamme de produits finis (Duboc et al., 2001). C‘est un moyen peu coûteux et une technologie qui préserve les aliments, améliore leurs valeurs nutritives et améliore leurs propriétés sensorielles (Marty et Kummar, 1995 ; Steinkrauss, 1996). Elle peut également conduire à la désintoxication, la destruction d'éléments indésirables présents dans les aliments crus comme le cyanure, les tanins et les polyphénols (Blandino et al., 2003) et aussi à la dégradation du lactose (Fox et Thomson, 2007 ; Schaasfsma, 2008).
De plus, les laits fermentés ont un effet bénéfique sur la santé humaine (Oberman, 1998 ; Von Wright, 1998). Ils sont en effet utilisés comme ferments lactiques pour remédier aux troubles gastro-intestinaux (Rastall et al., 2005).
Les produits laitiers fermentés traditionnellement ont une part très importante dans l'alimentation quotidienne des gens de différents pays. En effet, ils ont fait l‘objet de plusieurs études : au Maroc (Ouadghiri et al., 2009), en Roumanie (Zamfir et al., 2006), au Liban (Chammas et al., 2006), en Egypt (El-Baradei et al., 2008), au Burkina Faso (Aly Savadogo et al., 2004), au Kenya (Mathara et al., 2004), en Afrique du sud (Beukes et al., 2001) etc. Généralement, les gens qui vivent à la campagne possèdent leurs propres vaches, ils utilisent le lait pour produire la crème et le fromage pour leurs propres besoins. Les agriculteurs qui ont plus d‘animaux vendent le lait à de petites usines situées dans un village voisin, ou vendent le lait et les produits fermentés sur le marché local (Zamfir et al., 2006 ; Ouadghiri et al., 2009). Dans la plupart des cas, le lait non pasteurisé est utilisé et le processus de fermentation se base sur la flore microbienne naturelle du lait et de l'environnement (levains naturels). Le processus appelé « Backslopping » consiste à prélever une partie d'un lait traditionnellement fermenté ou de crème aigre à partir d'un lot précédant et l‘utiliser comme inoculum pour la nouvelle fournée. Ce processus est parfois pratiqué pour accélérer la fermentation. Les produits fabriqués par ce processus peuvent avoir une teneur microbienne très constante dans le temps. (Zamfir et al., 2006 ; El Baradei et al., 2008 ; Nzigamasabo et al., 2009 ; Ouadghiri et al., 2009). Cependant, les conditions environnementales telles que la température, l‘origine du lait, les conditions de transformation et les conditions sanitaires, etc, peuvent avoir une influence significative sur la composition microbienne des produits laitiers fabriqués traditionnellement.
Au Maroc, la fermentation du lait donne le «Lben ». Sa préparation, très simple, est demeurée au stade familial ou artisanal (Benkerroum et Tamime 2004): le lait est abandonné à lui-même jusqu'à sa coagulation. Celle-ci se fait à température ambiante et dure 24 à 48 h suivant la saison. Le barattage qui lui succède dure 30 à 40 min. A la fin du barattage, on ajoute généralement un certain volume d'eau (environ 10 % du volume du lait), chaude ou froide, suivant la température ambiante, de façon à ramener la température de l'ensemble à un niveau convenable au rassemblement des grains de beurre ; produit de grande valeur marchande (A. Tantaoui-Elaraki et al., 1983).
3- Le fromage frais :
Plusieurs variétés de fromage à partir du lait de vache, de chèvre et de brebis sont fabriquées, à travers le monde, dans des fermes suivant des techniques traditionnelles, sans addition intentionnelle de levains, et sont généralement conçues comme des " fromages artisanaux". Les paramètres technologiques ont une grande influence sur les caractéristiques finales du fromage et jouent un rôle important dans la composition microbienne qui est considérée à la fois par les fabricants et les consommateurs comme une caractéristique spéciale des fromages artisanaux (Randazzo et al., 2009).
Le « Jben » est le fromage frais le plus connu et consommé au Maroc depuis fort longtemps aussi bien en milieu rural qu'en milieu urbain. Dernièrement, la consommation de ce produit s'est accrue suite à l'installation dans les villes d'un grand nombre de laiteries traditionnelles qui préparent le « Jben » à partir du lait cru selon des procédures souvent artisanales. A côté de ce secteur traditionnel, certaines unités laitières semi-industrielles se sont aussi intéressées à la fabrication du « Jben », utilisant du lait soit cru, soit pasteurisé, et des procédures de préparation plus ou moins améliorées. De ce fait, il existe aujourd'hui de nombreuses méthodes de préparation du « Jben », et par conséquent, plusieurs variétés de fromage frais sont commercialisées au Maroc sous la dénomination populaire commune de "Jben" (Benkerroum et Tamime 2004).
D‘une manière générale, le fromage frais commercialisé est fabriqué soit à partir du lait de vache ou du lait de chèvre. Le processus de fabrication nécessite trois grandes étapes essentielles (voir figure 1): la maturation, la coagulation et l‘égouttage (Randazo et al., 2002) :
la maturation : c‘est l‘incubation du lait cru à température ambiante pendant un temps variable de façon à favoriser la multiplication d‘une flore lactique qui va jouer un rôle important dans l‘acidification du lait. Cette maturation peut être spontanée ou provoquée par adjonction de levains. Le recours à des levains artificiels du commerce n‘est cependant pas toujours une nécessité absolue, car le fermier producteur de lait a lui-même la possibilité de cultiver un levain naturel à partir de la flore contenue dans son propre lait.
La coagulation : c‘est une opération qui vise à coaguler le lait au moyen de la présure (emprésurage) ou de toute autre enzyme coagulante. L‘activité coagulante est déterminée par la force de présure, la température du lait et son acidité. Après l‘emprésurage, le lait est abandonné au repos à température ambiante pendant 6 à 10 heures. Il va prendre en masse (caillage) avec une consistance plus ou moins ferme selon le degré d‘acidité développé.
En réalité, le coagulum est obtenu par deux modes de coagulation : la coagulation dite lactique et celle engendrée par l‘action de la présure. Ces deux modes ont une action simultanée sur le lait avec cependant une prédominance plus ou moins marquée de l‘un ou l‘autre selon que le fromager souhaite obtenir une pâte à caractère plus présure ou à caractère plus lactique.
L‘égouttage : un des buts essentiels de cette opération est de régler la teneur en eau du fromage. Il permet l‘élimination de la plus grande partie du sérum qui imprègne le coagulum. L‘égouttage est amorcé dans des moules qui confèrent au fromage sa forme. La nature du gel influe sur la conduite de l‘égouttage. Un gel lactique subit un égouttage spontané et le caillé a par conséquent une forte humidité. Cependant, un gel présure est un gel compact, solide ou l‘égouttage ne peut avoir lieu qu‘après certaines interventions telles des actions mécaniques de pression.
Suivant le goût du fromager, le salage peut être fait. C‘est une opération importante dans la fabrication des fromages. Elle a des effets multiples : elle améliore l‘égouttage en le complétant, elle oriente et sélectionne le développement microbien et relève la saveur de la pâte (Kbibou, 1987; Benkerroum et Tamime 2004).
∙ Fermentation spontanée Maturation (T° ambiante 24-72h)
∙ Barattage
Fig.1. Schéma de fabrication des produits laitiers traditionnels marocains (Benkerroum et Tamime 2004) Lait cru Lait caillé Beurre (zebda beldia) « Lben » Coagulation Égouttage Maturation (Optionnel) « Jben »
II- Consommation des produits laitiers au Maroc :
Malgré l‘augmentation de la production laitière durant ces dernières années (triplement de la production entre 1969 et 2004), le niveau de consommation en lait et dérivés demeure faible (38 litres/an) comparativement aux pays du Maghreb ; l‘Algérie et la Tunisie ou la consommation respective en lait est de 95 et 68 litres/an. Cette faible consommation peut s‘expliquer par des habitudes alimentaires où le lait n‘est pas souvent utilisé dans les préparations culinaires, et surtout par la faiblesse du pouvoir d‘achat. De plus, le lait n‘est pas accessible pour de nombreux ménages surtout en milieu rural (Haut Commissariat au Plan, 2004).
III- Composition physico-chimique du lait cru et ses dérivés:
1- Lait cru :
Le lait est un liquide blanc mat, légèrement visqueux, dont la composition et les caractéristiques physico-chimiques varient sensiblement selon les espèces animales, et même selon les races (Rahali et Ménard, 1991 ; Soryal et al., 2004). Ces caractéristiques varient également au cours de la période de lactation, de la traite ou de l'allaitement. Elles sont aussi tibutaires de la nature de l‘alimentation des animaux (Sutton, 1989 ; Coulon et al., 1995).
Schématiquement, on peut considérer le lait comme une émulsion de matière grasse dans une solution aqueuse, comprenant de nombreux éléments, dont les uns sont à l‘état dissous et les autres sous la forme colloïdale. D‘aprèsDoyle et al., 2001, Le lait renferme une grande quantité d‘eau 87%, le lactose (4.8 %), les lipides (3.7%), la caséine (2.6%), l‘azote non protéique (urée, créatinine), les protéines du petit lait (0.6%) et les sels minéraux :
cations: sodium (58mg/100g), potassium (140mg/100g), calcium (118mg/100g) et magnésium (12mg/100g) ;
anions : citrate (176mg/100g), chlorure (104 mg/100g) et phosphore (74 mg/100g) Il existe en effet de fortes variations de composition entre les laits provenant de différentes exploitations. Ces variations sont dues essentiellement à l‘état de l‘animal : hérédité, âge, état de santé, équilibre neurovégétatif, régime alimentaire, période de lactation, qualité du trayeur, vitesse de la traite et au conditionnement au moment de la traite (Ercolini et al., 2009).
Concernant la composition physico-chimique, le lait est à la fois une émulsion, une solution et une suspension. Les sels minéraux (à l‘état d‘ions ou de sels non dissociés) et le lactose sont en solution. La matière grasse est en émulsion, les matières azotées (caséines) étant en suspension (Bennacir, 1985).
Le pH du lait est légèrement acide (compris entre 6,4 et 6,8 pour le lait de vache). L'acidité du lait augmente avec le temps. En effet, sous l‘action des micro-organismes du lait, le lactose va être dégradé en acide lactique, ce qui permettra d'avoir un indicateur du degré de conservation du lait qui est le degré dornic (°D) (Doyle et al., 2001).
2- Lait fermenté écrémé « Lben »:
La composition chimique du « Iben » est variable, elle dépend des localités, des régions, des fermes, de la composition chimique du lait cru de départ et de la procédure de fabrication (El Baradei et al., 2008). Néanmoins, certains indicateurs donnent une idée sur la qualité globale du produit et le processus de sa fabrication. La fermentation du lactose augmente l‘acidité titrable dans le « Lben » a plus de 0.60 % d‘acide lactique, par conséquent le pH et le lactose baissent respectivement au dessous de 4.7 et 3.7 g 100g-1. L‘extraction du beurre diminue le contenu en lipides à environ 1.8 g.100 g−1 (Benkerroum et al., 1984). Généralement, Les valeurs moyennes pour les principaux constituants sont les suivantes: pH : 4.2; acidité titrable : 8.2 g en acide lactique; graisses: 8.9 g/l; protéines totales: 25.6 g/l; lactose: 26.9 g/l et matière sèche totale: 89 g /l (A. Tantaoui-Elaraki et al., 1987)
La fermentation du citrate dans le lait génère des composés carbonés volatiles (acétaldéhyde, acétoine et diacétyl). On reporte aussi la présence d‘éthanol dans le « Lben », c‘est un élément qui confère un arôme typique au produit, pourtant, sa concentration est trop faible pour donner un goût alcoolique au produit.
3- Fromage frais « Jben » :
Comme mentionné ci-dessus pour le lait fermenté « Lben », le fromage frais « Jben » ne présente pas de caractéristiques définies à cause des méthodes artisanales utilisées pour sa préparation reposant, essentiellement, sur les connaissances acquises à partir d'une longue expérience (Salmeron et al., 2002). Les arômes, les propriétés organoleptiques et les caractéristiques physico-chimiques du fromage dépendent de celles du lait cru qui à son tour dépend de la race des animaux et leur type d‘alimentation (Poznanski et al., 2004).
Généralement, Le pH (<4,2) et l'acidité titrable (> 0,9%) sont les paramètres les moins variables du « Jben ». Cependant, les matières solides totales du « Jben » sont le facteur le plus variable car ce dernier dépend de la durée d'égouttage. Étant donné que les lipides, le lactose et les protéines constituent les principaux composants de l'ensemble des matières solides en « Jben », ils sont directement influencés par les variations des dites matières solides (Benkerroum et Tamime 2004).
IV- Microbiologie du lait cru et ses dérivés:
1- Lait cru :
La Connaissance de la composition microbienne du lait est d'un intérêt particulier pour les agriculteurs et les transformateurs du lait. Le prix du lait est calculé en fonction du nombre total de bactéries qui doit être aussi faible que possible (Verdier-Metz et al., 2009). Le lait dans les cellules du pis est stérile (Tolle, 1980), mais la glande mammaire, la peau du pis (Brisabois et al., 1997), le matériel de traite, la litière, la qualité de l'air et les pratiques des éleveurs (Sevi et al., 1998, 2003 ; Ménard et al., 2004) sont des sources de contamination. La colonisation du lait par des microorganismes n‘a été que partiellement décrite. Seuls les microorganismes pathogènes ont été souvent considérés (Wareing, 2005).
Les genres : Lactococcus, Lactobacillus, Streptococcus, Staphylococcus et
Micrococcus spp. constituent la flore bactérienne du lait (Chye et al., 2004). Cette flore peut
être prédominée par les psychrotrophes si le lait est conservé au frais avant son utilisation ultérieure (Bishop et White, 1986 ; Sorhaug et Stepaniak, 1997). La détection des bactéries coliformes et des pathogènes dans le lait témoigne d'une contamination fécale possible (Olson et Mocquot, 1980; Bonfoh et al., 2003). Généralement, un lait cru provenant d'une vache en bonne santé contient une faible charge microbienne (moins de 1000 ml-1), mais cette charge peut augmenter jusqu'à 100 fois ou plus quand le lait est abandonné à température ambiante (Richter et al., 1992).
Toutefois, le maintien du lait dans des contenants propres et sa conservation au réfrigérateur immédiatement après la traite peuvent retarder l'augmentation de la charge microbienne initiale et éviter la multiplication des micro-organismes dans le lait entre la traite à la ferme et le transport vers l‘usine de transformation (Adesiyun, 1994 ; Bonfoh et al., 2003).
2- Lait fermenté écrémé:
Les premières études sur la composition microbiologique des laits fermentés datent de la fin du 19éme siécle (Obermann et al., 1998). A l'heure actuelle, des espèces de bactéries lactiques des genres Lactobacillus, Lactococcus, Leuconostoc, Pediococcus, Streptococcus et
Bifidobacterium ont été identifiées dans les laits fermentés. Des souches de Lactococcus, Lactobacillus, Streptococcus, et Bifidobacterium sont principalement utilisées dans les
cultures commerciales d'amorçage (Mogensen et al., 1993). Très peu d'information est disponible sur la flore microbienne impliquée dans la fabrication traditionnelle du lait fermenté (Cogan et al., 1997 ; Bizzaro et al., 2000 ; Randazo et al., 2002 ; Caridi et al., 2003 ; Fortina et al., 2003.).
Au Maroc, une étude de la flore microbienne impliquée dans la fermentation du lait pour produire le « Lben » a montré que les bactéries lactiques mésophiles sont responsables de la fermentation lactique et du développement de l‘arôme dans le « Lben », elles peuvent atteindre 108 cfu.ml−1 .
Les espèces Lactococcus et Leuconostoc sont prédominantes dans le « Lben », les
Lactobacillus spp. sont présents à de faibles nombres. Les espèces dominantes sont Lactococcus lactis subsp. lactis et subsp. lactis biovar diacetylactis, et Leuconostoc mesenteroides subsp. cremoris et subsp. lactis. (Elaraki et al (1983a) et
Tantaoui-Elaraki et al (1983b)
3- Fromage frais :
La composition microbiologique du fromage dépend de celle du lait de départ, du processus de fabrication qu‘il a subi et de l‘âge du fromage (Ercolini et al. , 2009). Généralement, elle est dominée par les bactéries lactiques en l‘occurence les Lactococcus et les Enterococcus qui influencent les caractéristiques sensorielles du produit fini (Randazzo et al . , 2009).
La microflore du « Jben » marocain est dominée par les bactéries lactiques (108-109 ufc.g-1) qui sont principalement représentées par L. lactis subsp. lactis, Leuc. mesenteroides subsp. lactis et Lact. casei subsp. casei (Hamama, 1997). En plus des bactéries lactiques dans le « Jben », d'autres micro-organismes peuvent être présents en assez grand nombre. Les dénombrements des levures et moisissures peuvent dépasser 106 ufc.g-1. Bien que les levures dans le « Jben » ne soulèvent pas d'inquiétude pour la sécurité du produit, leur nombre élevé
dans le produit est associé avec les principaux défauts du produit, tels que l'aspect visqueux, la décoloration et la forte odeur d'alcool. Néanmoins, à des niveaux modérés, les levures peuvent contribuer à la saveur du produit. Les coliformes et les entérocoques ont été également signalés à des nombres dépassant 105 ufc.g-1 (Benkerroum et Tamime 2004).
V- Découverte et application industrielle des bactéries lactiques:
1- Découverte des bactéries lactiques :
Bien avant que l‘on soit conscient de l‘existence des bactéries lactiques, elles n‘ont été utilisées que récemment dans la conservation des aliments à base de lait, de viande, de poissons, de légumes et de fruits (Paul Ross et al., 2002). C‘est à l‘époque des grandes découvertes de la microbiologie, à la fin du 19 éme siècle, que des chercheurs se sont penchés sur la fermentation du lait pour trouver la cause de sa coagulation acide. Storch (1890), Conn (1889) et Weigmann (1896) ont conclu que la présence de bactéries lactiques est responsable de l‘acidification du lait et de la maturation de la crème (De Roissart et Luquet, 1994).
2-
Application industrielle des bactéries lactiques :Les bactéries lactiques furent et sont encore utilisées sous la forme de levains artisanaux, mais le développement de l‘industrie de transformation, en particulier de l‘industrie laitière, a conduit à la production de ferments industriels capable d‘assurer à la fois la qualité et la constance du produit (Leveau et Bouix, 1993 ;Pfeiler et Klaenhammer 2007).
Les bactéries lactiques produites comme ferments commerciaux sont des cultures pures ou un mélange appartenant aux genres : Lactococcus, Streptococcus, Lactobacillus,
Leuconostoc, Pediococcus et Bifidobacterium. (Leveau et Bouix, 1993)
On doit d‘emblée souligner la dualité qui existe entre les ferments lactiques naturels et les ferments lactiques sélectionnés (De Roissart et Luquet, 1994; Wouters et al., 2002).
2.1- Les ferments lactiques naturels : proviennent du lait n‘ayant subi aucun
traitement thermique et sont de composition complexe et variable selon le terroir d‘ou ils proviennent.
2.2- Les ferments lactiques sélectionnés : sont composés d‘une souche pure ou d‘un
ensemble de souches pures. On entend par souche pure, suivant la définition classique, une population formée à partir d‘une colonie isolée, développée sur boite de pétri sur un milieu de culture gélosé, c‘est à dire une culture provenant en principe d‘une seule cellule bactérienne.
Normalement, les bactéries constituant ces ferments sont des espèces déterminées et leur activité globale caractérise le ferment : l‘acidification, la protéolyse, la formation d‘arômes. Actuellement, les souches commercialisées ont été isolées du lait ou des produits laitiers et en particulier des levains artisanaux (Wouters et al., 2002).
Les qualités exigées des ferments lactiques sont multiples. Ces derniers doivent être capables de transformer l‘aliment en un nouveau produit possédant des propriétés définies et constantes et permettre une bonne conservation de l‘aliment en le protégeant en particulier contre la détérioration par d‘autres micro-organismes par le biais de l‘acidification et / ou la production d‘antibiotiques et de bactériocines (Wouters et al., 2002 ; Patrignani et al., 2006).
De nos jours, les bactéries lactiques sont, de plus en plus, recherchées pour d‘autres qualités :
- nutritionnelles et thérapeutiques dans des préparations appelées probiotiques. (Leveau et Bouix, 1993; Patrignani et al., 2006 ; Steijns et al., 2008),
-
de production de bactériocines : substances actives inhibant la croissance d‘autres microorganismes qui sont généralement pathogènes (Cleveland et al., 2001 ; Paul Ross et al., 2002 ; Touré et al., 2003)VI- Caractéristiques, classification et identification des bactéries lactiques :
1- Caractéristiques principales des bactéries lactiques :
Les bactéries lactiques sont des cellules vivantes, procaryotes, hétérotrophes et chimio-organotrophes. A quelques exceptions près, les bactéries lactiques sont généralement Gram positives, immobiles, asporulées, anaérobies mais aérotolérantes, et ne possédant pas de catalase (certaines souches possèdent une pseudocatalase), de nitrate réductase, et de cytochrome oxydase. Elles ont des exigences nutritionnelles nombreuses (acides aminés, peptides, sels, acides gras et glucides) (Holzapfel et al., 2001 ; Gevers 2002)
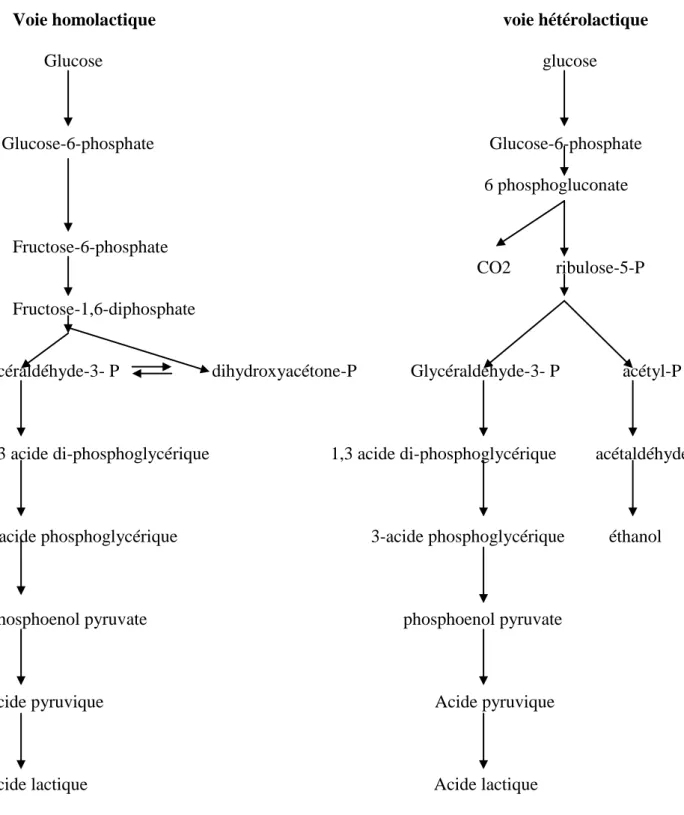
Toutes les bactéries lactiques ont un métabolisme fermentaire strictement saccharolytique qui, en utilisant les glucides, elles peuvent produire soit de :
- l‘acide lactique exclusivement (bactéries homolactiques strictes),
- l‘acide lactique et de l‘acide acétique (bactéries hétérolactiques facultatives), - l‘acide lactique, de l‘acide acétique ou de l‘éthanol et de CO2 (bactéries
hétérolactiques strictes) (Vandamme et al., 1996).
Certaines espèces ou certaines souches peuvent en outre produire de l‘acide formique ou de l‘acide succinique (Voir figure 2) (De Roissart et Luquet, 1994).
Voie homolactique voie hétérolactique Glucose glucose Glucose-6-phosphate Glucose-6-phosphate 6 phosphogluconate Fructose-6-phosphate CO2 ribulose-5-P Fructose-1,6-diphosphate
Glycéraldéhyde-3- P dihydroxyacétone-P Glycéraldéhyde-3- P acétyl-P
2 1,3 acide di-phosphoglycérique 1,3 acide di-phosphoglycérique acétaldéhyde
2 3-acide phosphoglycérique 3-acide phosphoglycérique éthanol
2 phosphoenol pyruvate phosphoenol pyruvate
2 Acide pyruvique Acide pyruvique
2 Acide lactique Acide lactique
Figure 2 : Dégradation du glucose par les bactéries lactiques (De Roissart et Luquet, 1994).
2- Classification des bactéries lactiques :
Traditionnellement, les bactéries lactiques ont été classées sur la base des propriétés phénotypiques : la morphologie, le mode de fermentation du glucose, la croissance à différentes températures, l‘isomére de l'acide lactique produit et la fermentation des différents hydrates de carbone (De Roissart et Luquet, 1994; Holzapfel et al., 2001). Cependant, les études basées sur la comparaison des séquences de l'ARN ribosomal 16S ont montré que certains taxons générés sur la base de la caractérisation phénotypique ne concordent pas avec les relations phylogénétiques suggérées. Ainsi, certaines espèces ne sont pas faciles à distinguer par des caractéristiques phénotypiques (Gevers, 2002). Par conséquent, Les méthodes de typage moléculaire telles que l'électrophorèse en champ pulsé (PFGE), la réaction de polymérisation en chaine utilisant des éléments répétés (rep-PCR), ainsi que les Restriction Fragment Length Polymorphism (RFLP) sont extrêmement précieux pour la caractérisation et la détection des bactéries lactiques (Holzapfel et al., 2001).
Sur la base des données de séquençage de 16S et 23S de l‘ADNr, les bactéries Gram positives forment deux embranchements (figure 3). Un embranchement composé de bactéries Gram positives avec un pourcentage G + C inférieur à 50% (Clostridium) et un autre formé de bactéries ayant une teneur en G + C supérieure à 50% (Actinomycétes) (Holzapfel et al., 2001 et Gevers, 2002). Les bactéries lactiques typiques ont une teneur en G + C inférieure à 50% alors que le genre Bifidobacterium qui, d'un point de vue physiologique, fait partie des bactéries lactiques, appartient à la branche des Actinomycètes qui comprend aussi
Propionibacterium et Brevibacterium (Vandamme et al., 1996). Il y a peu de corrélation entre
la classification traditionnelle et la parenté phylogénétique des bactéries lactiques. Des genres morphologiquement distincts, Lactobacillus, Leuconostoc et Pediococcus sont phylogénétiquement entremêlés (Schleifer et Ludwig, 1996 ; Gevers, 2002).
Les bactéries lactiques sont définies comme des bactéries qui fermentent le glucose pour produire surtout l‘acide lactique. Cependant cette définition couvre plus de taxa que ceux désignés par bactéries lactiques. C‘est surtout leur importance dans la fermentation des aliments et produits alimentaires (viandes, végétaux, fruits, poissons, produits laitiers et ensilage) qui les délimite (Vandamme et al., 1996). Ainsi le groupe des bactéries lactiques renferme les genres suivants: Carnobacterium, Enterococcus, Lactobacillus, Lactococcus,
Leuconostoc, Oenococcus, Pediococcus, Streptococcus, Tetragenococcus, Vagococcus et Weissella. Le genre Bifidobacterium est considéré comme appartenant aux bactéries lactiques
du fait de son effet probiotique sur l‘organisme et son utilisation dans les aliments (Vandamme et al., 1996 ; Gevers 2002 ; Patrignani et al., 2006).
Figure 3: Arbre phylogénétique des bactéries Gram positives basé sur la comparaison des
séquences de l‘ARNr 16S. La barre indique une divergence de séquence à 10%. (Schleifer et Ludwig, 1995)
3- Identification et typage des bactéries lactiques :
L'approche classique de la taxonomie des bactéries lactiques a été toujours basée sur les caractéristiques morphologiques et physiologiques. Cette identification a été élargie pour inclure des marqueurs chimiotaxonomiques (acides gras cellulaires), analyse des protéines totales de la cellule et autres caractéristiques de la cellule (Holzapfel et al., 2001 ; Temmerman et al., 2004). Une identification fiable est dépendante de l'information génotypique. Les méthodes génotypiques tels que le séquençage de l'ADNr, ribotypage, Random Amplified polymorphic DNA (RAPD), rep-PCR fingerprinting, Amplified Fragment Length Polymorphism (AFLP), électrophorèse en champ pulsé (PFGE) de l'ensemble de l'ADN chromosomique digéré constituent aujourd'hui une partie importante de la taxonomie moderne des bactéries lactiques (Holzapfel et al., 2001 ; Gevers, 2002 ; Temmerman, 2003 ; Temmerman et al., 2004).
Ci-dessous, un aperçu concis des techniques les plus importantes utilisées pour la classification et l'identification des bactéries lactiques.
3.1- Méthodes phénotypiques :
Les méthodes phénotypiques sont toujours utilisées dans les laboratoires de microbiologie alimentaire appliquée. Différents tests clefs ont été largement adoptés et de nos jours, les caractérisations morphologiques ainsi que les méthodes physiologiques, métaboliques, biochimiques et chimiotaxonomiques sont pratiquées. Des tests physiologiques simples, tels que la croissance à différentes températures, la tolérance aux acides et au sel ainsi que la production de gaz sont utiles pour la différenciation des genres (Gevers, 2002 ; Temmerman et al., 2004).
Parmi les méthodes biochimiques utilisées, les microméthodes ont connu un développement important, avec la commercialisation de systèmes d‘identification associant, pour un groupe bactérien donné, une galerie miniaturisée de tests biochimiques, et des documents ou des programmes informatiques permettant d‘interpréter les résultats obtenus (De Roissart et Luquet, 1994). La première galerie biochimique miniaturisée destinée à l‘identification des bactéries lactiques a été la galerie API (Analytic Programme Index) 50 CHL, commercialisée en 1970 pour l‘étude des souches du genre Lactobacillus, puis rapidement étendue à d‘autres genres (Leuconostoc et Lactococcus). Cette technique nécessite une durée d‘incubation plus ou moins longue (12 heures à 48 heures) mais exige l‘emploi
La comparaison des profils des protéines totales de la cellule obtenus par electrophorése sur gel de polyacrylamide (SDS-PAGE), s'est révélée être extrêmement fiable pour l'identification au niveau de l‘espèce voir même de la sous-espèce, à condition d‘avoir une base de données des profils protéiques numérisés et normalisés de toutes les espèces connues de bactéries lactiques (Pot et al., 1994 ; Vandamme et al., 1996). Pour certaines espèces, le pouvoir discriminatoire de cette technique est limité, c‘est le cas du complexe
Lactobacillus acidophilus (Gancheva et al., 1999), et les espèces Lactobacillus plantarum, Lactobacillus pentosus et Lactobacillus paraplantarum (Torriani et al., 2001).
3.2- Méthodes génotypiques :
Les techniques basées sur l‘analyse de l'ADN permettent une meilleure différenciation des micro-organismes à différents niveaux, allant du genre jusqu‘à la souche en fonction des méthodes utilisées. En général, elles ont l'avantage sur les méthodes d'identification phénotypique de ne pas être influencé par les conditions de culture (Gevers, 2002). Le séquençage direct du gène d'ARNr 16S est l'une des méthodes les plus puissantes pour l‘identification en une seule étape d'une souche inconnue. Toutefois, il existe quelques limites (Vandamme et al., 1996; Rossello-Mora et Amann, 2001). A titre d‘exemple certaines espèces qui sont différentes peuvent avoir les même séquences de l'ADNr 16S (Fox et al., 1992) et la fiabilité de certaines séquences hébergées dans la base de données peut être discutable.
Les méthodes de typage des souches deviennent de plus en plus importantes dans l'étude des bactéries lactiques. Les méthodes génotypiques utilisées pour le typage comprennent PFGE de l‘ADN chromosomique digéré, ribotypage, profil plasmidique et les méthodes de typage (empreintes digitales) basées sur PCR telles que les RAPD, AFLP et rep-PCR.
3.2.1- Le ribotypage :
Il associe l‘analyse de l'ADN chromosomique par des enzymes de restriction avec l'utilisation de sondes ADN recombiné ; ce qui permet de différencier entre les différentes espèces (Johansson et al., 1995a; Rodtong et Tannock, 1993; Zhong et al., 1998; bjorkroth et Korkeala, 1996 ; Lyhs et al., 1999). Le pouvoir discriminatoire de la méthode dépend du nombre et du type de sondes d'oligonucléotides et enzymes de restriction utilisées. Le ribotypage a été particulièrement utilisé pour révéler les hétérogénéités entre des souches à faible homologie (Roussel et al., 1993).
3.2.2- Le profil plasmidique :
La variation du nombre et de la taille des plasmides hébergés par des souches de la même espèce, est utile pour typer les bactéries lactiques car la plupart des souches de ce groupe semblent contenir plusieurs plasmides (Hill et Hill, 1986; Ahrne et al., 1989, Tannock et al., 1990 ; Dykes et von Holy, 1994 ; Holzapfel et al., 2001). Cependant, cette méthode de typage est affectée par la capacité des souches à perdre ou à gagner des plasmides.
3.2.3- Méthodes des empreintes digitales (fingerprinting) :
3.2.3.1- L’électrophorèse en champs pulsé de l'ADN chromosomique digéré (Puled Field Gel Electrophoresis) :
Cette technique est souvent considérée comme la meilleure des méthodes de typage moléculaire, car elle a un pouvoir discriminatoire puissant et une plus grande reproductibilité (Tenover et al., 1995). Cependant, cette méthode assez laborieuse nécessite une approche spécifique à chaque espèce (différentes enzymes de restriction et conditions d‘électrophorèse). Elle est donc principalement utilisée pour étudier la diversité intra-spécifique et vérifier l‘origine des souches (clonalité) (McCartney, 2002).
3.2.3.2- Random Amplified Polymorphic DNA (RAPD):
Considérée comme une méthode rapide, sensible et moins coûteuse pour le typage des différentes souches de bactéries lactiques (BenAmor et al., 2007). Elle a été utilisée avec succès pour différencier les bactéries lactiques au niveau intra-spécifique (Johansson et al., 1995b ; Berthier et Ehrlich, 1999), au niveau inter-spécifique pour les entérocoques (Descheemaeker et al., 1997), pediocoques (Nigatu et al., 1998), et les lactobacilles (Du Plessis et Dicks, 1995; Gancheva et al., 1999; Khaled Daud et al., 1997 ; Nigatu et al., 2001), et au niveau inter-genre (Cocconcelli et al., 1995 ; Moschetti et al., 2001 ; Yost et Nattress, 2002). Cependant, des amorces avec un fort pouvoir discriminatoire et une large applicabilité dans un grand groupe d'espèces de bactéries lactiques n'ont pas été décrites. La RAPD n'est pas approprié pour la construction d‘une base de données pour l'identification.
3.2.3.3- Amplified Fragment Length Polymorphism (AFLP) :
Cette technique a été signalée comme l'un des outils les plus reproductibles permettant de discriminer les souches au niveau de l'espèce et intra-spécifique (Janssen et al.,1996) et son utilisation est en augmentation (Torriani et al., 2001; Gancheva et al., 1999; Bruinsma et al., 2002; Borgen et al., 2002 ; Vancanneyt et al., 2002).