HAL Id: dumas-01438380
https://dumas.ccsd.cnrs.fr/dumas-01438380
Submitted on 17 Jan 2017HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Le traitement hormonal de substitution de la ménopause
en 2008 : point sur les différentes études menées à ce
sujet et analyse de leur impact sur les pratiques de
prescription en Isère ces dernières années
Céline Crozet
To cite this version:
Céline Crozet. Le traitement hormonal de substitution de la ménopause en 2008 : point sur les différentes études menées à ce sujet et analyse de leur impact sur les pratiques de prescription en Isère ces dernières années. Sciences pharmaceutiques. 2008. �dumas-01438380�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur
..
D
1111111,1J~ïmJ[m11111
1
UNIVERSITE JOSEPH FOURIER FACULTE DE PHARMACIE
2008 N°
t
0
/1.9
LE TRAITEMENT HORMONAL DE SUBSTITUTION DE LA MENOPAUSE EN 2008 : POINT SUR LES DIFFERENTES ETUDES MENEES A CE SUJET
ET ANALYSE DE LEUR IMPACT SUR LES PRATIQUES DE PRESCRIPTION EN ISERE CES DERNIERES ANNEES.
THESE
PRESENTEE POUR L'OBTENTION DU TITRE DE DOCTEUR EN PHARMACIE
DIPLÔME D'ETAT
CELINE CROZET
I
THESE SOUTENUE PUBLIQUEMENT A LA FACULTE DE PHARMACIE DE GRENOBLE Le : 02 juillet 2008
DEVANT LE JURY COMPOSE DE
Président du jury : Madame Diane GODIN-RIBUOT Membres :
Monsieur BRUDIEU Etienne Madame EQUY Véronique
r
Mada~e
MOUTET Béatrice /r·
' 4
2008
UNIVERSITE JOSEPH FOURIER FACULTE DE PHARMACIE
No
LE TRAITEMENT HORMONAL DE SUBSTITUTION DE LA MENOPAUSE EN 2008:
POINT SUR LES DIFFERENTES ETUDES MENEES A CE SUJET
ET ANALYSE DE LEUR IMPACT SUR LES PRATIQUES DE PRESCRIPTION EN ISERE CES
DERNIERES ANNEES.
THESE
PRESENTEE POUR L'OBTENTION DU TITRE DE DOCTEUR EN PHARMACIE
DIPLÔME D'ETAT
CELINE CROZET
THESE SOUTENUE PUBLIQUEMENT A LA FACULTE DE PHARMACIE DE GRENOBLE
Le : 02 juillet 2008
DEVANT LE JURY COMPOSE DE
Président du jury : Madame Diane GODIN-RIBUOT Membres:
Monsieur BRUDIEU Etienne Madame EQUY Véronique Madame MOUTET Béatrice
BAKRI BURMEISTER CALOP DANEL DECO UT DROUET FAVIER GODIN-RIBUOT GRILLOT MARIOTTE PEYRIN RIBUOT ROUSSEL WOUESSIDJEWE CHAMPON RIEU
CHU : Centre Hospitalier Universitaire
UNIVERSITE JOSEPH FOURIER
FACULTE DE PHARMACIE DE GRENOBLE
Domaine de la Merci 38700 LA TRONCHE Doyen de la Faculté : Mme le Professeur Renée GRILLOT
Vice -Doyen: Mme Edwige NICOLLE
Année 2007-2008
PROFESSEURS A L'UFR DE PHARMACIE
Aziz Wilhelm Jean Vincent Jean-Luc Emmanuel Alain Diane Renée Anne-Marie Eric Christophe Anne-Marie Denis Bernard Isabelle
Pharmacie Galénique et Industrielle, Formulation et Procédés Pharmaceutiques (GRNR}
Physique (U.V.H.C.I) Pharmacie Clinique (CHU)
SAMU-SMUR et Toxicologie (CHU) Chimie Inorganique (D.P.M.)
· Immunologie I Microbiologie I Biotechnologie (U.V.H.C.I) Biochimie (L.C.I.B I CHU)
Physiologie - Pharmacologie (HP2)
Parasitologie - Mycologie Médicale (Directeur UFR et CHU) Pharmacognosie (D.P.M.)
Chimie Analytique (D.P.M.) Physiologie - Pharmacologie (HP2) Biochimie (L.B.F.A)
Pharmacotechnie et Vectorisation (D.P.M.)
Pharmacie Clinique (CHU) Qualitologie (CHU)
DPM: Département de Pharmacochimie Moléculaire
GRNR : Groupe de Recherche sur les Nouveaux Radio pharmaceutiques HP2 : Hypoxie Physiopathologie Respiratoire et Cardiovasculaire LBF A : Laboratoire de Bioénergétique Fondamentale et Appliquée
LCIB : Laboratoire de Chimie Inorganique et Biologie
UVl:tCI: Unit ofVirus Host Cell Interactions Mise à jour du 11/09/07
ALDEBERT ALLENET BATANDIER BOUMENDJEL BRETON BUDAYOVASPANO CHOISNARD COLLE DELETRAZ-DELPORTE DEMEILLIERS DESIRE DURMORT-MEUNIER ESNAULT FAURE GEZE GERMI GILLY GROSSET HININGER-FA VIER JOYEUX-FAURE KRIVOBOK MOUHAMADOU MORAND MELO DE LIMA NICOLLE PINEL RACHIDI RAVEL RAVELET SEVE SOUARD TARBOURIECH VANHAVERBEKE VILLET
UNIVERSITE JOSEPH FOURIER FACULTE DE PHARMACIE DE GRENOBLE
Domaine de la Merci 38700 LA TRONCHE Doyen de la Faculté : Mme le Professeur Renée GRILLOT
Vice -Doyen : Mme Edwige NICOLLE
Année 2007-2008 ·Delphine Benoît Cécile Ah cène Jean Monika Luc Pierre Emmanuel .Martine Christine Jérôme Claire Danielle Patrice Annabelle Raphaële Catherine Catherine Isabelle Marie Serge Bello Jean-Marc Christelle Edwige Claudine Walid Anne Corinne Michel Florence Nicolas Cécile Annick Parasitologie-Mycologie (L.A.P.M)
Pharmacie Clinique (ThEMAS TIMC-IMAG /CHU) Nutrition et Physiologie (L.B.F.A)
Pharmacognosie (D.P.M.)
Biologie Moléculaire/ Biochimie (L.C.I.B) Biophysique Structurale (U.V .H.C.I) Pharmacotechnie et Vectorisation (D.P.M) Anglais
Droit Pharmaceutique Economie Santé Biochimie (N.V.M.C)
Chimie Bio- organique (D.P.M.) Microbiologie (l.B.S.)
Chimie Analytique (D.P.M.) Biochimie (HP2 /CHU)
Pharmacotechnie et Vectorisation (D.P.M.) Microbiologie (I.V .RC.L I CHU)
Chimie Thérapeutique (D.P.M.) Chimie Analytique (D.P.M.) Biochimie (L.B.F.A)
Physiologie-Pharmacologie (HP2)
Botanique (L.C.B.M)
Cryptogamie, Mycologie Générale (L.E.C.A) Chimie Thérâpeutique (D.P.M.)
Biostatistiques (LE.C.A) Chimie Organique (D.P.M.)
Parasitologie - Mycologie Médicale (CID / CHU) Biochimie (L.C.I.B)
Chimie Analytique (D.P.M.) Chimie Analytique (D.P.M.) Biotechnologie (CHU/ CRI IAB) Pharmacognosie (D.P.M) Biophysique (U.V.H.C.1.) Chimie Bio- organique (D.P.M.) Chimie Analytique (D.P.M.)
ENSEIGNANTS ANGLAIS FITE Andrée GOUBIER Laurence POSTESD'ATER
1hATER RECHOUM Yassine Immunologie 1hATER MESSAI Radja Mathématiques %ATER GLADE Nicolas Biophysique
lATER KHALEF Nawale Pharmacie Galénique et Industrielle, Formulation et Précédés Pharmaceutiques
lATER lATER
NZENGUE Yves 'Biologie cellulaire PEUCHMAUR Marine Chimie Organique
PROFESSEUR AGREGE (PRAG) . ROUTABOUL
CHU : Centre Hospitalier Universitaire CIB : Centre d'Jnnovation en Biologie
DPM : Département de Pharmacocbimie Moléculaire
Christel
HP2 : Hypoxie Physiopathologie Respiratoire et Cardiovasculaire
IAB : Institut Albert Bonniot, Centre de Recherche « Oncogenêse et Ontogenêse »
ms : Institut de Biologie Structurale
LAPM : Laboratoire Adaptation et Pathogenèse .des Microorganismes
LBF A : Laboratoire de Bioénergétique Fondamentale et Appliquée
LCBM : Laboratoire Chimie et Biologie des Métaux LCIB : Laboratoire de Chimie Inorganique et Biologie
LECA : Laboratoire d'Ecologie Alpine
NVMC : Nutrition, Vieillissement, Maladies Cardiovasculaires
Chimie Inorganique (D.P.M.)
TIMC-IMAG : Laboratoire Technique de l'Imagerie, de la Modélisation et de Cognition UVHCI: Unit of Virus Host Cell Interactions
REMERCIEMENTS:
Je remercie Mme Godin-Ribuot de s'être impliquée dans cette thèse, ainsi que pour son soutien et son aide tout au long de ce travail. Je la remercie aussi d'avoir accepté le rôle de Présidente de mon jury.
Je remercie Mme Equy pour sa participation à mon jury en tant que praticien hospitalier, prescripteur du THS ainsi que Mr Brudieu pour sa participation en tant que pharmacien hospitalier.
Je remercie également Melle Moutet pour sa participation à mon jury de thèse en tant qu'officinale, ayant un contact étroit avec les patientes traitées par THS.
Je remercie tous les professeurs qui m'ont formée durant ces six années d'études. Je remercie toute ma famille pour leur soutien tout au long de ces années d'études. Merci à Christophe pour m'avoir soutenue et supportée notamment au cours de ces derniers mois.
Merci à toute l'équipe de la pharmacie de Poisat pour leur aide et leur soutien au cours de ces 6 mois de stage.
Table
des matières
LISTE DES PROFESSEURS REMERCIEMENTS
INTRODUCTION
Première partie : INTRODUCTION SUR LA MENOPAUSE
A) Symptômes ayant des conséquences à court et moyen terme 1) Symptômes vasomoteurs ou bouffées de chaleur 2) Troubles de l'humeur
3) Sécheresses vaginales 4) Symptômes urinaires 5) Asthénie
6) Prise de poids
7) Sécheresse de la peau et des muqueuses B) Symptômes ayant des conséquences à long tenne
1) L'ostéoporose
2) Athérosclérose coronarienne
Deuxième partie : LE TRAITEMENT HORMONAL DE LA MENOPAUSE
A) Les estrogènes
1) Les différentes molécules a. Les estrogènes naturels
b. Les estrogènes équins conjugués c. Les estrogènes de synthèse 2) Les différentes voies d'administration
a. La voie orale
b. La voie cutanée (patch ou gel) c. La voie nasale
d. Conclusion sur les voies non orales 3) Les rôles des estrogènes
a. Action sur les symptômes de la ménopause ayant des incidences à court terme
page 1 page 4 page 18 page 19 page 19 page 19 page 20 page 20 page 20 page 20 page 20 page 21 page 22 page 22 page 23 page 25 page 25 page 25 page 25 page 25 page 26 page 26 page 26 page 27 page 28 page 28 page 29 page 29
b. Action sur les symptômes de la ménopause ayant des incidences à long terme
1. Effets sur le sein 11. Effets sur l'endomètre
m. Effets sur l'os
1v. Effets sur le métabolisme lipidique B) Les progestatifs
1) Les différentes molécules 2) Pharmacologie des progestatifs 3) Indications et effets indésirables 4) Voie d'administration
5) Conclusion sur les progestatifs C) Les schémas thérapeutiques
1) Traitements séquentiels « avec règles » a. Traitements sur mesure
b. Traitements prêts à l'emploi
2) Traitements combinés ou semi-continus « sans règles » a. Schéma combiné continu
b. Schéma combiné discontinu c. Autre
Troisième partie : LES ETUDES CONCERNANT LE THS
A) La HERS B) La WHI C) LaMWS
D) Résultats de ces différentes études 1) Par rapport au cancer du sein
a. Résultats WHI b. Résultats MWS
c. Résultats de l'étude E 3N d. Conclusion sur ces études e. Etude MISSION page 29 page 29 page 29 page 30 page 30 page 30 page 30 page 32 page 33 page 34 page 34 page 34 page 34 page 34 page 35 page 35 page 35 page 35 page 35 page 37 page 37 page 37 page 40 page 41 page 41 page 41 page 43 page 44 page 49 page 50
f. Baisse de l'incidence des cancers du sein en 2005 et 2006 en France
g. Conclusion
2) Par rapport au cancer colorectal
3) Par rapport aux cancers gynécologiques a. Cancer de l'endomètre
i. Résultats WHI ii. Résultats MWS b. Cancer des ovaires
i. Résultats WHI ii. Résultats MWS 4) Par rapport à l' A VC
a. Résultats WHI b. Résultats HERS
5) Par rapport au risque thromboembolique veineux a. Résultats WHI
b. Résultats HERS I c. Résultats HERS II
d. Résultats de l'étude ESTHER 6) Par rapport aux risques cardiovasculaires
a. Résultats WHI
b. Résultats de la HERS I et II 7) Par rapport à la démence
8) Par rapport à la qualité de vie a. Résultats WHI
b. Résultats HERS 9) Par rapport à l'ostéoporose
a. Résultats WHI
b. Conclusion del' Afem et del' Afssaps E) Critiques des études
1) La WHI a. Premier biais b. Deuxième biais c. Troisième biais d. Quatrième biais 2) LaMWS a. Premier biais b. Deuxième biais c. Troisième biais page 52 page 53 page 53 page 53 page 53 page 53 page 54 page 54 page 54 page 54 page 55 page 55 page 57 page 59 page 59 page 62 page 62 page 64 page 68 page 68 page 70 page 74 page 78 page 79 page 79 page 81 page 81 page 82 page 84 page 84 page 84 page 85 page 85 page 86 page 86 page 86 page 87 page 87
d. Quatrième biais 3) LaHERS
Quatrième partie : RECOMMANDATIONS DEL' AFSSAPS
A) Les indications
1) Troubles du climatère
2) Prévention du risque fracturaire B) Les contre-indications
1) Cancers
2) Accidents thromboemboliques veineux 3) Autres
C) Mis en place d'un THS
1) Information de la patiente 2) Examens préalables D) Réévaluation du traitement E) Choix du THS
1) Cas spécifique de l'hystérectomie 2) Choix de l'estrogène a. Voie d'administration b. Dose 3) Choix du progestatif F) Surveillance G) Durée de prescription du THS
Cinquième partie : LES TRAITEMENTS ALTERNATIFS AU THS
A) Traitements des bouffées de chaleur 1) L'Agréal® 2) l' Abufène® 3) Autres page 88 page 88 page 89 page 89 page 89 page 89 page 90 page 90 page 90 page 90 page 91 page 91 page 91 page 91 page 92 page 92 page 92 page 92 page 92 page 94 page 94 page 95 page 96 page 96 page 96 page 97 page 97
4) La tibolone
a. Effets sur les troubles du climatère b. Effets sur la prévention de l'ostéoporose c. Effets sur la prévention des risques fracturaires d. Effets cardiovasculaires
e. Effets sur le sein
f. Effets sur les risques d' A VC g. Effets sur l'endomètre h. Conclusion sur la tibolone B) Traitement de l'ostéoporose
1) La vitamine D
a. Effets osseux
b. Conclusion sur la vitamine D 2) Le calcium
a. Effets sur la DMO b. Risques fracturaires
c. Conclusion sur la supplémentation calcique 3) Les biphosphonates
a. Les différentes molécules b. Précaution d'emploi
c. Conclusion sur les biphosphonates 4) Le raloxifène
a. Effets sur l'os
b. Risque cardiovasculaire c. Cancer du sein
d. Effets sur l'endomètre e. Tolérance générale
f. Conclusion sur l'utilisation du raloxifène 5) Le tériparatide
a. Effets sur les os b. Effets secondaires
c. Conclusion sur l'utilisation du tériparatide 6) Ranélate de strontium
a. Effets sur les os b. Effets extra-osseux c. Précaution d'emploi page 98 page 98 page 99 page 99 page 100 page 101 page 102 page 102 page 103 page 103 page 103 page 104 page 104 page 104 page 105 page 106 page 106 page 106 page 106 page 107 page 108 page 108 page 108 page 109 page 109 page 109 page 109 page 110 page 110 page 110 page 110 page 111 page 111 page 111 page 111 page 112
d. Conclusion sur l'utilisation du ranélate de strontium
7) Stratégie thérapeutique
Sixième partie : ANALYSE DES REPONSES AU QUESTIONNAIRE
A) Sélection de l'échantillon B) Analyse de la question n°1 C) Analyse de la question n°2 D) Analyse de la question n°3
1) Avant les études WHI ...
2) Après les études WHI. .. 3) Après les études françaises E) Analyse de la question n°4
1) Avant les études WHI ...
2) Après les études WHI. .. 3) Après les études françaises F) Analyse de la question n°5
1) Mode d'administration des estrogènes
2) Type d'estrogène utilisé G) Analyse de la question n°6
1) Avant les résultats de la WHI ... 2) Après les résultats de la WHI...
3) Après les résultats des études françaises H) Analyse de la question n°7
1) Analyse de la question n°8
1) Avant les résultats de la WHI ...
2) Après les résultats de la WHI. ..
3) Après les résultats des études françaises J) Analyse de la question n°9
1) Fréquence de réévaluation 2) Méthode de réévaluation
a. Par suspension du traitement
b. Par réévaluation du rapport bénéfice/risque
page 112 page 112 page 116 page 116 page 116 page 118 page 118 page 119 page 119 page 120 page 121 page 122 page 123 page 124 page 124 page 125 page 127 page 128 page 128 page 129 page 129 page 130 page 131 page 131 page 132 page 132 page 135 page 135 page 136 page 136 page 136
c. Par une autre méthode K) Analyse de la question n°10
L) Analyse de la question n°ll M) Analyse de la question n°12
1) Modalités de prescription
2) Type de traitement alternatif prescrit N) Analyse de la question n°13
1) Modalités d'information des patientes sous THS 2) Attitude des patientes vis-à-vis du THS
3) Inquiétudes des patientes sous THS 0) Discussion autour de l'enquête
1) Biais de l'enquête 2) Principaux résultats 3) Conclusion
BIBLIOGRAPHIE
LISTE DES ABREVIATIONS ANNEXES
../ Résultats de l'étude HERS 1: Analyses des risques thromboemboliques ../ Résultats de l'étude WHI : Analyse du niveau de qualité de vie
../ Prise en charge de la ménopause : Arbre décisionnel ../ THS en 2008, spécialités disponibles en France ../ Questionnaire
../ Serment des Apothicaires
"' 11 "'
page 136 page 137 page 138 page 139 page 139 page 141 page 142 page 142 page 143 page 144 page 144 page 145 page 145 page 147 page 151 page 158 page 160Liste des figures
Figure 1. Formules chimiques des différents types d'estrogènes
Figure 2. Avantages et inconvénients théoriques des différentes voies d'administration des estrogènes
Figure 3. Formules chimiques des différents progestatifs Figure 4. Les différents schémas d'administration du THS
Figure 5. Risque cumulé de survenue de cancer du sein au cours de l'étude WHI (branche estroprogestative)
Figure 6. Accidents vasculaires cérébraux: risque cumulé au cours de l'étude WHI (branche estroprogestative)
Figure 7. Thromboses veineuses: risque cumulé au cours de l'étude WHI (branche estroprogestative)
Figure 8. Evénements thromboemboliques veineux: risque cumulé au cours de l'étude WHI (branche estroprogestative)
Figure 9. Maladie coronarienne : risque cumulé au cours de l'étude WHI (branche estroprogestative)
Figure 10. Maladie coronarienne: incidence cumulée au cours de l'étude HERS
Figure 11. Démence: risque cumulé au cours de l'étude WHI (branche estroprogestative)
Figure 12. Risque fracturaire: nsque cumulé au cours de l'étude WHI (branche estroprogestative)
Figure 13. Stratégie thérapeutique en cas d'ostéoporose post-ménopausique en cas de fracture
Figure 14. Stratégie thérapeutique en cas d'ostéoporose post-ménopausique en 1' absence de fracture
Figure 15. Prescription du THS avant les études WHI Figure 16. Prescription du THS après les études WHI Figure 17. Prescription du THS après les études françaises
Figure 18. Proportion de patientes traitées par THS avant les études WHI Figure 19. Proportion de patientes traitées par THS après les études WHI Figure 20. Proportion de patientes traitées par THS après les études françaises Figure 21. Indications du THS avant les études WHI
Figure 22. Indications du THS après les études WHI Figure 23. Indications du THS après les études françaises
Figure 24. Impact des différentes études sur l'administration des estrogènes par voie orale
Figure 25. Impact des différentes études sur l'administration des estrogènes par voie cutanée
Figure 26. Impact des différentes études sur l'administration des estrogènes par voie nasale
Figure 27. Courbes de tendance de prescription des différents types de progestatifs selon les résultats des études
Figure 28. Courbes de tendance de la durée de prescription du THS
Figure 29. Intervalle de temps entre le début de la ménopause et le début de traitement parTHS
Figure 30. Prescription des différents schémas du THS Figure 31. Fréquence de réévaluation du THS
Figure 32. Comparaison du suivi des patientes ménopausées sous THS et des patientes ménopausées non traitées
Figure 33. Posologies privilégiées pour le THS
Figure 34. Modes d'information des patientes sous THS Figure 35. Degré de confiance accordé aux patientes au THS Figure 36. Principales inquiétudes des patientes sous THS
Liste des tableaux
Tableau 1. Symptômes observés chez 875 femmes ménopausées lors de l'étude PEPI Tableau 2 . Risque de fracture après 50 ans
Tableau 3. Effets protecteurs cardiovasculaires possibles des estrogènes Tableau 4. Répartition et caractéristiques des participantes de l'étude WHI
Tableau 5. Cancer du sein: risque relatif selon le type de THS administré au cours de l'étude E3N
Tableau 6. Cancer du sein: risque relatif en fonction des différents types de THS utilisés au cours des deux premières années de l'étude E3N
Tableau 7. Cancer du sein : risque relatif en fonction des différents types de THS utilisés après deux années et plus d'exposition au cours de l'étude E3N
Tableau 8. Cancer du sein: risque relatif en fonction du type de THS utilisé au cours de l'étude MISSION
Tableau 9. Accidents vasculaires cérébraux : nature et risque relatif au cours de l'étude WHI (branche estrogène seul)
Tableaux 10 et 11. Accidents vasculaires cérébraux : nature et risque relatif au cours de l'étude WHI (branche estroprogestative)
Tableau 12. Accidents vasculaires cérébraux: nature et risque relatif au cours de l'étude HERS
Tableau 13. Evénements thromboemboliques veineux : nature et risque relatif au cours de l'étude WHI (branche estroprogestative)
Tableau 14. Evénements thromboemboliques veineux : nature et risque relatif au cours de l'étude WHI (branche estrogène seul)
Tableau 15. Evénements thromboemboliques vemeux: comparaison entre l'étude HERS I et HERS II
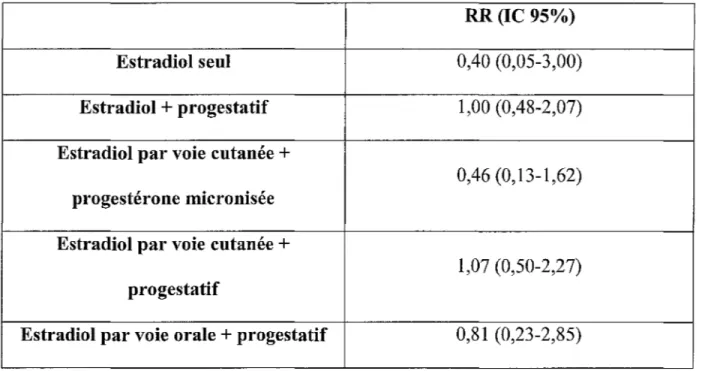
Tableau 16. Impact du THS sur le risque de thrombose veineuse en fonction de la voie d'administration de l' estrogène et du type de progestatif administré au cours de l'étude ESTHER
Tableau 17. Evénements thromboemboliques veineux : comparaison des risques en fonction de la durée, de la voie d'administration, de la posologie et de la nature du THS utilisé au cours de l'étude ESTHER
Tableau 18. Evénements cardiovasculaires: nature et risque relatif au cours de l'étude WHI (branche estroprogestative)
Tableau 19. Evénements cardiovasculaires : nature et risque relatif au cours de l'étude WHI (branche estrogène seul)
Tableau 20. Evénements cardiovasculaires : nature et risque relatif au cours de l'étude HERS
Tableau 21. Evénements cardiovasculaires: comparaison entre l'étude HERS I et HERS II
Tableau 22. Evaluation du Mini Mental Score (MMS) : comparaison entre les patientes traitées par THS et celles non traitées au cours de l'étude WHI (branche estrogènes seuls)
Tableau 23. Démence: nature et risque relatif au cours de l'étude WHI (branche estrogènes seuls)
Tableau 24. Evaluation du Mini Mental Score (MMS): comparaison entre les patientes traitées par THS et celles non traitées au cours de l'étude WHI (branche estroprogestative)
Tableau 25. Démence: nature et risque relatif au cours de l'étude WHI (branche estroprogestative)
Tableau 26. Bouffées de chaleur : évolution de leur fréquence en fonction du type de THS utilisé au cours de l'étude HERS
Tableau 27. Signes de sous et de surdosage estrogénique Tableau 28. Examens de surveillance d'une femme sous THS
Tableau 29. Approches thérapeutiques étudiées dans la prévention et/ou le traitement de l'ostéoporose post-ménopausique
Tableau 30. Apports calciques recommandés en fonction de l'âge
Tableau 31. Place des différents traitements de l'ostéoporose post-ménopausique en cas de fracture
Tableau 32. Méthode de réévaluation du THS
Tableau 33. Types de traitements alternatifs prescrits
Titre : Le Traitement Hormonal de Substitution de la ménopause en 2008 : Point sur
les différentes études menées à ce sujet et analyse de leur impact sur les pratiques de prescription en Isère ces dernières années.
INTRODUCTION :
Le traitement hormonal substitutif (THS) de la ménopause est, depuis de nombreuses années, un sujet à polémique. Souvent sollicité, quelques fois dénigré, de nombreuses études ont été menées à ce sujet, parfois avec des résultats contradictoires.
Un bref rappel sur les symptômes engendrés à court et à long terme par le bouleversement hormonal qu'est la ménopause semble nécessaire pour bien cerner le sujet.
Ensuite, le but de la partie bibliographique de cette thèse est de faire un point en cette année 2008 sur les principales études ayant été menées à ce sujet et les modifications qu'elles ont pu entraîner.
Les recommandations de l' Afssaps (Agence française de sécurité sanitaire des produits de santé) sur les bonnes pratiques de prescription du THS rédigées en fonction de ces résultats sont ensuite analysées.
La deuxième partie de cette thèse concerne l'analyse des résultats de questionnaires envoyés à une centaine de gynécologues dans le département de l'Isère. Le but était d'évaluer les modifications éventuelles des habitudes de prescription du THS en fonction des résultats de ces différentes études.
Première partie : INTRODUCTION SUR LA MENOPAUSE
La ménopause est un phénomène naturel survenant chez toutes les femmes aux alentours de la cinquantaine.
Elle est responsable de différents symptômes d'intensité plus ou moins prononcée, et pouvant altérer la qualité de vie.
Ces symptômes peuvent être divisés comme ayant des conséquences à court, moyen et long terme.
A) Symptômes ayant des conséquences à court et moyen terme [l, 38] 1) Symptômes vasomoteurs ou bouffées de chaleur
C'est le trouble le plus fréquent lié à la ménopause, touchant environ 65% des femmes ménopausées (taux variant selon la population étudiée). Ces symptômes vasomoteurs peuvent causer des désagréments sévères. Ils sont ressentis comme une sensation brève de chaleur envahissant tout le corps et se décomposent typiquement en 3 phases :
une phase d'aura ou de prodrome,
- une deuxième phase avec sensation de chaleur, associée à une hypersudation et à des palpitations,
une dernière phase de résolution se caractérisant par des tremblements et des frissons.
Ces bouffées de chaleur deviennent problématiques quand elles empêchent une vie normale et lorsqu'elles sont nocturnes, obligeant la patiente à se découvrir, à se lever et à ouvrir les fenêtres.
Ces bouffées de chaleur n'ont pas forcément tendance à s'atténuer au fil du temps, elles peuvent encore être présentes des années après le début de la ménopause (pour 10 à 15% des femmes ménopausées). Comme le taux d'estrogène mesuré n'est pas différent entre les femmes ayant des bouffées de chaleur et celles n'en ayant pas, on ne peut pas vraiment leur imputer ces symptômes.
2) Troubles de l'humeur
Bien souvent, la ménopause est associée à une période de troubles de l'humeur, caractérisée par de la morosité, de l'angoisse, de la tristesse, de l'irritabilité. La ménopause peut même être responsable de la survenue d'un épisode de dépression.
3) Sécheresses vaginales
Elles toucheraient 30% des femmes pendant la phase précoce de la ménopause et 47% pendant la phase tardive. Elles peuvent être responsables de trouble de la libido et de dyspareunie (d'où possibles problèmes de couple), ainsi que de picotement ou brûlure vulvaire.
4) Symptômes urinaires
Ils sont moins caractéristiques et apparaissent souvent à distance de l'installation de l'aménorrhée.
Ces symptômes sont surtout représentés par des infections urinaires à répétition. En effet, celles-ci sont favorisées par la sécheresse vaginale ainsi que par la modification du pH vaginal qui devient neutre (alors qu'il était plus acide avant la ménopause), ce qui facilite la prolifération des bactéries entériques.
En ce qui concerne l'incontinence urinaire d'effort et les impériosités mictionnelles, elles ne sont pas à proprement parler des signes climatériques mais la carence estrogénique semble les aggraver.
5) Asthénie
Les femmes ménopausées se plaignent souvent d'une fatigue intense, mais aussi d'anxiété, difficultés de concentration ... Elle peut être liée à un manque de sommeil (dû aux bouffées de chaleur) mais la carence estrogénique est aussi responsable.
6) Prise de poids
Cette prise de poids est souvent attribuée au traitement hormonal de la ménopause. Pourtant, il est actuellement prouvé que celui-ci n'en n'est pas la cause. Cette variation pondérale est progressive, et dépend de certains facteurs prédisposants (surpoids
préexistant, notion de surpoids familiaux...). Elle peut aussi être causée par une modification des habitudes alimentaires (liée au trouble de l'humeur ou à une augmentation quantitative des apports).
De plus, la carence estrogénique est responsable d'une modification de la répartition des graisses chez la femme ménopausée favorisant leur localisation sur le ventre (situation androïque). Cela est aussi souvent associé à une diminution de la masse musculaire (liée à une baisse de l'activitéphysique).
Il faudra donc sensibiliser les femmes ménopausées à l'importance d'une diététique équilibrée ainsi qu'à une pratique régulière d'une activité physique.
7) Sécheresse de lapeau et des muqueuses [53]
A la ménopause, les femmes se plaignent souvent d'une accentuation de certains signes de vieillissement cutané. En effet, la peau devient plus fine et plus rêcheavec une sensation de sécheresse. Il existe de plus une diminution de l'élasticité de la peau. Ces symptômes sont liés à une diminution de l'épaisseur du derme ainsi qu'à une perte de collagène, tandis que la couche cornée s'est, elle, épaissie et que sa composition lipidiques'est modifiée.
Tableau 1: Symptômes observés chez 875femmes ménopausées lors de l'étude PEPI
1
Troubles~ Ut"$ : bouff6csde ~
a~ noctumcs ~
Foncdo cogn:icJv c: a~
~de ~ d ~ d ~ S<;>conccnt.rcr ~~ ~ ~ d ~~ au(r;ov;a1I d" cac...:é au tr.av.&•
d6sAnuô.-r•< .,;,s.-vis rcnvu-onnoment.~
confusôon AnxJ
"uffoc::ation
· c .1r ~ vision trouble Pok:ls -appédt : prù..depokk ...?" '1ppok:lc , a~ ~ J de.pocds Appa.r il quelettomusc. re: doula....s .. 500f'fr.lnco d ~
raideurs muKui;:a•rcs
~~e -d e~ do bnuque bu:on4'ort m mm Ire !o.4nS I! d e ~
"
'
1
'46 )6 7 34 2.S 2'4 18 1) 18 1 3 8 7 s 4..
32 22 s..
'48 4"' '42 3'4 9..
B) Symptômes ayant des conséquences à long terme [l] 1) L'ostéoporose [56, 62]
Comme tous les organes, l'os évolue avec le temps sous l'influence d'un remodelage osseux permanent : gain de masse osseuse jusqu'à 20 ans grâce aux ostéoblastes, équilibre ensuite avec les ostéoclastes, puis, perte osseuse progressive, multifactorielle, avec grandes variations individuelles.
La déminéralisation o.sseuse est donc un phénomène physiologique normal quand on prend de l'âge. Mais il s'accentue à la ménopause sous l'influence de la carence estrogénique, conduisant ainsi à l'ostéoporose.
L'ostéoporose est définie selon l'OMS (Organisation mondiale de la santé) par une densité osseuse mesurée au rachis lombaire et/ou à l'extrémité supérieure de la hanche abaissée de plus de 2,5 écarts-type par rapport à la moyenne des jeunes adultes (T :S -2,5).
Elle a pour principale conséquence le risque fracturaire aux faibles traumatismes. L'ostéoporose est, selon l'Afem (Association française pour l'étude de la ménopause), la cause la plus importante de toutes les fractures. En effet, en 2001, sur les 10 200 000 femmes ménopausées françaises, 3 300 000 d'entre elles sont ostéoporotiques et 1 600 000 auront une fracture.
L'ostéoporose peut atteindre tous les sites osseux. Les fractures caractéristiques de la maladie sont celles des vertèbres, de l'extrémité supérieure du fémur et de l'extrémité distale de l'avant-bras. Ces fractures ont évidemment une conséquence en terme médicale et socio-économique. Il convient donc de dépister et de prévenir cette ostéoporose.
Pour la dépister, un examen peut être proposé aux femmes ménopausées: l'ostéodensitométrie. Il permet de mesurer la densité minérale osseuse et constitue le meilleur indicateur de risque de fracture. A noter que cet examen est désormais pris en charge par la sécurité sociale sous certaines conditions.
La réalisation d'une ostéodensitométrie peut être proposée, chez la femme ménopausée, en présence d'un ou de plusieurs des facteurs de risques suivants :
- des antécédents de fracture vertébrale ou du col fémoral sans traumatisme majeur chez un parent au premier degré,
- un indice de masse corporel < 19 kg/m2 ,
- une ménopause avant 40 ans quelle qu'en soit la cause ou ménopause iatrogénique,
- antécédent de corticothérapie prolongée (> 3 mois) à la dose de corticoïde équivalent prednisone 8 à 7,5 mg/j.
Lorsque le résultat de l'ostéodensitométrie est normal et qu'aucun traitement n'est institué, une deuxième ostéodensitométrie peut être proposée après 2 à 5 ans et ce, en fonction de l'ancienneté de la ménopause, du résultat de la première mesure et de la persistance ou de l'apparition de facteurs de risques.
Tableau 2: Risque de fracture après 50 ans
Risque
."f)rès50 .ais (
0/o) Fennmes HommesExtrémié supérieure duf anur 1l,5 6,0 (FESF}
F radu rev ertébrale 15,6
ko
...,
Poignet 16 2,5 Toutes 397 1 13, 1
2) Athérosclérose coronarienne
La ménopause est responsable de la perte de la protection cardiovasculaire liée aux estrogènes dont les femmes bénéficient.
L'hyperinsulinisme observée pendant la ménopause agit sur l'incidence des accidents vasculaires de plusieurs façons :
-elle induit une hypertension par une élévation de la réabsorption du sodium et par une augmentation de l'activité du système nerveux sympathique,
-elle provoque une élévation des triglycérides, du cholestérol total et surtout du LDL cholestérol (qui deviennent plus petites donc plus oxydables et plus athérogènes) ainsi qu'une diminution du HDL cholestérol (fraction protectrice),
-elle s'accompagne d'une détérioration de la toléranceau glucose.
Les taux de Lp(a) augmentent aussi avec l'âge chez la femme, notamment lors du passageàla ménopause. Le Lp(a) est un marqueur de risque cardiovasculaire indépendant de celui des autres fractions lipidiques. Il semble impliquéàla fois dans le processus d'athérosclérose et de thrombose.
Le taux d'homocystéine lui aussi s'élèveàla ménopause. L'homocystéine pourrait prédisposer aux thromboses en retentissant sur le système de la coagulation et la résistance de l'endothéliumàlathrombose.
Enfin, la ménopause serait aussi responsable d'altérations directes de la paroi vasculaire, en diminuant la vasoréactivité artérielle et en favorisant la progression de l'athérosclérose.
Il n'y a donc rien d'étonnant, que, dans l'étude de Framingham, la ménopause multiplie par deux le risque d'affection coronarienne, quel que soit l'âge auquel les règles s'arrêtent.
Tableau 3 : Effets protecteurs cardiovasculaires possibles des estrogènes
Métabolisme des lipides
,..-/!synthèse hépatique des HOL et apolipoprotéines A 1 -accélération du catabolisme des LOL par leurrécepteur ,..-/!élimination postprandiale des chylomicrons
~d fluxdes acides gras non estérifiés ~d lipidiquesartériels
-inhibitionde l'oxydationdes LOL
~ Lp(a)
Métabolisme glucidique
,..-/!sensibilitéàl'insuline ,..-/!élimination de l'insuline
,..-/!sécrétion pancréatique de l'insuline
Effets directs surlaparoi artérielle
- préservation de l'intégritédes cellules endothéliales ~ molécules d'adhésion
- effets vasodilatateurs :
,..-/! sécrétion prostacycline (PG12) ,..-/! oxyde nitrique(NO)
~ endothéline (ET - 1)
~ thromboxane-A2 (TXA2)
~ a et migration des cellules musculaires lisses
Autres effets
,..-/!activité fibrinolytique ,..-/!PAi - 1
~ a e VII ~ homocystéine - inhibiteurcalcique
- inhibitionde laréponseadrénergique
- inhibitionde l'activitéet de l'agrégabilitéplaquettaires ,..-/!relaxine
Deuxième partie: LE TRAITEMENT HORMONAL SUBSTITUTIFDELA MENOPAUSE
Le but du THS est de pallier les inconvénients à court terme et à long terme liés à la carence en sécrétion ovarienne d'estrogène.
Les hormones qui composent leTHS sont donc :
· les estrogènes, qui ont pour but de limiter les différents symptômes liés à la ménopause,
· la progestérone naturelle ou un progestatif de formule chimique proche, lui conférant des propriétés légèrementdifférentes. Les progestatifs ont pour seul objectif de compenser l'effet des estrogènes sur la prolifération endométriale et d'induire les activités enzymatiques nécessaires à un métabolisme normal de l'estrogène.
A)Les estrogènes [2, annexe 4] 1) Les différentes molécules
a) Les estrogènes naturels
Les estrogènes naturels sont les estrogènes sécrétés par l'organisme. Parmi eux, on compte le 17-fJ-estradiol, synthétisé par les ovaires, l'estrone, sécrétée par les ovaires et les tissus graisseux (moins actif que le1 ~ e ad et l'estriol qui est le
métabolite des deux estrogènes précédents (moins actifégalement).
Il existe aussi des estrogènes semi naturels. Ce sont des produits susceptibles d'être métabolisés, au moins partiellement, dans l'organisme en estrogènes naturels. Il s'agit des esters de l'estradiol, de l'estrone ou de l'estriol, caractérisés par la présence d'un radical de substitution au niveau du carbone 17.
b) Les estrogènes équins conjugués
Les estrogènes équins conjugués sont extraits d'urine de jument. Ils sont beaucoup utilisés aux Etats-Unis, mais ne sont pas administrés en France.
c) Les estrogènes de synthèse
Les estrogènes de synthèse sont divisés en deux groupes :
les estrogènes stéroïdiens dont l'éthinylestradiol, utilisés essentiellement en contraception,
les estrogènes non stéroïdiens, le diéthylstilbestrol et le diénestrol, dont seul le premier est utilisé dans le traitementdu cancer de laprostate.
En France, seuls sont utilisés dans les THS l'estradiol micronisée, le valérate d'estradiol et l'estriol.
Figure 1. Formules chimiques des différents types d'estrogènes
Estrogènes naturels
,a 1 , ~
liO . OO OO
Estrad1ol Estrone Estriol Esters de l'estradiol R=radical de substitution
HO
Estrogènes synthétiques non stéroïdiens
*
OH/,
"
Diéthylstilbestrol Phytoestrogènes
,Woo
< CH3 OH 0~
dP
R =-CO-CHf C Valérianate OH I' 1 OH3 ~ ~ 1 R =-CO-( CH2)9-CH3 Undecylate ~ 1 ~ 0 ~ 0 HO HO HO liO R=-CODEsters de I' estradiol Benzoate Daidzéine Genistéine Equol Estrogènes synthétiques stéroïdiens
OH
dP"
'
"
HO ,
Ethinylestradiol
2) Les différentes voies d'administration des estrogènes Ces différents estrogènes peuvent être utilisés selon différentes voies :
a) La voie orale
L'avantage de la voie orale est qu'elle permet d'obtenir une bonne compliance. Son inconvénient reste le premier passage hépatique, responsable d'une augmentation de synthèse de la plupart des protéines produites par le foie. Parmi ces protéines, on note
une augmentation de certains facteurs de la coagulation et l'inhibition d'autres facteurs comme l'anti-thrombine III. Ceci explique donc les contre-indications des estrogènes pris par voie orale chez les femmes à risque de thrombose.
Le premier passage hépatique est aussi responsable d'effets métaboliques doses dépendants dont une augmentation du HDLc, une diminution du LDLc, mais aussi une augmentation des triglycérides. On note aussi une augmentation du substrat de la rénine (mais les chiffres de la tension artérielle ne sont généralement pas modifiés) ainsi qu'une modification de la composition de la bile.
En ce qui concerne le métabolisme de ces différentes molécules pnses par voie orale, on remarque que les estrogènes naturels sont plus rapidement inactivés que les estrogènes de synthèse. En effet, l' estradiol est en partie détruite dès son entrée dans le tube digestif et est fortement métabolisée au niveau hépatique; plusieurs solutions ont alors été proposées pour pallier ce problème. On a imaginé l'utilisation de dérivés d'estrogènes comme les estrogènes conjugués équins (utilisés aux Etats-Unis) ou le valérate d'estradiol (sels d'estradiol) qui le mettent à l'abri du métabolisme hépatique, ou encore la micronisation de l' estradiol qui favorise son absorption et permet à une partie de celui-ci de passer à travers le tube digestif et le foie et de rejoindre la circulation générale.
b) La voie cutanée (patch ou gel)
La voie cutanée à l'avantage d'éviter le premier passage hépatique, permettant ainsi une administration très proche de la physiologie et de la sécrétion ovarienne.
Deux systèmes transcutanés existent : le gel et le patch.
Pour les patchs, le passage de l' estradiol dans la circulation sanguine est rapide, puis sa diffusion est à peu près constante pendant 72 heures pour les patchs bihebdomadaires ou pendant 7 jours pour ceux à libération prolongée.
Pour le gel, l' estradiol diffuse dans la circulation générale en quelques heures.
La voie cutanée permet certes d'éviter ce premier passage hépatique, cependant, la compliance est moins bonne et le taux d' estriol est moins constamment favorable.
c) La voie nasale
Elle est permise par l'utilisation d'une molécule m ~ de e qui permet
de solubiliser les stéroïdes.
Elle s'apparente à la voie cutanée en permettant d'éviter le premier passage hépatique, mais le seul produit qui permettait cette utilisation a été retiré du marché.
d) Conclusion sur les voies non orales
En évitant le premier passage hépatique, les voies non orales permettent d'administrer des doses plus faibles. Ces voies n'induisent pas d'augmentation de synthèse hépatique de diverses protéines, comme le fait la voie orale. En particulier, il ne se produit pas d'élévation du taux de rénine ou de triglycérides, ni de modification des taux de facteurs de la coagulation.
Figure 2. Avantages et inconvénients théoriques des différentes voies d'administration des estrogènes
1
Parentérale Orale
•
+
Pas ou peu de ....,_ Circulation générale Absorption intestinale
+
Veine porte modifications
métaboliques
•
1er passage hépatique HDLC*
LDLC* inchangésHDLC :discrèàcoutert terme élévationàlong terme
~~ ~~~~ ~ ~ ~~~~~~
E1 > E2
+
+
TG inchangés ou
j
,
légère*Effet dose-dépendant
Organe cible
Foie Catabolisme
Modifications métaboliques Modifications
Î
HDLC* de la compositiont
LDLC*Î
Substrat rénine*Î
TG*t
Antithrombinede la bile
3) Les rôles des estrogènes
a) Action sur les symptômes de la ménopause ayant des incidences à court terme
Les estrogènes, quelles que soient leurs voies d'administration, soulagent efficacement l'ensemble des symptômes vasomoteurs, ce qui est particulièrement appréciable pour les femmes ménopausées.
De plus, ils ont une action proliférative sur la plupart des muqueuses de l'organisme. En effet, ils permettent d'augmenter l'épaisseur de la muqueuse vaginale en favorisant la prolifération cellulaire et en inhibant la tendance à la desquamation des couches superficielles. Ils agissent de la même façon sur beaucoup d'autres muqueuses (utérine, buccale, vésicale), permettant de redonner le confort perdu.
En ce qui concerne les problèmes cutanés, grâce à la présence de récepteurs aux estrogènes dans les cellules endothéliales et les fibroblastes dermiques, ils permettent d'augmenter l'épaisseur de la peau, leur teneur en collagène et d'améliorer le nombre et la structure des fibres élastiques. Ils améliorent aussi la sensation de sécheresse cutanée.
b) Action sur les symptômes de la ménopause ayant des incidences à long terme
i. Effets sur le sein
Ces hormones favorisent le développement du tissu glandulaire par multiplication des canaux galactophores. Ils permettent donc la croissance des seins à la puberté, le maintien de la structure mammaire et phénomènes cycliques chez la femme en activité génitale.
ii. Effets sur l'endomètre
Les estrogènes sont responsables d'une prolifération des cellules de l'endomètre ce qui engendre son épaississement et l'allongement de ses glandes.
Ceci explique que toute imprégnation estrogénique isolée et prolongée risque d'induire un développement excessif et anormal de l'endomètre (hyperplasie) et peut même aller jusqu'au cancer.
iii. Effets sur l'os
Comme cela a été dit précédemment, l'os est un tissu en perpétuel renouvellement. Les ostéoblastes sont responsables des phénomènes d'anabolisme, tandis que les ostéoclastes sont responsables des processus de catabolisme. Avec le vieillissement, la durée de vie des ostéoblastes diminue. Ils n'arrivent plus à combler totalement les lacunes de résorption créées par les ostéoclastes, ce qui entraîne l'ostéoporose.
Les estrogènes vont inhiber la résorption osseuse en freinant le processus de remodelage osseux. Ils vont agir de façon directe sur les ostéoclastes en inhibant le phénomène de résorption qu'ils engendrent, mais aussi de façon indirecte en interférant avec la calcitonine et la parathormone, deux hormones ayant une action directe sur les cellules du tissu osseux. Les estrogènes vont donc permettre d'annuler la perte osseuse.
iv. Effets sur le métabolisme lipidique
Les estrogènes protègeraient du risque d'athérome grâce à une action sur le métabolisme, étant ainsi responsables d'effets favorables vis-à-vis d'un certain nombre de marqueurs intermédiaires du risque cardiovasculaire.
En effet, ils seraient à l'origine d'une diminution des fractions athérogènes plasmatiques (LDL-C, Apo B), d'une augmentation des fractions antiathérogènes (HDL-C, Apo Al) et d'une diminution de la Lp(a). Ils diminueraient aussi l' insulinorésistance.
D'autre part, les estrogènes exercent une action directe sur les artères qui permettrait d'augmenter le phénomène de vasodilatation et d'avoir un effet antiathéromateux local.
Il paraît donc logique que les estrogènes administrés dans le THS permettent de contrer l'augmentation du risque cardiovasculaire engendrée par la ménopause.
B) Les progestatifs [l, 3, 49, annexe 4] 1) Les différentes molécules
De nombreux progestatifs peuvent être utilisés pour compléter les estrogènes dans le traitement hormonal de la ménopause :
-laprogestérone naturelleet son isomère, ladydrogestérone -les dérivés de laprogestérone,
-legroupe prégnane -legroupe norprégnane
-lesdérivés dela19-nortestostérone,composés d'un noyau estrane, qm dérivent non pas de laprogestérone, mais de latestostérone. Cette sous classe se divise en deux groupes :
-legroupe estrane -legroupe gonane
Figure 3. Formules chimiques des différents progestatifs
Progestérone et ses dérivés
Progestérone
Dérivés prégnanes
Dérivés norprégnanes
*dydrogestérone
*ac.dechlormadinone
*ac.de cyprotérone
* ac.de médroxyprogestérone *ac.de mégestrol *médrogestone *démégestone * promégestone *ac.de nomégestrol .. trirnégestone
Dérivés de la19-nortes1:os-t.érone
0
Dérivé de lasplronolactone
*d 1~ e ... noréthistérone ou noréthîndrone
l
*ac. denoréthistérone .. diacétate d'éthynodiol *lynestrenol 1••génération .. norgestrel *norgestriénone *désogestrel *gestodène *norgestimate *diénogest *tibolone ] 2• génération ] 3• génération2) Pharmacologie des progestatifs
Tous les progestatifs et leurs dérivés, possèdent, grâce à leur structure chimique, une affinité plus ou moins grande pour le récepteur de la progestérone. Ils ont donc tous une activité progestative plus ou moins importante.
Cependant, ils sont aussi capables de se fixer sur d'autres récepteurs stéroïdiens, ceci grâce à la similitude entre les structures des récepteurs de la progestérone et des récepteurs aux androgènes, aux glucocorticoïdes ou à l'aldostérone. Les différentes molécules auront donc, selon leur affinité à ces différents récepteurs, des activités androgéniques, et glucocorticoïdes différentes. A noter que selon les cas, ces molécules peuvent aussi présenter une activité estrogénique plus ou moins importante. La progestérone et la dydrogestérone sont beaucoup utilisées dans le THS car elles ont l'avantage d'être dénuées de toute activité androgénique. Cependant, la progestérone a l'inconvénient de voir son absorption varier d'une patiente à l'autre.
La dydrogestérone, elle, se caractérise par une affinité relativement importante pour le récepteur de la progestérone, une affinité négligeable pour celui des androgènes et une absence d'affinité pour celui des estrogènes. La dydrogestérone conserve un effet endométrial, mais elle a perdu les effets anti-androgènes, anti-aldostérone et sédatifs de la progestérone.
Les dérivés de la testostérone ont, en général, des effets progestatifs puissants, mais ils conservent un effet androgénique plus ou moins important selon les molécules, ce qui peut entraîner des effets secondaires notamment cutanéo-muqueux.
Les dérivés prégnanes résistent à la dégradation hépatique, et ils possèdent une excellente activité progestative. Les produits de cette classe sont très diversifiés. Certains conservent un effet androgénique comme l'acétate de médroxyprogestérone, d'autres un effet anti-androgénique comme l'acétate de cytoprotérone, d'autres encore un effet diurétique comme la spironolactone, d'autres enfin sont des progestatifs purs comme la médrogestone ou l'acétate de chlormadione.
Les norprégnanes dérivent des prégnanes. Ils ont une bonne absorption digestive, ne subissent pas de métabolisme hépatique, ils possèdent un très bon effet progestatif et sont dénués d'effets collatéraux.
On peut donc utiliser de manière indifférente sur le plan de l'efficacité l'ensemble de ces produits en association avec les estrogènes. Le choix sera fonction des effets collatéraux des progestatifs.
3) Indications et effets indésirables
L'adjonction d'un progestatif au THS va permettre de limiter l'épaississement de l'endomètre induit par la prise des estrogènes et donc l'apparition possible d'une hyperplasie. Hyperplasie, qui, en plus du risque de cancer, peut entraîner de nombreux saignements inopportuns, responsables d'une mauvaise observance au traitement. Très peu d'autres effets positifs liés au progestatif ont été démontrés, sauf en ce qui concerne la progestérone naturelle, qui a un très léger effet diurétique et sédatif.
En ce qui concerne leur tolérance globale, elle est plutôt satisfaisante. La progestérone naturelle est cependant susceptible de donner des nausées et des vertiges ainsi que des somnolences, elle sera donc préférentiellement prise le soir et/ou en administration vaginale. De plus, certains produits peuvent avoir des effets androgéniques cutanés : acné, hirsutisme ou chute de cheveux.
En ce qui concerne les effets secondaires métaboliques et vasculaires, les progestatifs pourraient bien s'opposer aux effets bénéfiques obtenus par les estrogènes. En effet, la majorité des progestatifs semble entraîner une insulinorésistance. De plus, certains progestatifs s'opposent à l'élévation du HDL cholestérol induite par les estrogènes (ce qui serait corréler à l'effet androgénique).
Le respect de l'effet antiathéromateux induit par les estrogènes dépendrait là aussi du type de progestatif associé. Des études sur les animaux ont montré que l'acétate de médroxyprogestérone s'opposerait à cet effet, tandis que la progestérone le respecterait.
Il en est de même en ce qui concerne l'effet vasodilatateur induit par les estrogènes : la progestérone naturelle le respecterait alors que l'acétate de médroxyprogestérone l'inhiberait.
4) Voie d'administration
Dans la majorité des THS, les progestatifs sont administrés sous forme orale. Mais ils peuvent aussi être administrés d'autres façons :
par voie vaginale: réservée à laprogestérone en post-ménopause en cas de mauvaise tolérancepar voie orale,
par voie intra-utérine : grâce à un dispositif intra-utérin délivrant un progestatif nortestostérone qui n'a pas d'indication dans la ménopause en France (Mirena®),
par voie transcutanée : certains patchs délivrent en effet un mélange d'estrogènes et de progestatifs.
5) Conclusion sur lesprogestatifs
Aux Etats-Unis, le THS le plus largement prescrit est fondé sur l'association des estrogènes équins conjugués par voie orale et d'un progestatif de synthèse, l'acétatede médroxyprogestérone (MPA). En France, la préférence est donnée au1 ~ e ad
associé à la progestérone ou à des progestatifs de synthèse peu ou non androgéniques (type norprégnane).
C) Les schémas thérapeutiques [l,57]
1) Traitements séquentiels«avec règles»
Ils permettent d'obtenir une hémorragie de privation durant l'arrêtdu progestatif. a) Traitements surmesure
-avec intervalle d'arrêt, ou séquentiel discontinu: prescription d'un estrogène du 1er au 24 ou au 25 du mois associé à un progestatif les 12 derniers jours. Ce schéma est pratique pour les patientes, car il est calqué sur le cycle menstruel naturel, il permet d'éviter les erreurs.
-sans intervalle d'arrêt ou séquentiel continu : les estrogènes sont prescrits tous les joursdu mois, leprogestatif est associé les 12 à 15 derniers jours.
b) Traitements prêts à l'emploi
Ils se présentent sous forme de plaquettes dans lesquelles estrogènes et progestatifs sont associés :
-traitement de 21 jours, un progestatif étant présent les 10 derniers jours,
-traitement de 28 jours (sans interruption) le progestatif étant associé à l'estrogène pendant les 10 ou 14 derniers jours.
La forme de timbre hebdomadaire est aussi disponible, les deux premiers patchs utilisés les deux premières semaines du cycle contiennent un estrogène seul (14j), les deux derniers patchs utilisés les deux dernières semaines du cycle contiennent un mélange d' estrogène et de progestatif ( 14j)
2) Traitements combinés ou semi-continus« sans règles»
L' estrogène est pris suffisamment longtemps au cours du cycle pour induire une atrophie endométriale, _supprimant ainsi l'hémorragie de privation observée lors des schémas séquentiels.
a) Schéma combiné continu
L'estrogène peut être pris de façon ininterrompue, associé au progestatif. Ce schéma entraîne souvent des problèmes de spotting.
b) Schéma combiné discontinu
L' estrogène peut être pris de façon ininterrompue, le progestatif étant pris 26 à 28 jours par mois. L'interruption de 3 jours favorise l'apoptose des cellules mammaires.
c) Autre
Figure 4. Les différents schémas d 'administration du THS
Comme nous l'avons vu, le principal but du THS est de contrer les effets indésirables provoqués par la ménopause. Mais comme l'a laissé sous entendre la partie concernant les molécules composant le THS, celui-ci n'a pas une innocuité parfaite. Plusieurs études se sont justement penchées sur ce problème.
Troisième partie : LES ETUDES CONCERNANT LE THS A) La HERS [22, 29]
La HERS (Heart and Estrogen/progestin Replacement Study) est une étude randomisée, effectuée en double aveugle et multicentrique (20 centres aux Etats-Unis). Elle a débuté en Février 1993.
Cette étude avait pour but d'évaluer l'efficacité du traitement estroprogestatif en prévention secondaire des maladies cardiovasculaires en post-ménopause. Elle a englobé 2 763 femmes ménopausées, ayant une moyenne d'âge de 68 ans, non hysterectomisées, et qui présentaient un antécédent documenté de pathologie coronarienne (un infarctus du myocarde, une revascularisation des coronaires ou une occlusion de plus de 50 % d'une des coronaires majeures). A noter que plus de la moitié des participantes présentaient sur surpoids (IMC2:27 kg/m2).
Un groupe a reçu 0,625 mg d'estrogène équin conjugué et 2,5 mg de MPA par jour alors que l'autre groupe a reçu un placebo (les deux groupes n'ayant pas de différences démographiques significatives initiales). Ces femmes ont été suivies pendant une période moyenne de 4, 1 ans. Les principaux critères étudiés étaient la survenue d'infarctus du myocarde non fatal et le décès d'étiologie coronarienne. Les critères secondaires étaient l'apparition d'angor instable, de maladies artérielles périphériques, d'insuffisance cardiaque et d'accident vasculaire cérébral.
A la suite de HERS 1, les patientes le désirant ont été suivies pendant une durée supplémentaire de 2,7 ans (soit un total de 6,8 ans). Cette prolongation de l'étude HERS 1 (appelée HERS II) avait pour but essentiel de confirmer la tendance à la baisse du risque coronarien remarqué lors de l'étude HERS pour les femmes traitées sous THS.
B) La WHI [10, 59]
L'étude WHI (Women's Health Initiative) est une étude s'intéressant aux différentes stratégies de prévention des maladies cardiovasculaires, cancer du sem, cancer
colorectal, et des fractures ostéoporotiques chez les femmes ménopausées. Parmi les méthodes de prévention étudiées, on compte évidemment le THS, mais aussi les habitudes alimentaires des femmes ménopausées, ainsi que la supplémentation en vitamine D et calcium.
Cette étude est composée de deux parties, une étude randomisée et une étude observationnelle.
L'étude observationnelle a pour but d'établir une relation entre le style de vie, la santé, les facteurs de risque et les maladies spécifiques.
L'étude randomisée étudie trois stratégies de prévention:
- Le THS : l'effet des estrogènes seuls et des estrogènes associés aux progestérones est étudié par rapport à la prévention des maladies cardiovasculaires, des fractures et des cancers du sein. C'est la seule branche de l'étude à laquelle nous nous intéresserons.
- Les modifications de régimes diététiques (notamment la diminution en graisse, l'augmentation des fruits, légumes et céréales).
- La supplémentation en calcium et en vitamine D : elle concerne les femmes participant à une ou deux des autres études citées ci-dessus.
La branche de l'étude WHI s'intéressant au THS était composée au total de 161 808 femmes ménopausées, ayant une ménopause asymptomatique, de moyenne d'âge élevée (50 à 79 ans), la majorité des femmes étant ménopausées depuis plus de 10 ans. Ces femmes ne devaient pas avoir d'antécédents de cancer de sein ni suspicion de cancer du sein au moment de l'inclusion et pas d'antécédents d'autres cancers dans les 10 ans auparavant. Il existait de nombreux autres critères d'exclusion, les plus importants étant que les femmes ne devaient pas avoir d'antécédents d'infarctus du myocarde ou de pathologie thromboembolique, ni avoir présenté un accident vasculaire cérébral ou un accident ischémique transitoire au cours des six derniers m01s.
La partie de l'étude randomisée concerne 68 132 femmes, elle est multicentrique (concerne 40 centres aux Etats-Unis), effectuée en double aveugle, avec contrôle par rapport à un placebo. Elle est composée de deux bras:
-le bras numéro 1 inclut 16 608 femmes ménopausées, d'un âge moyen de 63,3 ans, certaines (8 506) ont reçu l'association continue par voie orale de 0,625 mg/jour d'estrogènes équins conjugués (CEE) et de 2,5 mg/jour de MPA, les autres (8 102) sont sous placebo.
- le deuxième bras de cette étude s'intéresse à 10 000 femmes ménopausées et hysterectomisées dont certaines sont uniquement sous CEE (0,625 mg/j) alors que les autres sont sous placebo.
Tableau 4 : Répartition et caractéristiques des participantes de l'étude WH! CEE+MPA CEE seuls CEE+MPA Placebo CEE Placebo
Nb de femmes 8506 8012 5310 5429 Age moyen 63,2 63,7 63,6 63,6 Durée moyenne du 5,2 ans 6,8 ans suivi IMC moyen Kg/m2 28,5 30,1
En ce qui concerne leur suivi, les participantes avaient un bilan clinique tous les 6 mois (s'intéressant aux différents symptômes apparus au cours de l'étude), et une mammographie annuelle. Un électrocardiogramme a été effectué lors de la 3ème et de la 6ème année.
Commencée à l'automne 1997 et prévue pour durer 9 années, cette étude a été interrompue après 6,8 années en moyenne pour le bras traité par estrogènes et après 5,2 ans pour le bras traité par estrogènes et progestérones suite à la publication de
résultats intermédiaires qui montraient une augmentation du nsque d'accident vasculaire cérébral et de cancer du sein invasif.
C) La MWS [58]
L'étude MWS (Million Women Study) est une étude de cohorte prospective qui s'est intéressée à 1,3 millions de femmes âgées de 50 à 64 ans entre 1996 et 2001.
L'objectif principal de cette étude était d'obtenir des informations sur la relation entre la survenue d'un cancer du sein et l'usage de différents types de traitement hormonal substitutif. En effet, avant cette étude, les apparences semblaient montrer que le THS augmentait le risque de cancer du sein, mais les données étaient insuffisantes pour déterminer si les THS estroprogestatifs ou estrogènes seuls avaient les même risques. Dans tout le Royaume Uni, les femmes enregistrées auprès d'un médecin généraliste sont invitées à un dépistage du cancer du sein réalisé par mammographie, environ tous les 3 ans. Cet examen est effectué dans l'un des 100 centres de dépistage du pays. Entre 1996 et 2001, ces femmes ont vu un questionnaire accompagner leur invitation à ce dépistage. Ce questionnaire s'intéressait à leurs antécédents médicaux, leur mode de vie ainsi qu'à la prise d'une contraception orale ou d'un traitement hormonal substitutif, le but étant de pouvoir établir un lien entre l'exposition à un facteur particulier et le risque de développer certaines maladies. On a ainsi pu comparer l'état de santé des femmes sous THS par rapport à celles n'en prenant pas.
Environ trois ans après l'envoi du premier questionnaire, toutes les participantes ont reçu un deuxième questionnaire, visant à connaître l'évolution de leur état de santé et des facteurs pouvant en être corrélés. Certaines femmes ayant développé des pathologies spécifiques comme le cancer du sein ont reçu des compléments de questionnaire, permettant de détailler davantage certains points.
Au total, cette étude a inclus 1 084 110 femmes de moyenne d'âge de 55,9 ans. Environ la moitié des participantes ont utilisé un THS (compositions et voies d'administrations variées, mais comparables aux THS utilisés en Europe) à un moment donné de leur vie, l'autre moitié n'en a jamais reçu.
La variable principalement étudiée étant l'utilisation actuelle ou passée d'un THS, la MWS va donc distinguer différentes catégories de patientes :
- Les utilisatrices actuelles, qui utilisent le THS au début de l'étude et ce depuis quelques années.
- Les utilisatrices passées, qui ont déjà utilisé le THS mais ayant arrêté au moins un an avant le début de l'étude.
- Les femmes n'ayant jamais utilisé de THS (utilisées comme référence pour calculer le risque relatif RR).
Cette étude a confirmé le sur-risque de cancer du sein associé au THS, et ce, chez des femmes européennes, quel que soit le type de THS.
D) Résultats de ces différentes études
1) Par rapport au cancer du sein
Le risque de cancer du sein augmente avec l'âge et la durée d'imprégnation en stéroïdes sexuels (ménopause tardive notamment). La question qui se pose par rapport au THS est de savoir si, au même titre que l'obésité, l'alcool, le risque familial, une densité mammographique élevée ... il peut être considéré comme un facteur de risque dans la survenue d'un cancer du sein, et dans quelle proportion.
a) Résultats WHI [8, 33]
D'après la branche de la WHI qui n'utilise que des estrogènes seuls (donc sur des femmes hysterectomisées), il n'y aurait pas d'augmentation du risque, le RR étant de 0,77 [0,59-1,01] pour une durée de suivi de 6,8 ans et de 0,80 [0,62-1,04] pour une durée de 7,1 ans.
Dans la branche qm associe les estrogènes à un progestatif, les résultats sont totalement différents.
En effet, le RR de développer un cancer invasif du sein sous THS par rapport à un placebo est de 1,24 [ 1,00-1,59], les courbes entre les groupes estroprogestatifs et placebo ne divergeant qu'après les quatre premières années de traitement.
Figure 5. Risque cumulé de survenue de cancer du sein au cours de l'étude WH! (branche estroprogestative) 0.04
o.œ
'Q)Cancer du sein
Estrogène + progestatif Placebo :::S RR= 1,24 (IC 95%: 1,02-1,50)E
P<0,001 :::s u ll.02 Q) :::s C" V>i:i:
0.01 0 1 2 3 4 5Temps (année)
7Si l'on entre plus dans les détails, les femmes n'ayant jamais utilisé de THS avant l'étude, ont des taux de cancers du sein invasifs plus bas pendant les 2 premières années (par rapport groupe placebo), et identiques la 3ème année. La 4ème et la 5ème
année, les taux sont devenus supérieurs dans le groupe THS.
Pour les femmes qui avaient déjà utilisé un THS avant l'étude, le taux de cancer invasif du sein est largement supérieur à partir de la troisième année et au-delà. Cela peut suggérer un effet cumulatif des années d'exposition aux hormones de la ménopause.
\ Il faut aussi noter que les tumeurs mammaires diagnostiquées sous THS sont plus
C\ , \
grandes et ont un stade plus avancé (envahissement ganglionnaire ou métastasé, 25,4% versus 16%), le grade et l'histologie étant les mêmes.Ceci laisse supposer que l'association estrogène/progestatif stimule la croissance des cellules mammaires, ce qui provoque une hyperdensité qui pourrait être responsable du retard de diagnostic des tumeurs.