Optimisation de la désacidification
électrodialytique du jus de canneberge par
les champs électriques pulsés
Mémoire
Stéphanie Pelletier
Maitrise en sciences et technologie des aliments
Maître ès sciences (M. Sc.)
Québec, Canada
Optimisation de la désacidification
électrodialytique du jus de canneberge par
les champs électriques pulsés
Mémoire
Stéphanie Pelletier
Maitrise en sciences et technologie des aliments
Maître ès sciences (M. Sc.)
Sous la direction de :
iv
Résumé
La canneberge est bien reconnue pour les effets bénéfiques qu’elle peut apporter à la santé humaine. Cependant, la consommation de jus de canneberge est limitée car le jus a une grande acidité (teneur élevée en acides organiques) qui cause des effets secondaires tels la diarrhée, des vomissements et ballonnements. Par conséquent l’acidité du jus de canneberge doit être réduite pour améliorer la palatabilité du jus et diminuer les effets secondaires dus à sa consommation. La désacidification des jus, tels le jus de fruit de la passion et le jus de canneberge, par électrodialyse conventionnelle et électrodialyse avec membranes bipolaires par application d’un courant direct et continu s’est montrée efficace en comparaison avec les autres méthodes de désacidification telles les résines échangeuses d’ions et la précipitation au sel de calcium. L’objectif global de cette étude était d’appliquer les champs électriques pulsés (CÉPs) pendant l’électrodialyse avec membranes bipolaires pour désacidifier le jus de canneberge efficacement au niveau énergétique. Le CÉP consiste à appliquer un courant (Ton) et une
pause de courant (Toff) pendant un temps donné consécutivement. Neuf conditions différentes ont été
testées: 10s/2s, 1s/0.1s, 10s/0.1s, 6s/2s, 10s/1s, 2s/2s, 1s/1s, 6s/0.1s, 6s/1s. La désacidification du jus de canneberge a été 15% plus rapide avec les conditions de CÉPs de 1s/1s et 2s/2s en comparaison avec la désacidification à courant direct et continu et les autres combinaisons de pulse-pause. Pour ces 2 conditions, les migrations d’acide citrique et d’acide malique étaient plus rapides, ce qui a engendré un taux plus important de désacidification. Pour préserver l’authenticité du jus de canneberge, l’acide quinique doit être conservé, ce qui est le cas dans cette étude puisque l’acide quinique ne migre pas significativement quelles que soit les conditions testées. De plus, les PACs, les anthocyanes et les polyphénols totaux ont été conservés dans toutes les conditions de CÉP. Pour la première fois, l’efficacité d’appliquer du CÉP dans la désacidification de jus a été démontrée. L’électrodialyse avec membranes bipolaires pourrait être une méthode alternative verte et durable pour désacidifier des jus de fruits tout en préservant leurs caractéristiques organoleptiques et physico-chimiques.
vi
Abstract
Cranberry is well recognized for its beneficial effects on human health, but the consumption of cranberry juice is limited due to its high acidity (high organic acid contents) which is the cause of undesirable side effects such as diarrhea, vomiting and bloating. Therefore, the acidity should be reduced to improve the palatability of the juice and to decrease the side effects. The deacidification of juices, such as citric acid solutions, passion juice and cranberry juice, by conventional electrodialysis and electrodialysis with bipolar membranes (EDBM) with coutinuous direct current (DC), has shown to be very effective in comparison with chemical methods such as calcium salt precipitation or ion-exchange resine. Therefore, the objective of this project is to apply pulsed electric field (PEF) during EDBM to deacidify cranberry juice. The PEF procedure consists of introducing to the process an electric pulse and a pause consecutively for a given time. Nine different pulse/pause combinations were tested: 10s/2s, 1s/0.1s, 10s/0.1s, 6s/2s, 10s/1s, 2s/2s, 1s/1s, 6s/0.1s, 6s/1s. The deacidification of cranberry juice was about 15% faster with PEFs for 1s/1s and 2s/2s conditions in comparison with deacidification with DC and other pulse-pause combinations. In these two conditions, the migration of citric and malic acids was faster, thus producing a more important rate of deacidification. To preserve the authenticity of the juice, the quinic acid must be conserved, which is the case in this study since the quinic acid did not migrated significantly in every conditions. Also, the PACs, anthocyanins and total polyphenols were preserved whatever the PEF conditions. It’s the first time that the efficiency of applying PEF for deacidification of juice was demonstrated. EDBM under PEF would be a green and sustainable alternative process to deacidify fruit juice and to preserve its organoleptic and physicochemical characteristics.
viii
Table des matières
Résumé --- iv
Abstract --- vi
Table des matières --- viii
Table des tableaux --- xii
Table des figures --- xiv
Liste d’abréviations --- xvi
Remerciements --- xix
Avant-Propos --- xxi
Introduction --- 1
Chapitre 1 : Revue de Littérature --- 3
1.1 Canneberge et jus de canneberge --- 5
1.1.1 La canneberge --- 5
1.1.1.1 Informations générales --- 5
1.1.1.2 Composition --- 5
1.1.2 Le jus --- 6
1.1.2.1 Fabrication --- 6
1.1.2.2 Composition et caractéristiques physico-chimiques --- 6
1.2 Composés d’intérêts du jus de canneberge---7
1.2.1 Proanthocyanidines (PACs) --- 8
1.2.1.1 Structures chimiques --- 8
1.2.1.2 Effet Santé/Mécanismes d’action --- 11
1.2.2 Anthocyanes --- 13
1.2.2.1 Structure chimique --- 13
1.2.2.2 Effet Santé/Mécanismes d’action --- 14
1.2.3 Acides Organiques --- 15
1.2.3.1 Structures chimiques --- 15
1.2.3.2 Effet Santé/Mécanismes d’action --- 16
1.3 Méthodes de désacidification---17
1.3.1 Résine échangeuse d’ions --- 17
1.3.2 Précipitation au sel de calcium --- 18
1.3.3 L’électrodialyse (ED) --- 18
ix
1.3.3.2 Membranes d’électrodialyse --- 20
1.3.3.3 Désacidification des jus de fruits par électrodialyse --- 23
1.3.3.4 Limites --- 24
1.3.3.5 Électrodialyse sous champs électriques pulsés --- 27
Chapitre 2 : But, hypothèse et objectifs --- 29
2.1 But et Hypothèse---31
2.2 Objectifs--- ---31
Chapitre 3 : Optimization of Cranberry Juice Deacidification by Electrodialysis with Bipolar Membrane : Impact of Pulsed Electric Field Conditions --- 32
Résumé --- 34
Abstract --- 36
3.1.Introduction --- 38
3.2. Materials and Methods---40
3.2.1 Cranberry Juice and chemicals --- 40
3.2.1.1 Cranberry Juice --- 40
3.2.1.2 Chemicals --- 40
3.2.2 Statistical design --- 41
3.2.3 Electrodialytic configuration and deacidification protocol --- 42
3.2.3.1 Electrodialytic configuration --- 42
3.2.3.2 Deacidification Protocol --- 43
3.2.5 Analyses --- 44
3.2.5.1 Physicochemical characteristics of cranberry juice and acid recovery solutions --- 44
3.2.5.2 Charges transported and relative energy consumption --- 46
3.2.5.3 Statistical analyses --- 47
3.3 Results and Discussion---47
3.3.1 Overall Results --- 47
3.3.2 Conductivity and pH --- 48
3.3.3 Proanthocyanidin and Anthocyanin Content --- 50
3.3.4 Relative energy consumption --- 52
3.3.5 Titratable Acidity and deacidification rate --- 53
3.3.6 Organic Acids Content --- 56
3.4 Conclusion---61
x
Chapitre 4 : Discussion générale, conclusion et perspectives --- 64
4.1 Discussion générale et conclusion---66
4.2 Perspectives---68
xii
Table des tableaux
Tableau 1. Composition de la canneberge ...5
Tableau 2. Teneur en certains composés d'intérêts des canneberges ...6
Tableau 3.Caractéristiques physico-chimiques ...7
Tableau 4.Physico-chemical characteristics of the raw cranberry juice ... 40
Tableau 5. Final deacidification rate and number of charges transported obtained for each pulsed electric field combination conditions and for the direct current control ... 48
Tableau 6. Evolution of a) Proanthocyanidins concentration (ppm) and b) Anthocyanins concent ration (ppm) at the beginning and at the end of treatments for each condition for cranberry juice during the process ... 51
Tableau 7. Relative energy consumption calculated in each condition teste d ... 53
Tableau 8. Deacidification rate of each condition at 2750 C ... 55
Tableau 9. Total polyphenol content before and after each cond ition for the cranberry juice and recovery solution ... 62
xiv
Table des figures
Figure 1. Représentation moléculaire des composés principaux retrouvés dans la canneberge --- 8
Figure 2. La voie générale des flavonoïdes conduisant à la biosynthèse des proanthocyanidines --- 9
Figure 3. Structure des proanthocyanidines possédant un lien de type A --- 10
Figure 4. Structures chimiques des anthocyanes de la canneberge --- 13
Figure 5. Structure chimique de l'acide hydroxycinnamique --- 15
Figure 6. Structure chimique des principaux acides organiqu es du jus de canneberge --- 16
Figure 7. Configuration utilisée au sein d'un module d'électrodialyse pour le Principe de concentration/dilution --- 19
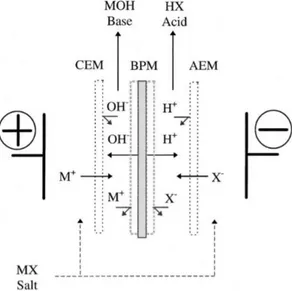
Figure 8. Production d'acide et de base au sein d'une cellule électrodialytique. CEM:membrane échangeuse de cations. BPM: membrane bipolaire. AEM: membrane échangeuse d'anions --- 22
Figure 9. Configuration utilisée pour la désacidification du jus de canneberge --- 24
Figure 10. Phénomène de concentration de polarisation. DBL: couche de diffusion limite. J: Flux. C: profil de la concentration en ion --- 26
Figure 11. Représentation du champ électrique pulsé et d'un courant constant --- 27
Figure 12.Parameters of the statistical program used to determine the condition --- 41
Figure 13. A) Graph representing the surface area covered by the program and B) coefficients results --- 42
Figure 14. Electrodialytic configuration --- 43
Figure 15. Evolution of a) Conductivity and b) pH in cranberry juice and KCl during Deacidification process for the different conditions --- 49
Figure 16. Evolution of titratable acidity in cranberry juice and recovery solution (KCl) during the deacidification process for CC control and conditions 6 (2s/2s) and 7 (1s/1s) --- 54
Figure 17. Evolution of the deacidification rate calculated at 2750 charges as a function of pulse and pause conditions--- 55
Figure 18. Evolution of citric, malic and quinic acids as a function of number of charges transported in cranberry juice and KCl. --- 58
xvi
Liste d’abréviations
MEAs: Membranes échangeuses d’anions MECs: Membranes échangeuses de cations CEPs : Champs électriques pulsés
CP : Concentration de polarisation DMAC : Diméthylacétamide
DR Demineralization rate ED : Électrodialyse
EDMB : Électrodialyse avec membrane bipolaire EDMF : Électrodialyse avec membrane de filtration HDL : «High density lipoprotein» cholesterol
HPLC : Chromatographie en phase liquide à haute performance LDL : «Low density lipoprotein» cholesterol
MBs : Membranes bipolaires MCV : Maladies cardiovasculaires MEIs : Membranes échangeuses d’ions MFs : Membranes de filtration
PACs : Proanthocyanidines
Ton : Temps de pulsation en secondes
xvii
Believe you can and you’re halfway there
Theodore Roosevelt
In the end, it’s not the years in your life that count. It’s the life in your years.
xix
Remerciements
C’est lorsque se termine un chapitre de notre vie que l’on se rend compte de toute la chance qu’on a pu avoir de côtoyer les personnes qui en faisaient partie. Tout d’abord, je tiens à remercier sincèrement mon directeur de maîtrise, Dr. Laurent Bazinet, pour m’avoir accueilli à bras ouverts au sein de son équipe formidable où règne une belle atmosphère de joie, d’amitié et d’entraide. Merci d’avoir éveillé mon intérêt à la recherche lors de votre présence aux cours du baccalauréat en Science et technologies des aliments et de m’avoir offert un projet de recherche intéressant qui a su être stimulant du début à la fin. Votre passion, votre écoute, votre grande disponibilité et tous vos précieux conseils ont rendu mon cheminement durant la maîtrise mémorable.
Je ne peux pas faire des remerciements sans remercier grandement Élodie Serre qui a été là du début à la fin. Merci pour ces heures passées avec moi tant en laboratoire qu’autour d’un café à discuter du projet, à trouver des solutions et les meilleures explications qui soient pour chaque bémol rencontré durant mon projet. Toujours prête à aider et à donner des conseils, tu as grandement contribué à mon projet de maîtrise et ce, en rendant toujours le travail plus amusant et agréable. Ta présence réussissait toujours à dissiper mes inquiétudes. Merci beaucoup.
Un grand merci aussi à Jacinthe Thibodeau qui est toujours présente pour qu’il ne nous manque de rien, pour nous aider dans nos analyses et manipulations, nous soutenir et nous encourager dans nos projets de maîtrise ou de vie. Pétillante et plein de vie, tu contribues grandement à l’atmosphère de l’équipe qui fait de nos projets une expérience si enrichissante à tous les niveaux. Merci à Pascal Dubé et Véronique Richard pour les analyses d’acides organiques et à Diane Gagnon, qui est partout à la fois, pour l’aide apporté au laboratoire du Pavillon Paul-Comtois. Merci à tous les personnes du bureau qui ont été présentes de près ou de loin à tous les jours de ma maîtrise : Véronique, Loïc, Sergey, Dany, Gabrielle, Stéphanie, Alice, Camile, Mathieu, Anne-Violaine, Sagar, Valérie et Shyam.
Un énorme merci à ma famille, dont Marie-Josée, Louis-Philippe et Jean-Marc qui m’ont toujours supporté dans les bons comme dans les moments plus difficiles, et qui m’ont appris qu’il faut travailler et aller jusqu’au bout pour obtenir ce que l’on veut. Un énorme merci à mes amies proches qui sont toujours
xx
là pour me remonter le moral ou me faire pleurer de rire : Kassandra, Katherine T, Marie-Philippe, Monalie, Marie-Élaine, Katherine G, Anne, Raphaëlle, Alexandra G, Alexandra M-R et Sidki.
Enfin, merci aux industriels qui faisait partie du projet MAPAQ Innov’Action pour leur soutien financier tout au long du projet.
xxi
Avant-Propos
Le premier chapitre de ce mémoire est une revue de littérature consacrée à l’état des connaissances actuelles sur le jus de canneberge, l’effet de ses composés sur la santé, les méthodes de désacidification dont l’électrodialyse et les champs électriques pulsés. La problématique associée à ce travail est incluse dans ce chapitre.
Le deuxième chapitre comprend l’hypothèse de recherche et les objectifs qui s’y rattachent ayant pour but de confirmer ou non celle-ci.
Le troisième chapitre de ce mémoire porte sur l’article scientifique rédigé en anglais intitulé «Optimization of Cranberry Juice Deacidification by electrodialysis with Bipolar Membrane : Impact of
Pulsed Electric Field Conditions» soumis pour publication dans la revue «Separation and Purification Technology». Les auteurs sont Stéphanie Pelletier, Élodie Serre, Sergey Mikhaylin et Laurent Bazinet. J’ai fait les expérimentations en laboratoire, les analyses des échantillons, l’interprétation des résultats et la rédaction de ce mémoire en tant qu’auteure principale. Élodie Serre, a participé aux laboratoires lors de ma formation en début de maîtrise et elle m’a guidé tout le long de mon interprétation des résultats. Sergey Mikhaylin a révisé et corrigé l’article. Laurent Bazinet, a révisé et corrigé mon article en plus de superviser les travaux réalisés.
Finalement, le dernier chapitre est consacré à une discussion et conclusion générales et présentent les perspectives de ce projet.
1
Introduction
La canneberge fait partie de la vie des Nord-Américains depuis très longtemps. En effet, les premiers colons et les Amérindiens utilisaient la canneberge comme un aliment, un médicament et pour le troc (Howell, 2012). Le Québec est présentement au 3e rang mondial de la production de canneberges
(Samson, 2013). De plus, entre 1999 et 2009, le Québec a enregistré une croissance moyenne de 6% par année de sa production de canneberges et 200 millions de dollars ont été investis dans les cannebergières depuis 1992 pour transformation (APCQ, 2010a). Le secteur de la transformation des canneberges est aussi un maillon important de la valorisation de ces petits fruits. Effectivement, le Québec transforme les 2/3 de ses canneberges produites et près de 95% des canneberges transformées sont exportées principalement vers les États-Unis et dans 25 autres pays du monde (APCQ, 2010a). La consommation de canneberges fraîches et des produits de la canneberge deviennent de plus en plus populaire de par les effets bénéfiques pour la santé qu’ils apportent.
Le nom scientifique de ce fruit est Vaccinium Macrocarpon et il est connu pour sa grande teneur en polyphénols, dont les anthocyanes et les proanthocyanidines (PACs) (Bazinet, Brianceau, Dubé & Desjardins, 2012). La canneberge ne contient pas seulement des polyphénols, mais aussi des acides organiques à hautes concentrations (acide quinique, acide malique, acide citrique et acide succinique) qui sont responsables en grande partie de l’acidité du jus de canneberge (Bazinet et al., 2012). Effectivement, dans les études cliniques étudiant le jus de canneberge, des taux d’abandon d’environ 30% ont été observés majoritairement dus à un mécontentement vis-à-vis de la palatabilité du jus et également à l’apparition potentielle de troubles intestinaux chez certains sujets (Mcmurdo, Bissett, Price, Phillips, & Crombie, 2005; Takahashi et al., 2013; Vasileiou, Katsargyris, Theocharis, & Giaginis, 2013; Wing, Rumney, Preslicka, & Chung, 2008). Malgré les inconvénients engendrés chez certaines personnes par la consommation du jus de canneberge, plusieurs études démontrent que le jus de canneberge a un impact positif sur la prévention des infections urinaires en réduisant l’adhérence d’Escherichia coli (E.coli) sur les cellules épithéliales vaginales (Raz, Chazan, & Dan, 2004; Vasileiou et al., 2013). Cette prévention des infections urinaires serait due aux PACs contenus dans la canneberge (Howell, 2012; Howell et al., 2005, 2010). Plusieurs autres effets bénéfiques des anthocyanes et PACs sur la santé ont été rapportés : prévention des ulcères gastriques(Wing et al., 2008), diminution des facteurs de risques de maladies
2
cardiovasculaires (MCV) (Blumberg et al., 2013) et diminution de la plaque dentaire (Howell, 2012; Weiss, Lev-Dor, Sharon, & Ofek, 2017).
Pour que les consommateurs puissent mieux apprécier le jus, une méthode de désacidification n’altérant pas les composés phénoliques du jus de canneberge devrait être développée. Plusieurs méthodes existent pour désacidifier les jus, cependant, l’électrodialyse semble être l’option la plus favorable à l’atteinte de ces objectifs. L’électrodialyse (ED), un procédé électromembranaire, est basée sur la migration des molécules chargées à travers des membranes échangeuses d’ions (MEIs) (Mikhaylin, 2015) sous l’effet d’un champs électrique. Ce procédé a déjà été appliqué sur plusieurs produits tels que les jus de fruits de la passion pour leur désacidification, le vin pour sa stabilisation et désacidification et le jus de canneberge pour son enrichissement en anthocyanes (Bazinet et al., 2012; Bazinet & Castaigne, 2011; Husson, Araya-Farias, Gagné & Bazinet, 2013). Serre (Serre, Rozoy, Pedneault, Lacour & Bazinet, 2016) et al. ont récemment testé différentes configurations de membranes pour obtenir une configuration optimale et ainsi désacidifier le jus de canneberge en une étape seulement. De plus, l’électrodialyse est considérée comme un procédé écoresponsable, car aucun solvant n’est utilisé contrairement aux autres procédés de désacidification existants comme les méthodes chimiques ou les résines échangeuses d’ions. Cependant, la principale limite de l’électrodialyse est le colmatage des membranes (Bazinet et al., 2012; Casademont, Sistat, Ruiz, Pourcelly & Bazinet, 2009; Cifuentes-Araya, 2012; Mikhaylin, 2015; Ren, Wang, Zhang, Kang & Shi, 2008) et la concentration de polarisation. Les champs électriques pulsés (CEPs) ont été proposés récemment en électrodialyse pour diminuer le colmatage des membranes et augmenter l’efficacité de l’ED. L’objectif général du projet vise donc à optimiser la configuration électromembranaire récemment développée, par Serre et al. (Serre, Rozoy, et al., 2016), par l’utilisation de CÉP et ainsi permettre une désacidification efficace énergétiquement tout en préservant les composés du jus de canneberge.
3
5
1.1 Canneberge et jus de canneberge
1.1.1 La canneberge
1.1.1.1 Informations générales (APCQ, 2010b)
La canneberge, une plante vivace provenant de l’Amérique du Nord, appartenant à la famille des éricacées, peut vivre plus de 100 ans. Cette plante rampante et ligneuse fleuri en début d’été et produit des fruits qui atteignent la maturité dès la fin du mois de septembre/début octobre. Elle est cultivée sur sols sableux avec une bonne irrigation. De plus, la disponibilité en eau doit être importante pour faciliter la récolte et protéger les cultures lors des périodes de gels. La récolte se fait de mi-septembre à fin octobre. Après la récolte, les champs sont inondés d’eau pour qu’une couche de glace d’environ 6 pouces se forme au-dessus de la plante, ce qui crée une protection pour l’hiver à venir. Cette eau utilisée pour la couche de glace est retirée des champs au printemps et entreposée dans des réservoirs pour être réutilisée plus tard dans la saison.
1.1.1.2 Composition
Le tableau 1 ci-dessous présente la composition globale de la canneberge tandis que le tableau 2 présente la teneur en composés d’intérêts tels que les PACs et anthocyanes.
Tableau 1. Composition de la canneberge Composantes Teneur (%)* Eau 87,13 Protéines 0,39 Lipides 0,13 Glucides 12,2 Fibre 3 Calcium 0,008 *(Santé Canada, 2010)
6
Tableau 2. Teneur en certains composés d'intérêts des canneberges Composé d’intérêts Teneur
Acide ascorbique 13,3 mg/100g*** Acide citrique 2,0-3,0 g /100g** PACs et Anthocyanes 192,3 à 676,4 mg/100g*
*(Viskelis et al., 2009)**(Fruit d’Or, 2015)***(Santé Canada, 2010)
1.1.2 Le jus
Plusieurs effets bénéfiques sont associés à la consommation de canneberges et de ses dérivés. Cependant, les canneberges sont rarement consommées fraîches. En effet, les canneberges sont consommées à 60% sous forme de jus (Blumberg et al., 2013).
1.1.2.1 Fabrication
Les étapes principales de la fabrication sont le pressage, la dépectinisation, la filtration et la pasteurisation. Pour un jus pur, aucun colorant, saveur ou agent de conservation n’est ajouté. Les procédés de transformation ont un effet sur les composés d’intérêts de la canneberge. Par exemple, beaucoup de pertes de composés se fait lors de l’élimination des résidus tels que peau et graines (Blumberg et al., 2013). Les anthocyanes sont les plus affectés avec une perte d’environ 50% par les différents types de transformation (Blumberg et al., 2013). Heureusement, les PACs sont stables à la chaleur et résistent bien à la clarification et à la pasteurisation, mais connaissent des dégradations sous hautes températures (Blumberg et al., 2013).
1.1.2.2 Caractéristiques physico-chimiques
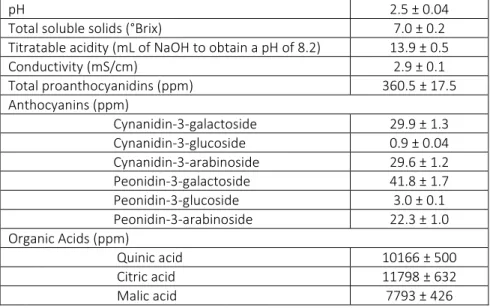
La composition du jus de canneberge peut varier beaucoup d’un cultivar à l’autre. Le tableau 3 ci-dessous présente les caractéristiques physico-chimiques du jus utilisé.
7
Tableau 3.Caractéristiques physico-chimiques
1.2 Composés d’intérêts du jus de canneberge
De plus en plus d’études démontrent une relation entre la consommation de fruits et de légumes et la diminution de la prévalence de certaines maladies tels le cancer et les maladies cardiovasculaires (Graf, Milbury, & Blumberg, 2005; Hu, 2003; Riboli & Norat, 2003). En effet, une consommation accrue de certains composés, et plus particulièrement les vitamines, les minéraux, les fibres, les composés phénoliques, comprenant les flavonoïdes semble responsables de cette relation (Graf et al., 2005; Hu, 2003; Riboli & Norat, 2003). Les flavonoïdes synthétisés par les plantes sont impliqués dans la photosynthèse, dans la protection des plantes contre les rayons ultraviolets et dans la protection contre différents types de pathogènes qui pourraient agresser ces plantes(Graf et al., 2005). Ils sont présents dans les fruits, les légumes, les noix et plus, mais aussi dans le thé, café et vin rouge (Graf et al., 2005). Les 6 classes faisant parties des flavonoïdes sont les flavonoles, les flavones, les flavonones, les flavan-3ols, les isoflavones et les anthocyanidines (Graf et al., 2005). La figure 1 ci-dessous montre les principaux composés retrouvés dans la canneberge. Les PACs et les anthocyanes sont des composés faisant partie de la catégorie des flavonoïdes et ce sont sur ces composés que l’accent sera mis dans cette deuxième partie de la revue de littérature, ainsi que sur les acides organiques qui ont une place importante dans la canneberge. Les effets santé de ces composés seront brièvement discutés.
pH 2,5 ± 0,04
Total soluble solids (°Brix) 7,0 ± 0,2
Acidité titrable (mL de NaOH pour atteindre un pH de 8.2) 13,9 ± 0,5
Conductivité (mS/cm) 2,9 ± 0,1 Proanthocyanidines totaux (ppm) 360,5 ± 17,5 Anthocyanes (ppm) Cynanidine-3-galactoside 29,9 ± 1,3 Cynanidine-3-glucoside 0,9 ± 0,04 Cynanidine-3-arabinoside 29,6 ± 1,2 Peonidine-3-galactoside 41,8 ± 1,7 Peonidine-3-glucoside 3,0 ± 0,1 Peonidine-3-arabinoside 22,3 ± 1,0 Acides Organiques (ppm) Acide quinique 10166 ± 500 Acide citrique 11798 ± 632 Acide malique 7793 ± 426
8
Figure 1. Représentation moléculaire des composés principaux retrouvés da ns la canneberge (Vasileiou et al., 2013)
1.2.1 Proanthocyanidines (PACs)
1.2.1.1 Structures chimiques
Le premier chercheur à découvrir les PACs dans les années 1940 est le Français Jacques Masquelier qui a suggéré que les PACs, initialement nommées Vitamine P, étaient des vitamines
9
provenant des flavonoïdes des plantes (Feghali, Feldman, La, Santos & Grenier, 2012). La figure 2 ci-dessous montre la voie générale de biosynthèse des PACs à partir des flavonoïdes des plantes.
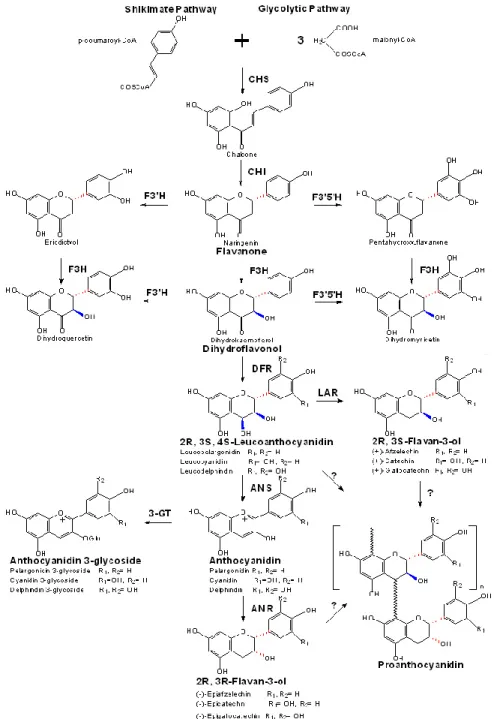
Figure 2. La voie générale des flavonoïdes conduisant à la biosynthèse des proanthocyanidines(He, Pan, Shi, & Duan, 2008)
La structure des PACs est primordiale pour comprendre leur bioactivité. Les PACs de la canneberge forment un groupe de structures chimiques hétérogènes qui sont caractérisées par leur degré de
10
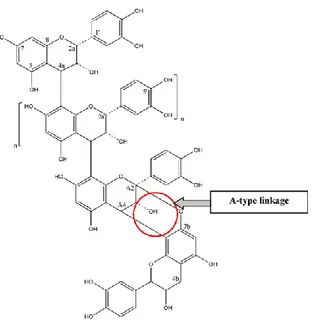
polymérisation, leur type de lien et la nature de leurs unités (Blumberg et al., 2013). Les PACs sont des polymères de flavan-3-ols composés principalement de 2 à 50 sous-unités, comme la catéchine et l’épicatéchine, et sont reliés la plupart du temps par un lien entre C4-C8 ou C4-C6 (Lien de type B) (Feghali et al., 2012). Les PACs ayant un lien de type B se retrouvent dans les aliments communs tels les raisins, les pommes et le chocolat (Feghali et al., 2012). Cependant, pour observer une inhibition bactérienne, les PACs doivent posséder le lien de type A (Figure 3), qui relie O7 et C2 en plus des liens C-C de type B, qui est beaucoup plus rare (Blumberg et al., 2013). Très peu d’aliments contiennent des PACs avec le lien de type A : avocats, cannelle, arachides, airelles, prunes et canneberges (Blumberg et al., 2013).
Figure 3. Structure des proanthocyanidines possédant un lien de type A (Feghali et al., 2012)
Selon Carpenter & al, même si le contenu total en PACs dans les canneberges varie d’une région/cultivar à l’autre, les octamères de catéchines ayant un lien de type A ont été retrouvés dans tous les cultivars de canneberge analysés (Carpenter, Caruso, Tata, Vorsa & Neto, 2014). Donc, même si la concentration des composés phénoliques varie beaucoup, les effets santés associés aux liens de type A restent présents.
11 1.2.1.2 Effet Santé/Mécanismes d’action
Les PACs sont reconnus pour leurs nombreux effets bénéfiques pour la santé humaine tels que la prévention d’infection urinaire, la prévention de maladies cardiovasculaires et propriétés anti-cancéreuses.
L’effet santé principal des PACs est la prévention d’infection bactérienne. La première étape d’une infection bactérienne est l’adhésion de ces bactéries. Les PACs sont en mesure d’inhiber cette adhésion ce qui empêche par conséquent la croissance de ces dernières (Blumberg et al., 2013; Feghali et al., 2012; Howell, 2012). De plus, puisque les PACs ne tuent pas les bactéries comme le font les antibiotiques, il n’y a donc pas de résistance aux PACs qui se crée (Howell, 2012). C’est cette propriété d’anti-adhésion qui est reliée à la prévention des infections urinaires, la prévention d’ulcère gastriques et la prévention de la plaque dentaire (Blumberg et al., 2013; Feghali et al., 2012; Howell, 2012; Vasileiou et al., 2013). Effectivement, on a longtemps cru que le mécanisme d’action de la prévention des infections urinaires était dû à l’acidité du jus de canneberge (Howell, 2012; Lavigne, Bourg, Botto & Sotto, 2007). De plus, les extraits de canneberge qui contiennent des PACs préviennent l’adhésion de la bactérie Helicobacter pylori (H.pylori) qui est responsable des ulcères gastriques (Feghali et al., 2012; Howell, 2012). Dans le même ordre d’idée, les PACs préviennent aussi l’adhésion des biofilms responsables de la plaque dentaire (Bodet et al., 2008; Feghali et al., 2012; Howell, 2012). Tout comme les bactéries, les premières étapes de formation de biofilms sont la coagrégation et l’adhésion des bactéries aux dents. Donc, le même extrait de PACs inhibe l’adhésion de Streptoccocus sobrinus, inhibe la glycosyltransférase impliquée dans la formation de biofilms et aide à la désorption des bactéries de leur biofilm (Howell, 2012).
Le système cardiovasculaire est influencé par des mécanismes complexes, dont l’inflammation et le stress oxydatif (Blumberg et al., 2013; Feghali et al., 2012; Howell, 2012) . Les «low density lipoprotein» (LDL) cholestérols sont aussi grandement impliquées dans les maladies cardiovasculaires(MCV) (Blumberg et al., 2013; Howell, 2012). Puisque les canneberges ont une grande teneur en anthocyanes et en PACs , qui ont des propriétés anti-inflammatoires et antioxydantes, ceux-ci peuvent aider les consommateurs à avoir une meilleure santé cardiovasculaire (Howell, 2012). Effectivement, ces composés peuvent prévenir les MCV en inhibant l’expression du récepteur des LDLs, en inhibant l’oxydation des LDL cholestérols et en augmentant l’absorption du cholestérol par l’augmentation des «high density lipoprotein (HDL)
12
cholesterols (Blumberg et al., 2013; Howell, 2012). La canneberge a donc un grand potentiel sur le marché puisque les MCVs sont la deuxième cause de décès chez les canadiens en 2009 et ont une énorme incidence économique au Canada ayant coûté plus de 22.2 millards de dollars en l’an 2000 (Agence de la santé publique du Canada (Gouvernement du Canada), 2016).
Finalement, les PACs sont aussi associés à des propriétés anti-cancéreuses. Le développement d’un cancer est un long processus qui peut prendre des années avant qu’il puisse être diagnostiqué (Société canadienne du cancer, 2016). Un grand nombre de cellules de notre corps est programmé pour vivre pendant une période fixe (Société canadienne du cancer, 2016). Une fois cette période terminée, les cellules meurent par un processus automatique de mort cellulaire nommé apoptose (Société canadienne du cancer, 2016). Ce phénomène est un processus qui aide le corps à rester en santé (Société canadienne du cancer, 2016). Cependant, ce renouvellement des cellules peut subir quelques défectuosités. En effet, des mutations génétiques, qui peuvent engendrer un bon nombre de cancers, peuvent survenir à un moment ou à un autre (Société canadienne du cancer, 2016). Normalement, chaque cellule est capable de reconnaître ces mutations pour les réparer avant qu’elles ne se multiplient ou pour engendrer le processus de mort cellulaire, l’apoptose. Lorsque cette capacité à la reconnaissance fait défaut, les cellules deviennent anormales et c’est la première étape de développement de cancer qui débute (Société canadienne du cancer, 2016). Plusieurs facteurs peuvent entraîner ce défaut de reconnaissance tel que produits chimiques, tabac, radiations et autre. La promotion (lésions
additionnelles et répétées : les cellules deviennent cancéreuses), la progression
(doublement/reproduction des cellules cancéreuses : les cellules cancéreuses forment une tumeur) et les métastases (envahissement des tissus avoisinants ou déplacement dans le sang et système lymphatique) sont les étapes suivantes du développement du cancer (Société canadienne du cancer, 2016). Les PACs ont un influence sur plusieurs facteurs du mécanisme de carcinogénèse (Howell, 2012; Neto, 2011). Entre autres, elles peuvent 1) inhiber l’oxydation, 2) induire l’apoptose 3) être antiprolifique, et 4) réduire l’invasion par les métastases (Howell, 2012; Neto, 2011). Par contre, la plupart des recherches a été faite
in-vitro sur des cellules cancéreuses puisqu’il est difficile de transférer les études in-vitro en études
13
1.2.2 Anthocyanes
1.2.2.1 Structure chimique
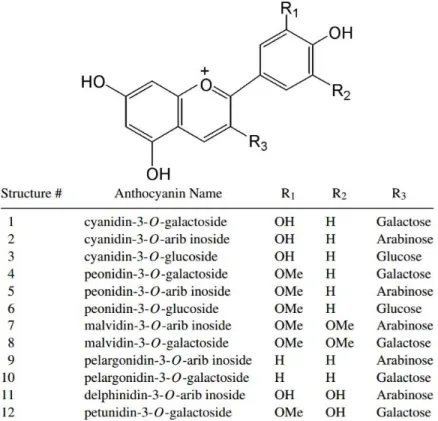
Les anthocyanes, qui sont des composés pouvant contenir dans leurs structures une fraction glycolysée, se retrouvent en très grande quantité dans les canneberges et contribuent en grande partie à la couleur de ce fruit et de ses produits dérivés (Blumberg et al., 2013). En fait, la canneberge d’Amérique est un des rares aliments à contenir les six aglycones de la famille des anthocyanes : cyanidine, peonidine, malvidine, pelargonidine, delphinidine et petunidine (Blumberg et al., 2013) (Figure 4). Les anthocyanes détectées en plus grande quantité sont les 3-O-galactoside et 3-O-arabinoside de cyanidine et peonidine (Blumberg et al., 2013). La quantité d’anthocyane dans la canneberge augmente avec le degré de maturité du fruit et cette quantité dépend aussi du cultivar.
14 1.2.2.2 Effet Santé/Mécanismes d’action
Pour les anthocyanes, l’effet santé principal mis en évidence dans le plus grand nombre d’études scientifiques est une action anti-cancer. Seeram et al. (Seeram, Adams, Hardy, & Heber, 2004) ont démontré un effet antiprolifique sur les cellules de tumeur lorsqu’il y a combinaison dans un même extrait avec des anthocyanes, des proanthocyanidines et des flavonoles. Effectivement, selon eux, il y a un effet synergique assez important entre ces composés comparativement aux études faite sur ces composés séparément (Seeram et al., 2004). Quelques mécanismes d’action des anthocyanes ont été soulevés dans les dernières années. Les mécanismes évoqués et appuyés par des résultats d’études in vitro sont l’induction de l’apoptose cellulaire, la diminution de l’invasion des métastases qui seraient en fait le résultat de 1) l’inhibition de la métalloprotéinase matricielle, 2) la diminution de l’expression et de l’activité de l’ornithine décarboxylase (ODC), 3) la réduction du stress oxydatif grâce aux activités antioxydante et 4) la diminution du processus d’inflammation, incluant l’activité de la cyclooxygenase-2 (COX-2) (Neto, 2011). De plus, les anthocyanes limiteraient l’angiogénèse, mais ceci n’a pas été testé en utilisant seulement les anthocyanes de la canneberge (Feghali et al., 2012; Howell, 2012; Neto, 2011). Selon une autre étude, les anthocyanes et les composés phénoliques non polaires présenteraient les plus grandes activités neutralisantes des radicaux libres (Caillet, Côté, Doyon, Sylvain, & Lacroix, 2011). De plus, des extraits d’anthocyanes purifiés démontrent que ce sont les plus efficaces à inhiber la peroxydation des lipides comparativement aux autres extraits de canneberge présent dans l’étude tels que des composés phénoliques non polaires et des composés phénoliques soluble dans l’eau (Caillet et al., 2011). De plus, les anthocyanes et les acides hydroxycinnamiques (Figure 5) isolés des canneberges réduiraient la réponse inflammatoire au niveau des cellules endothéliales microvasculaires en limitant la régulation des cytokines et l’adhésion des molécules (Vasileiou et al., 2013). Finalement, tous comme les PACs, les anthocyanes seraient responsables de la diminution des LDL cholestérol, ce qui impliquerait une meilleure santé cardiovasculaire (Blumberg et al., 2013; Howell, 2012).
15
Figure 5. Structure chimique de l'acide hydroxycinnamique
1.2.3 Acides Organiques
Le jus de canneberge contient aussi des acides organiques à haute concentrations (acide quinique, acide malique, acide citrique et acide succinique qui sont responsables en grande partie de son acidité (Bazinet et al., 2012).
1.2.3.1 Structures chimiques
Les acides organiques du jus de canneberges responsables de la haute acidité titrable sont l’acide citrique (PM=192.12 g/mol, pKa1 = 3.13, pKa2 = 4.76, pKa3 = 6.39), l’acide malique (PM=134.09g/mol, pKa1 = 3.46, pKa2 = 5.05), l’acide succinique (PM=118.09 g/mol, pKa1 = 4.03, pKa2 = 5.28) et l’acide quinique (PM=192.17 g/mol, pKa = 3.46)(Serre, Rozoy, et al., 2016) (Figure 6). Par contre, l’acide quinique est le deuxième plus important en concentration dans le jus de canneberge et sert de référence pour la détection d’adultération des jus (Serre, Rozoy, et al., 2016). Cet acide est présent dans plusieurs autres fruits tels que le citron, la pomme, la pêche, la tomate, etc. (Serre, Rozoy, et al., 2016).
16
Figure 6. Structure chimique des principaux acides organiques du jus de canneberge a) Acide quinique B) Acide Malique C) Acide Citrique D) Acide Succinique
1.2.3.2 Effet Santé/Mécanismes d’action
Les informations concernant les effets sur la santé humaine des acides organiques ne sont pas aussi abondantes que pour les PACs. Effectivement, dans plusieurs études cliniques lors de la consommation prolongée de jus de canneberge pur, il a été noté des taux d’abandons d’environ 30% dû à des effets secondaires (nausée, vomissement) (Mcmurdo et al., 2005; Takahashi et al., 2013; Vasileiou et al., 2013). Les effets secondaires sont causés par la grande acidité titrable et le pH faible du jus de canneberge. Selon Lacombe et al. (Lacombe, Wu, Tyler, & Edwards, 2010), les acides organiques présents dans la canneberge joueraient un rôle antimicrobien sur E.coli O157 :H7. Cependant, cet effet antimicrobien ne serait pas lié directement aux acides organiques, mais au changement de pH que ces acides organiques peuvent engendrer au sein des microorganismes (MO). En fait, les acides organiques auraient un effet sur les MOs car ils diminueraient le pH de l’environnement des MOs et le pH intracellulaire de ceux-ci (Lacombe et al., 2010). Ces deux diminutions de pH pourraient ainsi réduire le gradient chimique nécessaire, la force motrice liée au transport des protons : ce mécanisme est à la base de la survie des Mos (Lacombe et al., 2010). Le deuxième effet des acides organiques sur les microorganismes serait l’accumulation des acides organiques chargés négativement sur la membrane cellulaire, ce qui causerait une augmentation du stress osmotique (Lacombe et al., 2010). Finalement, il serait possible que la présence des acides organiques dans le jus, principalement l’acide malique, l’acide quinique et l’acide citrique, aiderait la stabilisation et la protection des anthocyanes de la canneberge, qui eux, auraient des propriétés anti-cancer décrites dans la prochaine section (Caillet et al., 2011).
17
1.3 Méthodes de désacidification
La consommation de canneberge est en hausse depuis plusieurs années (Neto, 2011) dû notamment aux nombreux effets bénéfiques démontrés de la canneberge sur la santé, et à l’attrait croissant des consommateurs vers des produits ayant une valeur-ajouté/effet santé. Malgré ces effets santé attrayants, la consommation de jus de canneberge reste limitée puisqu’il induit des effets secondaires (nausées, vomissements, diarrhées) et son goût est amer et acide. L’industrie de la transformation de la canneberge est consciente de cette problématique et cherche à rendre le jus de canneberge plus accessible aux consommateurs et se tournent aujourd’hui vers la désacidification du jus brut. Plusieurs méthodes sont disponibles afin désacidifier les boissons acides, notamment les résines échangeuses d’ions, l’ajout de sel et l’électrodialyse. Cette dernière se place comme un procédé écoresponsable. En effet, l’électricité qui est utilisée comme force motrice, permettant donc la migration des acides organiques est produites de manières dite « vert » au Québec. De plus, l’absence de produits chimiques utilisés durant la séparation, la capacité d’adaptation à la production à très grande échelle sont autant d’atouts rendant l’intégration de l’électrodialyse plus facile dans une ligne de production industrielle.
1.3.1 Résine échangeuse d’ions
La méthode de désacidification du jus par résine échangeuse d’ions consiste à mettre en contact le jus à désacidifier avec une résine absorbante, afin que les acides organiques viennent remplacer les ions présents sur la résine et se retrouvant ainsi fixés à cette dernière. À la fin du procédé, les acides organiques seront élués à l’aide d’un solvant et ne seront donc pas valorisables. Pour que les résines restent efficaces, il est nécessaire de régénérer après un certain temps les ions initialement présents sur la résine , à l’aide d’effluent tel que l’hydroxyde de sodium (Vera, Dornier, Ruales, Vaillant, & Reynes, 2003). Les résines échangeuses d’anions désacidifie le jus de citron à hauteur de 30 à 60% selon la résine utilisée (Johnson & Chandler, 1985). Le même résultat a été observé pour le jus d’orange. Une étude menée par Couture et Rouseff démontre que l’acidité moyenne du jus d’orange est réduit de 57 à 87% en utilisant des résines échangeuses d’anions neutres ou à base faible (Couture & Rouseff, 1992). Malgré le fait que cette méthode présente un bon taux de désacidification, elle présente des désavantages tels
18
que des changements au niveau des caractéristiques organoleptiques et une grande production effluents produits lors de la régénération des résines échangeuses d’ions (Vera, Ruales, et al., 2003).
1.3.2 Précipitation au sel de calcium
Cette méthode est utilisée pour désacidifier du jus de fruit de la passion et le vin. Les réactifs qui pouvant être utilisé sont le CaCO3 (équation 1) et le Ca(OH)2 (équation 2). Les réactions de désacidification
qui se produisent dans le jus et qui permettent de calculer la quantité de réactifs à ajouter sont les suivantes :
Le jus à désacidifier est ajouté jusqu’à ce que le pH de 4.5 soit atteint (Vera, Ruales, et al., 2003). Le pH ne doit pas descendre plus bas car le citrate de calcium devient soluble à bas pH (Vera, Ruales, et al., 2003). Après 24h de repos à 4°C, le jus est filtré et mélangé avec un jus clarifié pour obtenir un pH de 4 au produit final (Vera, Ruales, et al., 2003). Cependant, cette méthode n’est pas acceptée dans tous les pays dû à l’ajout de molécule tel le calcium. De plus, la concentration en calcium du produit final est plus élevée qu’au début, ce qui pourrait créer un problème de re-précipitation lors de l’ajout du jus clarifié au jus désacidifié en plus d’une perte de jus d’environ 19%, observable (Vera, Ruales, et al., 2003). Finalement, cette méthode va entrainer des modifications organoleptiques du jus en lui conférant un goût de « craie ».
1.3.3 L’électrodialyse (ED)
1.3.3.1 Principe de l’électrodialyse
L’électrodialyse est une méthode basée sur 2 procédés: la dialyse et l’électrolyse. La dialyse, proposée par Nollet (Nollet, 1752), consiste au départ en la séparation de l’alcool et de l’eau par un gradient de concentration (Mikhaylin, 2015). L’électrolyse, proposée par Nicholson (Nicholson, Carliebe, & Al., 1800), est un procédé conçu pour la décomposition de l’eau à l’aide d’un courant électrique appliqué à un système contenant des solutions ioniques et 2 électrodes qui permettent la dissociation des molécules
19
d’eau (Mikhaylin, 2015). L’électrodialyse est donc un procédé basé sur la migration d’espèces ioniques sous l’influence d’un champ électrique à travers différents types de membranes (Bazinet & Castaigne, 2011; Mikhaylin, 2015)
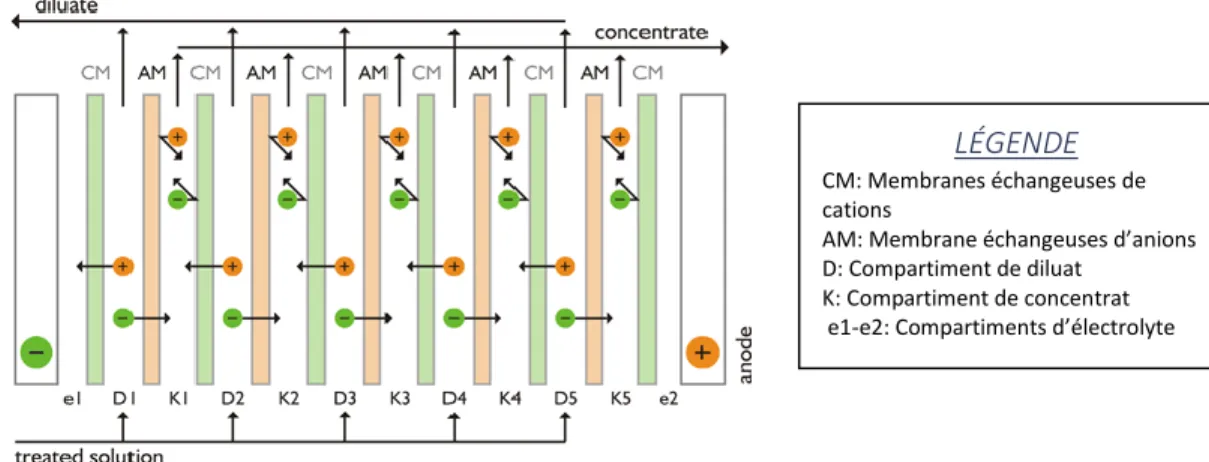
Le principal avantage de ce procédé est que la nature chimique des espèces dans les solutions n’est pas modifiée puisqu’aucun solvant n’est utilisé et le seul impact du champ électrique est d’assurer le transfert des espèces chargées ( Bazinet & Castaigne, 2011). Par exemple, lors de la déminéralisation de l’eau, le courant appliqué permet aux sels en solutions aqueuses de se dissocier en ions (Figure 7). Ces ions sont attirés par la cathode, si ce sont des cations, et par l’anode, si ce sont des anions. Lorsque les membranes échangeuses de cations et d’anions sont bien placées, les cations et les anions peuvent migrés à travers une membrane échangeuse de cation et membrane échangeuse d’anions respectivement (Bazinet & Castaigne, 2011; MEGA, 2006). Tous les ions se retrouvent donc dans le même compartiment nommé le compartiment de concentrat, tandis que la concentration de l’eau en sels est diluée, l’eau déminéralisée se retrouvant au final dans le compartiment de diluat ( Bazinet & Castaigne, 2011; MEGA, 2006).
Figure 7. Configuration utilisée au sein d'un module d'électrodialyse pour le Principe de concentration/dilution (MEGA, 2006)
L’efficacité énergétique du procédé d’électrodialyse dépend de plusieurs facteurs : la densité du courant électrique, la surface totale des membranes, l’épaisseur des cadres séparateurs, la conductivité
LÉGENDE CM: Membranes échangeuses de cations
AM: Membrane échangeuses d’anions D: Compartiment de diluat
K: Compartiment de concentrat e1-e2: Compartiments d’électrolyte
20
électrique du produit traité et finalement, les caractéristiques intrinsèques des membranes qui sont le cœur du procédé (résistance, perméabilité sélective aux ions, etc.) ( Bazinet & Castaigne, 2011).
1.3.3.2 Membranes d’électrodialyse
Trois types de membranes peuvent être utilisés en électrodialyse : les membranes monopolaires, les membranes bipolaires (MBs) et les membranes de filtration (MFs).
1.3.3.2.1 LES MEMBRANES MONOPOLAIRES ET LEURS APPLICATIONS
Les membranes monopolaires sont des membranes échangeuses d’ions qui sont très utilisées dans le procédé d’électrodialyse. Elles sont appelées monopolaires, car elles ne laissent passer qu’un seul un type d’ion : les anions (Membranes échangeuses d’anions (MEA)) ou les cations (Membranes échangeuses de cations (MEC))( Bazinet & Castaigne, 2011). Elles sont génériquement appelées membrane échangeuse d’ions (MEIs). Voici les principales propriétés de ce type de membrane (Mikhaylin, 2015) :
Haute permsélectivité, c’est-à-dire que ce type de membrane est très perméable aux contres-ions ou aux contres-ions spécifiques.
Haute perméabilité sous l’effet d’une force motrice tel qu’un gradient de potentiel.
Bonne stabilité chimique (stable pour une large gamme de pH et stable lorsqu’il y a présence d’agents oxydants)
Bonne stabilité mécanique (stable aux actions mécaniques et à un faible degré de gonflement et de rétrécissement lorsqu’il y a une transition d’une solution ionique diluée à concentrée.
Uniformité et planéité sur toute l’aire de la membrane Bonne durabilité
Coût raisonnable
La principale différence entre les MEAs et MECs est la charge des groupes chargés fixés à la membrane. En effet, les MECs sont chargés négativement, ce qui a pour conséquence de laisser passer les cations et de repousser les anions. Les groupes chargés fixés sur les MECs sont principalement sous forme de –PO32-, -SO3-, -PO3H-, etc (Bazinet & Castaigne, 2011; Mikhaylin, 2015). Pour les MEAs, le principe
21
de laisser passer les anions et de repousser les cations Les principaux groupes fixés sur les MEAs sont – NH3+, -NR3+, -PR3+, -NRH2+, etc (Bazinet & Castaigne, 2011; Mikhaylin, 2015). Il existe plusieurs applications
industrielles de l’électrodialyse avec membranes monopolaires comme par exemple, la déminéralisation de l’eau de mer, qui est la principale utilisation, le traitement des eaux usées provenant des industries métallurgiques, la concentration d’acide organiques, la déminéralisation de solutions salées contenant des substances organiques telles l’acide lactique et la glutamine, le traitement des déchets, l’utilisation en industrie alimentaire telle la déminéralisation du lactosérum (Bazinet, 2016; Huang, Xu, Zhang, Xue, & Chen, 2007; Mikhaylin, 2015; Nagarale, Gohil, & Shahi, 2006; Strathmann, 2010).
1.3.3.2.2 LES MEMBRANES BIPOLAIRES ET LEURS APPLICATIONS
Les membranes bipolaires (MBs), quant à elles, sont composées de trois couches : une couche cationique, une couche anionique et finalement une couche hydrophile à leur jonction (Interface hydrophile). Sous l’effet d’un champ électrique, les MBs vont permettre la génération de H+ et de OH- par
dissociation des molécules d’eau, au niveau de la jonction hydrophile entre les 2 couches (Mikhaylin, 2015). Les membranes bipolaires doivent respecter plusieurs exigences pour qu’elles soient utilisées en industrie alimentaire : faible résistance électrique à une densité de courant élevée, haut taux de dissociation de l’eau, bonne stabilité chimique et thermique en présence d’acides et de bases fortes, grande sélectivité d’ion et faible transport des co-ions (Bazinet, Lamarche, & Ippersiel, 1998). Dépendamment de la méthode de fabrication, la plupart de ses exigences peuvent être respectées (Bazinet et al., 1998; Mikhaylin, 2015).
Il y a aussi plusieurs applications industrielles de l’électrodialyse avec membranes bipolaires, par exemple, la production d’acides organiques, la production d’agents nettoyants, la valorisation des déchets et de nombreuses applications potentielles en industrie alimentaire telle la précipitation des caséines couplé à un module d’ultrafiltration afin d’éviter le colmatage, et l’électroacidification pour la séparations des protéines de soya et l’inhibition des réactions enzymatiques du jus de pomme (Bazinet et al., 1997; Bazinet & Castaigne, 2011; Huang & Xu, 2006; Mikhaylin, 2015). La première utilisation des membranes bipolaires a été pour la production de chlore et de soude (Bazinet et al., 1998). En appliquant le procédé d’électrodialyse avec MBs, une solution aqueuse salée comme le NaCl peut se transformer en base comme le NaOH et en acide comme le HCl (Bazinet et al., 1998) (Figure 8). De plus, Lam Quoc & al (Lam
22
Quoc et al., 2006) ont démontré qu’il était possible de rendre le jus de pomme non clarifié plus stable après une acidification par l’électrodialyse avec membrane bipolaire et anionique combinée à un traitement de chaleur à intensité moyenne. Dans cette application, le jus a été placé dans le compartiment qui recevait les H+ de la membrane bipolaire en plus d’avoir une recirculation du côté des OH- pour faire
en sorte que le pH puisse monter jusqu’au pH initial (Lam Quoc et al., 2006).
Figure 8. Production d'acide et de base au sein d'une cellule électrodialytique. CEM:membrane échangeuse de cations. BPM: membrane bipolaire. AEM: membrane échangeuse d'anions (Bazinet et
al., 1998)
1.3.3.2.3 LES MEMBRANES DE FILTRATION ET LEURS APPLICATIONS
Les membranes de filtration, quant à elles, créent une sélection selon le poids moléculaire des composés présents dans les solutions. Plusieurs types de MFs (Microfiltration, ultrafiltration, nanofiltration) peuvent être intégrés dans une cellule d’électrodialyse à la place d’une MEI (Bazinet & Castaigne, 2011). En effet, selon la membrane, les composés ayant un poids moléculaire plus élevé que le seuil de coupure de la membrane sont retenus. Seuls les composés chargés ayant un poids moléculaire plus faible que le seuil de coupure vont traverser la membrane, ce qui crée une séparation des composés (Bazinet & Castaigne, 2011). L’électrodialyse avec membrane de filtration (EDMF) a été développée et brevetée par Bazinet et al. (Bazinet, Amiot, Poulin, Labbé, & Tremblay, 2005). Récemment, ce procédé a
23
été utilisé, entre autre, pour le fractionnement de peptides bioactifs, l’enrichissement en anthocyanes du jus de canneberge, retirer les métaux lourds provenant des déchets aqueux industriels et plus (Barakat, 2011; Husson et al., 2013; Roblet et al., 2016).
1.3.3.3 Désacidification des jus de fruits par électrodialyse
Plusieurs études portent sur la désacidification par électrodialyse de jus de fruits tels le jus de fruit de la passion. Une des premières études sur la désacidification par électrodialyse de jus consiste en la désacidification de solutions d’acide citrique par Voss en 1986 (Voss, 1986) pour que son étude soit éventuellement appliqué à des jus d’agrumes. Cet auteur a testé trois configurations différentes dont une avec membrane bipolaire. Sa configuration avec MEAs et MECs était celle avec la meilleure efficacité de courant, mais du citrate de sodium est récupéré à la fin en plus d’utiliser de l’hydroxyde de sodium (Voss, 1986). La configuration avec membrane bipolaire avec une efficacité de courant moindre n’a pas créer d’hydroxyde de sodium et de l’acide citrique est récupéré à la fin (Voss, 1986).
Le jus de fruits de la passion a fait l’objet d’une étude en 2002 par Calle et al. visant à tester différentes méthodes de désacidification : résine échangeuse d’ion, précipitation de sel de calcium, ED conventionnelle et EDMB (Calle et al., 2002). Selon les résultats de l’étude, la méthode avec la précipitation au sel de calcium et l’EDMB sont les méthodes qui ont donné de meilleurs résultats au niveau physicochimique et sensoriel (Calle et al., 2002). Dans une autre étude portant sur le jus de fruit de la passion, le jus était soumis à des prétraitements avant la désacidification par ED et EDMB (Vera, Calle et al., 2009) et le résultat final consistait seulement à augmenter le pH des jus.
Pour désacidifier le jus de canneberge, il faut penser à augmenter le pH, mais il faut surtout penser à diminuer la quantité d’acides organiques puisque ce sont ces acides organiques qui sont responsable de l’acidité du jus de canneberge. Un premier essai de désacidification du jus de canneberge a été fait par Rozoy et al (Rozoy, Boudesocque, & Bazinet, 2015). Le procédé effectué se faisait en deux étapes distinctes (deux procédés d’électrodialyse). La première étape consistait à diminuer la quantité d’acides dans le jus et la deuxième étape était de réduire le pH jusqu’à sa valeur initiale pour ne pas affecter les propriétés des jus (Rozoy et al., 2015).
24
Serre et al. ont testé récemment l’électrodialyse du jus de canneberge en une seule étape avec plusieurs configurations et différents types de membranes (Serre, Rozoy, et al., 2016). De plus, le jus a été placé dans le compartiment recevant les OH- produit par la membrane bipolaire. L’apport des OH- dans
le compartiment du jus sont essentiels pour la migration des acides organiques à travers la membrane échangeuse d’ions. En fait, cela va jouer l’équilibre chimique des acides organiques afin de produire des formes anioniques d’acides organiques (Serre, Rozoy, et al., 2016). La meilleure configuration était la suivante (Figure 8):
Figure 9. Configuration utilisée pour la désacidification du jus de canneberge
La Figure 9 ci-dessus démontre les réactions qui se produisent lors de l’électrodialyse. En effet, sous l’effet du courant, les acides organiques migrent dans la solution de récupération, (solution de KCL dans le compartiment C1), à travers la membrane anionique(AEM), alors que le jus reçoit les OH- créés
par la membrane bipolaire (MB). Les résultats ont démontré que cette configuration d’électrodialyse permet de désacidifier le jus à 40% après trois heures et à 80% après 6 heures (Serre, Rozoy, et al., 2016). Aussi, cette configuration a permis d’apporter une sélectivité quant à la migration des acides organiques. Les acides organiques qui migrent le plus rapidement sont l’acide malique et l’acide citrique. L’acide quinique commence à migrer légèrement après 3 heures de traitements. Il serait important pour l’optimisation de cette configuration de porter une attention particulière à la migration de cet acide organique puisque l’acide quinique doit demeurer le plus possible dans le jus. En effet, selon Shui et Leong (Shui & Leong, 2002) et Flores, Hellin & al (Flores, Hellín, & Fenoll, 2012), l’acide quinique est
25
caractéristique du jus de canneberge et c’est cet acide qui permet de détecter si le jus a été altérer ou non (Flores et al., 2012; Shui & Leong, 2002).
Serre et al. (2016) ont de plus récemment démontré que la désacidification du jus de canneberge pouvait potentiellement créer une diminution de l’inflammation intestinale comparativement au jus de canneberge non désacidifié (Serre, Boutin, et al., 2016). En effet, des essais in-vitro ont été effectués sur des cellules Caco-2 pour mesurer l’intégrité des cellules après consommation de jus de canneberge désacidifié à différents pourcentages (Simulation de la digestion en 3 étapes : orale, gastrique et intestinale) (Serre, Boutin, et al., 2016). Selon cette étude, il faut une désacidification de 37% pour avoir une augmentation de l’intégrité des cellules Caco-2 de 56% par rapport au jus brut (Serre, Boutin, et al., 2016). En ayant une telle augmentation de l’intégrité des cellules, le jus de canneberge désacidifié a donc un grand potentiel sur le marché de par la diminution des effets secondaires qui pourraient être observés chez les consommateurs et de par son goût amélioré.
1.3.3.4 Limites
La limite la plus importante de l’électrodialyse est la formation de la concentration de polarisation (CP). La CP est formée lorsque la concentration en ions d’un côté de la membrane est élevée dû à leur transport qui vient de s’effectuer au travers la membrane et lorsque la concentration en ions de l’autre côté de la membrane diminue suite au transport des ions à travers la membrane pour changer de compartiment. D’un côté de la membrane, le compartiment s’appauvrit en ions, tandis que l’autre s’enrichit en ions (Figure 10) (Mikhaylin, 2015; Mishchuk, Verbich, & Gonzales-Caballero, 2001). La différence en concentration de chaque côté crée ainsi une couche de diffusion limite. Dans cette couche, le moyen de transport est la diffusion, ce qui diminue les performances du procédé au augmentant la résistance du système (Mikhaylin, 2015; Mishchuk et al., 2001). De plus, cela fait augmenter la consommation énergétique et peut créer de la sédimentation aux surfaces des membranes lorsque les solutions sont sensibles aux changements de pH.
26
Figure 10. Phénomène de concentration de polarisation. DBL: couche de diffusion limite. J: Flux. C: profil de la concentration en ion
Une deuxième limite à ne pas négliger est le colmatage à la surface des membranes ou à l’intérieur de celle-ci. Le colmatage engendre des conséquences tels que l’augmentation de la résistance électrique du système, l’altération des membranes, une diminution de la permsélectivité et une augmentation des coûts reliés au procédé d’ED jusqu’à 47% par les nettoyages et remplacements de membranes plus fréquents (Mikhaylin, 2015). Plusieurs possibilités existent pour contrer le phénomène de colmatage et par le fait même, augmenter la performance du procédé d’électrodialyse : 1) modifications des membranes, 2) appliquer des procédés de nettoyage avec différents agents nettoyants, 3) appliquer des prétraitements aux membranes, 4) actions mécaniques aux membranes et 5) changer le régime du procédé d’électrodialyse par le contrôle des conditions hydrodynamique, l’application d’une polarité inverse dans l’électrodialyse, l’application de champs électriques pulsés ou l’application d’un régime au-delà du courant limite (Mikhaylin, 2015).
Que ce soit pour la CP ou le colmatage, plusieurs études prometteuses ont été faites avec les champs électriques pulsés pour diminuer ces deux problématiques.
27 1.3.3.5 Électrodialyse sous champs électriques pulsés
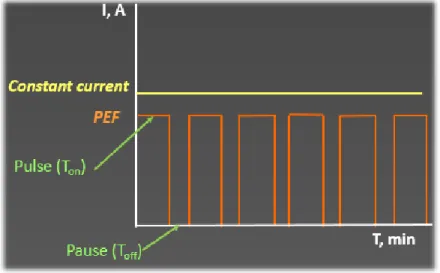
1.3.3.5.1 DÉFINITION
Le champ électrique pulsé (CÉP) consiste à appliquer un courant (pulsation) pendant une durée donnée (Ton) suivi d’un arrêt du courant (une pause) pendant une durée donnée (Toff) de manière
consécutive pendant un temps donné. La figure 11 ci-dessous représente bien la différence entre le courant constant et le CÉP.
Figure 11. Représentation du champ électrique pulsé et d'un courant constant (Mikhaylin, 2015)
Les avantages du CÉP sont les suivants (Mikhaylin, 2015):
Réduction du colmatage
Augmente l’efficacité du courant par la diminution des phénomènes de polarisation de la concentration qui engendre une diminution de la dissociation de l’eau, et augmente l’efficacité de l’électrodialyse.
Équipements simples, ce qui rend l’intégration aux systèmes existants très facile.
1.3.3.5.2 UTILISATIONS RÉCENTES
La plupart des études sur les CÉP avaient pour but de réduire la concentration de polarisation ou les différents types de colmatage. Casademont (2009) a utilisé des membranes échangeuses d’ions et a prouvé qu’il est possible d’augmenter le taux de déminéralisation de solutions modèles laitières de 25%
28
avec le champ électrique pulsé (Casademont et al., 2009). De plus, il a pu réduire considérablement le colmatage minéral des MECs et le colmatage protéique des MEAs (Casademont, 2008). Pour pousser plus loin les connaissances des CEPs, Cifuentes-Araya et al. ont étudié le contrôle du colmatage de MEIs et les CÉPs avec des solutions modèles (Cifuentes-Araya, 2012). Durant leurs recherches, les auteurs ont testé différentes conditions de champs électriques pulsés et la meilleure condition pour limiter le colmatage était 10sec/30sec (Ton/Toff)(Cifuentes-Araya, 2012). Cependant, ce n’était pas le meilleur ratio pour
améliorer la performance d’électrodialyse. Les conditions ayant un effet positif sur la performance d’électrodialyse sont celles ayant un temps de pause de 10 à 50% du temps de pulsation(Cifuentes-Araya, 2012). Mikhaylin et al. (Mikhaylin, Nikonenko, Pismenskaya, et al., 2016; Mikhaylin, Nikonenko, Pourcelly, & Bazinet, 2014) ont démontré qu’il est possible d’éliminer complètement le colmatage minéral sur les AEMs et de contrôler ce colmatage pour les CEMs lorsqu’il y a application d’un champ électrique pulsé à courtes durées d’impulsion/pause en plus d’améliorer les performances d’ED. Il ont aussi démontré qu’il est possible d’appliquer les CÉP sur un système comprenant une ou plusieurs membranes bipolaires (Mikhaylin, Nikonenko, Pismenskaya, et al., 2016; Mikhaylin et al., 2014). Leurs études ont été effectuées avec des solutions modèles de magnésium ou de calcium et pour la première fois, des essais EDMB avec CÉPs ont été effectués sur une matrice alimentaire : du lait écrémé (Mikhaylin, 2015; Mikhaylin, Nikonenko, Pourcelly, & Bazinet, 2016). Mikhaylin et al. ont proposé dans cette étude de coupler l’ultrafiltration (UF) à EDMB, ce qui a permis de prévenir complètement les précipitations de caséines à l’intérieur de la cellule et ainsi améliorer l’efficacité du procédé (Mikhaylin et al., 2016). De plus, l’application des PEFs a permis d’inhiber la formation de colmatage minéral et la fuite des ions OH-, ce qui
29
31
2.1 But et Hypothèse
Le but de cette étude est d’appliquer le principe des champs électriques pulsés en électrodialyse sur le jus de canneberge afin de rendre ce procédé électrodialytique plus efficace énergétiquement tout en diminuant la concentration des acides organiques et rendre le jus plus doux à la consommation. L’hypothèse est donc la suivante :
Les caractéristiques des CEPs (temps de pulsation et temps de pause) appliquées au cours de la désacidification du jus de canneberge par EDMB influent sur l’efficacité énergétique tout en conservant les
composés procurant un effet bénéfique sur la santé humaine.
2.2 Objectifs
Afin de répondre à cette hypothèse, plusieurs objectifs seront réalisés :
1. Étudier l’impact des différentes conditions de CÉPs sur le pourcentage de désacidification du jus de canneberge
2. Caractériser l’impact des PEFs sur la composition des jus dans les différentes conditions
32