ÉTUDE
DE
LA POLYMÉRISATION
CATALYTIQUE
DES
ORGANOSaANESP~ADŒS
par Bruno Côté
Thèse présentée à la Faculté des Études Supérieures ct de Recherche en vue de l'obtention du grade de Maître ès Sciences (M. Sc.).
Dépanement de Chimie Université McGill MontnSal, Québec
CANADA
(
Chimie
RÉsUMÉ
"
, BronoCOTEÉTIJDE DE LA POLYMÉRISATION CATALYTIQUE DES
ORGANOPOLYSaANESP~S
M.Sc.
Les silanes du type RS~ (où R = phényl (Ph), benzyl (Bz) et n-hexyl (n-Hx» ont été polymérisés par déshydrogénation catalytique avec Cp2ZrMe2 (Cp = ",5
-C
5HS)' Cette réaction produit des oligomères contenant de dix à quinze atomes de silicium. L'étude de l'influence des paramètres de base: concentration de catalyseur, de monomères, la température et le temps de la réaction, montre qu'ils influencent le poids moléculaire des polysilanes obtenus. Ceux-ci sont principalement linéaires et atactiques. Des oligomères cycliques sont aussi présents.
Le CP2ZrMe2 est plus réactif que le CP2 TiMe2 et il permet d'obtenir des polymères de poids légèrement supérieur. Leurs mécanismes de polymérisation semblent similaires et s'apparentent à une polycondensation.
La polymérisation du phénylsilane par le CP2ZrMe2 en présence de divers alcènes a donné dans le cas du cyclohexène et de l'hexène-l des polymères partie!lement hydrosilés. La capacité du cyclooctadiènediméthylplatine (II), du dimère de Zeise et du tétraéthylène-j.L;.L , -dichlorodirhodium à hydrosiler le poly(phénylsilane) en présenc,· d'alcènes est aussi rapporté.
Chemistry BnmoCÔTÉ
"
M.Sc.Primary silanes of the type RS~, where R = phenyl (Ph), bellzyl (Dz) and n-hexyl (n-Ilx), undergo cab'lytic dehydrogenative polymerization in the presence of CP2ZrMe2 (Cp = l1S - CSHS)' The resulting olit:omer consists of about 10 to 15
silicons atoms. A study of the influence of the reaction conditions, reactant
cO~'1centration, solvent, temperature and reaction time, shows that the molecular weight is dependent on them. The polysilanes produced are mainly linear and atactic although cyclic oligomers are aIso produced.
CP2ZrMe2 is more reactive than CP2 TiMe2 to polymerize silanes and produces slightly higher polymers. The polymerization mechanisms resemble polycondensation and seem to be similar for both catalysts.
The polymerization of phenylsilane with CP2ZrMe2 in the presence of various alkenes was aIso studied. Sorne hydrosilated polymr.rs were isolated in the cases of cyclohexene and I-hexene. Hydrosilation ability of cyclooctadiene-dirnethyl-platinum(m. Zeise's dimer and tetrakis(ethylene)-#J,-il' -dichlorodirhodium is also reported.
,
REMERCIEMENTS
Je ticns à remercier le Dr. John F. Harrod, mon directeur de th~se, pour l'aide, la compréhension et le suppon qu'il m'a aimablement fournis tout au lona de mon II'Ivail de recherche. Mes remerciements vont aussi au Dr. Françoise Sauriol pour ses nombreux conseils en RMN, à M. Alain Desjardins pour l'entraînement reçu en CPG.
De plus. je veux remercier toute l'~quipe du labo 435. François Gauvin pour ses conseils dans le domaine des manipulations sous atmosphère inene et pour les corn'ctions appon~es à ma thèse. M. Jacques Dcmers pour l'entraînement reçu en RMN, l'enregistrement de nombreux spectres et pour ses suggestions au sujet de ma thèse. Enfin, M. Pierre-Yves Plouffe pour le temps consacré (et les nombreux caf~s) à nos nombreuses discussions. Je les remercie tous de leur amiti~ et de l'atmosphère de camaraderie qu'ils ont crée dans notre laboratoire.
Des remerciements vont aussi aux fonds FCAR pour le suppon qu'il m'a fourni. Finalement merci à Chantal pour sa compréhension, sa grandeur d'âme, sa force à la fois tranquille et constante qu'elle m'a apponéc: son amour.
Merci aussi à Chantal Marotte d'avoir dactylographi~ cette thèse.
R6sUlDé . . • • . . . • • • . • . . • . . • . . . . . . • . . . . . . . . • . . . . . i
Absttact . . . . . . . . . . . . . . . . . . ii
Rel1lelCÎclllents • • • . . • . • • • • • . . • . . • . . • . . • • . • • • • • • • • . . . • • . iii
Table des ma.ti~œs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . iv
Liste des figures . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . x
Liste des tableaux . . . . . . . . . . . . . . . . . . . . . xii
Liste des abréviations . . . • . . . • . . • . . . • . . . xiv
Chapitre 1: Revue des organopolysilanes . . . . 1
1.1 Inttoduction... 2
1.2 Histonque... Il • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • 2 1.3 Synthèse des organopolysilanes . . .. . . . 5
l.3.1 La photochimie des polysilanes . . . 11
1.3.2 Les spectres électroniques des polysilanes . . . 12
l.3.3 Étude de la configuration des polysilanes par spectroscopie de résonance magnétique nucléaire . . . 13
1.4 Les méthodes de synthèse catalytiques des polysilanes . . . 13
1.5 Applications technologiques des polysilanes . . . 16
Chapitre 2: Étude de l'influence des paramètres de bases pour la polymérisation des organopolysilanes primaires sous l'influence du diméthylzirconocène . . . 19
2.1 Inttoduction..., 20
(
TABLE DES MATlERES (suite)
2.1.1 Les zœthodes utilisées pour d6tcnniner la structure des polysilanes préparés à partir du système à base
Page de titane . . . • . . • • • . . . • • . • . . • . . . • • • • . • • 21 2.1.1.1 La RMN-IH. 29Si . . . . . . . . . . . . • . • • • . • • . . . • 21 2.1.1.2 I...,'înfiël-rouge . . . . . . . . . . . . . • . • . . . . . • . . • 21 2.1.1.3 OPV et CPG • • • . • • . • • • • . . • • • • . . • . . • • • • • . 22 2.1.1.4 La spectroscopie de masse . . . . . . • . . . . • . • . • . . • • 22 2.2 Partie expérimentale . . . . . . . . . . . . . . . . , . . . • . . . . . 23 2.2.1 Instrumentation... 23 2.2.2 Manipulations... 24
2.2.3 Polymérisation catalytiques avec le
diméthylzirconocène . . . . . . . . . . . . . . . 26 2.2.4 Réaction entre le poly(phénylsilane), le phénylsilane,
et le trichlorophénylsilane et l'éthanol . . . . . 27 2.2.5 Polymérisation du benzylsilane avec le
diméthylzirconocène. . . . . . . . . . . . . . 28 2.2.6 Sommaire des essais de polymérisation du
n-hexylsilane sous diverses conditions . . . . 29 2.3 Résultats et discussion . . . . . . . . . . . . . . . . . • • . . . . . • . 29 2.3.1 IntrOOuction. 1 • • • • • • • • • • • • • • • • • • • • • • • • • • • • • • 29 2.3.2 Caractérisation et propriétés physiques des
poly(phénylsilanes) . . . . . . . . . . . . . . . . . . . . . . . . . 29 2.3.3 La réactivité du poly(phénylsilanes) face aux
alcools . . . . . . . . . . . . . . . . . . . . . . 35
Page 2.3.4 Étude de l'influence des paramètres de base pour la
polymérisation du phénylsilane • . . • . . . • . . . 40 2.::'.4.1 Étude de la variation de la distribution des
poids moléculaires (DPM) en fonction de la
concentration de catalyseur . . . • . . . 40 2.3.4.2 Étude 1e la variation de la DPM des
poly(phénilsilanes) obtenus en fonction de la
concentration de phénylsilane en solution. . . . . . . 44 2.3.4.3 Étude de la variation de la DPM en fonction
du temps de polymérisation du
phénylsilane. . . 46 2.4 Polymérisation catalytique du benzylsilane . . . 48 2.4.1 Caractérisation du poly(benzylsilane) . . . 48 2.4.2 Étude de l'influence des paramètres de base pour
la polymérisation du benzylsilane . . . . . . 50 2.5 Polymérisation catalytique du n-hexylsilane . . . 51
2.5.1 Caractérisation du poly(n-hexylsilane) . . . 51 2.5.2 Étude de l'influence des paramètres de base pour
la polymérisation du n-hexylsilane . . . 54
Chapitre 3: Études comparatives des systèmes catalytiques à
3.1
3.2
base de titane et de zirconium . . . 56 Int:Jl:)(J.uction . . . . . . . .. . . Partie expérimentale . . . . 3.2.1 Manipulations... 1 • • • • • • • ... 1 vi 57 57 57
(
(
TABLE DES MATIERES (suite)
Page 3.2.1.1 Le profù de la réaction. . . • . . . 58 3.2.1.2 La vitesse de conversion du phénylsilane
en fonction du temps . . . • . . . 58 3.2.1.3 Comparaisons de DPM des poly(phénylsilanes)
obtenus en fonction de la concentration de
phénylsilane . . . . . . . . . . . . . . 1 • • • • • • • • • • • • • S9 3.2.1.4 Comparaison des vitesses relatives de
polymérisation de divers organo!ilanes pour
le système CP2ZrMe2 . . . • . . . 59 3.2.1.5 Comparaison des vitesses relatives de
polymérisation du phénylsilane . . . 60 3.2.1.6 Comparaisons des DP et poids moléculaires
(CPG) des poly(phénylsilanes) obtenus à
partir du CP2TiMe2 et CP2ZrMe2 . . . • . . . 61 3.3 Résultats et discussion . . . 61 3.3.1 Le profIl de la réaction . . . 61 3.3.2 La vitesse de conversion du phénylsilane en
fonction du temps . . . 64 3.3.3 Comparaisons de DPM des pciy(phénylsilanes) obtenus
en fonction de la concentration du phénylsilane en
présence de CP2 TiMe2 et CP2ZrMe2 . . . 67 3.3.4 Comparaisons des vitesses relatives de polymérisation
du phénylsilane avec Cp2 TiMe2 et CP2ZrMe2' . . . • . . . 69
3.3.5 Comparaisons des vitesses relatives de polymérisations de divers organosilanes pour les systèmes
Cp2ZrMe2 et CP2 TiMe2 . . . • . . 70 3.3.6 Comparaison des mécanismes de polymérisatl(J&~s des
organosilanes primaires sous l'influence du
Cp2 TiMe2 et CP2ZrMe2 . . . • . . . 71 3.3.6.1 Comparaison entre deux mécanismes de
polymérisation . . . . 1 • • • • • • • • • 1 • • • • • • • • • 1 • • 71 3.3.6.1.1 La réaction en chaîne . . . 71 3.3.6.1.2 La polycondensation . . . 72 3.3.6.2 La relation entre l'activité catalytique
et la structure du catalyseur . . . 72 3.3.6.2.1 L'encombrement stérique. . . 72 3.3.6.2.2 La particularité électronique
des complexes du groupe 4 . . . . . . . 73 3.3.6.3 Le mécanism~ de polymérisation des organosilanes
primaires sous l'influence du CP2ZrMe2 . . . 75 3.3.6.4 Comparaisons des DP (CPG) des poly(phénylsilanes)
obtenus avec le CP2 TiMe2 et le CP2ZrMe2 . . . 79 3.3.7 Les méthodes de caractérisations des polysilanes au
. d' '1 h" ,
sem un me ange eterogene . . . . 3.3.7.1 Considérations générales . . . . 80 80 3.3.7.2 La RMN-IH . . . 80 3.3.7.3 LaRMN-29Si . . . 81 viii
(~
TABLE DES MATIERES (suite)
3.3.7.3.1 Analyse théorique des r6sonances
associées l un mélange des stâéoisoàzes
Page
de l'hexaphénylcyclohexasUane . • • . . . . • • . • • • 83 3.3.7.4 La spectroscopie infra-rouge • . . • . . . • . . . . . . . • • . 84
3.3.7.S La spectroscopie de masse . . . • . . . . . . • • • . . • . 87 3.3.7.6 La chromatographie par perméation de gel . . . • • • . . . • 88
3.4 Conclusion... 91
Chapitre 4: L'hydrosilation des polysilanes . • . . • . . • . . . . . . • . . . . . 93 4.1 Int:rocluction... fi • • • • • • • • • • • • • • • • • • • • 94
4.2 Partie expérimentale . . . • • . . . . • . . . . 9S
4.2.1 Manipulations... 95
4.3 Résultats et discussion . . . . . . . • . . • . . . . . 99 4.3.1 Réactions entre le phénylsilane ou le phénéthylsUane
et le styrène en présence de diméthylzirconocène . . . . . . 99 4.3.2 Réactions entre le phénylsilane et le cyclohexène ou
l 'hexène-l en présence de diméthylzirconocène . . . . . . . .. 105 4.3.3 Tentative d 'hydrosilation avec divers alcènes après
90% de conversion du phénylsUane en présence de
diméthylzirconocène . . . . . . • • . . • • . • . . •. 106 4.3.4 Hydrosilation avec divers alcènes du poly(phénylsilane)
en présence de CODPtMe2' le dimère de Zeise et du
tétraéthylène-J.l.-J.l.' -dichlorodirhodium (l) . . . • . . • . . . .. 108
4.4 Conclusion... 110
Bibliographie. . . • . . . 112
Q
.,. USTB DES FIGURESPage
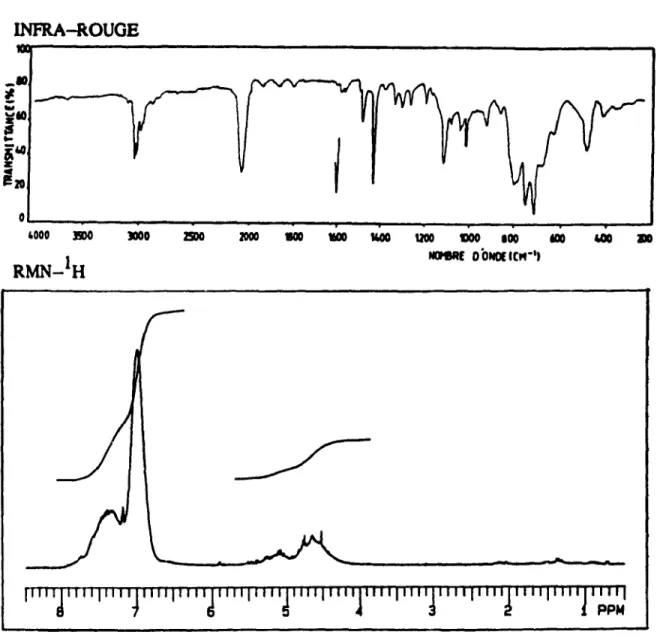
2.1
Spcct:rCs caract6ristiques: IR et RMN-IH duJJOly(ph6nylsUane) . . .
30
2.2
Spectre RMN_l H du tri6thoxyph6nylsilane, obtenu lors de lar6action entre le poly(ph6nylsilane) et 1'6thanol ...••.••...•..•
36
2.3
Chromatogrammes des poly(ph6nylsilanes) (CPO) obtenus enabsence de solvant à partir de diverses concentrations
de Cp2ZrMc2 . . . . . . . . . . . . . . . . . . 1 • • • • • • • • • • • •
43
2.4
Spectres caract6ristiques: IR et RMN.IH dupoly(benzylsilan.e) . . .
49
2.5
Spectres caractéristiques: IR et RMN.IH dupoly(n-hexylsilane) . . .
52
2.6
Chromatogrammes (CPG) caractéristiques despolysilan.es . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
53
3.1
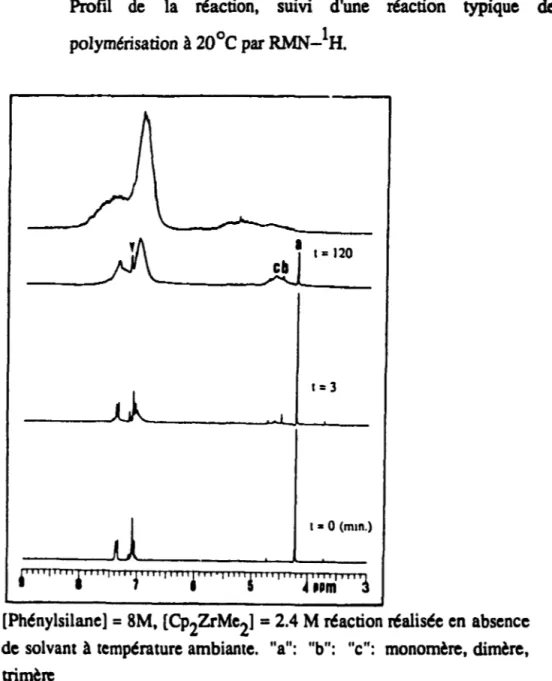
Profil de la réaction, suivi d'une réaction typiquede polymérisation à
20·C
par RMN-IH . • . . .62
3.2
Variation du nombre de mole de phénylsilane présenteen fonction du temps de polymérisation . . . . . . . . . . . . . . . . . . . . 64
3.3
Variation deOP
n en fonction du temps, pour lapolym6risation catalytique des organosilanes . . . . . . . • . . . . . . . . . . .
66
l
LISTE DES FIGURES (suite) Page3.4 Chromatogrammes (CPG) de l'étude comparative de la variation de DPM de divers poly(phénylsüanes) obtenus
en fOllction de la concentration de phénylsilane . . • • • . • . • • • • . • • • •
68
3.5
La migration de l'hydrure en alpha du complexe silicium-titane 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ... ... 743.6 Vue d'ensemble du mécanisme de polymérisation des organosUanes sous l'influence du Cp2ZrMe2 . . . • . . . • • . . • . . • • • . 78
3.7 Spectres RMN_29Si DEPT des poly(n-hexylsilanes) obtenus avec Cp2ZrMe2 et CP2 TiMe2 . . . . . . . • . . . . • . •
82
3.8 L'effet du DPn sur l'intensité de la bande d'absorption IR (a Si-H2' 900 cm-1) du poly(phénylsüane) . . . • . . . • • . . • • • • .
85
3.9 Spectre de masse caractéristique tlu poly(phénylsilane) ••...••••..
89
3.10 Spectre de masse caractéristique du poly(n-hexylsilane) . . . • . . . 90
3.11 Spectre de masse caractéristique du poly(benzylsilane) . • . . . . . . . • .
91
4.1 Spectres RMN-l H (COSY) des produits obtenus pour la réaction entre le phénylsüane et le styrène en présence de CP2ZrMe2 .•....••.
101
4.2 Spectre RMN-IH (COSY) des produits obtenus pour la réaction entre le phénéthylsilane et le styrène en présence de CP2ZrMe2 ...••..
103
4.3 Spectres RMN .IH d'un poly(phénylsilane) hydrosillés à l 'hexène-I et CODPtMe2 . • . . • . . . . • • • . . • . • . . • . • • • . • . . .
109
(
Ct
USTEDBS TABLEAUX Page 2.1 Sommaire cL:s essais de polym6risation catalytique duph6nylsüane avec le dim6thylzirconoc~ne • . • . . . • • . . . . • • • . . . • • 26 2.2 SotDDlBÎœ des essais de polym6risation catalytique du
bcnzylsüane avec le dim6thylzircon~ne . • • . • . • • . . . . • • • . • . . . 28 2.3 Variation de la distribution des poids mol6culaircs (DPM)
des poly(ph6nylsüanes) obtenus en fonction de la
concentration de CP2ZrMe2 . . . • . . . . . . . . . . . . . . . . 0 42
2.4 Variation de DPM des poly(phénylsilanes) obtenus en fonction
de la concentration de phénylsilane en solution • . . • . . . . . • . . . . . • . 4S
2.5 Variation de DPM des poly(phénylsilanes) obtenus en fonction
du temps de polymérisation . . . • . . . 47 3.1 Fréquence typique d'échantillonnage pour suivre l'évolution
d'une polymérisation . . . 58 3.2 Quantités de réactifs utilisés pour l'étude comparative de
DPM en fonction de la concentration de phénylsilane . . . . . . . . . . . . . 0 59
3.3 Quantités de réactifs utilisés pour l'étude comparative des
vitesses relatives de polymérisation de divers organosilanes . . . S9
3.4 Quantités de réactifs utilisés pour l'étude comparative des vitesses relatives de polymérisation du phénylsilane avec divers
catalyseurs . . . • . . . • . . . 60
,...---
-LISTE DES TABLEAUX (suite)
Page
3.5
Quanti~s de r6actifs utilis~s pour 1'6tude comparative des DPM et des poids mol6culaires des poly(ph6nylsiJanes) préparésà partir du Cp2 TiMe2 et du Cp2ZrMe2 . . . . • . . • . . • . . • . . . • . . . • 61
3.6
Vitesses relatives de polym6risation de phénylsilane sousl'influence de Cp2ZrMe2 et Cp2TiMe2 • . . . . • . . . . • . . . . • • . . . • • 69
3.7
Vitesses relatives de polymérisation de divers organosilanesavec CP2ZrMe2 et CP2TiMe2 . • . . • . . . . • . • . . . . • . . • . . • • • . .
70
3.8
Étude comparative des DP net DP n des poly(phénylsilanes)obtenus avec Cp2ZrMe2 et CP2 TiMe2 . . . . . . . . . . • . . . . .
79
3.9
Analyse théorique des résonances associées à un mélangedes stéréoisomères de 1 'hexaphénylcyclohexasilane . . . . . . . . . • . . . • • 84 4.1 Hydrosilation du styrène en présence de phénylsilane et de
phénéthylsilane et de CP2ZrMe2 . • . . . . . . . . . . . • . . . • •
96
4.2 Hydrosilation de cyclohexène en présence du phénylsilane
et de CP2ZrMe2 . . . . . . . . . . . • . . . . . . . . . . . . • .
97
4.3 Hydrosilation de l 'hexène-I en présence de phénylsilane et de
CP2ZrMe2 . . .
97
4.4 Tentative d'hydrosilation avec divers alcènes après 90% de
conversion du phénylsilane, en présence de Cp2ZrMe2 . • . . . • . • •..•
98
4.5
Hydrosilation avec divers alcènes du poly(phénylsilane) enprésence de CODPtMe2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
98
4.6
Composition du mélange obtenu pour la réaction entre lephénéthylsilane et le styrène en présence de CP2ZrMe2 . . . . . . . • . . . . 104
(
A:
angstr6m (10.10 M)BPM: e~e de bas poids mol6culaire qui pn!domine dans une distribution donn6c Bz: benzyle COD: cyclooctadiényle (llS.CSH12) Cp: cyclopentadiényle (T)S.CSHS) Cp': méthylcyclopentadiényle (T)S.CSH4CH3) Cp.: pcntaméthylcyclopentadiényle (l1S.CS(CH3)S) d: doublet
0: Dalton (ID = 1 unité de masse atomique)
OP n,p: degré de polymérisation moyen en nombre, en poids DPM: distribution des poids moléculaires
Et: éthyle h: heure
HPM: espèce de haut poids moléculaire qui prédomine dans une distribution donnée 1: indice de polydispersité ou de polymolécularité
IR: infra-rouge j: jour
m: multiplet M: métal
Mn,p: poids moléculaire moyen en nombre, en poids Me: méthyle
min: minute n-hexyle: normal
OPV: osmoméuie de pression de vapeur Ph: phényle
(
LISTE DES ABRÉVIATIONS (suite) ppm: partie par million
q: quadriplet
RMN: r6sonance magn6tique nucI6aire SiC: carbure de silicium
SM: spectroscopie de masse t: triplet
THF: tétrahydrofuranne TMS: tétraméthylsilane
UHP: gaz ultra pur ("ultra high purity") UV: ultravi.olet
v: volume d'élution
V h: volume hydrodynamique moyen
CHAPIfRE
1{
(~
-2-1.1 lrUroduction
Les organopolysilanes se définissent comme étant des composés qui contiennent des chaînes, des cycles ou une sttucture tridimensionnelle (3 D) d'atomes de silicium li6s de façon covalente. De plus, au moins un lien silicium carbone (Si-C) doit aussi être p~sent dans ces compos6s. Leur structure est similaire à celle des alcanes. Ces polymères suscitent un intérêt grandissant, tant dans le milieu académique par l'étude de leurs propriétés fondamentales aue dans le milieu industriel pour leurs applications diverses. Les organopolysilanes ont déjà fait l'objet de quelques revues (l, 2, 3) au cours des trois dernières années.
1.2 Historiguc
Le premier composé contenant un lien Si-8i, l'hexaéthyldisilaoe, fut préparé par Friedel et Landenburg (4) en 1869. En 1924 Kipping (4a) rappone la synthèse du premier organopolysilane préparé par l'action du sodium métallique sur le dic hlorodiphényl silane. Ce composé ne fut pas caractérisé à l'époque. Ce n'est que -vingt ans plus tard en 1949 que Burkhard (5) rapporta la première synthèse d'un composé linéaire - (Me2Si)n -. La description qu'il fit de ce composé, celle d'un solide blanc insoluble dans les solvants habituels et qui se décompose par chauffage au-dessus de 200°C, bien qu'exacte, a probablement contribuée au peu d'intérêt porté à ce nouveau matériau. Aujourd'hui il est clair que le poly(diméthylsilanc) cst une exception parmis les organopolysilanes, mais ceci ne fut pas réalisé à l'époque. Donc de 1951 à 1975 très peu de publications sur le sujet virent le jour. Dans les années 60 Gilman ~ (6, 7) démontrent que Kipping avait cn cffct produit le (P~Si)n où n = 4,5 et 6. D'autre part, les poly(perméthylsUanes) - Mc(SiMe2)nMe - ont 6té préparés et étudiés par Kumada ct ses étudiants (8).
Les compos6s cycliques furent étudié au d6but des années 70 par Henlle (9) et par West (10). Comme dans bien des cas, la d6couvene d'une application industtieUe, la transformation des polysüanes en CarbUle de silicium (SiC) selon un procéd6 mis au
point par Yajima et Hayashi (11-14), r6anima l'int6œt des chercheurs pour la mise cn oeuvre de nouvelles m6thodes de synth~se de ces polyrœrcs.
Le SiC est obtenu par le chauffage en deux étapes du poly(pcnnéthylsilane). La
prcmi~re, un chauffage à 450°C produit le polycarbosilane -(SiH(0I
3) - ~)-n où n ~ 1500. Ce dernier peut-être ensuite extrud6 et réticulé lui donnant ainsi sa fonne d6finitive. La seconde, une pyrolyse du polycarbosilane (à 12500C sous atmosphère inerte) produit le SiC (schéma 1.1)
Étape 1
1:-tb
1 1 1 Me Me nH
H
~
i---c~-! i---C~
1 1 Me Me n Polycarbosilane Étape 2 H!i~
~e
2n 2n SiC + 2n CH4 + 2n ~ Schéma 1.1Le carbure de silicium possède des propriétés physiques et chimiques remarquables: très dur, chimiquement et thermiquement très stable. De plus sa
(
-4-r6sistance à la traction (350 kglmm2) est excellente (15). Une revue traitant des polycarbosilanes (16) a œcemment 6t6 publi6e. Mais les besoins des c6ramisœs 6taient loin d'être combl6s. En effet. ceux-i:Ï d6siraient un polym~re soluble et fusible afin de
pennettre la production industrielle du SiC. La solution à ce probl~me fut ~ouvene
de façon fortuite par West (17) en 1978. Ce dernier, voulant p1'6parer un compos6 cyclique, fit réagir un m6lange de diméthyldichlorosilane et de phénylméthylsilane avec du sodium. Au lieu du composé espéré, il obtint un copolym~re relativement soluble dans les solvants organiques usuels (schéma 1.2). L'introduction de groupements phényles en alternance conduit à une diminution de la cristallinité du polym~re le rendant ainsi plus soluble.
Schéma 1.2
Ph Me
!i+--+!i
~em ~en
De plus, ce polymèm fond sans se décomposer et se transforme facilement, par simple chauffage, en SiC :)ans fonnation de polycarbosilane (18). La découverte de ce copolymère soluble a mené à la production industrielle du poly(silastyrène) (18). Durant la même période, Wesson ~
&
(19) et Trujillo (18) ont rapporté la préparation de polysilane soluble. Depuis la fin des années 70, le nombre de publications traitant des polysilanes n'a cessé d'augmenter. De nos jours. le poly(dim6thylsilane) et le poly(silastyrène) sont fabriqués au Japon et sont commercialement disponibles en grandes quantités.1.3
La méthode utili~e de nos jours pour préparer ces polym~res n'a pas beaucoup changé depuis l'époque de Kipping. Cette méthode, une condensation du type
Wunz-Fitting, permet la préparation de polym~res cycliques, lin~aires,
d'homopolym~res et de copolym~res. Elle consiste à faire réagir des dichlorosilanes avec des métaux alcalins ou leurs alliages (NaJK) (schéma 1.3).
RR'SiC~ nR'R2SiCI 2 + mR3R4SiCl 2 Na, Solvant > 100°C Na, Solvant > 100°C R
--( Ji
)n
+ 2NaCl~,
Schéma 1.3Cette méthode présente beaucoup de désavantages rendant sa mise en oeuvre à l'échelle indus nielle assez peu pratique. Aussi, cette condensation non-catalytique nécessite une grande quantité de sodium fondu dans un solvant hydrocarboné. Le rendement en polymère de haut poids moléculaire est relativement faible (généralement moins de 50%). De plus, la présence de grande quantité d'oligomères cycliques nécessite plusieurs étapes de purification. Les polymères obtenus possèdent un indice de polydispersité (1) élevé ainsi qu'une distribution polymodale. Les conditions drastiques de cette méthode empêchent la production directe de polymères substitués par des groupements autres que ceux de type aryle et ou alkyle. Plusieurs
(
-6-modifications de cette m~thode de synth~sc ont ~t6 publi~es (vide infra). Le dim6thyldichlorosilane, produit cn grande; quantit6 par l'industrie des compos6s du silicium, est le monom~re le plus utilise! pour la p~paration des organopolysilanes. Con~quemment, le poly(dim6thylsilane) est le polyrœre qui fut le plus ~tudi6 paniculi~rement en vue de son utilisation comme pRcurseur du carbure de silicium. De plus, si on considère la faible stabilit6 du lien Si-H .,ar rapport à celle du lien C-H, et sa susceptibilit6 d'être attaquée par les acides, les bases ou l'oxygène, il n'est pas surprenant que la plupart des chercheurs se soient concentr~s sur 1'6tude des d6riv6s peralkylés et perarylés.
Les premiers travaux traitant de la polymérisation des organosilanes furent concentrés sur l'obtention de chaînes ou de cycles de petites tailles (20, 21, 22). A partir des travaux de Gilman ~ (6, 7). des composés du type (Ph2Si)n où n
=
4,5 et 6 furent isolés et caractérisés. De nos jours, on peut produire presque sélectivement un cycle de taille donnée, en contrôlant les conditions de la réaction. Par exemple, si le Ph2SiCl2 réagit avec deux équivalents de Li en présence de THF, le tétramère cyclique (Ph
2Si)4 sera produit avec un rendement de 75%. Par contre, un excès de Li et un temps de réaction plus long conduiront à la formation du cyclopentamère (Ph
2Si)S' thermodynamiquement plus stable. Dans ces deux cas, ainsi que pour plusieurs autres ~ynthèses impliquant les perphénylcyclosilanes, le cycle où n
=
6 n'est qu'un produit secondaire (3).Les composés du type (Me
2Si)n les plus étudiés furent aussi de nature cyclique où n = 4, 5, 6 et 7 (10). Burkhard fut le premier à les isoler en petite quantité et à les caractériser en même temps qu'un autre organopolysilane linéaire (5). Ici, contrairement au (Ph2Si)n' l'hexamère cyclique (Me2Si)6 est le compos6 principal themlodynamiquement plus stable. De nos jours, le perm6thylcyclohexasilane
peut~tre préparé avec un bon rendement à l'aide d'un alliage de Na/K à 46°C (23) de
même que (Me
-(24). La première d6termination de structure par rayons-X fut celle du (Me
2Si)6 en 1972 (25) puis celle de (Me
2Si)4 (2.(;) et plus récemment celle du (Me2Si)7 (27). Des cycles contenant jusqu'à 35 atomes de Si sont maintenant connus (28, 29). Au début des années SO. des polysilanes substitués par des groupements autres que méthyles et phényles furent produits (30-32) soient les groupements n-propyles, n-butyles, iso-propyles et isHutyles.
Une série de composés du type polyspirocyclopolysilane - [(C~)4Si]n où n =
5-12, et [(C~)5Si]n où n = 4-6 ont été synthétisés et caractérisés (33, 34). Pour les composés [(~)4Si]5 et [(C~)5Si5] des structures ont été détenninées par rayon-X. Une autre classe de polysilanes possédant une structure polycyclique en 3D a été préparée. Indriksons et West ont isolé le premier polysilane de type "cage" à partir de la co-condensation d'un mélange équimolaire de Me
2SiC12 et de MeSi Cl3 en présence d'un alliage de Na/K en solution dans le naphtalène (35). Après une longue et difficile purification, le tétradécaméthylbicyclo [2.2.2] octasilane fut obter.u avec un rendement de 0.5%. La formule brute Me
14Sig fut obtenue par spectroscopie de masse. La structure proposée fut principalement déduite à partir de la RMN-IH et l3C. Suite à des améliorations de leurs techniques de synthèse, ces même chercheurs réussirent à isoler cinq autres "polysilane--cage" (36). Cette étude démontra que la présence de l'alliage Na/K et du THF était essentielle afin de prévenir la formation de polysilane de haut poids moléculaire. De plus, en modifiant le rapport molaire du mélange MeSiCl
3 : Me
2SiCl2 (1:3) le rendement initial de 0.5% était augmenté à 5%. De cette seconde étude, les "polysilanes-cage" suivants ont été isolés: Me16Si
9, Mel6SilO, Me18Si lO, Me
1SSi11 et Me22Si13' Tous ces composés furent obtenus avec des rendements inférieurs à 5%. Les structures proposées à l'époque ont été confirmées que quelques années plus tard par les travaux de Stalling et Donohue qui réussirent à établir la structure de Me
16Si9 par rayons-X (37).
{.'
-8-O!lanopolysUanes ont ét6 rapport6es afin de faciliter son utilisation l l'6chelle industrielle. La première fut l'addition invers6e (38-40). Cette variation consiste l
ajouter la dispersion de sodium l la solution de dichlorosilane, le polymm-e qui en résulte montre un poids moléculaire moyen plus élevé bien que le rendement soit g~n~ralement plus bas que celui obtenu par la m6thode classique. De plus, le mat6riau possède une distribution bimodale. Dans la synthèse classique, le toluène est le solvent le plus utili~. Miller ~ (41) ont exploré l'effet des co-solvants pour polym6risation des dichlcrosilanes. Cette étude a démontr6 que l'addition d'aussi peu que S% (en volume) de diglyme augmentait le rendement en polymère d'un facteur 617 (41). Ici, le co-solvant est utilisé pour stabiliser les anions par solvatation des contre-ions. Mais le poids moléculaire moyen (:&Ip) des polymères obtenus est inférieur à ceux obtenus en absence de diglyme (42).
Matyjaszewski
U
(43) ont développé trois nouvelles approches pour préparer les polysilanes: un couplage des dichlorosilanes à température ambiante à l'aide des ultrasons, des réactions de modification des substituants des poly(alkylarylsilane) avec l'acide triflique et la polymérisation par ouvenure des composés cycliques.L'utilisation des ultrasons permet d'obtenir des polysilanes de poids moléculaire moyen en nombre (~n) de l'ordre de 50,000 - 300,000. Ceux-d sont caractérisés par une distribution monomodale et un indice de polydispersité aussi bas que 1.2. Ces auteurs ont aussi démontré que le rendement, le degré moyen de polymérisation (DP) et l'indice de polydispersité dépendent de la puissance des ultrasons utilisés. Ces derniers pennettent un contact efficace entre les monomères et la dispersion de sodium ainsi qu'une cc..nstante régénération de la suspension. De plus, le poids moléculaire diminue et l'indice de polymérisation augmente en fonction de la température. Le temps de la réaction est plus coun que celui de la synthèse classique. La présence de pentamm-e cyclique, comme produit secondaire, a été signalée. A partir d'études antérieures, les auteurs proposent, pour expliquer la disbibution monomodale que les ultrasons et
....
..
l'tlds de sodium d6truisent npidemcnt ct s6lccûvemcnt ICI olla_rel. CCI dcmlm
pourraient avoir une micro-structurc diff6rcnte de celle dei polysil.nes de poids mol6culairc plus 6lev6s. De plus, la fonnation de ces dcmien pourrait~tre f.vorilC!e par les conditions de synth~ses l basse temp6raturc. Eventuellement. un arand elœ. de sodium peut influencer la cin6tique de la r6:-.ction ct favoriser la fonn.don de polysilane de haut poids mol6culaire. La ~gradation des polysilanes en pr6scnce de sodium sugg~re que le polym~re lin6aire est le produit cin6rique ct qu'il est facilement dégradé en oligomères cycliques, thennodynamiquement plus stables.
La présence d'un métal alcalin durant la préparation des polysilanes empeche la synthèse de ceux-<:i avec des substituants autres que les alkyles ou aryles. Ceux-<:i seraient cliv6s sous ces conditions réductrices. Des polymères contenant des groupements fonctionnels arnino ou alkoxy n'ont été développés (43) que tout récemment. L'étude de ces réactions de déplacement électrophile fut réalisée à partir d'un dimère et ensuite appliquée au poly(ph6nylméthylsilane). Cc dernier fut choisi comme modèle car le déplacement des groupements aryles est plus facile que celui des alkyles. De plus, celte réaction est très rapide à température ambiante (schéma 1.4).
CF3S020-Si(CH3>2-OS02CF3 + 2RH (R = ph6nyle) Schéma 1.4
Les groupements CF
3S020- sont très r6actifs et fonnent un gel insoluble en présence de trace d'humidité. De plus ce groupement s'hydrolyse en silanol, lequel se condense avec les groupements CF
3S020- restant fonnant ainsi une unité siloxane . Cette dernière se lie de façon, intra ou intennoléculaire aux atomes de silicium (schéma
• .1
.,
(
-10-1.5). Sch~ma 1.5Si un alcool est' utilisé au lieu de l'cau, un poly(alkoxysilane) sera fonn6. Cc type de polymère est plus sensible à la lumière que les polysilanes classiques (43) (i.e. ayant des groupements aryles et ou alkyles).
La polymérisation par ouverture de cycle, vise elle aussi la p~paration de polysilane de haut poids moléculaire. Ici, l'approche consiste à utiliser comme monomère de départ des oligomères cycliques ct d'en provoquer chimiquement leur ouverture fonnant ainsi des terminaisons réactives qui polymérisent entte elles. Cette méthode est loin d'être au point même si des polymères où
M
n= 104 ont pu êtreobtenus (43).
Jusqu'à présent. très peu de polysilanes contenant des liens Si-H ont ~té préparés par la méthode classique. West
a..aJ.
(44) ont rapporté la synthèse d'un tel polymère par cette méthode. Il fut préparé à partir de la copolymérisation d'un dialkydichlorosilane avec le méthydichlorosilane. West nous précise que la purification d'un tel polymère doit êlœ faite dans des conditions parfaitement neutres afin d'6viter toute réaction avec les fontions Si-Ho Une revue traitant de la copolymérisation des dichlorosilanes a récemment été publiée (45).1.3.1
La
pbotgçblmje des golYIi'IDC 'Le componement tout à fait unique des polysilanes lorsqu'ils sont irradi~s l l'aide de rayons ultraviolets (UV) fut nppon6 pour la premiùe fois par Oilman (46, 47). Depuis, ce ph~no~ne particulier a ~t~ 6tudi6 de façon extensive (48). En fait. tous les polysilanes absorbent ~s fonement dans la n!gion UV. Cette
caract~ristique est d'autant plus paniculi~re pour un polym~re dont le squelette est essentiellement constitu~ de liens de type sigma (G). La fone d61ocalisation des électrons a toul le long de la chaine d'atomes de silicium explique bien ce phénosœne (10).
Lors d'une irradiation, deux réactions se produisent: la r6ticulation et la photo-scission. Lors de la réticulation, les substituants organiques réagissent avec les atomes de Si formant ainsi des chaînes secondaires (49). Plusieurs 6tudes leur ont 6t6 consacrées (50. 51). Un mécanisme de photo-dégradation des polysilanes a ét~ propos6 par West (50).
Si on irradie un poly(alkysilane) à l'aide d'UV, ce dernier subit presqu'exclusivement la scission. Par contte, dans les mêmes conditions. les poly(arylsilanes) subissent à la fois scission et réticulation (52, 53). Bien que le mécanisme de photolyse ne soit pas complétement compris, une photolyse exhaustive du polysilanes du type (RR' Si)n en présence d'un agent piégeant, le tri6thylsilane, conduit à la fonnation de Et
3Si-SiRR' -H ainsi qu'à celle de di silanes (54). Un intéressant système reticulé via une vulcanisation à température ambiante (55) fut présenté par West. Celle-ci implique un oligopolysilane contenant des liens Si-H, un composé polyinsaturé et l'acide chloroplatinique comme catalyseur pour l'hydrosilation.
(
-12-1.3.2
Les mectres 6lecttooÎQ.UCs des
polysUancsLes polysilanes absorbent dans la région de 300 à 400nm. (56). Les
•
bandes d'absorptions sont dûes à des ttaDsitions électroniques
a ...
CJ. Plusieursfacteurs influencent la position de la longueur d'onde d'absorption maximale (Âmax) des polysilanes. Ce phénomène a été étudié tant en solution (41) qu'à l'état solide. De nombreuses études théoriques (57-61) sont venues appuyer les résultats expériJpentaux. La position de Âmax dépend du type de polymère i.e. cyclique ou linéaiœ, du poids moléculaire, de la température, de la nature des substituants et de la conformation de la chaîne principale.
Les polymères cycliques furent étudiés par Cuberry
m..Al
(62) en 1969. A mesure que le nombre d'atomes de Si présents dans le cycle augmente, la position de Àmax se déplace vers les courtes longueur d'onde (déplacement hypsochromique). Ce déplacement s'explique de la façon suivante: à mesure que le cycle s'agrandit, ce dernier perd son caractère planaire. Lorsque le nombre d'atomes de Si est supérieur à 7 un déplacement bathochromique (déplacement vers les longueurs d'ondes plus grandes) est observé.Les spectres UV des composés linéaires du type Me(Me2Si)iiMe où n = 2-8 ont aussi été mesurés (47). Ces composés furent les premiers a ne pas contenir d'électrons de type 1t ou désappariés ayant des Àmax à des longueurs d'onde élevées (3) démontrant ainsi le caractère chromophorique du lien Si-Si. Les valeurs de Â.
max pour ces composés augmentent en fonction du nombre d'atomes de Si, vers une valeur limite de 300 nm pour une chaîne taille infinie (63).
Les poly(di-alkylsilanes) montrent des bandes d'absorptions près de 300 nm, mais l'introduction de groupements stériquement encombrants et de groupements aryles cause un déplacement bathochromique (60, 63, 66). En fonction de la température, plusieurs polysilanes montrent des changements importants dans leur spectre
d'absorption (67).
1.3.3 Etude de la confipratioo des polysilanes par specQ'OSCOJ)ie de résonance maptStiQ.ue nucltSaire
lRMNl
Des spectres de RMN-1H, de I3
e
ct de 29Si de plusieurs polysilanes ont d6jà éttS publiés (68). En soi, la RMN_1H n'est pas très utile pour fournir des informations relatives à la structure. Par contre, l'inttSgration des résonances associées aux monomères présents dans un copolymère permet d'en 6valuer la composition. La RMN - 29Si est d'un int6rêt particulier car elle reflète la configuration de la chaîne polymérique (69). Pour un homopolymère telle poly(di-n-hexylsilane) ne présentant pas de centres chiraux, la résonance associée à ce type d'atomes de Si sera plutÔt étroite. Pour les poly(dialkylsilanes) du type (RR' Si)n chaque atome de Si est un centre chiral et sa résonance dépendra de la stéréochimie des atomes de Si avoisinants. De tels polymères montrent des signaux de résonances assez larges. Ce résultat est consistant avec un polymère atactique. Pour les poly(arylsilanes) les résultats sont assez différents (70).1.4 Les méthodes de synthèse catalytique des polysilanes
Les exemples de synthèse d'organopolysilanes à l'aide de catalyseur sont assez rares. Le plus connu fut publié par Ojima ~ (71). Ce dernier fit réagir de nombreux silanes en présence du catalyseur de Wilkinson «Ph3P)3RhCI). Il obtint un m6lange de dimère, trimère ainsi qu'une certaine quantité de "polysilanc de haut poids mo16culairc" qui ne fut pas caractérisée. A partir du phénylsilane, les auteurs réussiren~ à isoler le diphényl-l,2 disilane, le triphényl-l,1,2 disilane et le triphényl-l,2,3 trisilane. De plus, la présence de silylène (Ph
-14-tti6thylsilane produisant ainsi le E~SiS~H. Brown-Wensley (71a) a pour sa part r6ussit à dim6riser plusieurs silanes à l'aide de catalyseurs à base de Pt, Pd, Rh et Ir. Cependant, aucun polym~re ne fut produit. De plus des produits d'hydrosilation furent 6galement obtenus.
La contribution la plus importante dans ce domaine revient à Harrod et à ses collaborateurs. Des r6:entes publications (72-75) présentent les premiers r6sultats de la preparation des polysilanes par couplage déshydrog6natif d'organosilanes primaires à l'aide de complexes organométalliques du titane et du zirconium en catalyse homog~ne. La découvene que des complexes du groupe 4 catalysaient la polym6risation des organosilanes fut accidentelle (76). D'auttes études montrent que les organosilanes primaires réagissent plus rapidement que les organosilanes secondaires. En présence de diméthyltitanocène(IV) des polymères comptant environ lO atomes de Si sont généralement produits. Dans le cas du catalyseur· analogue à base de zirconium, il était prétendu que des polymères contenant environ 20 atomes de Si étaient obtenus (79). Ces catalyseurs sont également capables d'induire des réactions de couplages d'organosilanes secondaires pour former des dimères. La formule générale de ces catalyseurs est: CP2MR2 (Cp = cyclopentadiényle , M = Ti, Zr; R = alkyles, H) (73-75). Le seul autre complexe d'un métal de transition capable d'induire des réactions similaires i.e. dimérisation et trimérisation, est le vanadocène (CP2 V) en
o
présence de phénylsilane en solution dans le toluène à 110 C (77).
Une méthylation excessive du ligand Cp désactive le catalyseur. Cependant, les ... ... 5
composés du type CpCp MR2 (Cp = Tl C5(~)5' M = Ti, Zr) sont catalytiquement
...
actifs (78) tandis que ceux du type CP2~ ne le sont pas (78). Par contre, le
...
complexe du type Cp2MR2 (où M = U et R = Me) dans l'éther éthylique conduit à la formation d'un polymère de 10 à 12 atomes de Si. Cependant, en présence du catalyseur analogue à base de thorium et de phénylsilane de petites quantités de dimère ont été isolées et caractérisées (78). Les composés bis(indényl)dim6thyltitane(lV) et de
zirconium (IV) fuient aussi ~tudi~s. Le premier conduit l la formation de c1iIœre et de
trimère du ph6nylsUane. Tandis que le bis(in~nyl)dim6thylzirconium produit des polymères semblables à ceux pr6par6s avec Cp2ZrMe2 (79). G6n6ra1ement, peu de polymères cycliques ont 6~ isol6s de ces ~actions catalyliques. On peut citer deux
- -
.
exceptions: le système CpCp TiMe
2 en p~sence de ph~nylsilane produit l'hexaph6nyicyclohexasUane de même que si du benzylsilane est utilis~,
l'hexabenzylcyclohexasUane est produit (79a).
La r6action g6n6rale de polymérisation des organosilanes s'illustre de la façon suivante (schéma 1.6). Gén6ralement, seuls les silanes primaires polymérisent sous ces conditions
R
n
RS~ ~
H--{!i )nH + (n -1)~
~
Schéma 1.6
Une étude des vitesses relatives de polymérisation de plusieurs organosilanes dans des conditions de co-hydrogénation en présence de CP2 TiMe2 a récemment été publiée. Celle-ci démontre que plus l'encombrement stérique des groupements organiques portés par les atomes de Si augmente, plus la vitesse de polymérisation diminue (79). De plus. la nature linéaire et atactique des polymères préparés à partir des complexes du groupe 4 a été clairement démontrée (80). Le diméthyltitanocène catalyse aussi le couplage des germanes (77).
Les complexes à base de titane ne catalysent généralement pas l'hydrosilation des oléfmes internes. Par contre, en présence d'oléfine certains silanes primaires et secondaires stériquement encombrés dimérisent (79). Lors de l'utilisation d'un catalyseur à base de zirconium les résultats furent très différents (schéma 1.7) (78).
(
{
16 -Ph PhO
Cp'ZrMe 2n PhSiH 3 +n/2
~
2 2. H-(~i-~i
)n"
+ (2n -1)~
JO
Schéma 1.7Ce catalyseur (Cp'
=
m!thylcyclopentadi~nyle) pennet à la fois de polymériser le phénylsilane ct d'hydrosiler le cyclohexène sur le polymère. Ainsi une fois la polymérisation complétée, une lente réaction d'hydrosilation permet l'introduction des groupements cyc10hexyles sur la chaîne polymérique. Environ 50-75% des fonctions Si-H sont ainsi hydrosilées. En présence d'une oléfine plus réactive, le styrène, la réaction de polymérisation n'a pas lieu. Dans ce cas, la vitesse d'hydrosilation est plus grande que celle de polymérisation et conduit presqu'exclusivement à la formation du phényl(phényl-l éthylsilane) (78).Le mécanisme, initialement proposé par Harrod, pour expliquer la polymérisation des organosilanes, consiste en une insertion répétitive d'unité silènes sur le lien Si - Métal de transition. Ce mécanisme fut en panie déduit grâce à l'isolement de quelques intermédiaires réactionnels (73, 75). Ces derniers sont des hydrures pontés uniques en leur genre. Cependant, beaucoup de travail reste à faire afin d'élucider certains détails de ces mécanismes de polymérisation.
1.5 Awlications tcchnulo&ÏClJlCs des polysil
anes
Le comportement inusité des polysilanes face à l'irradiation à la lumi~re ultraviolette a déjà été discuté. C'est justement ce comportement qui fut la base des nouvelles applications de ces matériaux dans l'industrie de la haute technologie. Celles-ci sont multiples: comme précurseur du carbure de silicium, en
IIdcro-litho .... phie, comme aient constrastant pour les lasen (82), en imaprie (83), comme aient de Rnfon:ement des cénmiques (84), Il polym6risltion de. ~RS vinyliques (85), comme semi-conducteun (86). Tlts r6c:emment. les polysilanes fURnt utilis6s comme photo-conducteurs (87) et comme mlt6riau optique non-lin6aiR (88).
Les -besoins techniques en micro-Iithographies n'ont ceslM! d'auamenter. paniculi~remcnt depuis la mise au point de cirtuits-int6gr6s de plus en plus petits et puissants (89). L'utilité des polysilanes dans ce domaine fit l'effet d'une bombe. En effet, trois nouveaux proc6d6s lithographiques furent développ6s avec ce mat6riau, soit la photorésistance positive et négative et la gravure au plasma d'oxyg~ne.
Pour obtenir une photorésistance négative, il suffit d'irradier le poly.œre ll'aide de myons UV. Celui-ci se réticule, présentant ainsi de nouvelles propri6t6s par rappon aux parties non-exposées. Il est alors possible d'attaquer sp6cifiquement les parties
non~xposécs. Par contre, en photorésistance positive c'est la propriété de photod6gradation qui est utilisée car les panies expos6es aux myons UV seront dégradées et 6liminées, laissant les partie non~xposées intactes. On peut, par exemple à l'aide d'un laser, tracer un patron quelconque sur la surface se trouvant sous le polymère exposé. De plus, puisqu'en se décomposant ce dernier voit sa capacit6 d'absorption des radiations réduite, plus rien n'empêche alors l'interaction de la lumi~re avec la couche située sous le polymère. La panie du polym~re intacte, quant à elle, peut être détruite par oxydation ou pyrolysée, formant ainsi une couche protectrice.
West
cul
(38) ont démontré que les polysilanes jouent le rôle de photoinitiateur dans la polymérisation du styrène et du métacrylate de méthyle. La réaction consiste à placer une quantité de monomère en présence d'une petite quantité de polysilane et d'ex}JOser ce mélange à la lumière. West explique que sous l'action de la lumi~re des unités silènes sont produites. Celles-ci seraient de bons capteurs d'oxygène et pourraient simultanément provoquer la polymérisation des monom~res. Ccci, toujours selon l'auteur, expliquerait le faible rendement photonique de l'organopolysilane danst
(
-18-son rôle de photoinitiateur puisque l'es~ce initiatrice - le sil~ne - est si r6Bctif que trh peu survivent assez longtemps pour induire une polym6risation .
(
-20-2.1 Ioggducdon
Comme nous l'avons vu, la recherche dans le domaine de la synth~se classique des polysilanes s'est consi~rablement d~velop~e au cours des demi~res ann6es. Dans le domaine de la pr6paration catalytique de ces polym~res, nos pr6d6cesseurs ont ouven de nouvelles voies. Mais beaucoup de questions sont encore sans ~ponse. C'est dans
ce contexte, qu'a été entreprise une étude plus approfondie de la polymérisation des organosilanes primaires sous l'influence catalytique du CP2ZrMe2'
Le choix de diméthylzirconocène comme catalyseur, pour 1'6tude systématique de l'influence des paramètres de base de ce système se justifie facilement. En effet, ce dernier est un des plus actifs composés organométalliques, pour la polymérisation des organosilanes primaires découverts à ce jour. Même si ce complexe est très sensible à l'air, il est relativement facile à préparer. Des études sommaires du système à base de titane (72) ont déjà été réalisées. Celles~i démontrent que le poids moléculaire moyen (~) des polymères produits était plutôt il1sensible aux variations des paramètres de base. Ces derniers sont: la concentration du monomère, l'absence ou la présence de solvant, la concentration du catalyseur, la température et la durée de la réaction. Par contre, aucune étude systématique de ceux-ci n'a été réalisée pour le système catalytique à base de zirconium. Une telle étude pennettrait-i:lle d'augmenter ~ des polysilanes? Si oui, il est imponant de comprendre le rôle et l'importance de ces paramètres. A ce stade, deux mises en garde s'imposent afin d'éviter toute confusion, lorsque nous réfèrons à "la méthode de préparation classique des polysilanes", nous faisons allusion à la condensation des dichlorosilanes en présence de sodium. De plus, pour éviter d'alourdir le texte de chiffres, les ~ seront exprimés à l'aide du degré de polymérisation moyen en nombre (OP n)' Ce dernier représente le nombre moyen d'atomes de siliciums présents dans une chaîne polymérique.
la taille de divers polysilanes obtenus à panir du dim6th)'titanoc~ne. Plusieurs techniques furent uti1is~es lors de ces ~tudes: l'infra-roule (IR), la r6sonance
magn~tique nucl~airc (RMN), la spectroscopie de misse (SM), l'osmom6trie de pression de vapeur (OPV) et la chromatographie par pc~ation de gel (CPO). Les conclusions de l'auteur sont les suivantes: les poly~res obtenus sont Iin6aires et contiennent des groupements tenninauA -5iH
2R. Les de~s de polyml!risations sont tous d'environ 10 et la dispersion de leurs poids moll!culaires est ~s ~troite.
2.1.1 Les méthodes utilisées pour déterminer la structure des polysilanes préparés à partir du système à base de titane
2.1.1.1
Toutes les résonances observées pour ces polym~res sont relativement larges. Très peu d'infonnations peuvent en être tirées afin de détenniner la structure fine de ces composés. La largeur de ces résonances est probablement due au couplage Si-H, H-H, à la nature atactique du polymère ainsi qu'à la présence de nombreux stéréoisomères cycliques.
Par contre, la séquence pulsée DEPT en RMN-29Si pennet d'identifier qualitativement la présence des groupements -SiH, -SiH
2 et -SiH3. Ainsi l'auteur (80) démontra la prédominance des -SiH et la présence en faible quantité de groupements -5iH
2 pour le poly(n-hexylsilanc) et le poly(phénylsilane).
2.1.1.2 L'infra-rouge
Deux bandes caractérisent les polysilanes: la premiè"'C due aux étirements Si-H (v Si-H, 2100 cm -1) la seconde, une vibration de défonnation déjà
<
--22-attribu6e à un groupement
-S~
(8Si~,
900 cm-I). La pr6scnce constante decette demi~re constitue une preuve de la pr6scnre de groupements -S~ terminaux. De plus, Harrod a d6montr6 que l'intensit6 et la position de ces bandes d6pendent du
poids molkulaiœ des composeSs (80).
2.1.1.3 OPVetÇPQ
Une ~tudc préliminaire par OPV avait permi d'~valuer le degr6 de polymérisation moyen en nombre (CP n) de ces polymères (80). Gén~ralement les
ms
n étaient tous d'environ 10. Les résultats obtenus par CPG sont assez en accord avec ceux mesurés initialement par OPV. De plus, la CPG a permis de d6moDtrer le caractère bimodal et l'étroitesse de la distribution des poids moléculaires de ces polymères. Typiquement. la fraction de haut poids contient des espèces dont la longueur des chaînes varient de 14-16 atomes de silicium. La fraction de bas poids moléculaire semblait être uniquement composée d'une seule espèce dont les chaines contiennent environ 9 atomes de silicium.2.1.1.4 La spectroSCQPie de masse
Harrod
U
(80) a rapporté une étude comparative entre le patron de fragmentation du pentaphénylpentasilane préparé par l'auteur et celui de l'hexaphénylcyclohexasilane déjà rapporté par Hengge (vide supra). Cette étude suggèn qu'il est possible d'identifier les polymères lin~aires et cycliques. En effet, ces derniers possèdent des patrons assez différents. Pour les composés cycliques, l'abondance relative de l'ion moléculaire est assez élevée. Pour les f101ymères linéaires. celui-ci est presqu'absent.r6ponse non 6quivoque quant lia structu~ ct la taille de, polyd~s.
2.2 Panic;
cg&imcma'c
2.2.1 Instrumentation
Les spectres infr.t-rouges des poly(ph6nylsilanes) furent obtenus par formation de film sur une plaque d'iodure de c6sium. Les spectres IR des poly(benzylsilanes) et poly(n-hexylsilanes) furent r6a1is6s en plaçant une mince couche de l'échantillon étudié directement sur une plaque de bromure de potasium. Tous les spectres furent enregistrés à l'aide d'un appareil Perkin-Elmer de mod~le 297, entre 4000 et 200 cm -1. La bande de référence choisie fut celle d'un film de
polyst~ne
située à 1601 cm -1. La résolution est de l'ordre de 4 cm -1.Les spectres de résonance magnétique nucléaire de proton (RMN-1H) ont été enregistrés sur un spectromère Varian de mod~le XL-200 à transform6e de Fourier. Les spectres de RMN-29Si furent enregistrés à l'aide du modèle XL-300. Les déplacements chimiques (± 0.05 ppm) rapponés plus loin, sont exprimc!s par rapport au tétraméthylsilane (TMS) à 0.00 ppm. Dans certains cas, le TMS ne fut pas ajouté aux échantillons. Pour ces derniers. la référence fut obtenue à partir de la résonance résiduelle protonique du solvant deutérié.
Les mesures de poids moléculaire furent réalis6es selon deux techniques. La première: l'osmométrie de pression de vapeur (OPV), à l'aide d'un appareil Corona-Wescan de modèle 232A. Le toluène de qualite! spectrale fut utilisé comme solvant. Toutes les mesures furent effectuées à 50°C. La précision de cette m6thode est évaluée à
±
70 Daltons. La seconde méthode de mesure de poids molc!culaire fut la chromatographie par penné"tion de gel (CPO). Un apparei' de la compagnie Varlan modèle 5000 équipé d'une colonne ultrastyragel 500 Â de la compagnie Waters-24-Associates furent utilis6s. Le t6trahydrofuranne (THF) de qualit6 HPLC fut utilis6 comme 61uant à un d6bit de 1 ml min -1. La temp6rature du d6tecteur à indice de n!fraction ainsi que celle de la colonne furent maintenues à 30.00
±
o.osoe.
Les standanls utilis6s 6taient constitu6s d'6chantillons de polystyœne obtenus respectivement des compagnies Polysciences et Toyosoda Manufacturing Co. Lld. La précision de cette m6thodc est 6valu6e à±
40 Daltons.Les 6tudes de spectroscopie de masse (SM) furent r6alis6es avec un spectromètre ZAB-HS de modèle 2F. Les échantillons furent inject6s en mode direct. L'énergie d'impact électronique fut de 70 eV, et la température de la sonde variait de 60 à 280°C.
2.2.2 Manipulations
Sauf dans certains cas particuliers décrits plus loin, toutes les manipulations ont été effectuées sous atmosphère inette par la technique de Schlenk (90,91). L'argon de qualité UHP (Linde), fut utilisé tel quel sans aucune purification.
Le toluène fut séché par chauffage à reflux sur un mélange de sodium et de benzophénone, puis distillé sous atmosphère inette (92). Pour chaque expérience le toluène fut dégazé par au moins trois cycles gel-dégel juste avant d'être utilisé. Le toluène pour OPV et le THF pour la chromatographie par perméation de gel furent dégazés par barbotage d'argon à OOC pendant 15 à 20 minutes par litre de solvant et conservés sous atmosphère inene.
Toute la verrerie: éprouvette de Schlenk, adaptateur, etc... fut préalablement séchée à l'étuve pendant au moins 24 hrs à 110°C avant d'être utilisée. De plus, celle-d fut assemblée à chaud. Une fois le montage tenniné celui-ci fut passé à la flamme et refroidi sous vide juste avant l'utilisation.
trichlorohexylsilane (Petra."Ch) et le dichloro-bis(cyclopcntadi~nyl)zirc:onium(IV) (Aldrich) furent obtenus commercialement et utilis6s tels que reçus. Le. or,lnolilane. suivants: le ph~nylsilane, le benzylsilane, le n-hexylsilane et le ph~nc!thylsilane furent p~parés selon la m~thode d~crite par Finholt
cul
(93) avec des Rndements de 75 • 85%. Ces monom~Rs furent d6gaz~s par de nombreux cycles gel~lel et conserv6. sous atmosph~re inerte. ~ dim6thylzirconoc~ne (Cp2ZrMe2) fut synth6ti~ selon une méthode publi6e (94). Le rendement de cette synth~se varie de 70 à 80'1. Ce catalyseur fut toujours fraîchement pr6paré et utilisé le jour même.Pour chacun des organosilanes, une ~rie d'essais de polym6risation sous diverses conditions furent réalisées. Celles-d sont présentées aux tableaux 2.1 et 2.2. Pour tous ces essais, le catalyseur fut transféré à sec à l'aide d'une allonge coud6e. La quantité de catalyseur placée dans une éprouvette de Schlenk s~che fut d6tennin6e par différence de masse. Tous les liquides: solvants, monomères, et autres mélanges furent introduits à l'aide de seringues. Un essai typique est décrit ici. Dans une éprouvette Schlenk sèche, on transfert 30.0 mg (0.12 mmole) de catalyseur. Cc dernier est ensuite dissous sous agitation dans 1.0 mL de toluène. Aussitôt le catalyseur dissout, 1.0 ml (8.0 mmole) de phénylsilane est ajouté à la solution. Sauf mention contraire, tous les essais de polymérisations furent effectu6s sous agitation magn6tique constante et à l'abri de la lumière. Une fois la réaction complét6e, le m61ange est chromatogr<t.phié à l'aide d'une colonne ( 1 cm x 25 cm) de Florisil (60 - 100 mesh Fisher) éluée avec environ 300 mL de toluène fraîchement distillé. Après élution le toluène est vaporisé avec un évaporateur rotatif. A quelques reprises, il fut nécessaire d'utiliser du néo-pentane sec et dégazé afin de faciliter d'élimination du toluène. Finalement, le séchage du polymère est complété en le laissant sous pression r6duite (10-2 mm de Hg) pendant une période minimale de 24 heures avant d'être
caractéri~.
(
Tableau 2.1 # Essai 1 2 3 4 5 6 7 8-26-2.2.3 Polym6risation catalytiQue du phgnylsilane par le
dim6tbylzjrcoooctne
Sommaire des essais de polymérisation catalytique du phénylsilane avec le diméthylzirconoœne
[Monomère] (M) 8.00 8.00 8.00 8.00 5.30 4.00 2.70 4.00 Solvanta 1 1 1 1 2 2 2 2 [Cat]
(M)
0.075 0.160 0.259 0.375 0.087 0.080 0.090 0.078 Durée (jours) 3 3 3 3 3 3 3 20a 1. essais réalisés en absence de solvant à température ambiante 2. essais réalisés en présence de solvant à température ambiante
2.2.4
Râction
entre le polyCpMnylsUanel.le
»Mnylsi1anc. le gjcblompbgnylsi1aoe et1'6tbaool
Typiquement, 1.0 mL d'une solution de poly(ph6nylsilane) (1.0 g mL -1) dans le tolu~ne fut lentement ajout6e à environ 10.0 à 15.0 mL d'6thanol froid (Ooe). Ceci afin de purifier par pr6cipitation le polym~re. Dans un premier temps, le polym~re pr6cipitait mais très tôt celui-ci repassait en solution. Celle-ci fut chromatographi6c (Florisil) et 6lu6e avec environ 100 mL de tolu~ne. Ce dernier fut 6vaponS sous pression Iéduite et environ 0.5 mL d'un liquide incolore et limpide fut récupéré. Après caractérisation, par RMN-1H celui-ci 6tait du triéthoxyphénylsilane.
D'autres exp6riences de contrôle furent réalisées afin de confmner la nature du produit initialement obtenu. Ainsi, 5.0 ml (40 mmole) de phénylsilane furent lentement ajoutés à température ambiante à 7.0 ml (120 mmole) d'éthanol absolu. La réaction fut complète, très rapide et exothermique. De plus, aucune purification ne fut nécessaire. Après caractérisation de ce liquide incolore, seul le triéthoxyphénylsilane était présent.
De plus, 5.0 mL (31 mmole) de trichlorophénylsilane furent réagit dans les mêmes conditions à S.4 mL (93 mmole) d'éthanol absolu. Encore une fois seul le triéthoxyphénylsilane fut obtenu. Les spectres RMN_1H de ces produits sont identiques à celui enregistré lors de la réaction entre le poly(phénylsilane) et l'éthanol.
l
Tableau 2.2 #Essai 1 2 3 4 5 6 7 8 9 10 11 12-28-2.2.S PolynWisation du benmsilane par
le
<liIœtbylzirçonocboe
SolJllDaÏ1'e des essais de polym6risation du benzylsilane avec le diméthylzirconocène [Monomère] Solvanta (M) 7.36 1 4.91 2 3.68 2 2.45 2 7.36 1 4.91 2 3.68 2 2.45 2 2.45 2 3.68 2 3.68 2 2.45 2 [Cat] (M) 0.148 0.092 0.081 0.047 0.148 0.099 0.069 0.045 0.038 0.076 0.080 0.099 Temps Température b (Db joms) (oC) 7 50 7 50 7 50 7 50 7 20 7 20 7 20 7 20 16 20 21 20 7 50 7 20
a 1. essai réalisé en absence de solvant 2. essai réalisé en solution dans le toluène
..-..
2.2.6 Sommaire des essais de golygrisation du o-belylsUano IOUJ diverses conditions
L'ensemble de ces essais n'a pas 6t6 r6sum6 ici. Les raisons justifiant un tel choix sont p~sent6es à la section des r6sultats et discussion.
2.3 N.ultats ct discussion
2.3.1 Introduction
A prime abord, il nous avait semblé que l'étude systématique des paramètres de bases d'un système catalytique homogène serait plus facile que celle d'une catalyse hétérogène. De plus, notre système possède des avantages indiscutables par rapport à la méthode classique: conversion rapide ct quantitative du monom~re, utilisation de faible quantités de complexe organométallique. production de polym~re presque monodispersé et une purification simple et peu coûteuse. Cette méthode pennet l'obtention directe de polymères contenant des fonctions Si-Ho Ces demi~res. très réactives peuvent être le point de départ pour des réactions d'hydrosilation et/ou de réticulation.
n
est certain que les polymères de haut poids ainsi produits pos~deront des propriétés chimiques et physiques intéressantes.2.3.2 Caractérisation et pro.priétés physiQyes dy poly(ph6nylsilane>
Tous les poly(phénylsilanes) obtenus sont des solides blancs vitreux. Plus précisement. des thermoplastiques solubles dans: le tolu~ne. le benzène, l'éther éthylique et le 1lIF. La température de fusion de ces matériaux varie de 7S à 77°C en fonction de OP n' Ces valeurs se comparent à celles rapportés par Barry (78) pour le