Variabilité temporelle, diversité et biogéographie
des ciliés et dinoflagellés dans l’Océan Arctique
Thèse
Deo Florence Onda
Doctorat interuniversitaire en océanographie
Philosophiae Doctor (Ph. D.)
Québec, Canada
ii
Variabilité temporelle, diversité et biogéographie
des ciliés et dinoflagellés dans l’Océan Arctique
Thèse
Deo Florence Onda
Sous la direction de :
Connie Lovejoy, directrice de recherche
Marcel Babin, codirecteur de recherche
iii RÉSUMÉ
Des impacts du changement climatique sur les communautés de phytoplancton microbien ont déjà été reportés dans l'océan Arctique. Cependant, peu d’attention a été portée sur le microzooplancton aux rôles écologiques multiples tels que les ciliés et les dinoflagellés. Le but de cette thèse était d'améliorer les connaissances et la compréhension de l'écologie du microzooplancton, mais aussi de permettre la prédiction de leur réponse dans un Arctique en mutation. Nous avons utilisé la technique de séquençage d'amplicons à haut débit du gène 18S ARNr et de l'ARNr 18S (à partir d'ADNc) afin d’étudier le profil des communautés ainsi que leur diversité. Par la suite, nous avons testé différentes hypothèses reposant sur les variations temporelles et spatiales de ces assemblages microzooplanctoniques. Les résultats ont montré que le microzooplancton présente une forte saisonnalité dans le golfe d'Amundsen en réponse aux conditions changeantes. Des assemblages estivaux semblables ont été observés de 2003 à 2010, à l'exception de juillet 2008, après le record de minimum de glace en été 2007. Cet évènement particulier a permis de nous indiquer une sensibilité de ces espèces face aux conditions de glace. Les communautés de dinoflagellés du bassin du Canada sont régies par des processus déterministes et stochastiques qui dépendent de la variabilité de l'environnement, indiquant une sensibilité potentielle aux changements environnementaux. Nous en avons déduit que les dinoflagellés et autres taxons apparentés, ayant des rôles fonctionnels similaires, peuvent fournir une stabilité des flux alimentaires et énergétiques dans des conditions de limitation de lumière ou de nutriments, associées à l’approfondissement de nitracline. Étant donné que de nombreux ciliés et dinoflagellés sont mixotrophes, ils pourraient indirectement influencer les cycles biogéochimiques par le broutage sur les bactérivores et le petit plancton, et ainsi relier la boucle microbienne avec les niveaux trophiques supérieurs. La grande diversité et l'ubiquité des ciliés et des dinoflagellés suggèrent également une complexité dans les réseaux trophique microbiens et de nouvelles possibilités de recherche pour les océanographes.
iv
ABSTRACT
Impacts of climate change on microbial communities in the Arctic Ocean have been mostly reported for major phytoplankton groups, with less attention to microzooplankton, such as ciliates and dinoflagellates, which have multiple ecological roles. For example, many ciliates and dinoflagellates are mixotrophic and could indirectly influence biogeochemical cycles by grazing on bacterivores and small plankton and linking the microbial loop with the higher trophic levels. The aim of this thesis was to address knowledge gaps in microzooplankton phylogeny, ecology and distribution with a goal of providing information needed to eventually predict of microzooplankton responses to the changing Arctic. We used high throughput amplicon sequencing of the 18S rRNA gene and 18S rRNA (as cDNA) to generate community and diversity profiles, which were used to test hypotheses on microzooplankton assembly across time and space. Results showed that microzooplankton exhibited strong seasonality in response to changing conditions in Amundsen Gulf. Similar summer assemblages were seen from 2003-2010 with the exception in July 2008 following the summer ice minimum record in 2007. Canada Basin dinoflagellate communities were governed by both deterministic and stochastic processes that were dependent on the variability of the environment, indicating potential sensitivity to environmental change. We inferred that dinoflagellates and other taxa with similar functional roles could provide stability to food and energy flows under conditions of light- or nutrient-limitation associated with a deepening nitracline. The high diversity and ubiquity of ciliates and dinoflagellates also suggest a complexity within microbial food webs and new research opportunities for oceanographers.
v
TABLE DES MATIÈRES
RÉSUMÉ ... ii
ABSTRACT ... iv
TABLE DES MATIÈRES ... v
LISTE DES TABLEAUX ... viii
LISTE DES FIGURES ... ix
LISTE DES TABLEAUX SUPPLÉMENTAIRES ... xi
LISTE DES FIGURES SUPPLÉMENTAIRES ... xii
LISTE DES ABRÈVIATIONS ... xiv
REMERCIEMENTS ... xvii
AVANT-PROPOS ... xix
CHAPITRE 1: INTRODUCTION GÉNÉRALE ... 1
1.1 L’Océan Arctique et l’Arctique canadien ... 1
1.1.1 Golfe d’Amundsen ... 3
1.1.2 bassin Canada ... 3
1.2 La succession d’eucaryotes microbiens dans un Arctique stratifié ... 4
1.2.1 Banquise et eau de surface ... 5
1.2.2 L’Halocline du Pacifique et le Maximum de Sub-surface en Chlorophylle (MSC) ... 7
1.3 Vue d’ensemble des ciliés et des dinoflagellés ... 8
1.3.1 Ciliés ... 9
1.3.2 Dinoflagellés... 9
1.3.3 Les fonctions trophiques des ciliés et des dinoflagellés ... 10
1.4 Identification et classification des communautés microbiennes ... 12
1.5 Méthodes statistiques... 13
1.5.1 Mesures de Dissimilarité et regroupement ... 13
1.5.2 L'analyse canonique de la correspondance (ACC) ... 14
1.6 Les communautés microbiennes dans un Arctique en changement ... 14
1.7 Objectifs et structure de la thèse ... 16
Chapter 2: Seasonal and interannual changes in ciliate and dinoflagellate species assemblages in the Arctic Ocean (Amundsen Gulf, Beaufort Sea, Canada) ... 19
Résumé ... 19
Abstract ... 20
2.1 Introduction ... 21
2.2 Materials and Methods ... 22
2.2.1 Sample collection, extraction and sequencing... 22
2.2.2 Post-sequence data processing and taxonomic classification ... 24
vi
2.3 Results ... 26
2.3.1 Physico-chemical regimes of the Amundsen Gulf ... 26
2.3.2 Community clustering based on 18S rRNA and 18S rRNA genes ... 26
2.3.3 Seasonal succession and distribution ... 27
2.3.4 Interannual variability ... 28
2.4 Discussion ... 28
2.4.1 Interpretation of DNA and RNA-derived abundances and diversity ... 29
2.4.2 Environmental influences on microzooplankton ... 30
2.4.3 Ecological functions ... 31
2.4.4 Interannual microzooplankton turnover and the changing Arctic ... 31
2.5 Acknowledgments ... 33
2.6 Author Contributions ... 34
Chapter 3: Dinoflagellates (Dinophyceae) in size fractionated samples from Canada Basin, Western Arctic Ocean ... 50
Résumé ... 50
Abstract ... 51
3.1 Introduction ... 52
3.2 Materials and Methods ... 54
3.2.1 Sampling and sequencing ... 54
3.2.2 Bioinformatics and small fraction-associated Dinophyceae OTU picking ... 56
3.2.3 Phylogenetic placement of short reads ... 57
3.2.4 Statistical and ecological network analyses ... 58
3.3 Results ... 58
3.3.1 Physico-chemical profiles of the sampling sites ... 58
3.3.2 Small fraction-associated dinoflagellate diversity ... 59
3.3.3 Community structuring and correlation with environmental variables ... 59
3.4 Discussion ... 60
3.4.1 Linking ratio of fractionated rDNA reads to potential cell characteristics ... 61
3.4.2 Phylogenetic identity of small-fraction associated Dinophyceace ... 62
3.4.3 Distribution and potential ecologies ... 63
3.5 Conclusions ... 65
vii
Chapter 4: Assembly rules governing dinoflagellates and their potential responses to changing
Western Arctic Ocean ... 81
Résumé ... 81
Abstract ... 82
4.1 Introduction ... 83
4.2 Materials and Methods ... 85
4.2.1 Study sites, sample collection and processing ... 85
4.2.2 DNA-RNA extraction, sequencing and bioinformatics processing ... 86
4.2.3 Community diversity and statistical analyses ... 87
4.3 Results ... 89
4.3.1 Environmental characteristics and general features ... 89
4.3.2 Community Similarity and Phylogenetic structuring ... 89
4.3.3 rRNA to rDNA ratios and taxonomic distribution ... 91
4.4 Discussion ... 92
4.4.1 Environmental variability and selection processes ... 92
4.4.2 Community structuting and variability in life cycle strategies ... 95
4.4.3 Dinoflagellate communities in the deepening nitracline ... 95
4.5 Conclusion ... 97
4.6 Acknowledgments ... 97
CHAPTER V. GENERAL CONCLUSIONS ... 111
5.1 Synthesis of the study ... 111
5.2 Perspectives ... 113
5.2.1 Databases and taxonomic classification ... 114
5.2.2 Limitations of 18S rRNA gene for ciliate and dinoflagellate studies ... 115
5.2.3 Microzooplankton in Arctic food web models ... 116
viii LISTE DES TABLEAUX
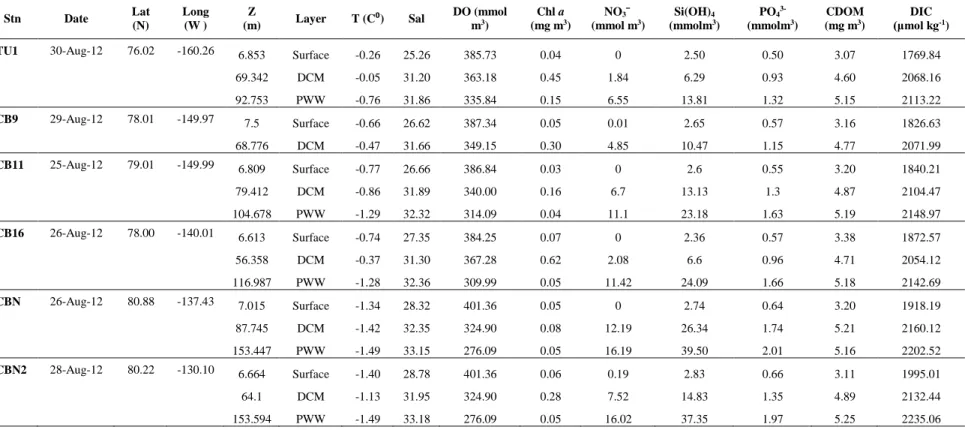
Table 2.1. Dates of collection 2007 -2008 (Date), Stations (Stn), collection Latitude and Longitude (Lat-Long), physico-chemical parameters and chlorophyll a (mg.m3 Chl a) concentrations of the samples used for amplicon tag pyrosequencing. Other column names refer to day length (DayL), depth (Z) of sampling, temperature (T), salinity (S), nitrate+nitrite (NO3¯mmol m3), phosphate (PO43-mmol m3),dissolved oxygen (DO mmolm3) and Photosynthetically Active Radiation (µE m-2 s-1 PAR). na: not available. ... 34 Table 3.1. Stations (Stn), dates of collection (Date), collection Latitude and Longitude (Lat-Long),
physico-chemical parameters and chlorophyll a (Chl a) concentrations of the samples used for amplicon high throughput sequencing. Other column names refer to depth (Z) of sampling, depth category (Layer), temperature (Temp), salinity (S), dissolved oxygen (DO), nitrate (NO3 ¯), silicate (Si(OH)4), phosphate (PO43-), colored dissolved organic matter (CDOM) and
dissolved inorganic carbon (DIC). ... 67 Table 4.1. Station name (Stn), Dates of collection 2012-2013 (Date), collection Latitude and
Longitude (Lat-Long), and physico-chemical parameters of the samples used for amplicon tag Illumina sequencing. Other column names refer to depth (Z) of sampling, temperature (T), salinity (S), dissolved oxygen (DO), Chlorophyll a fluorescence (Chl a mg m3), nitrate (NO3¯ mmol m3), silicate (SiO4 mmol m3), phosphate (PO43 mmol m3),conductivity (Cond), colored dissolved organic mtter (CDOM mg m3), dissolved inorganic carbon (DIC x102 μmol kg-1), alkalinity (Alk x102 μmol kg-1), bacterial (Bact x104 cell ml-1), picoeukaryotic (Pico cell ml-1) and nanoeukaryotic (Nano cell ml-1) cell counts. na: not available. ... 99
ix LISTE DES FIGURES
Figure 1.1. Projection polaire de la region de l’Arctique (60-90⁰ N). ... 1 Figure 1.2 Emplacements du Bassin Canadien (image à gauche) et du Golfe d’Amundsen (boîte
rouge), qui ont été les sites d’étude. Image generee par Ocean Data Viewer (ODV; Schlitzer, 2016)… ... 2 Figure 1.3.Un schéma simplifié du réseau trophique arctique où la préférence de taille joue un rôle
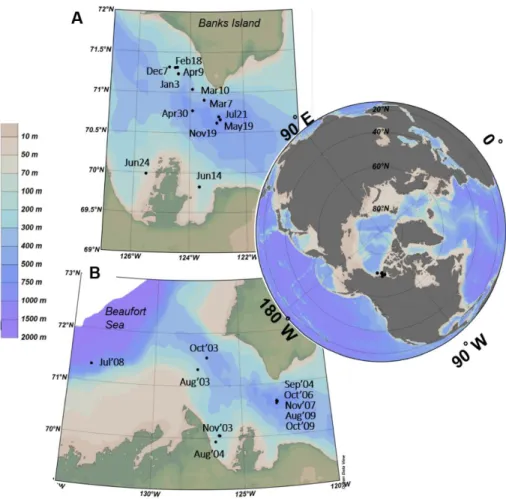
important. Notez la position des ciliés et des dinoflagellés en tant que prédateurs de petit phytoplancton que de proies pour le plus large zooplancton (redessiné de Glöckner et al.,2012, p. 27, original de Sandaa, 2009) ... 5 Figure 2.1. Sites and dates of collection of water samples used for A) seasonal (November 2007-July
2008) and B) interannual (2003-2010) studies from the Amundsen Gulf region and adjacent Darnley and Franklin Bays. ... 36 Figure 2.2. A dendrogram of the unweighted UniFrac dissimilarity matrix for both DNA- (filled
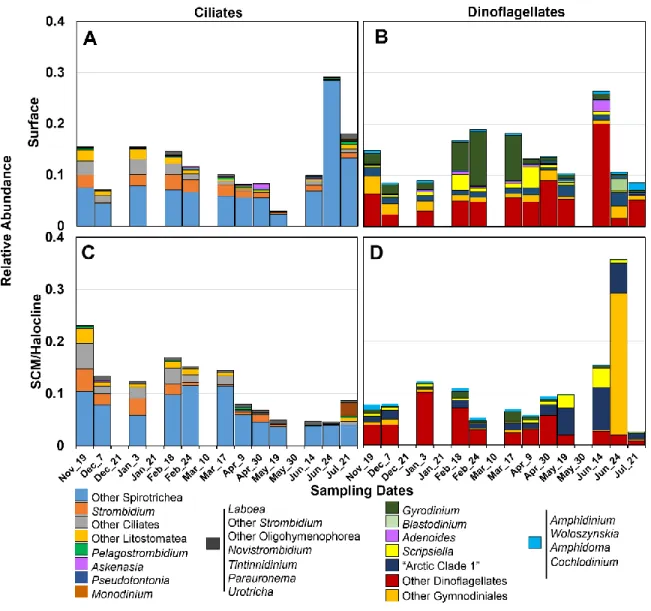
shapes) and RNA-based (open shapes) communities collected from surface (triangles) and subsurface chlorophyll maxima/halocline (SCM; circles) layers representing different seasons including Autumn-Winter (AW) and Spring -Summer (SS), collected over the course of the IPY-CFL study. ... 37 Figure 2.3. Distribution of potentially active (based on rRNA reads) major taxa of the lowest possible
ranks in (A, C) ciliates and (B, D) dinoflagellates (98% level) with the changing seasons (sampling date) in surface and SCMhalocline layers (see text). Samples were collected from Amundsen Gulf, Darnley Bay and Franklin Bay. ... 38 Figure 2.4. A network source-target plot showing the significant correlations of OTUs binned at the
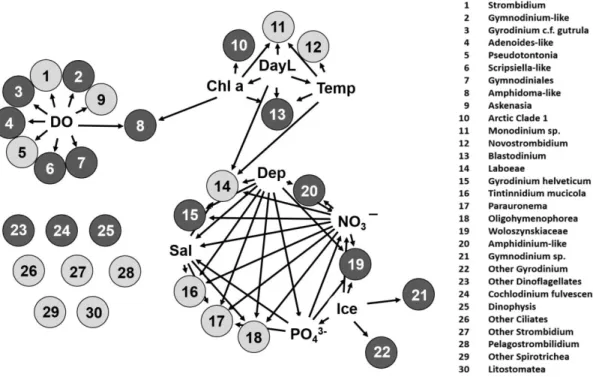
lowest possible ranks (relative abundances) and square root transformed environmental parameters. Only vertices (circles) and edges (arrows) that have Spearman’s rho >0.3 significant at p<0.001 were retained. Black circles are dinoflagellates and grey are ciliates. Environmental variables tested include dissolved oxygen (DO), total chlorophyll a (chl a), daylength (DayL), temperature (Temp), depth (Dep), salinity (Sal), nitrate+nitrite (NO3¯), phosphate (PO43-) and ice. Numbers correspond to the identities on the right. ... 39 Figure 2.5. (A) The pairwise unweighted UniFrac community dissimilarity of combined ciliate and
dinoflagellate communities. In the boxplots, one point (dot) represents the pairwise Unweighted UniFrac dissimilarity (Y-axis) of a particular sample against another sample. Thus, for each date there are 10 dots (overlapping dots are obscured) representing that date compared against 10 dates. The black line within the box, is the mean UniFrac distance of a particular sample against all the other samples. The broken line indicates the mean dissimilarity value among all samples. (B) Combined relative abundances of the major taxa contributing to the high July 8 dissimilarity, particularly of Strombidium, Laboea, Monodinium sp. and other unclassified ciliates. ... 40 Figure 3.1. Map of the stations (red circles) where samples used in this study were collected from
Western Canada Basin and Northwind Ridge in August 2012 onboard the CGGS Louis S St.
Laurent. ... 68
Figure 3.2. Salinity (a), temperature (b) and chlorophyll a fluorescence (c) plots of the six stations (color coded) used in this study... 68 Figure 3.3. Dinoflagellate OTUs were grouped according to the ratio of their rDNA reads in large
(>3 µm) over small (0.2-3 µm) fractions that were generated by high throughput sequencing from the surface, DCM and PWW m depths (see text) collected from Western Arctic Ocean
x
(Canada Basin). Negative Log10 values indicate small fraction-associated OTUs (small-associated) and positive are large fraction-associated OTUs (large-(small-associated). Not shown are OTUs that had equal chances (0 Log10) of being found in both fractions. ... 69 Figure 3.7. An ecological network showing strong and positive co-occurrences (Spearman’s rho
>0.6, p<0.01) of the Syndiniales and their potential microplankton hosts (ciliates,
dinoflagellates and radiolarians) generated from highly abundant OTUs (>100 reads). The different taxonomic groups are represented by the colored nodes, while varied thickness of the edges (black lines) refer to the level of Spearman’s correlation. The numbers refer to
significant clusters or grouping of highly connected co-occurrences, while the shapes correspond to depths where the OTUs were most abundant based on rRNA reads. The 21 small-associated dinoflagellate OTUs were excluded from this particular analysis since they were assumed to be inactive cysts. ... 73 Figure 4.1. Map of the stations in the northern and western regions of Canada Basin including the
Northwind Ridge (Stn. TU-1) White circles indicate stations uniquely visited in 2012 and black in 2013, while gray circles were visited in both years. ... 101 Figure 4.2. Relationship between selection processes and environmental variability. A.) Bar graphs
showing the range of variation of the standard deviations of within depth Bray-Curtis
Dissimilarities (SDBC) based on depth, temperature, salinity, DO, Chl a, transmissivity, nitrate, silicate, phosphate, conductivity and CDOM values. SDBC in the surface was significantly higher than the DCM and PWW also indicating highest overall variability. B) Phylogenetic structuring of communities (beta-diversity) based on the presence-absence of OTUs
(Unweighted-UniFrac) also showed strong depth-category association clustered using PCoA. Shapes represent year of collection: 2012 (circles) 2013 (triangles) C.) Depth-dependent differences in the relative influences of stochastic and deterministic processes along the three water masses inferred from the within-depth NTI was also observed. All values were > -2 indicating lack of signals of overdispersion or homogenous selection. Colors represent depths in A-C (green=surface, blue=DCM, violet=PWW). ... 102 Figure 4.3. Log transformed rRNA:rDNA ratio based on rarefied read counts of each taxa binned on
lowest possible rank represented by different colors on the right. The size of the circles corresponds to the number of OTUs of the same taxonomic ranking. A) surface, B) DCM and C) PWW waters ... 103 Figure 4.4. Heatmap based on the level of activity (rRNA reads) of the most abundant OTUs binned
to the lowest possible ranks. Distribution of these taxa mostly clustered by depth, where photosynthetic-mixotrophic groups were more abundant in the surface and DCM while heterotrophic taxa dominated in the DCM and mostly in PWW. Colored bars represent depths (green= surface, blue=DCM, violet=PWW) and clustering was determined using UPGMA approach. ... 104
xi LISTE DES TABLEAUX SUPPLÉMENTAIRES
Supplementary Table S2.1. Proportion of large (>3 µm) and small (0.2-3 µm) fractions in the normalized tag pyrosequencing based on size-fractionated chlorophyll a concentrations
estimated from the original samples. ... 41 Supplementary Table S2.2. Summary of physico-chemical data associated with the interannual
samples collected during summer to fall in the Amundsen Gulf and Beaufort Sea from 2003-2010. na: not available. ... 41 Supplementary Table S2.3. Summary of the OTUs in the surface shared by Jan 3 and Jun 14
samples but not present in the other summer samples from June 24 and July 21. ... 42 Supplementary Table S2.4. Summary of dinoflagellate OTUs detected in the seasonal data per depth
(surface and halocline/SCM) and their corresponding identities and abundances in RNA and DNA libraries. ... 43 Supplementary Table S2.5. Summary of ciliate OTUs detected in the seasonal data per depth
(surface and halocline/SCM) and their corresponding identities and abundance in RNA and DNA libraries. ... 43 Supplementary Table S3.1. Summary of the stations and depths sampled (surface, deep chlorophyll
maxima [DCM], PWW), and the fraction (small/large) and type of samples (RNA/DNA) used in this study. ... 74
xii LISTE DES FIGURES SUPPLÉMENTAIRES
Supplementary Figure S2.1. The mean number of OTUs in the different seasons, summer (Jul-Sep) and autumn (Oct-Nov), of ciliates and dinoflagellates collected from 2003 to 2010. No
significant difference was observed between these seasons within each taxa/group.
Dinoflagellates however were generally more abundant than ciliates (p<0.001). OTU picking was carried out using USEARCH 7 and compared against the SILVA database at 98%
similarity. ... 45 Supplementary Figure S2.2. Bray-Curtis similarity clustering of 9 environmental variables of the
seasonal surface and halocline/SCM samples in the Amundsen Gulf and Franklin Bay. Shapes indicate surface (triangle) and halocline/SCM (circle) depths. Samples from Darnley Bay (DB) are marked with red stars while those from Franklin Bay are indicated with blue stars. The samples grouped by depth and season rather than geographical location, except for the June 14 samples from DB. ... 46 Supplementary Figure S2.3. Species richness (Chao1 index) based on DNA also changed with
season (Julian Day). A significant decrease in richness in the total eukaryotic community was observed in the months after mixing and loss of ice (broken lines). Halocline/SCM-based richness (circles) was also significantly higher than the surface (triangle) in the samples
collected from Amundsen Gulf (AG), Darnley Bay (DB) and Franklin Bay (FB). ... 47 Supplementary Figure S2.4. Annual mean relative abundances of both A) ciliates and B)
dinoflagellates relative to the total eukaryotic microbial community based on 11 samples collected over an 8-year period from 2003 to 2010 in the SCM of the Amundsen Gulf and Beaufort Sea. ... 48 Supplementary Figure S2.5. A maximum likelihood gene tree generated from nearly full length 18S
rRNA gene sequences showing the placement of the most abundant “Other Ciliates” OTUs from the interannual data, here represented by their most similar reference sequences (OTU 1-14). Arrows indicate significant increase or decrease in abundance after 2007, tested using Krustal Wallis H-Test implemented in STAMP (Parks et al., 2014). The tree was constructed using RaxML with bootstrap support repeated 1000 times. Only bootstrap values higher than 50 are shown. The short HTS OTU reads were mapped back to the tree using
RaxML-Evolutionary Placement Algorithm (RaxML-EPA). ... 49 Supplementary Figures S3.1. An 18S rRNA gene reference trees generated by RaxML approach,
which was used to identify HTS-derived reads of small-associated core dinoflagellates OTUs, also described in Figure 3.4A. ... 75 Supplementary Figures S3.2. An 18S rRNA gene reference trees generated by RaxML approach,
which was used to identify HTS-derived reads of small-associated Syndiniales OTUs in
Syndiniales Group I (A) and Syndiniales Groups II-V (B), also described in Figure 3.4B. ... 77 Supplementary Figure S3.3. Principal components analysis (PCA) ordination of the samples based
on the nutrients (Nitrate, NO3¯; Phosphate, PO43-; Silicate, Si(OH)4), salinity (Sal), temperature (Temp), dissolved organic carbon (DIC), dissolved oxygen (DO) and chlorophyll a (Chl a) fluorescence values. Only variables that had significant contributions (marked by red arrows) are shown. Shapes indicate depth categories surface (square), deep chlotophyll maxima
(triangle) and PWW (circle). ... 78 Supplementary Figure S3.4. Principal coordinates analysis (PCoA) plot based on Unweighted
UniFrac (presence-absence) computed from small rDNA of the 143 selected putative picodinoflagellate OTUs showed that samples clustered by depth (surface=square,
xiii
Supplementary Figure S3.5. OTU-level likelihood occurrences of picoplanktonic Mamiellophyceae using ratios of rDNA reads in fractionated samples (large/small). The log10 values of the ratios were mostly negative, suggesting that most Mamiellophyceae were small fraction-associated and truly picoplanktonic. OTUs that were more positive or large fraction-fraction-associated may have been concentrated together with predators or associated with flocs of marine snow. ... 79 Supplementary Figure S3.6. Order/genus-level likelihood occurrences using ratios of rDNA and
rRNA relative abundances (from binned OTUs) in fractionated samples (large/small) showed that dinoflagellates could be grouped according to these ratios. Class 1 is composed of taxa whose rDNA and rRNA both occur more on the larges. Class 2 is made up of taxa whose rDNA are more on the large fraction, but rRNA with equal odds of being found in both
fractions. Class 3 are taxa that have rDNA found more in the large, but rRNA in small fraction, while Class 4 are taxa that have higher odds of being found in the small fraction for both rRNA and rDNA reads... 80 Supplementary Figure S4.1. Abundances of the different major taxonomic groups relative to the
total microbial community in the different depths (surface, DCM and PWW – see text) and fractions (small and large) based on (A) rRNA and (B) rDNA. Dinoflagellates were more abundant in the surface and PWW than the DCM. Samples from 2012 and 2013 were arranged starting with the stations from the shallower Northwind Ridge (TU1) northward to CBN2. Included are OTUs present only in either rRNA or rDMA. Not included are the taxa lower than 0.01%. ... 106 Supplementary Figure S4.2. A summarized log10 representation of the fraction association of
dinoflagellate OTU reads in small (0.2-3 um) over large (>3 um) fractions. Gray bars represent 1og10 rDNA reads and black are for log10 rRNA reads. This graph shows that in some OTUs, rRNA were more often found in the small fraction while rDNA reads were more associated with the large fraction, which may indicate effects of size fractionation artitifacts. ... 107 Supplementary Figure S4.3. Comparison of the distribution of rRNA (-log10) and rDNA (+log10)
after aggregation of reads from small and large fractions of the same OTUs. It was apparent that there was a stronger correspondence in the rRNA and rDNA reads of some OTUs after aggregation while others were more abundant in the rRNA than their rDNA and vice-versa, which could indicate environmental filtering. Many OTUs however, were either only present in the rRNA or in the rDNA, which were all removed from the final dataset. ... 107 Supplementary Figure S4.4. A depth-dependent change in the relative influences of stochastic and
deterministic processes (box plots) along the stratified layers of the Arctic inferred from the within-depth NRI was observed based on Net Relatedness Index (NRI) similar to the results of the NTI. Colours represent depths (green=surface, blue=DCM, violet=PWW). ... 108 Supplementary Figure S4.5. A triplot based on Canonical Correspondence Analysis (CCA) with
forward selection showing the association of the samples (sites) and selected dinoflagellate taxa with environmental variables or factors including silicate (S), nitrate (N), phosphate (P), depth (D), coloured dissolved organic matter (CDOM), salinity (Sal), chlorophyll a (Chl a), dissolved oxygen (DO), nanoplankton (Nano), picoplankton (Pico) and bacteria (Bac). Colors represent depths (green=surface, blue=DCM, violet=PWW). ... 109 Supplementary Figure S4.6. Heatmap based on the relative abundance of rRNA reads of the less
abundant taxa based on the lowest possible ranks. Coloured circles represent depths (green= surface, blue=SCM, violet=PWW) and clustering was determined using UPGMA approach.110
xiv LISTE DES ABRÈVIATIONS
18S: Large subunit of the ribosomal gene in eukaryotes ACC : Analyse Corréspondence Canonique
ADN ou DNA: Acide désoxyribonucléiques ou deoxyribonucleic acid AG: Amundsen Gulf
ANOVA: Analysis of variance AO: Arctic Ocean
ARN ou RNA: Acide ribonucléiques ou Ribonucleic acid BC: Bassin canadien
BG: Beaufort Gyre
BLAST: Basic local alignment search tool bp: Base pairs
Bray-Curtis: Bray Curtis Dissimilarity CB: Canada Basin
CBDW: Canada Basin Deep Water (l’eau profonde du basin canadien) CCA: Canonical Correspondence Analysis
CCGS: Canadian Coast Guard Ship
cDNA: complementary DNA generated from RNA, here using reverse transcription CDOM: coloured dissolved organic matter
CFL: circumpolar flaw lead study Chl a: Chlorophyll a
CO2: Carbon dioxide, dioxide du carbon CTD: conductivity, temperature, depth profiler DB: Darnley Bay
DCM: Deep Chlorophyll Maxima (favoured term for the Canada Basin) DIC: Dissolved Inorganic Carbon
DMSP: Dimethylsulfopropionate DO: Dissolved Oxygen
EOL: Encyclopedia of Life
EPA: Evolutionary Placement Algorithm EPE: l’eau du Pacificque d’été
EPH: l’eau du Pacificque d’hiver EPM: d’Eau polaire modifiée FB: Franklin Bay
GB: Gyre de Beaufort
HA: Halocline de l’Atlantique HP: Halocline du Pacifique
HSD: Honest significant difference HTS: High throughput sequencing
IBIS: Institut de Biologie Intégrative et des Systèmes IPY: International polar year
JOIS-BGEP: Joint Ocean Ice Studies – Beaufort Gyre Exploration Project MALVs: Marine alveolates
MSC : Maximum de chlorophyll sous-surface
NCBI: National Center for Biotechnology Information NMDS: Non-metric multidimensional scaling
NO3 ¯: Nitrate
NPZD: Nutrient-Phytoplankton-Zooplankton-Detritus model NRI: Net Relatedness Index
xv NTI: Nearest Taxon Index
NWR: Northwind Ridge OA: L’Océan Arctique
OTU: Operational Taxonomic Unit PAR: Photosynthetically active region PAST: Paleontogical Statistics
PC: Polycarbonate
PCA: Principal Component Analysis PCoA: Principal Coordinate Analysis PCR: Polymerase Chain Reaction PML: Polar Mixed Layer
PO43-: Phosphate
PSW: Pacific Summer Water PWW: Pacific Winter Water
QIIME: Quantitative Insights into Microbiology RaxML: Random AXelerated Maximum Likelihood
rDNA: ribosomal DNA genes, amplicons generated from 18S rRNA gene from DNA rRNA: ribosomal RNA amplicons generated from 18S rRNA from cDNA
SCM: Subsurface Chlorophyll Maxima, more general term used for Amundsen Gulf and adjacent seas
SG: Syndiniales Group Si (OH)4: Silicate
SRA: Short Read Archive (NCBI) Stn: Station
TS: Temperature–Salinity
xvi
To my family, especially my Tatay and Nanay, Rodantes C. Onda and Carmencita L. Onda. #ParaSaBayan
xvii REMERCIEMENTS
“If I have seen further, it is by standing on the shoulders of giants”
– Isaac Newton, 1676 Succeeding in this endeavour would not have been possible without the help of many people who believed in my capabilities and supported me throughout this journey.
My deepest and heartfelt thanks to my adviser, Connie Lovejoy, for taking the risk of sending a Pacific Islander to the wonderful Arctic. Your mentorship, guidance and expertise in all stages of my doctoral studies shaped me to become a better researcher and person. It was a realization of my aspirations, from just reading your work to training under your supervision. Thank you for opening doors of endless opportunities for which I will be always greateful. My gratitude also goes to my co-director, Marcel Babin for the support and guidance, whose enthusiasm for the Arctic and science inspires younger scientists like us to pursue our goals.
Many thanks to my thesis committee members, Yves Graton (INRS) and André Rochon (UQAR), who had always been there from my doctoral exam to my thesis completion. Your scientific advice guided and helped me direct my research to more productive objectives. I am also grateful to David Morse of Université de Montreal, and Alexander Culley and Juan Carlos Villareal Aguilar of U. Laval for accepting the responsibility of being in my evaluation committee and their time for reading and commenting on this thesis.
Many people also guided and continue to guide me and my scientific career. Many thanks to my former MSc advisers, Dr. Rhodora Azanza and Dr. Arturo Lluisma who continued to provide me with their support and guidance even after my stint in UP-MSI. To Warwick Vincent, your enthusiasm in science inspires us to do better. To the great scientists I admire: Chris Bowler, Leila Tirichine, David Montagnes, Micah Dunthorn, Helena Yap, Coke Montaňo, John Clamp: my utmost gratitude for the support, advice, and opportunities, which greatly helped my scientific career.
I was lucky and privileged to have worked with many people. To my partner in crime and PhD buddy, Nathalie Joli, the past 4 years would not have been bearable without you. Thank you for all the moral and emotional support, the existential crisis conversations, and for always pushing me to do more. To Vincent Carrier, my academic brother, thanks for helping me keep my sanity, for helping me become a Quebecois, and for being there through all ups and mostly downs. Same goes to your entire family. To the Lovejoy Labo past and current, especially Mary Thaler, Vani Mohit, André Comeau, Cindy Dasilva, Jerome Comté, Bérangère Péquén, Marianne Potvin, Sophie Creveceour, and Dimitri
xviii
Kalenitchenko for the patience and your readiness to always help me. To Adam Monier, whom I had the opportunity to share great experiences with in the ship, the friendship we built while freezing during deployments will never be forgotten! To Nastasia Freyria and Loic Jacquémot, thanks for the help especially with my French troubles. To my fellow Takuvik Peeps, and batchmates whom I started this journey with, especially Moritz Schmid and Nicholas Schiffrine, and also to Debbie Christiansen-Stowe and Marie-Heléne Forget, it had been a privilege knowing all of you.
I have met and made a lot of friends in Québec who made me felt at home and loved. To my first Québec gang - Sophie, Antoine, Joannie, Arnaud, Alex, Mike, Simon, I could not have hoped for a better circle of friends in Québec! You made my Québec experiences unforgettable, worthwhile, and fun! To my ASNUUL family and co-execs, thank you for the opportunity of sharing the wonderful UN experience and friendship with all of you. To the Filipino-Québecers Association (FQA), especially Ate Noxie and Kuya Nico, Chloe, Pia and Tita Tia, thanks for being a family to me when I needed it most, and to the entire FQA for always keeping me well fed and loved.
My PhD stint would not have been successful and memorable without experiencing one of the most fascinating regions of the earth – the Arctic! For this, I am greateful to all the Captains and Crew of CCGS Louis S St. Laurent, scientists, and the DFO-IOS people onboard the JOIS expeditions from 2013 to 2015 – the cruises had not only been scientifically productive but also fun. My special thanks to Bill Williams, Sarah Zimmerman, Jenny Hutchings and David Walsh, for your insights in my research, learning science onboard had been more fun with you.
I have survived for 4 years of being away from home because of many people who were always there for me even if they were half across the globe. My friends - Tin, Dang, Eric, Jords, Jojo and MSI peeps, thank you for proving that distance is never a hindrance to friendships. My highest gratitudes to Majih, thank you for the inspiration, support, understanding and love. You have always been my number one supporter even in my moments of self-doubt. This is for us!
Lastly, to my family - Nanay, Tatay, Ate and Kuyas, thank you for letting me explore the world, for supporting and believing in me. Everything I have, and everything I am will not be possible without you. This page will not be enough to say all my thanks!
xix AVANT-PROPOS
Cette thèse présente les résultats de mon doctorat réalisé sous la supervision du Dr. Connie Lovejoy, à titre de directeur, et du Dr. Marcel Babin, à titre de codirecteur, tous deux professeurs au Département de biologie de l’Université Laval à Québec. Cette thèse sera divisée en cinq chapitres ; on y retrouva une introduction générale (chapitre 1), suivie d’une présentation sous forme d’articles scientifiques (chapitres 2 à 4), en terminant par une conclusion générale des perspectives de recherche (chapitre 5). Ma thèse doctorale se concentre autour des les eucaryotes microbiens marins dans l’Océan Arctique, principalement sur les ciliés et dinoflagellés dans l’ouest de l’Océan Arctique. Les données biologiques, physico-chimiques et accessoires utilisés dans cette recherche ont été collectées par des collègues ou par moi-même lors de mes nombreuses expéditions. Les échantillons provenant du golfe d’Amundsen et de la mer de Beaufort ont été recueillis pendant les Canadian Arctic Shelf Exchange
Study 2003-2004, ArcticNet 2005-2010, Canada’s Three Oceans (C3O) 2007, Circumpolar Flaw Lead Study 2007-2008 et le projet France-Canada Malina 2009. En ce qui concerne le bassin canadien, les
études ont été réalisées en collaboration avec les Joint Ocean Ice Studies (JOIS) et Beaufort Gyre
Exploration Project (BGEP) 2012-2013. J’ai principalement utilisé la technologie séquençages haut
debit (SHD) et j’ai personnellement réalisé la majorité du travail en laboratoire et la collecte de données. La rédaction à titre de coauteurs sur les articles scientifiques reflète la contribution apportée aux banques de données, à l’analyse et à la direction des interprétations. De plus, j’ai dirigé toutes les analyses bio-informatiques, généré et testé statistiquement l’hypothèse, en plus d’écrire les manuscrits, le tout sous la supervision de mon directeur de recherche. Plus spécifiquement :
Chapitre 1 : Introduction Générale
Chapitre 2 : Onda D.F.L., Medrinal E., Comeau A., Babin M., Lovejoy C. (2017). Seasonal and interannual changes in ciliate and dinoflagellate species assemblages in the Arctic Ocean (Amundsen Gulf, Beaufort Sea, Canada). Frontiers in Marine Science, Aquatic Microbiology. 4(16), doi:10.3389/fmars.2017.00016
Chapitre 3 : Onda D.F.L., Lovejoy C. Dinoflagellates (Dinophyceae) in the size-fractionated samples from Canada Basin, Western Arctic Ocean. Soumis.
Chapitre 4 : Onda D.F.L., Monier, A., Babin, M., Lovejoy C. Assembly rules governing dinoflagellates and their potential responses to nitracline deepening in the Western Arctic Ocean. Ce
chapitre sera soumis sous peu pour publication.
Chapitre 5 : Conclusion Générale
Dans le cadre de mon doctorat, j’ai eu l’opportunité de faire un stage, supporté par Québec Océan, à l’Institut de biologie – École Normale Supérieure de Paris en France en 2014 sous la supervision des Drs Chris Bowler et Leila Tirichine, où j’ai appris des techniques moléculaires de pointe et où j’ai été
xx
introduit au programme Tara Oceans. Cette expérience a été grandement enrichissante pour ma recherche. De plus, mes études antérieures à la The Marine Science Institute de University of the
Philippines ont contribuées à mon doctorat, mais en m’orientant davantage vers la dynamique au niveau
communautaire plutôt que les modèles bases sur des espèces. Mon but était d’intégrer ces deux lignes de recherche pour découvrir les principes généraux qui sous-tendent la structure du réseau alimentaire microbien, et comment les espèces interagissent dans un plus large contexte. J’ai également été inspiré par mes expériences antérieures aux Phillipines réalisées dans le cadre de ma maîtrise et par mes recherches professionnelles pendant lesquelles je me concentrais sur l’identification et le suivi des espèces dinoflagellés toxiques et dangereuses, en utilisant la microscopie et l’approche moléculaire. J’ai poursuivi mes publications sur ce sujet tout au long de mon doctorat, ce qui fût contributoire à la réalisation des mes objectifs de recherche. Ces travaux et collaborations ont résulté sur les publications suivantes :
1. Onda DFL, Lluisma AO and Azanza RV. (2015). Potential DMSP-degrading bacterial assemblage dominate endosymbitoic microflora of Pyrodinium bahamense var. compressum (Dinophyceae) in vitro. Archives of Microbiology, 197:965-71.
2. Onda DFL, Azanza RV and Lluisma AO. (2014). Development, morphological characteristics and viability of temporary cysts of Pyrodinium bahamense var. compressum (Dinophyceae) in
vitro. The European Journal of Phycology, 49:265-275.
3. Onda DFL, Benico G, Sulit AF, Gaite PL, Azanza RV and Lluisma AO. (2013). Morphological and molecular characterization of some HAB-forming dinoflagellates from Philippine waters. The Philippine Science Letters, 6(1):1-10.
4. Azanza RV, Vargas VMD, Fukami K, Keshavmurthy S, Onda DF and Azanza PV. (2013). Culturable algalytic bacteria isolated from seaweeds in the Philippines and Japan. Journal of
Environmental Science and Management, 1:1-10.
5. Manset KJV, Azanza RV and Onda DFL. (2013). Algicidal bacteria from fish cultures in Bolinao, Pangasinan, Northern Philippines. Journal of Environmental Science and
Management, 1:11-20.
6. Marquez GPB, Reichardt WT, Azanza RV, Onda DFL, Lluisma AO, Hasegawa T and Montaño NME. (2015). Dominance of hydrogenotrophic methanogens at the peak of biogas production in thalassic digesters. Waste and Valorization, DOI 10.1007/s12649-014-9325-4.
La partie phylogénétiquede cette thèse, laquelle inclut la curation et la classification de haute résolutionet également l’amélioration de l’annotation et la classification taxonomique dans la plus récente version du Northern Microbial 18S rRNA Gene Reference Database sur laquelle j’ai travaillé à titre de collaborateur.
xxi
1. Lovejoy, C., Comeau, A., Thaler, M. 2016. Curated reference database of SSU rRNA for northern marine and freshwater communities of Archaea, Bacteria and microbial eukaryotes, v. 1.1 (2002-2008). Nordicana D23, doi: 10.5885/45409XD-79A199B76BCC4110.
Les résultats de ces travaux ont également été présentés dans plusieurs conférences scientifiques aux niveaux local, national et international :
1. Onda, DFL and Lovejoy C. (2016). Eukaryotic microbial communities in the changing Arctic. Presented at the Green Talents Alumni Conference 2016, Octobre 2016, Berlin, Allemagne. 2. Onda, DFL and Lovejoy C. (2016). Diversity and biogeography of ciliates in the Arctic Ocean.
Roundtable Meeting of the International Research Coordination Network for Biodiversity of Ciliates, Washington D.C., Septembre 2016.
3. Onda, DFL and Lovejoy C. (2016). The Missing Link: Ciliates in the changing Arctic. Poster, International Society of Microbial Ecology 2016, Montreal, Québec, Juliet 2016.
4. Onda, DFL and Lovejoy, C. (2016). Ciliates and Dinoflagellates exhibit strong seasonality and sensitivity to climatological changes in the Amundsen Gulf (Arctic). EMBL Symposia: New Age for Marine Eukaryote Discovery, EMBL-EMBO, Janvier 2016, Heidelberg, Allemagne.
5. Onda DFL and Lovejoy C. (2016). Patterns, Processes and Responses: understanding microbial community assembly in the changing Arctic. IBIS-Interlab, Novembre 2016. 6. Onda DFL. (2016). The Missing Link: ciliate in the changing Arctic. Journee des Etudiants.
IBIS, Université Laval. August 2016. Winner: Best Poster Presentation.
7. Onda DFL. (2016). Ciliate and dinoflagellates in the changing Arctic. IBIS-Interlab, Université Laval, April 2016.
8. Onda DFL, Joli N, Potvin M and Lovejoy C. (2014). Eukaryotic microbial diversity, biogeography and potential interactions in the Canadian Arctic and surrounding seas. Oral presentation, Quebec-Ocean Annual General Assembly. Rivier du Loup, Quebec, Novembre 2014.
9. Onda, DFL and Lovejoy C. (2013). Genetic diversity and distribution of planktonic Gymnodinoid species in the Arctic waters. Poster presentation, Quebec-Ocean Annual General Assembly. Rivier du Loup, Quebec, Novembre 2013.
Finalement, au cours de mon doctorat, j'ai été récipiendaire de plusieurs bourses provenant d'organisations locales et internationales pour ma participation à des ateliers scientifiques et stages internationaux :
1. Green Talents Competition 2016,sponsorisé parle German Ministry on Research and
xxii
2. Ecological Dissertations in Aquatic Sciences (ECO-DAS XIII), sponsorisé par leAmerican
Society for Limonology and Oceanography, SOEST-C-MORE-University of Hawa’ii (déclinée,
conflit d’horaire avec 1).
3. Marine Eukaryote Early Career Scientist Training and Pre-Summitfor Advanced PhDs and Post-Doc, sponsorisé par leGordon and Betty Moore Foundation – Marine Microbes
Initiative (MMI), tenu en European Molecular Biology Laboratory (EMBL), Heidelberg,
Allemgane, Janvier 2016.
4. Fonds de recherche du Québec - Nature et technologies (FRQNT) International Training FellowshipparQuébec-Océan, stagedansl’École Normale Superieur, Paris, France, Mai-Julliet 2014.
5. Bourse Leadership et developpment durable, Université Laval, 2012-2014.
6. Canadian Excellence Research Chair – Takuvik Joint International Laboratory, bourse Doctorat, 2012-2016.
7. Natural Science and Engineering Research Council, Discovery Granta Connie Lovejoy 8. Bourse Richard Bernard, Hiver 2017, Fondacion Richard-Bernard et La Sociéte Provancher
1
CHAPITRE 1: INTRODUCTION GÉNÉRALE
1.1 L’Océan Arctique et l’Arctique canadien
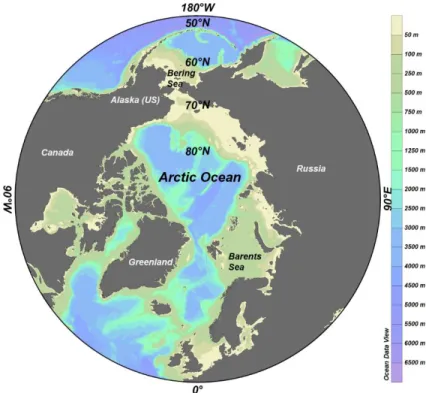
L’Océan Arctique (OA; Figure 1.1) est la plus petite des cinq régions océaniques, couvrant approximativement 3% (18,8 million km2) de la surface planétaire totale (Jakobsson, 2002). Avec une profondeur moyenne de 1050 m, c’est également l’océan lemoins profond, entouré de terres et ainsi considéré comme un double estuaire (Carmack & Wassmann, 2006). La majeure partie de l’OA est située au-dessus du Cercle Polaire et est couverte saisonnièrement ou de façon pérenne de glace (Morison et coll., 2012). Malgré sa petite taille, l’OA est fortement influencé par différents apports d’eaux plus chaudes de densités différentes résultant en des régimes océaniques grandement stratifiés. Cette stratification rend cet océanplus stable comparativement aux autres océans du monde (Rainville et coll., 2011).
Figure 1.1. Projection polaire de la region de l’Arctique (60-90⁰ N). Image generée par Ocean Data Viewer (ODV; Schlitzer, 2016)
Dans l’ouest de l’Océan Arctique au nord de l’Amérique (du 90⁰ au 180⁰, Figure 1.1), les couches stratifiées sont catégorisées en quatre principales masses. Les principales couches, en allant de la surface vers le fond, sont (i) la couche d’eau polaire mélangée (EPM) ou Polar Mixed Layer (PML) ayant une faible salinité dû à la fonte saisonnière de la glace et des apports riverains (S = 27-31), (ii) les eaux du Pacifique riches en nutriments (S = 31-33), (iii) la masse d’eau plus salée mais moins riche
2
en nutriments de l’Atlantique (S> 34) et (iv) l’eau profonde du bassin canadien (CBDW), une eau plus froide et plus dense associée avec la formation des canaux de saumure de la glace de mer (Shimada et coll., 2005; McLaughlin et coll., 2005; Timmermans, et coll., 2008; Bjork et coll., 2010). Les haloclines entre ces masses d’eau sont robustes et maintiennent la structure physique du basin avec l’Halocline du Pacifique (HP) et l’Halocline de l’Atlantique (HA) dans la partie supérieure des eaux du Pacifique et de l’Atlantique respectivement (Steele, 2004). Á cause de sa profondeur, l’Halocline du Pacifique joue un rôle important dans le réapprovisionnement de nutriments dans les eaux de surface (Steele, 2004; Pickart & Stossmeister, 2008). Plus précisément, le refroidissement périodique de la surface résulte en un mélange causant la diminution rapide de la profondeur des eaux d’origine du Pacifique et le transport des nutriments dans les couches supérieures. La stratification dans l’Océan Arctique est également fortement influencée par les systèmes de vents dominants (voir les sections suivantes).
La forte réciprocité entre les processus météorologiques et physicochimiques a des impacts significatifs sur les communautés biologiques, particulièrement sur les organismes marins planctoniques. Cette thèse se concentre sur les communautés de deux régions de l’Arctique canadien où nous avons testé des hypothèses sur l’écologie des protistes microzooplanctoniques.Des études temporelles (Chapitre 2) ont été réalisées en utilisant des échantillons recueillis au sud de la région de la Mer de Beaufort, dans le golfe d’Amundsen (Figure 1.2, encadré rouge), alors que les échantillons pour les analyses de diversité (Chapitre 3) et spatiales (Chapitre 4) ont été amassés au nord et à l’ouest du Bassin Canadien (Figure 1.2).
Figure 1.2 Emplacements du Bassin Canadien (image à gauche) et du Golfe d’Amundsen (carré rouge), qui ont été les sites d’étude. Image générée par Ocean Data Viewer (ODV; Schlitzer, 2016).
3 1.1.1 Golfe d’Amundsen
Le golfe d’Amundsen (GA) est un grande détroit (longueur de 400 km largeur de170 km) représentant une extension du sud-est de la mer de Beaufort bornée par l’île de Banks au nord, le plateau du Mackenzie à l’ouest, les côtes continentales du Canada au sud et ses archipels à l’est (Shadwick et coll., 2011; Figure 1.2 rectangle). Son courant de surface est fortement influencé par le Gyre de Beaufort (GB) qui est principalement située dans la partie septentrionale du golfe d’Amundsen (voir Section 1.2, encadré rouge). Alors que le courant de surface est principalement contrôlé par la circulation anticyclonique de la gyre, les courants en profondeur de la mer de Beaufort demeurent principalement contrôlés par une circulation direction cyclonique, entraînés en un transport vers l’est des eaux du Pacifique et de l’Atlantique (MacDonald et coll., 1987). Les directions opposées des courantsde surface et ses masses d’eau sous-jacentes causent des remontées qui fournissent des nutriments aux plateaux de l’Arctique (McLaughlin et coll., 2004). Malgré le fait que les côtes arctiques sont couvertes d’une banquise côtière durant l’hiver, son océan intérieur et ses marges continentales demeurent libres de glace pour une grande partie de l’année (Barber et coll., 2010). La présence de polynies, qui sont des régions d’eau libre de glace créées par les systèmesde vents, les remontées d’eau plus chaude ou une combinaison des deux (Smith et coll., 1990) est une caractéristique importantedu GA. La polynie du GA fait partie du Système du Cap Bathurst, qui est également connecté au chenal de séparation circumpolaire qui s’étend sur toute la côte de l’Océan Arctique (Barber & Massom, 2007). Cette polynieestune zone sensible pour la formation de saumure, les échanges de chaleur et de gaz et les activités biologiques intenses, faisant du GA une région caractérisée par une productivité biologique relativement forte (Barber et coll., 2010, 2012; Fransson et coll., 2013). Durant l’été, la plupart des détroits deviennent libres de glace et sont fortement influencés par les apports riverains et les écoulements continentaux, provenant en particulier du Delta du Mackenzie (Carmack & MacDonald, 2002). Ceci s’accompagne également de variations saisonnières des profils de salinité et de température de la colonne d’eau dues au mouvement vertical des masses d’eau (Garneau et coll., 2008).
1.1.2 bassin Canada
Le bassin Canada (BC) représentant la zone la plus grande et la plus profonde (ca. 4 km) de l’Arctique canadien. Il est délimité par le continent américain au sud, l’archipel canadien à l’est, la crête de Northwind à l’ouest et la crête de Lomonosov au nord (Figure 1.2). Le BC est également le dernier sous bassin de l’Océan Arctique qui reçoit un apport d’eau Atlantique (Aagard et coll., 1981). Il est unique par la présence d’un courant appelé le gyre de Beaufort (GB), principalement influencé par les vents, les oscillations atmosphériques, le forçage géostrophique et la formation et la fonte saisonnière de la glace. Le GB est reconnu pour être lié aux systèmes du climat global (Proshutinsky et coll., 2009; Morison et coll., 2012; Krishfield et coll., 2014). Le GB couvre la mer de Beaufort près du plateau
4
continental canadien jusqu’au nord du BC (Proshutinsky, 2002; Steele, 2004; McPhee, 2012). Sa circulation anticyclonique cause la formation d’un réservoir d’eau douce et éventuellement d’une coulée d’Ekman au centre du, menant à un renforcement de la stratification particulièrement durant l’été (Proshutinsky et coll., 2009; Yamamoto-Kawai et coll. 2009; McLaughlin & Carmack, 2010). On estime que ce réservoir contiendrait 17,000 à 22,410 km3 d’eau douce, correspondant approximativement au tiers du budget en eau douce de l’OA (Zhan & Zhang, 2001; Krishfield et coll., 2014). De plus, cela crée un gradient de densité horizontal empêchant la dispersion d’eaux continentales riches en nutriments vers le basin, augmentant en étendue latitudinale et en robustesse au cours de la dernière décennie (Nishino et coll., 2011a). Il a été observé que l’oscillation du GB s’inversait périodiquement, menant au relâchement de l’eau douce vers l’Atlantique Nord et contrôlant ainsi des anomalies de salinité mesurables dans la région (Proshutinsky, 2002). Ces fortes interactions air-mer ont des impacts significatifs sur la disponibilité des nutriments et conséquemment sur la productivité biologique de la région (Nishino et coll., 2008). Cela résulte en une productivité primaire se produisant dans les eaux plus profondes ou sous la surface au cours d’une grande partie de l’année dans le BC (McLaughlin & Carmack, 2010).
1.2 La succession d’eucaryotes microbiens dans un Arctique stratifié
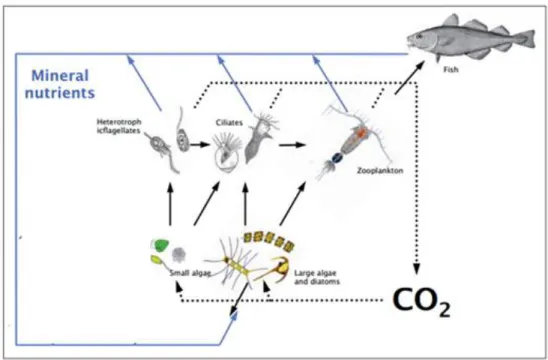
À plus basses latitudes, les cyanobactéries sont connues pour dominer les communautés phytoplanctoniques. Étant absentes de l’Océan Arctique, les communautés d’eucaryotes microbiens sont les composantes élémentaires des réseaux trophiques (Vincent, 2000; Lovejoy et coll., 2007). Selon les données de télédétection de la couleur de l’océan, la productivité primaire nette en milieu pélagique des microorganismes eucaryotes est estimés à 400-600 Tg C année-1 (voir Babin et coll., 2015) mais les calculs peuvent varier selon des modèles utilisés et n’incluent généralement pas les strates sous la surface (Ardyna et coll., 2013). Le carbone assimilé est transféré vers les niveaux trophiques supérieurs ou perdu par respiration via les innombrables interactions biologiques. Ces interactions sont en grande partie façonnées par la taille des organismes (Figure 1.3), c.-à-d. le petit phytoplancton est ingéré par le microzooplancton, lui-même qui est par la suite chassé par le mésozooplancton et ainsi de suite (Forest et coll., 2011; Glöckner et coll., 2012; LeFouest et coll., 2015). La plupart des transferts trophiques se produit dans la partie supérieure au-dessus de 200 m de l’OA où les ressources sont disponibles autant pour les fonctions photosynthétiques qu’hétérotrophes. De plus, les premiers 200 m sont influencés par la variabilité du couplage physico-météorologique, qui influence la dynamique chimique et biologique du système (McLaughlin & Carmack, 2010; Nishino et coll., 2011b). Mon travail de doctorat se focalise sur les communautés microbiennes ainsi que leurs
5
interactions dans les eaux supérieures (<200 m) de l’OA, comprenant principalement les eaux de mélange de surface(EPM) et les couches d’eau Pacifique.
Figure 1.3. Un schéma simplifié du réseau trophique marin arctique où la préférence de taille joue un rôle important. Notez la position des ciliés et des dinoflagellés en tant que prédateurs de petit phytoplancton et proies du plus large zooplancton (redessiné de Glöckner et coll., 2012, p. 27, original de Sandaa, 2009).
1.2.1 Banquise et eau de surface
Les communautés microbiennes arctiques sont caractétisées par une forte succession saisonnière et une biogéographie relative aux conditions et ressources environnementales (e.g. Ardyna et coll., 2011; Comeau et coll., 2011; Marquardt et coll., 2016). À la fin de l’hiver et au début du printemps, les algues de glace dominantes sont les diatomées, particulièrement adaptées aux basses températures et à la faible luminosité. Elle profite des nutriments à la base de la banquise et constituent une portion significative de la productivité primaire annuelle (Syvertsen, 1991; Melnikov et coll., 2002; Arrigo et coll., 2011; Boetius et coll., 2013). Elles sont aussi une source nutritive importante pour le zooplancton migrant vers la surface tôt au cours du printemps (Darnis et coll., 2012) et pour les hétérotrophes flagellés (Laurion et coll., 1995). Toutefois, les algues de glaces jouent un rôle important seulement lorsqu’elles sont relâchées par la fonte de la banquise pour couler hors de la zone photique durant la transition des efflorescences printanières de plancton (Hill & Cota, 2005; Boetius et coll., 2013). Par la suite, les efflorescences de phytoplancton peuvent se former dans les eaux nouvellement
6
libres de glace le long de la lisière de labanquise en fonte, survenant dans les zones couvertes de glace saisonnière et pouvant persister durant quelques mois sur de grandes étendues (20-100 km2; Perette et coll., 2011). Le réchauffement de la surface, l’augmentation de la stratification et de l’intensité lumineuse ainsi que le renouvellement en nitrate durant les évènements de remontée périodiques favorisent la croissance d’espèces photosynthétiques plus grosses telles que les diatomées et les dinoflagellés. Ces cellules peuvent éventuellement couler plus rapidement dû à leur plus grande taille et leur agrégation, faisant d’eux un des principaux moteurs de la pompe biologique (Perette et coll., 2011; Kluijver et coll., 2013). Une partie des grosses cellules peut également être recyclée par broutage et par lyse, maintenant le carbone organique la productivité primaire dans la zone euphotique. (Pesant et coll., 1998). Les premières efflorescences du printemp épuisent éventuellement les nutriments des eaux de surface ce qui interrompt la prolifération des grosses espèces (Pommier et coll., 2009). La variabilité intra-annuelle dans les compositions des communautés a également été observée dû aux variations saisonnières (Wang et coll., 2005; Comeau et coll., 2011). Les eaux océaniques du large, telles que dans le BC, sont généralement moins productives que les mers continentales, telles que le golfe d’Amundsen où le mélange turbulent a plus d’impact sur le renouvellement de nutriments. Cette différence est particulièrement visible lors des saisons libres de glace dans l’Arctique (Tremblay et coll., 2008; Lee et coll., 2012). Vers l’été, la diminution des nutriments favorise des communautés de surface dominées par les pico- et nanoeucaryotes. Leur rapport surface-volume l’assimilation de nutriments à faible concetration (Li et coll., 2009). Dans l’ouest de l’Arctique canadien, les
Mamiellales et autres petites cellules persistent sous la banquise durant la nuit polaire (Lovejoy et coll.,
2007; Terrado et coll., 2008) et constituent une composante importante du phytoplancton de l’été à l’automne (Vidussi et coll., 2004).
Les efflorescences sous la glace suivies des efflorescences printanières de phytoplancton survenant en lisière de banquise et dans les zones de glace marginales, épuisent les nutriments dans la PML. L’augmentation de l’apport en eau douce faible en nutriments au système durant le printemps et l’été, couplée au forçage atmosphérique, accentuent d’avantage l’approfondissement de la PML. Bien que la diminution de la banquise permette une plus grande pénétration et une plus grande disponibilité de lumière pour la photosynthèse, la limitation en nutriments à la surface inhibe la production par les microalgues et affecte ainsi les transferts d’énergie et de carbone (Nishinoet coll., 2011 b). Pendant ce temps, la forte stratification due à la différence de salinité empêche le transport des eaux riches en nutriments du Pacifique vers la surface. Le résultatestune surface faible en nitrates, mais occasionnellement forte en ammonium (Lee &Whitledge, 2004). La plupart des nutriments (principalement NO3) approvisionnant la surface par diffusion, par tourbillon, par remontéeconvective
7
ou encore par mélange turbulent (Nishino et coll. 2011a; Carpenter & Timmermans, 2012), proviennent des eaux sous-jacentes du Pacifique.
1.2.2 L’Halocline du Pacifique et le Maximum de Sub-surface en Chlorophylle (MSC) Les eaux Pacifique (EP) avec un écart de température variant de 0˚C a-2˚C se retrouvent sous la PML et sont modifiées de façon saisonnière avec une composante d’été (EPÉ), ci-après le Pacific
Summer Water (PSW) ayant une salinité de 30-32, et une d’hiver (EPH) ou ci-après le Pacific Winter Winter (PWW) avec une salinité de 33-34 (Steele, 2004). Les eaux du Pacifique entrent dans le bassin
Canadapar trois voies différentes, mais la plus large passe par des tourbillons dansle canyon de Barrow au nord de la mer des Tchouktches faisant de cette région unezone sensible où l’on observe de forte productivité (Watanabe, 2011; Nishino et coll., 2011b). Les EP contiennent plus de nutriments (c.-à-d. N, P et Si) que les eaux de surface avec le maximum de nitrates observé au centre du PWW (S = 33.1; McLaughlin et coll., 2005). Ceci est dû à la formationd’efflorescences de phytoplancton, consommant le NO3dans PSW lorsque la lumière estivale est disponible. En revanche, durant l’hiver, les fortes concentrations de NO3 sont conservées dû à la faible luminosité, ainsi, le NO3est transporté avec succès jusqu’au basin Canada (Nishino et coll., 2011a). En parallèle, la décomposition et le recyclage de la matière organique produisent de fortes concentrations d’ammonium (NH4), transportées dans le Bassin canadien et la mer de Beaufort (Yamamoto-Kawai et coll. 2006, 2008; Nishino et coll. 2008). Les EP combinées circulent sous le PML à des profondeurs comprises entre 40 et 150 m durant l’été (Steele, 2004).
Les nutriments, principalement le nitrate, atteignent des concentrations faibles ou indétectables dans la PML durant l’été. Ces conditions ne sont pas optimales pour la production primaire par lesplus grosses cellules (Li et coll., 2009) mais peuvent favoriser certaines espèces (Lee &Whitledge, 2004; Lovejoy et coll., 2007). Également, l’apport d’eau douce en surface dû à la fonte de la glace et aux rivières résulte en un approfondissement de la nitracline, la strate d’eau où la concentration en nitrates augmente abruptement dans la partie inférieure de la zone photique (Nishino et coll. 2011a). Les organismes photosynthétiques d’adaptent en suivant la nitracline, plus profonde et caractérisée par une faible lumière. Ceci mène à l’établissement d’un maximum de chlorophylle sous la surface (MSC), ci-après le « subsurface chlorophyll maxima » (SCM; Tremblay et coll. 2008; Pommier et coll., 2009; Martin et coll., 2012) dans la partie supérieure des eaux Pacifique. Dans le bassin Canadaet le golfe d’Amundsen, le SCM survient normalement dans la masse d’eau du PSW (McLaughlin et coll., 2004). À cette profondeur, les fortes concentrations en nutriments permettent aux cellules de croître mais la limitation en lumière nécessite une plus grande production de pigments photosynthétiques (Lovejoy et coll., 2007; Martin et coll., 2010). Ainsi, malgré le fait que le SCM coïncide avec une accumulation de
8
de biomasse photosynthétique, ceci n’implique pas forcément une plus forte productivité dans la colonne d’eau puisqu’il pourrait s’agir seulement d’une stratégie adaptative pour répondre à la faible disponibilité en lumière (Huisman et coll., 2006; Martin et coll., 2010). Puisque la lumière n’est pas limitante à la SCM peu profonde et que le NO3 est aussi abondant, elle peut supporter le développement de plus grosses cellules phytoplanctonique, telles que les diatomées et les dinoflagellés photosynthétiques-mixotrophes. En général, le NH4est une source d’azote énergétiquement préféréesous des conditions de faible luminosité puisque l’assimilation du NO3 implique une étape de réduction avant l’utilisation par les cellules (Kristiansen&Farbrot, 1991; Martin et coll., 2010, 2012; Coupel et coll., 2012). Le recyclage de l’azote organique, incluant le NH4, fait également du SCM un site important de productivités secondaire et tertiaire, particulièrement sous des conditions de forte stratification (Weston, 2005; Tremblay et coll., 2008). De plus, le SCM peut agir comme un piège à nutrimentsvenant du bas, affaiblissant d’avantage la production primaire dans la partie supérieure de la zone euphotiqueau-dessus de l’halocline (Weston, 2005; Mundy et coll., 2009; Martin et coll., 2010). Martin et coll. (2012) ont observé une forte contribution du SCM à l’assimilation de l’azote et du carbone du printemps jusqu’à la fin de l’automne dans l’Arctique canadien. Toutefois, le SCM demeure le site où l’on observe la plus grande productivité dans le Bassin canadien durant l’été (Hill & Cota, 2005; Steiner et coll., 2016). Également des modéles ont permisd’estimer qu’elleétait responsable d’approximativement 70% de la production primaire annuelle dans le Golfe d’Amundsen (Martin et coll., 2013). Dans d’autres régions, par exemple dans la Mer du Nord, le SCM contribue à 10% de la production primaire annuelle (Leeuwen et coll., 2012) et jusqu’à 58% dans la partie centrale durant l’été (Weston, 2005). Alors que la dynamiquede succession du phytoplancton a été intensément étudiée dans l’Arctique, l’évolution temporelle et les réponses des autres composantes des communautés, telles que le microzooplancton arctique (c.-à-d. les ciliés et les dinoflagellés) demeurent méconnues (e.g. Levinsen&Neilsen, 2002; Sherr&Sherr, 1998, 2009; Sherr et coll., 2013; Nelson et coll., 2014).
1.3 Vue d’ensemble des ciliés et des dinoflagellés
D’un point de vue moléculaire comme morphologique, les ciliés et les dinoflagellés constituentdes groupes d’eucaryotes microbiensles plus divers. Ils appartiennent au super-groupe Alveolata, qui incluent également l’Apicomplexa (Leander& Keeling, 2003; Adl et coll., 2005, 2012). Leurs classifications taxonomiques et généralesont subi de nombreuses révisions dans le passé. Ils sont également parmi plus anciens groupes de protistes étudiés et les espèces de microzooplancton les plus abondantes à de différentes latitudes, et leurs habitats incluent les régions côtières, les océans, les estuaires et même les lacs (Levinsen&Neilsen, 2002; Monti &Minocci, 2013). Certaines espèces des
9
deux taxa produisent des efflorescences massives, pouvant être nocives (Anderson et coll., 2002; Liu, 2012).
1.3.1
Ciliés
Les ciliés sont un grand groupe de microzooplancton à cils avec plus de 8000 espèces décrites. Toutefois, comparativement aux dinoflagellés, les ciliés sont considérés comme monophylétiques (Lynn, 2008). La taxonomie de ce groupe est confortéepar les classifications basées sur les caractères morphologiques tels que les motifs des kinétides somatiques, les structures orales ou encore les modèles de division cellulaire (Lynn, 2012). Présentement, les ciliés comprennent 12 lignées acceptées incluant les Oligohymenophorea, Plagiopylea, Colpodea, Prostomatea, Nassophorea, Phyllopharyngea, Litostomatea, Armophorea, Spirotrichea, Cariacotrichea, Heterotrichea et Karyorelictea (Orsi et coll., 2012; Lynn, 2012). La majorité des espèces vivent librement et sont distribuées globalement, incluant les régions polaires (Finlay et coll., 1996; Foissner et al., 2008).
En dépit des nombreuses études sur les ciliés et la richesse des données morphologiques archivées, plusieurs nouvelles espèces et taxon non-décrits sont signalés. Comparées à la microscopie, les analyses génétiques (c.-à-d. 18S ADNr) ont révélé d’avantage d’informations, telles que l’existence et l’importance de la biosphère des ciliés rares (Dunthorn et coll., 2014b). Par exemple, les phylotypes marins, autrefois considérés comme associés strictement aux colpodes d’eaux douces, ont été détectés en utilisant le séquençage à haut débit et la haute résolution des placements au sein d’arbres phylogénétiques (Dunthorn et coll., 2014a). Dans l’Arctique, les études ont principalement porté sur des taxon spécifiques, tels que les Tintinnida (Dolan et coll., 2016), à cause des difficultés de préservation et d’identification. Les analyses moléculaires ont toutefois indiqué que la plupart des séquences environnementales sont associées à Strombidium, les Strom A et les Strom B (Lovejoy et coll., 2006; Lovejoy & Potvin, 2011) ainsi qu’à d’autres taxon non-classifiés (Terrado et coll., 2009; Bachy et coll., 2012). La réconciliation entre la diversité morphologique et les séquences non-identifiées et récupérées directement depuis l’environnement reste un défi important (Santoferarra et coll., 2014; 2016).
1.3.2 Dinoflagellés
Les dinoflagellés sont des protistes flagellésreprésentés par une grandegamme de taille (5-200 µm) mais généralement considérés comme des espèces nano- et microzooplanctoniques (Gomez et coll., 2005; Not et coll., 2012). La caractérisation du groupe est principalement basée sur la morphologie cellulaire générale, comprenant les motifs des plaques thécales et les positions des sillons