© Stéphanie Gervais, 2020
Influence des conditions de culture sur le contenu en
protéine recombinante dans les feuilles du tabac
sauvage Nicotiana benthamiana
Mémoire
Stéphanie Gervais
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
ii
Résumé
La moléculture végétale a connu un essor considérable ces dernières années, permis par nombre d’avantages pratiques associés aux plantes incluant une mise à l’échelle aisée pour la production de vaccins ou d’anticorps thérapeutiques en grandes quantités. De nombreuses études ont été réalisées, ces dernières années, pour optimiser les rendements en protéines d’intérêt médical chez Nicotiana benthamiana, une cousine sauvage du tabac. Ces études ont été menées, toutefois, sans tenir compte de la teneur foliaire en protéines endogènes, souvent considérées comme des contaminants majeurs au moment de la purification des protéines d’intérêt. Dans ce contexte, notre principal objectif de recherche pour cette étude a été d’évaluer l’influence de traitements culturaux variés aussi bien sur le rendement total en protéine recombinante dans des plants agroinfiltrés de N. benthamiana que sur la teneur relative en ribulose-1,5-bisphosphate carboxylase/oxygénase (RuBisCO), principal contaminant endogène du tissu foliaire. Nos résultats confirment un impact souvent significatif des conditions culturales sur le rendement total en protéine recombinante dans la plante, mais peu d’effets sur la part relative en RuBisCO dans le tissu foliaire.
iii
Abstract
Plant molecular farming has grown considerably in recent years, thanks to a number of benefits associated with plants including a convenient scaling-up of production settings that allow for the production of large quantities of vaccines or therapeutic antibodies. Numerous studies have been conducted in recent years to optimize the yields of medically valuable recombinant proteins in the wild tobacco relative Nicotiana benthamiana. Most of these studies, however, have not considered the host plant endogenous proteins, which often represent major contaminants during the downstream purification of recombinant proteins. In this context, our main research objective for this project has been to evaluate the relative impacts of cultural conditions on recombinant protein yield and relative content of ribulose-1,5-bisphosphate carboxylase/oxygenase (RuBisCO), the major endogenous protein contaminant in leaf tissue. Our results confirm the influence of most cultural conditions on total recombinant protein yield, but a negligible effect of these conditions on the relative amount of RuBisCO in leaf tissue.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations ... xi
Remerciements ... xiii
Avant-propos ... xiv
Introduction générale ... 1
1. Revue de littérature : l’expression de protéines recombinantes d’intérêt clinique dans les plantes ... 3
1.1 La production hétérologue de protéines d’intérêt clinique ... 3
1.2. La moléculture végétale, une alternative aux approches de production classiques ………..4
1.3. Problématique de recherche ... 6
1.3.1. Stratégies pour l’optimisation du rendement en protéine recombinante ... 6
1.3.2. Influence des conditions de culture post-infiltration sur le rendement en protéine recombinante ... 7
1.3.3. La RuBisCO, un contaminant endogène majeur en moléculture ... 8
1.3.4. Impact des conditions de culture sur l’expression des protéines recombinantes en contexte de moléculture………...8
1.3.4.1. Influence du spectre lumineux………...9
v
1.3.4.3. Influence d’un apport d’azote exogène………..12
1.3.4.4. Influence de la teneur en CO2 atmosphérique……….14
1.3.4.5 Influence de la température ambiante……….15
1.3.4.6 En conclusion……….….17
1.4. Hypothèses et objectifs du projet de recherche ... 18
1.4.1. Hypothèses de travail du projet ... 18
1.4.2. Objectifs de recherche du projet ... 19
2. Résultats ... 20
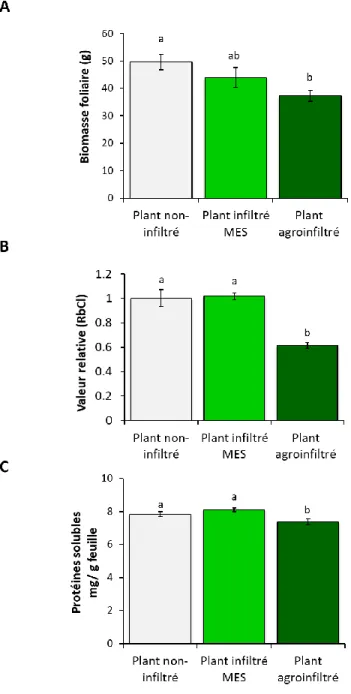
2.0. Travaux préliminaires : Influence du processus d’agroinfiltration avec l’expression H1 sur la biomasse foliaire et la teneur relative en RuBisCO après sept jours d’incubation ... 20
2.0.1. Influence de l’agroinfiltration avec l’expression H1 sur la croissance et le contenu en protéines solubles endogènes ... 21
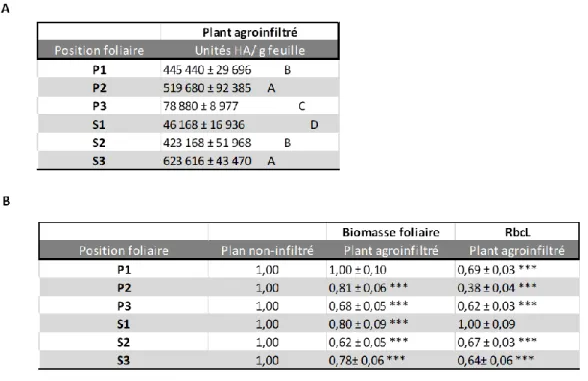
2.0.2. Influence de l’agroinfiltration avec l’expression H1 selon la position des feuilles sur la plante ... 21
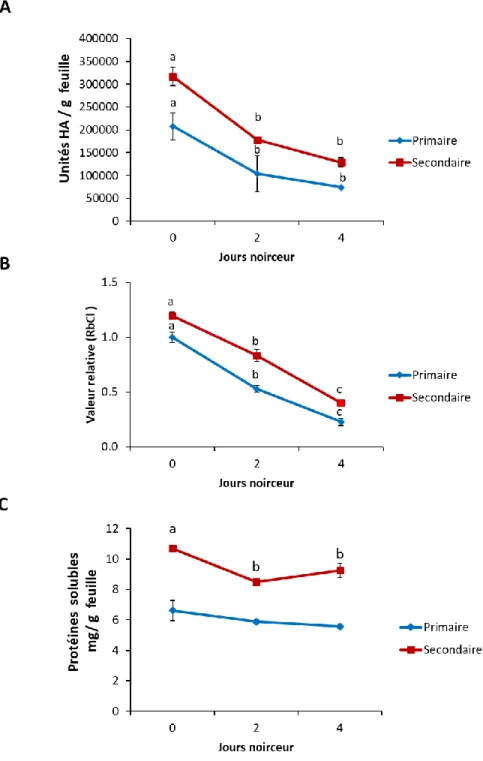
2.1. Paramètre cultural no. 1 : Influence d’une période d’obscurité sur le rendement en antigène H1 et la teneur relative en RuBisCO ... 23
2.1.1. Influence d’une période d’obscurité sur les teneurs pondérales en antigène HA et en RuBisCO... 24
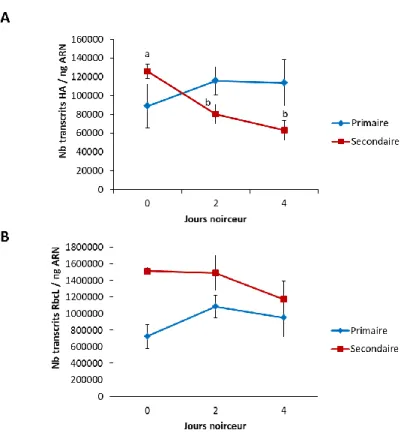
2.1.2. Influence de l’obscurité sur les taux de transcrits pour l’antigène H1 et la sous-unité RbcL ... 26
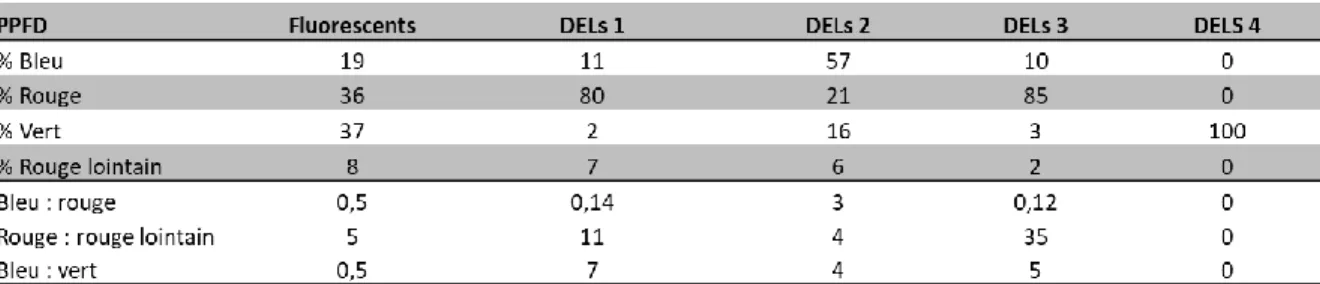
2.2. Paramètre cultural no. 2 : Influence du spectre lumineux sur le rendement en antigène H1 et la teneur relative en RuBisCO ... 28
2.3. Paramètre(s) cultural(aux) no(s). 3 : Influences de l’azote et de la concentration en CO2 atmosphérique sur le rendement en antigène H1 et la teneur relative en RuBisCO ... 30
2.3.1. Influence de la fertilisation azotée sur la biomasse et les teneurs pondérales en antigène H1 et en RbcL ... 30
vi
2.3.2. Influence de la fertilisation azotée combinée à l’enrichissement carboné sur
les teneurs en antigène H1 et en RbcL ... 33
2.4. Paramètre cultural no. 4 : Influence de la température ambiante sur le rendement en antigène H1 et la teneur relative en RuBisCO ... 34
3. Discussion ... 37
3.1. Influence du processus d’infiltration et de l’agroinfiltration exprimant H1 sur la croissance et la teneur en RuBisCO dans les feuilles ... 37
3.2. Influence d’une période d’obscurité en phase d’incubation ... 39
3.3. Influence du spectre lumineux en phase d’incubation ... 40
3.4. Influence de l’azote et du CO2 atmosphérique en phase d’incubation... 42
3.5. Influence de la température en phase d’incubation ... 44
4. Matériel et méthodes ... 47
4.1. Préparation et croissance des semis ... 47
4.2. Croissance des plantes avant infiltration ... 47
4.3. Agroinfiltration des tissus foliaires ... 48
4.4. Conditions de croissance en phase d’incubation ... 48
4.5. Précisions méthodologiques pour certains essais ... 49
4.5.1. Paramètre cultural no. 1 : Essai sur la noirceur ... 49
4.5.2. Paramètre cultural no. 2 : Essai sur la qualité spectrale ... 49
4.5.3. Paramètre cultural no. 3 : Essai sur la fertilisation et l’enrichissement carboné 51 4.5.4. Paramètre cultural no. 4 : Essai sur la température ... 52
4.6. Récolte des échantillons foliaires ... 53
4.7. Dosage et quantification des protéines ... 54
4.7.1. Extraction des protéines ... 54
4.7.2. Dosage des protéines solubles totales ... 55
vii
4.7.4. Quantification de la RuBisCO ... 56
4.7.5. Extraction de l’ARN foliaire et quantification des transcrits ... 56
4.8 Analyses statistiques ... 57
Conclusion générale ... 58
Bibliographie ... 60
Annexe 1 ... 67
A.1. Influence de l’agroinfiltration sur la biomasse et le taux de synthèse de RuBisCO de plantes agroinfiltrées exprimant l’antigène H1 ... 67
A.1.1. Influence de l’agroinfiltration avec l’expression H1 sur la biomasse foliaire ... 67
A.1.2. Influence de l’agroinfiltration et de l’expression H1 sur l’expression de la RuBisCO ... 67
A.2. Influence de la qualité spectrale en phase d’incubation sur la biomasse foliaire et la teneur pondérale en protéines solubles ... 68
A.3. Influence de la fertilisation azotée et de l’enrichissement carboné en phase d’incubation sur la teneur pondérale en protéines solubles dans les feuilles agroinfiltrées ………...69
A.4. Influence de la température ambiante pendant la phase d’incubation des plants agroinfiltrées ... 70
viii
Liste des tableaux
Tableau 2.0. Unités HA (H1) par g de matière fraîche (A), biomasse foliaire relative (B) et teneur relative en RuBisCO (RbcL) (B) dans les unités de production P et S de plantes agroinfiltrées exprimant l’antigène H1………..23 Tableau 2.1. Pourcentages relatifs de lumières bleue, rouge, verte et rouge lointain –et ratios lumineux correspondants– pour les traitements de lumière à l’étude ………...28 Tableau 4.1 Conditions culturales de base dans les chambres de croissance pendant la phase d’incubation de sept jours après agroinfiltration……….49 Tableau A.1. Influence de l’agroinfiltration et d’une infiltration avec tampon de resuspension MES sur la biomasse foliaire fraîche (BF), la masse sèche (MS), le ratio MS/BF et la surface foliaire totale des plantes après 7 jours d’incubation en chambre de croissance. ………...………....67
Liste des figures
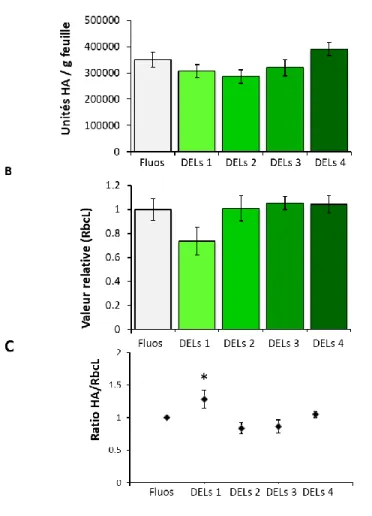
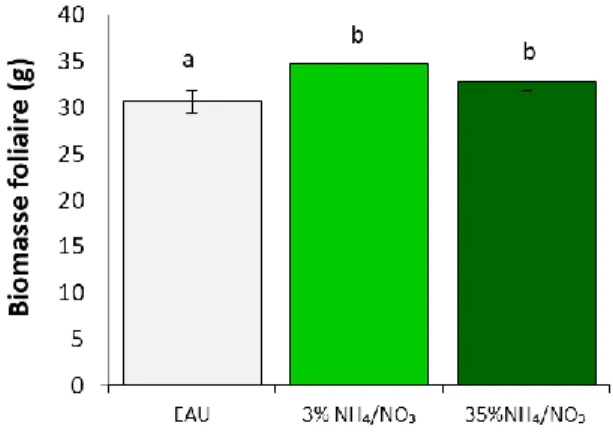
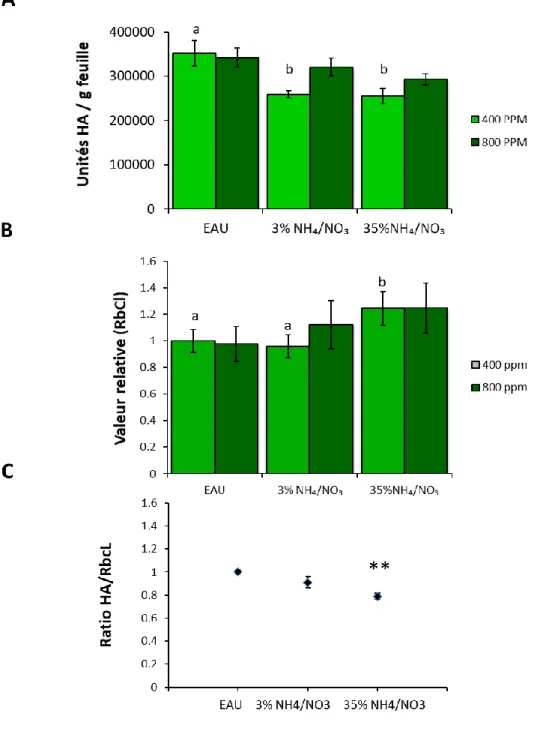
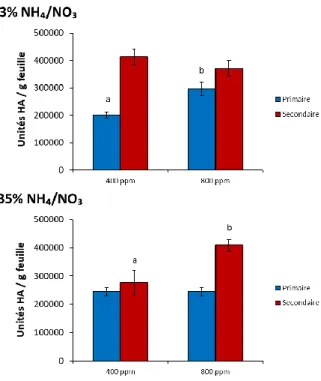
Figure 2.0. Biomasse fraîche totale (A), teneur relative en RuBisCO (sous-unité RbcL) (B) et concentration en protéines solubles (C) dans les feuilles de plantes agroinfiltrées exprimant l’antigène H1, de plantes infiltrées avec le tampon MES ou de plantes témoins non infiltrées……….…………22 Figure 2.1.Influence du nombre de jours d’obscurité sur les unités HA (H1) par g de matière fraîche(A), sur la valeur relative en RbcL (B) et sur la concentration en protéines solubles (C) dans les feuilles primaires et axillaires des plantes agroinfiltrées en phase d’incubation ………..…….25 Figure 2.2. Influence du nombre de jours d’obscurité en phase d’incubation sur le phénotype des plantes agroinfiltrées………..………..………..26 Figure 2.3. Influence du nombre de jours d’obscurité en phase d’incubation sur les taux de transcription de l’antigène H1 (A) et de la RbcL (B)………..27 Figure 2.4. Unités HA (H1) par g de matière fraîche (A), sur la teneur relative en RbcL (B) et le ratio HA/RbcL (C) dans les feuilles agroinfiltrées soumises aux différents traitements lumineux………...29 Figure 2.5. Influence d’un apport d’azote en phase d’incubation sur la biomasse foliaire fraiche totale des plantes agroinfiltrées cultivées sous une teneur en CO2 atmosphérique de ~400 ppm………. 31 Figure 2.6. Influence du régime azoté sur les unités HA (H1) par g de matière fraîche (A), la teneur relative en RuBisCO (B) et le ratio H1/RbcL (C) dans les feuilles agroinfiltrées de plantes cultivées sous des concentrations en CO2 atmosphérique de 400 et de 800 ppm……….………...…32 Figure 2.7.Influence du régime azoté et de l’enrichissement carboné sur les unités HA (H1) par g de matière fraîche dans les feuilles primaires et secondaires de plantes maintenues sous ~400 ppm ou 800 ppm de CO2 atmosphérique, au terme de la période d’expression en chambre d’incubation………34 Figure 2.8. Influence du régime de température ambiante sur les unités HA (H1) par g de matière fraîche (A) la teneur relative en RuBisCO (B) et le ratio HA/RbcL (C) dans les feuilles agroinfiltrées de la plante hôte au terme de la phase d’incubation. ………..36 Figure 4.0. Plantes incubées sous différents éclairages pendant l’essai sur la qualité spectrale ……...……….………..50 Figure 4.1. Distribution spectrale des éclairages fournis par les lampes de plafond (µW cm
-2 nm-1). ………..51
Figure 4.2. Dispositif expérimental pour les essais de fertilisation azotée et d’enrichissement carboné ………...……….…52
x
Figure 4.3. Dispositif expérimental pour l’essai sur la température ambiante. ……….53 Figure 4.4. Position des 6 parties, ou unités de production, récoltées sur la plante hôte au terme de la phase d’incubation (diagramme adapté de Goulet et al. 2019). ……….54 Figure A.1. Influence de l’agroinfiltration avec H1 sur la teneur relative en transcrits rbcL dans les feuilles ………..67 Figure A.2. Influence de la qualité spectrale en phase d’incubation sur la biomasse foliaire totale des plantes et la concentration en protéines solubles………68 Figure A.3.Influence du régime d’azote sur la concentration en protéines solubles dans les feuilles agroinfiltrées après 7 jours d’incubation en chambre de croissance………...69 Figure A.4. Influence du régime de température sur la biomasse foliaire totale (A) et la concentration en protéines solubles (B) dans les feuilles après 7 jours d’incubation post-agroinfiltration. ……….70
xi
Liste des abréviations
ADN-t : ADN de transfert (vecteur binaire d’Agrobacterium tumefaciens) ARNm : ARN messager
DELs : Diodes électroluminescentes GFP : Protéine fluorescente verte
HA : Hémagglutinine A du virus de l’Influenza H1 : Hémagglutinine 1 du virus de l’Influenza
PCR : Réaction de polymérisation en chaîne (Polymerase chain reaction) q-PCR : PCR quantitative en temps réel (Real-time PCR)
RuBisCO : Ribulose-1,5-bisposphate carboxylase/oxygenase RbcL : Grosse (large) sous-unité de la RuBisCO
RbcS : Petite (small) sous-unité de la RuBisCO VLPs : Particule pseudo-virale (Virus-ike particles)
xiii
Remerciements
Un grand merci à Dominique Michaud, mon directeur de recherche, pour m’avoir accueillie dans son équipe et m’avoir encadrée dans mon apprentissage. Merci Dominique pour vos commentaires et vos corrections, c’était très apprécié! Je suis certaine qu’à la fin de mon cheminement et dans ma future profession, je deviendrai une excellente agronome.
Merci à mon co-directeur, Steeve Pepin, pour sa gentillesse et son encadrement. Chaque commentaire a été une belle perle à recevoir et m’a redonné confiance à plusieurs reprises tout au long de ma maîtrise–merci Steeve.
Merci à Marie-Claire Goulet pour avoir été aussi généreuse et patiente. Tu as réussi à m’insuffler de la confiance en mes capacités sur le plan scientifique. Tu es un ange précieux dans le monde de la science et une amie géniale lors des « jeudredis ».
Merci à Ann-Catherine Laliberté pour tout le soutien technique lors des essais. Merci surtout pour ta gentillesse et ton sourire. Je n’oublierai jamais la fois où tu es venue m’apporter un réconfort caféiné pendant la grande « série hémagglute ».
Merci à tous les collaborateurs du projet Medicago et aux membres du Lab Michaud : André Gosselin, Linda Gaudreau, Gilbert Éthier, Anne-Marie Maltais, Antoine Leuthreau, Jonathan Tremblay, Philippe Varennes-Jutras, Vanessa Mercure. Ça prend toute une équipe pour repousser nos limites et nous épanouir dans notre travail. Merci de m’avoir « donné des ailes ».
La réussite d’un aussi gros projet dans une vie est intimement liée à des gens hors pair, des gens qui ont changé ma vie, des piliers sur lesquels chaque mer houleuse est devenue navigable: Isabelle A-P., Rachel D-M., Nathalie F., Vicky F., Natasha D-L., Simon L., Anne-Marie R., Charlène B., Andrée-Anne S-P., Marc-André L.
xiv
Avant-propos
Ce projet de maîtrise, réalisé sous la direction des Drs. Dominique Michaud et Steeve Pepin, s’inscrivait dans le cadre d’un projet de R&D coopérative de plus grande envergure co-financé par le CRSNG et un partenaire industriel, la compagnie biotech Medicago inc. Ce projet de recherche visait, dans son ensemble, à cerner l’influence de conditions de culture et de paramètres environnementaux comme le régime lumineux, l’enrichissement carboné, la fertilisation et la température ambiante sur l’expression de protéines recombinantes produites transitoirement dans l’hôte d’expression végétal Nicotiana benthamiana. Mon projet de recherche concernait, plus spécifiquement, l’impact des conditions culturales lors de l’incubation des plants agroinfiltrés, pendant la phase d’expression protéique en chambre de croissance.
1
Introduction générale
Le secteur des biopharmaceutiques a connu un essor économique important depuis une quinzaine d’années. Alors que le secteur est toujours en émergence, l’optimisation de procédures méthodologiques adaptées à l’expression transitoire de protéines hétérologues chez les végétaux a permis à l’industrie biopharmaceutique de mettre en place, ces dernières années, de nouvelles plates-formes prometteuses pour la production de grandes quantités de protéines d’intérêt thérapeutique. Les plantes montrent plusieurs avantages comme hôtes d’expression pour les protéines en comparaison aux systèmes de production courants basés sur les systèmes microbiens ou cellulaires en bioréacteurs, incluant notamment une mise à l’échelle plus aisée pour la production accrue de vaccins ou d’anticorps thérapeutiques dans l’éventualité d’une pandémie virale (Fischer et al. 2015). Des efforts soutenus ont été déployés depuis dix ans pour améliorer l’efficacité des systèmes d’expression végétaux à l’échelle moléculaire. Des progrès rapides ont été faits, en particulier, avec l’hôte d’expression transitoire Nicotiana benthamiana, une plante sauvage cousine du tabac de plus en plus étudiée aussi bien par le milieu académique que par l’industrie en raison de caractéristiques avantageuses comme une biomasse foliaire spécifique élevée et une efficacité naturelle à exprimer des gènes d’origine étrangère (Goodin et al. 2008).
Contrairement aux plantes domestiquées produites à des fins agricoles, dont les modes de production sont bien maîtrisés, l’optimisation des conditions culturales pour les plantes utilisées en moléculture est récente et demeure complexe en raison des objectifs poursuivis, qui visent un rendement élevé en protéine recombinante plutôt qu’un rendement élevé en biomasse foliaire ou en produit alimentaire. Pendant qu’elle exprime une protéique étrangère, la plante interagit de surcroît avec des organismes tiers, notamment la bactérie Agrobacterium tumefaciens utilisée souvent comme vecteur de transformation génique (Fujiuchi et al. 2016). Les impacts des conditions de culture en phase d’incubation ont été synthétisés récemment par Fujiuchi et al. (2016). Des travaux sur la lumière ont par exemple rapporté qu’une élévation de l’intensité lumineuse chez des plantes exprimant des protéines recombinantes avait peu d’effet sur le rendement effectif obtenu, alors que d’autres études établissaient à 20˚C la température optimale pour le transfert d’ADN-t par A. tumefaciens et rapportaient une chute du rendement en protéine d’intérêt et des symptômes de nécrose foliaire sous des températures élevées en phase d’incubation (Matsuda et al. 2012; Fullner
2
& Nester 1996). Ces travaux exploratoires, bien que pertinents considérant le peu de données disponibles, ne tenaient pas compte en revanche des teneurs en protéines endogènes, considérées par plusieurs comme des contaminants majeurs au moment de la purification des protéines d’intérêt (Robert et al. 2015).
Avec pour objectif de générer des données utiles sur les conditions de culture de N. benthamiana utilisé en moléculture, nous nous sommes attardés dans ce projet à l’impact des paramètres culturaux en phase d’incubation sur le rendement et la qualité d’un antigène recombinant utilisé pour la production de vaccins contre la grippe, l’hémagglutinine H1 du virus de l’influenza, en tenant compte aussi de la teneur foliaire en ribulose-1,5-bisphosphate carboxylase/oxygénase (RuBisCO), principal contaminant protéique au moment de la récolte. L’idée du projet était d’établir jusqu’où il était possible de favoriser le ‘bien-être’ de la plante hôte sur les plans de la croissance et du métabolisme primaire sans compromettre le rendement relatif en antigène H1 dans les feuilles. Différents paramètres culturaux ont été testés en chambre de croissance pendant la phase d’incubation, incluant la qualité du spectre lumineux, la température ambiante, la teneur en CO2 atmosphérique, la fertilisation minérale azotée et l’apport (ou non) de lumière en fin d’incubation. Les paramètres ayant été étudiés consistaient à évaluer le rendement en antigène H1 et la teneur relative en RuBisCO dans les feuilles principales et axillaires de plantes agroinfiltrées soumises aux différents traitements culturaux.
3
1.
Revue de littérature : l’expression de protéines recombinantes
d’intérêt clinique dans les plantes
La production de protéines recombinantes d’intérêt médical a connu un essor important au cours des dernières années, dans l’optique de répondre aux besoins de santé d’une population mondiale toujours plus grande et aux nouveaux défis que posent les risques croissants d’épidémies et de pandémies dans un contexte mondialisé. Depuis une trentaine d’années, les avancées rapides du génie génétique ont permis à l’industrie de produire des protéines d’intérêt médical par le transfert et l’expression hétérologue de leur séquence d’ADN dans une cellule hôte d’origine eucaryote ou procaryote, sans recours à l’organisme d’origine. Ces avancées nouvelles permettant la production de protéines d’intérêt clinique dans un organisme tiers ont entre autre été appliqué dans le domaine végétal et ont ainsi pavé la voie peu à peu à une nouvelle discipline des biotechnologies moléculaires végétales, la « culture de molécules » ou moléculture (Fischer & Emans 2000).
1.1
La production hétérologue de protéines d’intérêt clinique
Les bactéries, les levures et les cellules animales en cultures sont aujourd’hui des plates-formes d’expression largement utilisées par l’industrie pharmaceutique pour la production de protéines d’intérêt médical (Gomord et al. 2004). Les bactéries, en particulier la bactérie Escherichia coli, ont été les premières ‘bio-usines’ utilisées pour l’expression de protéines recombinantes d’intérêt clinique, avec comme exemple fondateur l'insuline recombinante humaine pour le traitement du diabète (Gomord et al. 2004). Malgré la capacité des bactéries à produire un volume imposant de protéines recombinantes, l’utilisation de ces organismes est souvent limitée en pratique, en raison de leur incapacité à produire de nombreuses protéines d’intérêt qui nécessitent des modifications post-traductionnelles complexes (Fischer & Emans 2000). Les cellules animales, bien qu’ayant pour avantage de produire des protéines plus complexes, présentent aussi des limitations importantes associées, en particulier, à des coûts de production élevés en bioréacteurs et à des contraintes sanitaires commandant un contrôle strict des risques de contamination des produits par des virus, des prions ou des séquences d’ADN oncogènes (Raskin et al. 2002; Capell et al. 2004).
4
1.2. La moléculture végétale, une alternative aux approches de production
classiques
C’est dans ce contexte que s’est développée graduellement la moléculture végétale (de l’anglais: Plant Molecular Farming), sur la base des avantages associés aux plantes utilisées comme hôtes d’expression (Fisher et Emans, 2000). En pratique, un premier avantage des plantes pour la production de protéines est leur faible coût de production. Selon Twyman et al. (2003), les coûts de production pour les plantes représentent de 2 à 10% des coûts de production associés à la culture de cellules microbiennes et de 0,1% des coûts de production associés aux cellules de mammifères, des différences attribuables aux investissements requis pour la mise en place des plates-formes de production qui, dans le cas des plantes, se résument à l’installation d’infrastructures de base pour l’irrigation, la fertilisation et l’apport de lumière (Capell et al. 2004).
Un avantage additionnel des plantes pour la production de protéines thérapeutiques est lié aux risques minimes de contamination des produits protéiques par des agents pathogènes humains (Capell et al. 2004). Un autre avantage est lié aux cycles de production très courts dans plusieurs systèmes, tel qu’illustré par exemple par l’entreprise québécoise Medicago, qui a su produire dans son usine de Caroline du Nord, en 2012, 10 millions de doses du vaccin H1N1 en moins de quatre semaines (Fonds de recherche du Québec 2015). Sur le plan biochimique, les plantes offrent l’avantage de produire des protéines complexes, notamment des protéines glycosylées (Fischer & Emans 2000), qui montrent des qualités structurales et fonctionnelles très semblables à celles de leurs contreparties humaines exprimées dans leur milieu cellulaire d’origine (Sabalza et al. 2014).
Différents organes sont utilisés pour la production de protéines d’intérêt clinique dans les plantes incluant les feuilles, les semences, les organes de reproduction végétative et les fruits, sélectionnés selon les caractéristiques intrinsèques de la protéine à exprimer et son utilisation éventuelle post-expression. Techniquement, deux approches sont adoptées pour l’expression de protéines recombinantes : (i) l’expression stable, basée sur l’utilisation de cellules ou de lignées transgéniques portant le transgène d’intérêt dans leur bagage génétique transmis à la descendance; et (ii) l’expression transitoire, basée sur l’expression de la protéine d’intérêt, sur une période de quelques jours, dans des cellules ou tissus végétaux soumis à une transfection du transgène correspondant (Xu et al. 2012). Depuis une dizaine d’années, la production de protéines d’intérêt à grande échelle dans les plantes
5
fait appel le plus souvent à l’expression transitoire (Paul et al. 2013). Les plates-formes d’expression transitoire sont basées en général sur l’utilisation du vecteur bactérien de transformation génique Agrobacterium tumefaciens, qui a pour particularité d’introduire un fragment de son ADN, l’ADN-t, dans les cellules de la plante hôte (Kapila et al. 1997). Techniquement, l’expression transitoire d’une protéine recombinante en système végétal comporte deux phases: (1) la phase de croissance en milieu confiné, pendant laquelle est produite la plante utilisée ensuite comme hôte d’expression; et (2) la phase d’expression (ou phase d’incubation), pendant laquelle la plante exprime la protéine d’intérêt. Au terme de la phase de croissance, la séquence d’ADN (ou transgène) codant pour la protéine d’intérêt, préalablement introduite en laboratoire dans l’ADN-t de la bactérie, est introduite dans la plante par transfection. Cette étape se base, dans la plupart des cas, sur une procédure d’infiltration bactérienne appelée l’agroinfiltration, par laquelle une suspension agrobactérienne portant le transgène d’intérêt est introduite, sous vide, dans les tissus foliaires de la plante hôte (Kapila et al. 1997). Suite à l’infiltration, les bactéries transfèrent des copies de leur ADN-t dans les cellules de la plante (Fischer & Emans 2000). La protéine s’exprime alors dans les cellules végétales transfectées, sur une période de 6 à 14 jours, dépendant du vecteur d’expression, des caractéristiques structurales de la protéine d’intérêt et de la souche agrobactérienne utilisée pour l’infiltration (Huang & McDonald 2009).
Une plante aujourd’hui prisée pour l’expression transitoire de protéines recombinantes d’intérêt clinique est la Solanacée N. benthamiana, une cousine sauvage du tabac originaire d’Australie utilisée comme modèle expérimental depuis de nombreuses années pour l’étude des interactions plante-pathogène (Goodin et al. 2008). Les lignées de cette plante utilisées en moléculture proviennent des régions désertiques de l’Australie centrale (Bally et al. 2015). Leur capacité d’adaptation à des environnements hostiles et leur caractère extrêmophile leur ont permis, avec le temps, d’acquérir des caractéristiques intéressantes en pratique pour la production de protéines recombinantes complexes comme des anticorps thérapeutiques ou des antigènes viraux pour la confection de vaccins (Bally et al. 2015; Goodin et al. 2008). En conditions confinées, N. benthamiana montre une croissance rapide et une biomasse foliaire importante qui lui permettent d’accumuler des quantités importantes de protéines recombinantes. Cette plante est aisément transformable et naturellement efficace pour l’expression de gènes d’origine étrangère. Il s’agit, de surcroît, d’une espèce non comestible, ce qui minimise les risques éventuels de contamination des produits destinés à l’alimentation humaine (Goodin et al. 2008).
6
En dépit de tous ces avantages, la culture de cette plante présente des défis importants, liés à un manque de données de base sur sa croissance dans les systèmes de production courants, sur les rendements en protéine recombinante dans ses tissus foliaires en fonction des conditions culturales et, de manière plus générale, sur la prépondérance des contaminants protéiques endogènes dans les feuilles exprimant des protéines recombinantes à des taux élevés.
1.3. Problématique de recherche
1.3.1. Stratégies pour l’optimisation du rendement en protéine recombinante
Plusieurs facteurs endogènes et exogènes peuvent influencer le rendement en protéine recombinante dans une plante, incluant des facteurs génétiques, les conditions de culture et, sur une base plus spécifique, les caractéristiques propres à la protéine exprimée dans son nouvel environnement cellulaire (Ullrich et al. 2015 ; Sack et al. 2015). La sélection génétique et le génie génétique ont été, au fil des années, des voies privilégiées pour l’optimisation des rendements en protéines recombinantes. Des stratégies d’optimisation ont notamment permis de sélectionner et d’améliorer les caractères de la plante hôte par hybridation, autopollinisation et la sélection de meilleurs cultivars (Sack et al. 2015; Hood et al. 2012). D’autres stratégies ont misé sur l’amélioration des vecteurs d’expression et des séquences régulatrices utilisés pour l’expression des transgènes d’intérêt (Ullrich et al. 2015). Comme différents facteurs dans la plante diminuent aussi l’accumulation et la qualité des protéines recombinantes, des efforts de recherche ont visé, plus récemment, à augmenter les rendements par une modification structurale de la protéine exprimée (génie protéique) ou une modulation de son environnement cellulaire (génie cellulaire). La dégradation protéolytique des protéines exprimées représente par exemple un cheval de bataille depuis plusieurs années. Des modifications ponctuelles dans la protéine exprimée ou une modification dirigée du fonctionnement de son nouvel environnement cellulaire ont permis sa protection dans plusieurs cas (Sack et al. 2015). Des études récentes utilisant les technologies de l’ARNi pour diminuer la quantité de protéases endogènes ou pour moduler les réactions de défense de la plante hôte ont permis, en outre, de favoriser l’expression et la stabilité de certaines protéines (Ullrich et al. 2015).
Quelques auteurs se sont intéressés en parallèle, ces dernières années, à l’impact des conditions de culture sur la croissance de la plante hôte et le rendement en protéine
7
recombinante. Des données ont été publiées, notamment, sur les effets de paramètres agronomiques et environnementaux de base comme la lumière, l’enrichissement carboné, la fertilisation, la photopériode et la température, aussi bien en phase de croissance qu’en phase d’incubation post-infiltration (Fischer et al. 2015). Les sections qui suivent dressent un portrait de ces travaux, avec une attention particulière portée aux plates-formes d’expression basées sur l’agroinfiltration et l’expression transitoire.
1.3.2. Influence des conditions de culture post-infiltration sur le rendement en protéine recombinante
En moléculture végétale, l’optimisation des conditions de culture sur la croissance et le développement des ‘plantes-usines’ destinées à l’expression transitoire s’étend sur l’ensemble des phases de croissance et d’expression, mais les conditions les plus avantageuses déterminées pour l’une des deux phases pourront différer des conditions les plus avantageuses pour l’autre phase. Durant la phase de croissance, une optimisation des conditions culturales est associée de facto à des critères quantitatifs d’ordre agronomique comme un gain en biomasse foliaire ou une vitesse de développement accélérée. Durant la phase d’incubation, une optimisation du rendement doit tenir compte du rendement obtenu en protéine recombinante et de la qualité du produit récolté, déterminés pour leur part par deux événements clés du processus : le transfert de l’ADN-t dans les quelques jours suivant l’agroinfiltration et la biosynthèse protéique à l’échelle de la cellule hôte dans les jours suivants (Robert et al. 2015). En pratique, toute optimisation effective du rendement global en protéine recombinante à cette étape devra viser à augmenter le taux de production de la protéine d’intérêt dans les tissus de la plante, à maximiser l’étendue des surfaces effectives de production sur chaque plante utilisée et à faciliter l’obtention d’un produit de qualité, notamment par une diminution de la teneur en contaminants protéiques endogènes retrouvés dans les extraits végétaux au moment de l’extraction des protéines à partir des tissus producteurs (Robert et al., 2015; Fujiuchi et al. 2016; Shang et al., 2018). La phase d’incubation montre une complexité d’autant plus grande par rapport à la phase de croissance que la plante interagit avec un organisme tiers, la bactérie A. tumefaciens, et qu’elle continue à accumuler en cours de route une variété de protéines endogènes incluant la RuBisCO, problématique pour la purification subséquente du produit d’intérêt (Robert et al. 2015).
8
1.3.3. La RuBisCO, un contaminant endogène majeur en moléculture
En général, l’étape ultime dans la production d’une protéine recombinante en moléculture végétale est l’obtention d’un produit protéique de qualité, par des opérations d’extraction et de purification plus ou moins complexes. Cette étape de traitement post-expression (de l’anglais : Downstream processing), souvent très onéreuse, peut représenter jusqu’à 80% des coûts totaux de production d’une protéine (Wilken et al. 2012). Un élément particulièrement problématique à cette étape est la présence de contaminants endogènes dans les extraits protéiques tirés de la plante hôte au moment de la récolte, qui contiennent dans plusieurs cas des polyphénols, des alcaloïdes, de la chlorophylle et des protéines solubles endogènes (Woodart et al. 2009). La présence de ces composés entraîne des coûts parfois élevés associés, d’une part, à leurs effets négatifs possibles sur l’intégrité structurale et, d’autre part, l’activité de la protéine d’intérêt et à leur élimination des produits finaux. Un contaminant endogène important dans les tissues foliaires est la RuBisCO, une protéine soluble essentielle à la fixation du CO2 atmosphérique par la photosynthèse et reconnue pour être la protéine la plus abondante sur terre (Robert et al. 2015). Cette protéine représente de 40 à 60% des protéines solubles dans les feuilles du tabac (Geada et al. 2007); son abondance et sa taille moléculaire élevée constituent des défis importants lors de la purification des protéines recombinantes, qui sont retrouvées systématiquement à des concentrations plus faibles dans la plante (Robert et al. 2015).
1.3.4. Impact des conditions de culture sur l’expression des protéines recombinantes en contexte de moléculture
Dans ce contexte, ce projet de maîtrise avait pour objectif général d’évaluer l’impact des conditions culturales post-infiltration sur l’accumulation relative de la RuBisCO et d’une protéine recombinante d’intérêt clinique exprimée dans les feuilles de N. benthamiana. L’hémagglutine H1 du virus de l’influenza, utilisée comme antigène pour la production de vaccins contre la grippe (D’Aoust et al., 2010), a été sélectionnée ici comme protéine recombinante modèle pour l’ensemble des travaux. Différents facteurs environnementaux ont été évalués dans le cadre de l’étude, incluant la lumière, la concentration en CO2 atmosphérique, la fertilisation en azote et la température ambiante à proximité du couvert végétal. Les paragraphes qui suivent résument brièvement l’état de nos connaissances sur l’impact de ces facteurs culturaux en contexte de moléculture végétale.
9
1.3.4.1. Influence du spectre lumineux
L’environnement lumineux d’une plante se caractérise par trois composantes principales : l’intensité lumineuse, qui réfère à la quantité de lumière reçue par la plante; la photopériode, qui réfère aux durées relatives du jour (période éclairée) et de la nuit (période d’obscurité); et la qualité spectrale, relative au spectre de longueurs d’ondes qui parviennent au couvert végétal. Alors que la quantité de lumière disponible aux plantes a un impact direct sur leur taux d’activité photosynthétique et leur efficacité à générer de la biomasse, la qualité spectrale a un impact aussi bien sur la photosynthèse que sur la mise en place d’une gamme de phénomènes morphogénétiques influençant leur métabolisme et leur développement (Janda et al. 2015). Il a été documenté à maintes reprises que différentes longueurs d’ondes pouvaient favoriser, ou au contraire limiter, le taux d’activité métabolique, le taux de croissance et le développement général d’une plante.
Dans un contexte de moléculture, quelques études ont abordé l’influence de la qualité spectrale sur des plants agroinfiltrés en phase d’incubation, se limitant toutefois à comparer les effets d’une lumière blanche fournie par des tubes fluorescents à ceux d’une lumière blanche fournie par des diodes électroluminescentes (DELs) (Matsuda et al. 2017; Janda et al. 2015; Norikane 2015). En contexte commercial, ces deux sources de lumière se distinguent par leur durée de vie, leur bilan éco-énergétique et leur impact sur les besoins en irrigation à l’échelle de la culture. Elles se distinguent également par leur distribution spectrale et la quantité de chaleur émise, des différences qui peuvent éventuellement avoir un impact significatif sur l’accumulation des protéines recombinantes et des métabolites secondaires (Matsuda et al. 2017). Janda et al. (2015) rapportaient par exemple qu’un éclairage avec fluorescents avait un impact variable dans la plante hôte selon l’âge physiologique des feuilles, en favorisant d’une part l’accumulation d’une protéine recombinante fluorescente modèle GFP, dans les feuilles plus âgées; et en altérant, d’autre part, la teneur en pigments caroténoïdes dans ces mêmes organes. Matsuda et al. (2017) observaient pour leur part un impact significatif de la chaleur émise par des fluorescents sur l’accumulation des protéines recombinantes, associé à des températures foliaires de 1⁰C à 2⁰C plus élevées par rapport à un éclairage de type DEL pour une température ambiante comparable dans le milieu ambiant.
Très peu d’études se sont attardées jusqu’ici à l’impact de longueurs d’onde spécifiques sur la production de protéines recombinantes dans les plantes, mais des impacts éventuels demeurent plausibles considérant les effets démontrés de certaines longueurs d’onde sur
10
la croissance, le développement et le rendement des cultures horticoles. Considérant les influences multiples du spectre lumineux sur la physiologie des plantes, des effets de cette variable sur l’expression d’une protéine recombinante ne peuvent être exclus à priori. La lumière bleue et la lumière rouge, en particulier, ont une forte influence sur la biologie d’une plante, aussi bien sur sa croissance qu’au niveau métabolique (Darko et al. 2014, Gautam et al. 2012). S’intéressant à ces questions dans un contexte de moléculture végétale, Gagné (2015) et Norikane (2015) ont étudié l’impact de sources lumineuses rouges et bleues sur la croissance de l’hôte d’expression N. benthamiana et son efficacité à exprimer des protéines recombinantes. En bref, les éclairages testés n’ont montré aucun effet significatif sur la biomasse foliaire ou sur l’expression de protéines recombinantes. De son côté, Norikane (2015) rapportait qu’un apport additionnel de lumière rouge couplé à une diminution de lumière verte permettait d’augmenter la teneur de certains pigments photosynthétiques, dont les caroténoïdes, dans le tissu foliaire.
Un éclairage sous lumière rouge peut aussi influencer la croissance et le développement des plantes en fonction du rapport « rouge:rouge lointain » atteignant le couvert végétal. Il est bien documenté qu’un faible rapport rouge:rouge lointain peut induire un changement de forme de la plante en favorisant son élongation, un phénomène appelé ‘évitement de l’ombre’ (de l’anglais: Shade avoidance) (Wang et al. 2015). Ce phénomène physiologique qui permettrait de réduire ou d’éliminer l’utilisation de certains régulateurs de croissance utilisé en sériculture tels que des auxines, des gibbérellines et des brassinostéroïde, un effet qui pourrait selon Norikane (2015) s’avérer d’intérêt sur le plan de la sécurité dans un contexte de production biopharmaceutique destiné à l’humain. Il n’est pas exclu, par ailleurs, qu’une altération du rapport rouge:rouge lointain puisse, par ses effets sur le ratio tige/feuille, influencer le rendement en protéine recombinante dans la plante sur une base pondérale. Une augmentation du nombre de photons dans le rouge lointain pourrait aussi présenter des avantages sur le plan de la photosynthèse en permettant une plus grande interception de lumière par les feuilles situées à la base des plantes (Smith et al. 2017).
L’ajout de lumière verte dans le régime d’éclairage pourrait par ailleurs s’avérer intéressant en moléculture, particulièrement en ce qui concerne le taux de photosynthèse dans les feuilles (Folta et al. 2007; Smith et al. 2017). Les photons verts pénètrent profondément dans les cellules végétales par la faible absorption de la chlorophylle dans le vert et la dispersion de la lumière verte dans la feuille, ce qui induirait une assimilation plus efficace de la lumière incidente, une hausse du ratio RuBisCO/chlorophylle et un taux de
11
photosynthèse accru dans les chloroplastes (Smith et al. 2017, Terashima et al. 2009; Evans & Volgelmann 2003). Des données additionnelles sont toutefois requises quant au potentiel de la lumière verte en moléculture, considérant les conclusions mitigées formulées jusqu’ici dans la littérature. Des articles récents rapportaient, par exemple, une biosynthèse protéique diminuée chez le concombre ou la laitue soumis uniquement à un éclairage vert de type DEL sous des intensités lumineuses égales ou inférieures à 100 μmol m−2 s−1 (Muneer et al. 2014; Su et al. 2014).
1.3.4.2. Influence d’un manque de lumière
La lumière est essentielle aux plantes pour l’accumulation d’énergie et la production de nutriments carbonés essentiels à leur survie par le processus de photosynthèse. Alors que l’impact crucial de ce facteur sur la croissance, le développement et le métabolisme des plantes est bien documenté, il est connu aussi que ces organismes poursuivent leur développement pendant la nuit en convertissant une part importante de l’énergie stockée en journée et en l’utilisant pour la croissance (Seluzicki et al. 2017). L’expression séquentielle de gènes diurnes (exprimés en journée) et de gènes nocturnes (exprimés à l’obscurité) dans la plante, essentielle à sa croissance et à son développement harmonieux, est régulée par le bon fonctionnement de son horloge biologique interne déterminé pour sa part par le rythme journalier (ou circadien) des périodes du jour et de la nuit (Seluzicki et al. 2017). L’obscurité ou des conditions lumineuses non optimales induisent des changements physiologiques importants dans la plante, qui se traduisent notamment par une altération de la biosynthèse des protéines et par une baisse marquée de la teneur en RuBisCO et autres protéines associées à la photosynthèse dans les chloroplastes.
Sous des conditions de lumière limitantes, la croissance des plantes se caractérise par un étiolement des tiges, des entrenœuds allongés et des chloroplastes indifférenciés appelés étioplastes (Seluzicki et al. 2017; Rodríguez-Villalón et al. 2009). Ce phénomène appelé skotomorphogénèse est régulé par des gènes et des photorécepteurs associés à la lumière. Il est influencé par la présence de plusieurs phytohormones, incluant des brassinostéroïdes, des gibbérellines, des auxines et des cytokinines (Seluzicki et al. 2017). En particulier, Benkovà et al. (1999) rapportaient que des chloroplastes de tabac soumis à 12 h d’obscurité accumulaient davantage de cytokinines que des chloroplastes maintenus à la lumière, de manière à soutenir la biosynthèse des protéines et de la chlorophylle en période de noirceur.
12
Il a été démontré que l’obscurité –ou l’anticipation d’une période d’obscurité par la plante– influençaient des fonctions métaboliques internes associées à une modification du taux de photosynthèse et de la teneur relative en amidon et en sucres solubles dans les feuilles (Seluzicki et al. 2017; Wang et al. 2016). En cours de journée, un taux métabolique élevé dans la plante est assuré par l’énergie produite par la photosynthèse alors que l’amidon accumulé en journée est dégradé graduellement pendant la nuit pour assurer un maintien de la synthèse protéique. Wang et al. (2016) rapportaient que la teneur en sucres solubles augmentait dans des feuilles soumises à 8 h de noirceur en cours de journée. D’autres études rapportaient qu’une augmentation de la concentration en saccharose dans le milieu de culture diminuait l’impact de la noirceur sur la croissance de plantules d’Arabidopsis en atténuant l’impact négatif du manque de lumière sur le fonctionnement du photosystème II (Haydon et al. 2013; Bläsing et al. 2005).
Des conditions de noirceur ont un effet marqué sur le chloroplaste, siège du processus de photosynthèse. Cet organite réagit fortement à des changements de luminosité et à une altération du spectre lumineux incident. Wang et al. (2016) rapportaient, à cet égard, qu’une période de noirceur de 8 h influençait le patron d’expression de plusieurs protéines chloroplastiques associées à la photosynthèse chez Arabidopsis. Ces auteurs rapportaient dans la même étude que l’absence de lumière inhibait des fonctions du photosystème II (tributaire de lumière) au profit d’un transfert cyclique des électrons au sein du photosystème I et de l’expression des gènes régulant la NADPH déshydrogénase associée au phénomène de chlororespiration. Les conditions de noirceur provoquaient de surcroît une baisse de la teneur en chlorophylle a au profit de la chlorophylle b, de même qu’une baisse générale de l’activité RuBisCO dans les feuilles. Aucune donnée n’est encore disponible, toutefois, quant à l’impact d’une période noirceur sur la teneur en RuBisCO dans un contexte de moléculture où la plante exprime une protéine recombinante.
1.3.4.3. Influence d’un apport d’azote exogène
L’azote est un élément essentiel à la croissance et au développement des plantes, de par son rôle dans la structure de métabolites primaires et secondaires variés comme les protéines, les acides nucléiques, les phytohormones, les polyamines, les terpénoïdes et les phénylpropanoïdes (Tegeder et Masclaux-Daubress 2017). Les plantes absorbent l’azote minéral sous deux formes principales, le nitrate (NO3⁻) et l’ammonium (NH4⁺). Quelques espèces montrent une préférence pour l’ion NH4⁺, en particulier dans les écosystèmes où
13
le processus de nitrification est restreint. À l’inverse, la plupart des autres espèces préfèrent l’ion NO3⁻, généralement plus accessible dans des sols bien drainés où le taux de nitrification est élevé (Truong Tho et al. 2017).
L’azote inorganique dans la plante est d’abord absorbé par les poils racinaires par l’action de transporteurs membranaires spécifiques, puis intégré, ou « assimilé », au métabolisme sous forme organique par l’intermédiaire du métabolisme des acides aminés. Les coûts nets associés à l’assimilation de l’azote inorganique diffèrent selon la forme absorbée. Les nitrates parvenus aux cellules racinaires sont d’abord réduits en nitrites dans les racines et les feuilles par l’action de la nitrate réductase puis en NH4⁺ par l’action de la nitrite réductase, pour être finalement assimilés aux acides aminés par l’action des enzymes glutamine synthétase et glutamate synthase (Hirel et al. 2001). En comparaison, l’azote absorbé sous forme de NH4⁺ est assimilé directement dans les racines par la glutamine synthétase et la glutamate synthase, sans recours à une étape de réduction préalable (Hirel et al. 2001). Au bilan, le coût énergétique associé à l’absorption du NH4⁺ dans la plante est inférieur au coût associé à l’absorption du NO3⁻. L’intégration d’un ion NH4⁺ aux acides aminés nécessite le transfert de deux électrons à partir du pool énergétique cellulaire alors que celle d’un ion NO3⁻, qui montre un état d’oxydation beaucoup plus élevé, nécessite huit électrons additionnels (Bloom et al. 1992; Stuart Chapin et al. 1987).
En pratique, l’impact des formes d’azote fournies à la plante dans la solution nutritive sur le métabolisme primaire et la biosynthèse protéique diffère d’une espèce à l’autre et varie selon les conditions de culture, notamment en situation de stress. Geiger et al. (1999) ont rapporté par exemple qu’un engrais azoté avec un ratio NH4⁺/NO3⁻ élevé avait un impact positif sur le taux de photosynthèse, l’activité des enzymes du cycle de Calvin, la teneur en acides aminés et la concentration en protéines dans les feuilles du tabac par rapport à un engrais de base ne contenant que du NO3⁻, aussi bien en conditions de culture optimales qu’en conditions défavorables. En comparaison, le taux de croissance, le taux de photosynthèse et la teneur en protéines dans les racines étaient optimales chez la tomate nourrie avec un engrais à ratio NH4⁺/NO3⁻ de 1 : 3, alors qu’une teneur relative plus faible en NO3⁻ était requise pour le maintien d’un taux métabolique et d’un taux de croissance comparables à des températures plus faibles (Liu et al. 2016). Peu de données sont disponibles quant à l’impact des ratios NH4⁺/NO3⁻ sur la performance des plantes utilisées en moléculture, mais les conditions de stress inhérentes aux procédés adoptés, par exemple lors du processus d’agroinfiltration dans les systèmes d’expression transitoire,
14
pourraient avoir une influence sur la biosynthèse des protéines et le rendement final en protéine recombinante.
Très peu d’études ont abordé l’impact d’un apport exogène d’azote sur le rendement en protéine recombinante dans un contexte de moléculture, ou encore l’impact des formes d’azote absorbées sur l’accumulation relative des protéines recombinantes et endogènes dans le tissu foliaire. Des études ont rapporté les effets positifs d’un apport exogène de NO3⁻ sur la quantité d’anticorps recombinants sécrétés par des cellules de tabac en culture ou par les poils racinaires de lignées de tabac transgéniques (Häkkinen et al. 2014; Holland et al. 2010). De leur côté, Fujiuchi et al. (2014) se sont attardés à l’impact d’un apport de NO3⁻ sur la teneur en antigène HA exprimé transitoirement chez N. benthamiana pendant les phases de croissance et d’incubation. Un apport de NO3⁻ à forte dose pendant la phase de croissance a montré un impact positif sur la teneur en protéines solubles et le rendement en antigène HA sur une base pondérale, mais un effet négatif sur la croissance des plants, pour un rendement net par plante comparable au rendement du traitement témoin sans fertilisation. De surcroît, l’ajout d’azote dans la solution d’irrigation pendant la phase d’incubation a influencé à la baisse la teneur en HA, soulignant l’importance d’un dosage adéquat de l’azote total en cours de production et d’un ratio optimal des formes ajoutées dans la solution nutritive. Peu de données sont encore disponibles dans le cas de l’hôte d’expression N. benthamiana, mais des travaux récents par notre groupe de recherche suggèrent les impacts mitigés d’un apport en NH4⁺ sur le rendement relatif en protéine recombinante, en raison d’un effet positif préférentiel de cette forme azotée sur la teneur en RuBisCO (Shang et al. 2019).
1.3.4.4. Influence de la teneur en CO2 atmosphérique
Constatant l’impact négatif d’une forte dose d’azote nutritif sur le taux de croissance de la plante hôte, Fujiuchi et al. (2014) suggéraient de coupler l’apport d’azote dans la solution d’irrigation à une teneur élevée en CO2 atmosphérique dans la serre ou dans la chambre de croissance, de manière à maintenir aussi bien un taux de croissance satisfaisant de la plante qu’une teneur pondérale élevée en protéines foliaires. Il est bien documenté pour les plantes en C3 qu’un enrichissement carboné en conditions confinées a un impact bénéfique non seulement sur le taux de photosynthèse global du couvert végétal, mais aussi sur l’efficacité du métabolisme azoté, l’allocation des réserves glucidiques et la croissance générale des plantes, par un effet positif direct sur la fixation du carbone ambiant et la production
15
conséquente de biomasse (Geiger et al. 1999). Sur le plan physiologique, les effets positifs d’une teneur élevée en CO2 atmosphérique, tributaires d’une assimilation accrue de ce nutriment dans les tissus photosynthétiques, sont liés directement à l’efficacité réciproque des sentiers métaboliques de l’azote et du carbone. En pratique, ces deux composantes majeures du métabolisme des végétaux sont en interaction étroite et sont souvent considérées conjointement par le biais du ratio C : N (Geiger et al. 1999). Lorsque le ratio C : N est en déséquilibre dans une plante, l’un des deux éléments devient limitant pour sa croissance et son développement.
À titre d’exemple, Martin et al. (2002) ont observé que le ratio C : N jouait un rôle important dans la croissance de jeunes plants d’Arabidopsis en raison de son influence marquée sur la mobilisation des réserves métaboliques endogènes et l’expression des gènes liés à la photosynthèse. Ces auteurs rapportaient notamment qu’un apport d’azote sous des conditions limitantes de CO2 entraînait une diminution significative du taux de transcription du gène de la petite sous-unité de la RuBisCO. De manière comparable, des plants de tabac soumis à un ratio C : N élevé par le biais d’un enrichissement en CO2 atmosphérique sans apport d’azote montraient une croissance ralentie, un taux de photosynthèse à la baisse, une activité diminuée des enzymes du cycle de Calvin et une faible teneur foliaire en acides aminés et en protéines solubles (Geiger et al. 1999). Peu de données sont actuellement disponibles quant aux effets réciproques d’un apport exogène d’azote nutritif et d’un enrichissement en CO2 en contexte de moléculture, mais un impact combiné de ces deux facteurs sur les teneurs en RuBisCO et en protéine recombinante dans la plante apparaît plausible.
1.3.4.5 Influence de la température ambiante
Il a été démontré qu’une variation de température de 5⁰C au-dessus ou en dessous des températures de croissance optimales de 15 à 25⁰C pour la croissance des agrobactéries avait un impact important sur le rendement total en protéine recombinante dans les feuilles agroinfiltrées de l’hôte N. benthamiana (Fujiuchi et al. 2016). Selon les auteurs, la teneur en protéine recombinante dans les feuilles serait fortement dépendante des effets de la température ambiante sur l’efficacité du transfert de l’ADN-t par les agrobactéries et sur l’incidence de symptômes de nécrose et de déshydratation foliaire en situation d’infection bactérienne.
16
Plusieurs auteurs par ailleurs ont établi un lien entre une faible teneur en protéine recombinante dans des feuilles agroinfiltrées et des températures ambiantes élevées, de l’ordre de 25 à 30⁰C, dans le couvert végétal (Matsuda et al. 2017; Patil et Fauquet 2015; Moon et al. 2014). Matsuda et al. (2017), en étudiant pendant six jours la relation entre la température ambiante et l’accumulation d’un antigène viral recombinant exprimé transitoirement dans le réticulum endoplasmique des feuilles de N. benthamiana, ont observé que la teneur en antigène atteignait un maximum après six jours à 20⁰C, comparativement à quatre jours sous une température de 25⁰C. Après quatre jours, la teneur en antigène diminuait dans les plantes cultivées à 25⁰C alors que le taux de protéines solubles diminuait dès le premier jour post-agroinfiltration à des températures plus élevées. Ces baisses de rendements étaient expliquées, entre autres, par un impact de la température ambiante sur l’efficacité de transfert de l’ADN-t par le vecteur agrobactérien. Il est bien établi que la température optimale pour le développement des tumeurs associées aux souches sauvages d’A. tumefaciens est de 22⁰C et que les risques d’infection sont minimes à des températures avoisinant 30⁰C (Fullner & Nester 1996). Une telle influence des températures élevées serait expliquée par leur impact négatif sur la machinerie de transfert de l’ADN-t, en particulier par une accumulation déficiente de plusieurs protéines de virulence.
Lorsque des plantes agroinfiltrées sont soumises à des températures ambiantes au-delà de 25⁰C, les feuilles développent aussi des symptômes de nécrose apparemment associés à la mise en place d’une réaction de la plante en réponse au stress subi par le transfert de l’ADN-t et l’abondance de protéines mal repliées (Fujiuchi et al. 2016). De telles nécroses ont été observées à plusieurs reprises, peu importe la protéine recombinante exprimée ou la plante hôte utilisée (Matsuda et al. 2017; Patil and Fauquet 2015; Moon et al. 2014). Des symptômes de déshydratation foliaire ont également été observés chez les plantes agroinfiltrées soumises à des températures élevées. Ces différents symptômes de stress seraient causés, en partie, par des effets cytotoxiques liés à la surexpression des protéines recombinantes (Matsuda et al. 2017).
Enfin, si un lien a été clairement établi dans la littérature entre la température ambiante et la teneur en protéine recombinante dans un contexte de moléculture, il convient de noter que la plupart des études publiées sur la question ont considéré l’incubation comme une phase homogène, sur une durée d’environ une semaine post-agroinfiltration. Or, des études ont démontré qu’il existe deux étapes distinctes pendant l’incubation, caractérisées, d’une
17
part. par le transfert de l’ADN-t dans les premiers jours suivant l’agroinfiltration; et, d’autre part, par une synthèse accélérée de la protéine recombinante dans les jours suivants (Robert et al. 2015; Jung et al. 2015). Constatant ce lien étroit entre la température ambiante et l’efficacité de transfert de l’ADN-t, Jung et al. (2015) ont posé l’hypothèse qu’un rendement optimal en protéine recombinante serait obtenu en adoptant une température bien adaptée au processus de transfection dans les premiers jours suivant l’agroinfiltration, suivie d’une température plus élevée favorable à la biosynthèse protéique dans les jours subséquents. Comme attendu, l’application de températures distinctes aux deux étapes de la phase d’incubation a permis l’obtention de rendements accrus en protéine recombinante dans des feuilles détachées du tournesol (Jung et al. 2015). Des travaux demeurent toutefois nécessaires pour évaluer le potentiel de cette approche sur des plantes intactes, notamment chez l’hôte d’expression N. benthamiana.
1.3.4.6 En conclusion
En somme, plusieurs études ont été réalisées ces dernières années pour évaluer l’impact des conditions culturales sur le rendement en protéine recombinante chez les végétaux, mais les données demeurent partielles considérant la complexité des systèmes et le nombre de questions en suspens. Par exemple, plusieurs conditions culturales ont été évaluées pour ce qui touche à la phase d’incubation dans les systèmes d’expression transitoire basés sur l’agroinfiltration mais les données disponibles sont à toutes fins pratiques inexistantes au sujet des effets de la qualité spectrale ou de l’enrichissement carboné. De surcroît, la quasi-totalité des études publiées jusqu’ici n’ont pas tenu pas compte de l’impact des différentes pratiques culturales sur la teneur en RuBisCO, qui représente le contaminant endogène majeur au moment de la récolte des tissus végétaux. En pratique, un rendement satisfaisant en protéine recombinante devrait être mesuré non seulement sur une base absolue, mais aussi sur une base relative tenant compte de la part du métabolisme consacré dans les feuilles à la biosynthèse et l’accumulation des protéines endogènes, qui pourront à terme influencer les coûts globaux de production du produit recombinant (Robert et al. 2015). Une stratégie d’étude tenant compte de cet aspect du problème pourra consister, dans cette optique, à évaluer l’impact des conditions culturales ou des facteurs environnementaux en fonction de leurs effets sur l’évolution du ratio rendement en protéine recombinante:teneur en RuBisCO.
18
1.4. Hypothèses et objectifs du projet de recherche
Avec pour objectif général de générer des données utiles sur l’impact des conditions de culture post-infiltration pour l’hôte d’expression transitoire N. benthamiana, nous nous sommes attardés dans ce projet à évaluer les effets d’une gamme de paramètres culturaux appliqués en phase d’incubation sur le rendement total d’un antigène viral recombinant, l’antigène H1, utilisé dans la production de vaccins contre la grippe saisonnière (D’Aoust et al. 2010). L’impact des conditions testées sur la teneur relative en RuBisCO dans les feuilles a été suivi en parallèle, de manière à assurer un suivi systématique de la teneur relative en antigène recombinant, tenant compte des ressources allouées par la plante à la production de protéines endogènes contaminantes.
1.4.1. Hypothèses de travail du projet
Cinq hypothèses de travail ont été formulées pour le projet, relatives chacune à l’impact général d’un paramètre environnemental sur les rendements total et relatif en antigène H1 dans les feuilles de la plante hôte. De manière plus spécifique, les hypothèses de travail testées dans le cadre du projet ont été les suivantes :
HYPOTHÈSE 1 Une période d’obscurité plus ou moins longue pendant la phase
d’incubation a un impact négatif sur la teneur foliaire en RuBisCO, à l’avantage du rendement relatif en antigène H1 – Section 2.1.
HYPOTHÈSE 2 La qualité du spectre lumineux au-dessus du couvert végétal a un impact
mesurable sur les rendements total et relatif en antigène H1 dans les feuilles – Section 2.2.
HYPOTHÈSE 3 Un régime azoté à base d’ammonium a un effet différentiel sur le
rendement en antigène H1 et la teneur en RuBisCO dans les feuilles – Section 2.3.
HYPOTHÈSE 4 Un enrichissement en CO2 atmosphérique a un impact positif sur le
rendement relatif en antigène par le biais d’une production accrue de biomasse foliaire – Section 2.3.
HYPOTHÈSE 5 La température ambiante à proximité du couvert végétal a un impact
différentiel sur le rendement en antigène H1 et la teneur en RuBisCO dans les feuilles – Section 2.4.
19
1.4.2. Objectifs de recherche du projet
L’objectif principal de ce projet de recherche était de déterminer, sous différentes conditions culturales en phase d’incubation, jusqu’où pouvait être favorisé le ‘’ bien-être ‘’ de la plante-usine N. benthamiana aux niveaux de sa croissance et de son métabolisme sans impact négatif sur la teneur relative en antigène H1 dans ses tissus foliaires.
Plus spécifiquement, le projet avait pour objet d’évaluer le rendement en antigène H1 et la teneur relative en RuBisCO dans les feuilles agroinfiltrées de la plante hôte pour différentes conditions de culture appliquées en phase d’incubation post-infiltration. Différents facteurs environnementaux ont été considérés dans le cadre des travaux, à savoir : (1) le spectre lumineux au-dessus du couvert végétal; (2) le régime en azote; (3) la concentration en CO2 atmosphérique; (4) la température ambiante; et (5) la présence (ou non) de lumière au terme de la phase d’incubation.
20
2. Résultats
Ce projet de recherche comportait quatre parties principales, abordant tour à tour l’impact des facteurs culturaux à l’étude sur le rendement en antigène H1 et la teneur en RuBisCO dans les feuilles de la plante hôte (Sections 2.1–2.4). Des travaux préliminaires ont aussi été menés pour mesurer l’influence possible du processus d’agroinfiltration exprimant H1 sur le taux de croissance de la plante et la teneur en protéines solubles dans ses tissus foliaires (Section 2.0).
La récolte et l’analyse des échantillons ont été réalisées d’abord en divisant la plante en six « unités de production » regroupant, chacune, les feuilles d’un ‘âge physiologique’ comparable (v. Chapitre 4, Figure 4.4) (Goulet et al. 2019). Comme nos données n’ont montré aucune tendance claire quant aux effets des traitements étudiés selon la position des feuilles, les résultats dans ce chapitre sont présentés pour la plupart à l’échelle de la plante entière, histoire d’en simplifier la présentation et l’interprétation.1 Pour toutes les sections qui suivent, les rendements en antigène H1 et les teneurs en RuBisCO sont rapportés sur une base pondérale par gramme (g) de tissu foliaire. Les données sur la RuBisCO ont été compilées en considérant comme modèle la grosse sous-unité de la protéine (RuBisCO large subunit, ou RbcL), facilement quantifiable par densitométrie post-électrophorèse. Les conditions de culture de base dans les chambres de croissance, constantes d’un essai à l’autre, sont rapportées au Tableau 4.1 et les cinq répétitions sont dans le temps.
2.0. Travaux préliminaires : Influence du processus d’agroinfiltration avec
l’expression H1 sur la biomasse foliaire et la teneur relative en RuBisCO
après sept jours d’incubation
Des essais préliminaires ont été menés au départ pour (1) caractériser sommairement la biomasse foliaire des plantes agroinfiltrées avec l’expression H1 au terme de la période d’incubation et (2) déterminer l’impact du processus d’agroinfiltration avec expression H1 sur la teneur en protéines solubles et en RuBisCO dans les feuilles. Ces essais consistaient
1 Les données sont présentées telles que récoltées (i.e. pour les six sections P1, P2, P3, S1, S2, S3) ou selon leur tige(s) d’origine(s) (i.e. tige principale, ou ‘primaire’ [P1+P2+P3] vs tiges axillaires, ou ‘secondaires’ [S1+S2+S3]) (Goulet et al., 2019) dans les quelques cas où les différences observées apparaissaient d’intérêt.