RELATION ENTRE LE CHRONOTYPE, LE SOMMEIL, LA
FATIGUE ET L’EXPOSITION À LA LUMIÈRE CHEZ LES
JEUNES ADULTES TRAVAILLEURS AUX ÉTUDES.
Mémoire
Jeanne Sophie Martin
Maîtrise en médecine expérimentale
Maîtrise ès Sciences (M.Sc.)
Québec, Canada
iii
Résumé
L'objectif de ce mémoire de maîtrise est de présenter les résultats d’une étude effectuée sur 97 étudiants âgés de 19 à 21 ans qui occupent un emploi rémunéré en cours d’année scolaire afin d'évaluer la relation entre le chronotype, l'exposition à la lumière, la fatigue reliée au travail et les problèmes de sommeil. La problématique de recherche découle des préoccupations relatives au fait que les jeunes sont de plus en plus nombreux à cumuler études et travail et qu’un grand nombre doit rogner dans les heures de sommeil pour pouvoir remplir l’ensemble de leurs obligations. Or, la deuxième décennie de la vie est une période de changements importants dans la régulation du sommeil et des rythmes circadiens. On observe dès le début de la puberté une propension à se coucher et à se lever de plus en plus tard, même si les besoins de sommeil demeurent inchangés. Ces changements sont dus à des facteurs physiologiques et sociaux et peuvent mener à l'accumulation d’une dette de sommeil prédisposant le jeune à de la somnolence diurne et à de la fatigue excessive. Il est donc permis de penser que l’intensification du cumul études-travail augmente le risque de présenter une dette de sommeil et, par le fait même, de présenter des symptômes associés à la privation de sommeil. Dans cette étude, le chronotype (ou « préférence circadienne ») est évalué comme facteur d’influence sur les problèmes de sommeil des étudiants travailleurs. De fait, plusieurs publications soulignent que les étudiants, majoritairement des chronotypes du soir (donc ayant une préférence circadienne plus tardive), ont plus de problèmes de sommeil et de fonctionnement pendant la journée (somnolence, fatigue, etc.) que les autres étudiants. Le niveau d’exposition des sujets à la lumière environnementale est également évalué; la lumière est en effet le facteur exogène le plus influent sur la fluctuation et l’entraînement des rythmes circadiens. En résumé, nos résultats suggèrent que les jeunes adultes sont en privation de sommeil lorsqu’ils cumulent études et emploi. Parallèlement, les résultats indiquent que le fait d’être un chronotype du soir, pour un jeune étudiant travailleur, est lié à une qualité de sommeil moindre, à un niveau de fatigue chronique reliée au travail plus élevé et à des patrons d’exposition à la lumière moins des autres chronotypes, notamment une plus faible exposition à la lumière durant le matin et l’après-midi.
v
Abstract
The objective of this master thesis was to evaluate the relationship between chronotype, exposure to light, work-related fatigue and sleep problems in 97 young adults aged 19-21 years who combine their studies with participation in paid work. The research question is based on the fact that several students combine school and work and that many of them report cutting on sleep in order to complete their daily tasks and activities efficiently. Also, the transition to adulthood brings significant changes in sleep patterns and circadian rhythms. Although sleep needs reportedly remain unchanged throughout adolescence, the onset of puberty is characterized by a propensity to delay wake times and bed times. These changes are caused by biological and social processes and can lead to the build-up of a sleep debt and, consequently, sleepiness and fatigue. One may thus advance that an intensification of school and work activities for this population may increase this sleep debt and concomitant symptoms of sleep deprivation. In this study, the chronotype (or "circadian preference") is evaluated as a factor that can influence sleep problems of student workers. Several publications have highlighted that students who have evening chronotype (or having a later circadian preference) have more problems related to sleep and daytime functioning than other students. It is therefore relevant to assess chronotype in student workers for its potential protective or deleterious effect on sleep and fatigue. The level of environmental light exposure was also evaluated, since light is the most important exogenous synchronizer of the circadian system. In summary, the results of this study underline that young adults are likely to exhibit a significant sleep debt when they work while studying. Furthermore, the results indicate that student workers with an evening chronotype is associated with lower sleep quality, higher level of work-related chronic fatigue and distinct patterns of light exposure such as lower light exposure during the morning and the afternoon.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... viii
Liste des tableaux ... ix
Liste des figures ... xi
Remerciements ... xv
Avant-propos ... xvii
Chapitre 1. ... 1
1. Introduction ... 1
1.1. Le sommeil des étudiants ... 1
1.2. Le sommeil des étudiants travailleurs ... 3
1.3. Les rythmes circadiens ... 4
1.3.1. L'horloge biologique ... 7
1.3.2. Entraînement de l'horloge ... 9
1.3.2.1. Zeitgebers photiques : la lumière ... 9
1.3.2.2. Zeitgebers non-photiques : les rythmes comportementaux et sociaux ... 10
1.3.2.3. Mesurer le rythme veille-sommeil par actigraphie ... 12
1.4. Le chronotype ... 14
1.5. Chronotype et sommeil chez les étudiants ... 15
1.6 Objectifs et hypothèses de recherche ... 17
Chapitre 2. ... 19
2. Résultats: Relationship of Chronotype to Sleep, Light Exposure, and Work Related Fatigue in Student Workers ... 19
2.1. Abstract ... 20 2.2. Introduction ... 21 2.3. Methods ... 23 2.3.1. Subjects ... 23 2.3.2. Protocol ... 24 2.3.3. Ambulatory monitoring ... 25
2.3.4. Light data analysis ... 26
2.3.5. SRM analysis ... 27
2.3.6. Statistical analysis ... 27
2.4. Results ... 28
2.4.1. Subjects demographics ... 28
2.4.2. Chronotype ... 28
2.4.3. Actigraphic sleep parameters ... 29
2.4.4. Light exposure ... 29 2.4.5. Social zeitgebers ... 30 2.5. Discussion ... 30 2.6. Acknoledgements ... 35 2.7. Disclosure ... 35 2.8. References ... 35
viii
Chapitre 3. ... 52
3. Discussion ... 52
3.1. Les étudiants travailleurs: une population en privation de sommeil ... 52
3.2. Fatigue chronique et chronotype: un problème de récupération? ... 55
3.3. Les chronotypes du soir sont plus faiblement exposés à la lumière ... 57
3.4. Les chronotypes du soir et leur exposition aux zeitgebers ... 61
Conclusion ... 63
ix
Liste des tableaux
Tableau 1.1. Liste de quelques-uns des systèmes étant sous contrôle circadien chez l’humain ... 6 Tableau 2.1. Sociodemographic data and clinical characteristics of student workers
according to chronotype . ... 46 Tableau 2.2. Sleep parameters of student workers according to chronotype... 47
xi
Liste des figures
Figure 1.1 Profil circadien typique de différentes fonctions physiologiques chez
l’humain... ... 5 Figure 1.2. Relation entre les noyaux suprachiasmatiques et de la glande pinéale dans le
cortex chez l’humain. ... 8 Figure 1.3. Influence des signaux photiques et non photiques sur l’horloge biologique
située dans les noyaux suprachiasmatiques (NSC) de l’hypothalamus... ... 11 Figure 1.4. Exemple d’actogramme ou enregistrement par actigraphie... ... 13 Figure 2.1. Mean (and SEM) number of minutes of exposure to bright light ( 1000 lux)
at different periods during waking hours.. ... 48 Figure 2.2. Mean (and SEM) number of minutes of exposure to different ranges of light
intensities during waking hours.. ... 49 Figure 2.3. Mean (and SEM) light intensity (in log lux) averaged with respect to formal
clock hour over the 14 days of actigraphy.. ... 50 Figure 2.4. Mean (and SEM) light intensity (in log lux) received after wake time, in
xiii
You can’t stop the waves,
but you can learn to surf.
xv
Remerciements
Dr. Luc Laberge et Dr. Marc Hébert, pour m’avoir donné l’opportunité d’effectuer ce
projet de maîtrise et de faire partie de leurs laboratoires, pour la haute qualité de ma formation scientifique, leur patience, leur disponibilité et leurs conseils avisés.
Les membres d’Écobes Recherche et transfert du Cégep de Jonquière – merci spécial à
Michael Gaudreault et Julie Auclair pour le soutien en maths.
IRSST – merci spécial à Chloé Thuilier, pour son aide à toute heure! …et pour m’avoir fait découvrir Boby Lapointe.
Mes collègues au lab de photobiologie du CRURLG – Alexandre Sasseville, Joëlle
Lavoie, Anne-Marie Gagné, Charlotte Fontaine : pour l’esprit de collaboration, et pour
ces journées où il va y avoir une tempête de neige.
Ma famille pour leur soutien et leur confiance durant ce projet d’étude qui était aussi une
réorientation professionnelle.
La famille Lebel pour leur accueil à Québec – les joyeux soupers improvisés, les coups de
main, je ne me suis jamais sentie seule grâce à vous.
Anthony Goncalves, gentleman et superhéros.
Guillaume Dumas-Lapointe, un grand homme, et le meilleur des amis.
xvii
Avant-Propos
Les travaux de recherche effectués durant ma maîtrise et présentés dans ce mémoire proviennent d’une enquête longitudinale ayant cours à ÉCOBES Recherche et transfert du Cégep de Jonquière (Saguenay, Canada), soit l’ « Enquête longitudinale auprès des élèves saguenéens et jeannois (ELESJ) ». Les résultats ici rapportés concernent plus particulièrement le quatrième temps de mesure (T4). Ce projet, financé par l’Institut de recherche Robert-Sauvé en santé et en sécurité du travail (IRSST) et la Fondation Asselin du Cégep de Jonquière, a été effectué en collaboration avec le laboratoire d’électrophysiologie visuelle et de photobiologie du Dr. Marc Hébert (LEVP).
Voici la contribution des auteurs de l’article scientifique intitulé :
The Relationship of Chronotype to Sleep, Light Exposure, and Work Related Fatigue in Student Workers. Martin JS, Hébert M, Ledoux É, Gaudreault M, Laberge L.
Chronobiology International, 2012 Apr;29(3):295-304.
Jeanne Sophie Martin a effectué la collecte de données (actigraphie, questionnaires), la calibration des instruments (actigraphie), la saisie et le traitement des données brutes, la création d’un algorithme de traitement de données de lumière, les analyses statistiques; a écrit l’article.
Dr. Marc Hébert a contribué à la calibration des instruments (actigraphie); discuté et révisé l’article.
Dr. Élise Ledoux a contribué à la conception de l’étude; a dirigé et effectué les entrevues semi-dirigées et le traitement des données qualitatives.
Michael Gaudreault a effectué la validation des calculs mathématiques.
Dr. Luc Laberge a conçu, initié, effectué le design et dirigé le projet de recherche; a discuté et révisé l’article.
1
Chapitre 1.
1. Introduction
1.1. Le sommeil des étudiants
Le sommeil des étudiants fait l’objet d’un intérêt grandissant depuis les dix dernières années. De nombreuses études rapportent en effet que ceux-ci présentent un sommeil de qualité insuffisante incluant des difficultés à s’endormir, de multiples éveils durant la nuit et un sommeil non réparateur au lever. Il est en outre bien établi qu’une majorité d’étudiants est en privation partielle de sommeil, et ce de manière chronique, conséquemment à une durée insuffisante de sommeil nocturne (Brown et al., 2002; Buboltz et al., 2001; Lund et al., 2010; Short et al., 2013). Chez les étudiants collégiaux et universitaires, il s’ensuit des problèmes de fonctionnement diurne tels un niveau alarmant de fatigue et de somnolence (Lemma et al., 2012; Oginska & Pokorski, 2006). D’ailleurs, les National Institutes of Health ont statué à l’effet que les adolescents et les jeunes adultes représentent une population à risque de somnolence diurne, au même titre que les adultes travailleurs postés et ou travailleurs de nuit (NIH, 1997).
Ces problèmes de fonctionnement diurne sont également associés à d’autres difficultés. Aussi, la somnolence et la fatigue peuvent être associés à une moindre performance académique et à des troubles de l’humeur et de l’anxiété (Abdulghani et al., 2012; Bahammam et al., 2012; Gomes et al., 2011; Mak et al., 2012; Ming et al., 2011). La privation de sommeil est également associée à une prise de poids plus importante, à une baisse de jugement moral, à une consommation accrue d’alcool et de substances psychoactives, à une incidence plus élevée de comportements de dépendance et de comportements à risque et à une idéation suicidaire plus importante (Dagis et al., 2012; Do et al., 2013; Gillen-O’Neel et al., 2013; Kenney et al., 2012; Lee et al., 2012; McKnight-Eily et al., 2011; Mitchell et al., 2013; Popovici & French., 2013; Telzer et al., 2013; Tempesta et al.. 2011; Wong et al., 2011; Wong & Brower, 2012). Bref, présenter un
2
sommeil de durée ou de qualité insuffisante à répétition peut s’avérer dramatique pour les jeunes étudiants.
Ces problèmes de sommeil et de somnolence sont expliqués en partie par les profonds changements qui se produisent relativement aux habitudes de sommeil durant l’adolescence. Dès la puberté, l’épisode de sommeil nocturne se décale peu à peu pour constituer un horaire de sommeil de plus en plus tardif. Ce phénomène se manifeste par des heures de coucher (et des heures de lever durant la fin de semaine) de plus en plus tardives (Andrade et al., 1993; Laberge et al., 2001).
Ces modifications du rythme veille-sommeil reposent à la fois sur des facteurs biologiques et sociaux et sur l’interaction entre ces facteurs. L’horloge biologique endogène, qui sera abordée en profondeur à la section 1.3.1, fait partie des facteurs physiologiques contribuant à modifier l’horaire du cycle veille-sommeil, en manifestant un délai de phase dans l’expression des marqueurs physiologiques régulant le cycle veille-sommeil. De manière plus spécifique, ceci signifie que le moment optimal pour se lever et se coucher, et donc pour être en état d’éveil vs. en état de sommeil, survient de plus en plus tard dans la journée entre la puberté et l’âge adulte (Carney et al., 2006; Carskadon et al., 1993; 1997; 2004; Díaz-Morales & Randler, 2008; Russo et al., 2007, Shochat et al., 2010; Urner et al., 2009). Parallèlement, des facteurs sociaux contribuent aussi aux modifications dans l’horaire des épisodes veille-sommeil. En effet, l’adolescence s’accompagne d’un besoin d’autonomie et d’affirmation et est le théâtre d’une panoplie de nouvelles activités « en soirée » qui contribuent à retarder l’heure de coucher incluant le travail rémunéré, les activités sociales, de plus grandes exigences académiques, une charge de devoirs accrue, etc. (Carskadon et al., 1989; Manber et al., 1995).
Or, si l’heure de coucher des adolescents est progressivement retardée jusqu’à l’orée de l’âge adulte, l’heure du début des cours, lui, ne change pas. Il s’ensuit que la durée de sommeil pendant la semaine scolaire diminue progressivement durant l’adolescence, alors qu’il est démontré que le besoin de sommeil demeure inchangé à environ 9-12 heures par nuit (Carskadon, 1982). Ceci entraîne une dette de sommeil, puisque les adolescents se
3 couchent toujours plus tard tout en gardant toujours la même heure de lever (Leger et al., 2012).
Ainsi, pour plusieurs adolescents et jeunes adultes, l’horloge biologique interne ne concorde pas avec l’horaire prescrit par la vie en société, phénomène aussi appelé social
jetlag ou « décalage horaire social » (Touitou, 2013; Wittman et al., 2006). Ceci peut avoir
pour effet de maintenir l’adolescent dans un état de décalage horaire léger mais permanent, qui peut à son tour occasionner des problèmes de fonctionnement diurne (somnolence, fatigue) et à une propension à dormir ou à être éveillé à des moments contradictoires par rapport à ce que commande l’horaire extérieur (Millman, 2005). Cet horaire « forcé » entraîne d’ordinaire les adolescents et les jeunes adultes à dormir plus longtemps le matin durant les fins de semaine lorsqu’ils sont libres de le faire afin de récupérer. Cette récupération partielle est cependant insuffisante pour compenser la dette de sommeil accumulée pendant la semaine (Kim et al., 2011). De plus, cette tentative de récupération durant la fin de semaine pourrait paradoxalement entraîner elle aussi un retard de phase; il deviendrait alors encore plus difficile de se lever tôt en début de semaine et de revenir à un rythme veille-sommeil davantage compatible avec l’horaire scolaire.
1.2. Le sommeil des étudiants travailleurs
Depuis les deux dernières décennies, le nombre d’étudiants à temps plein occupant un travail rémunéré à hauteur d’au moins 35 heures par semaine a pratiquement doublé (Marshall, 2010). On évaluait en 2010 que 50 % des étudiants post-secondaires Canadiens travaillaient durant l’année scolaire (Marshall, 2010). Les jeunes Canadiens sont théoriquement aussi occupés que les adultes plus âgés, avec une moyenne de 50 heures d’activités dites productives (cours, travaux scolaires, travail rémunéré, etc.) par semaine (Marshall, 2007). D’ailleurs, en ce qui a trait au temps passé au travail, les jeunes Canadiens de 15 à 24 ans se classent premiers lorsque comparés à leurs homologues de neuf autres pays de l'Organisation de coopération et de développement économiques (OCDE, 2008).
4
Un sondage de Statistiques Canada a récemment révélé que la grande majorité des étudiants canadiens doivent rogner dans leurs heures de sommeil pour pouvoir arriver à remplir leurs obligations quotidiennes (Marshall, 2007). En effet, il semble que le cumul études-travail-loisirs mènerait à une réorganisation de l’horaire et du style de vie. En somme, on constate que les besoins de sommeil entrent en conflit avec le travail des étudiants. Les étudiants travailleurs constitueraient donc un groupe à risque encore plus élevé de vivre de la privation de sommeil et des problèmes de sommeil comparativement aux étudiants qui n’exercent pas de travail rémunéré en cours d’année scolaire (Franke, 2003). Des études effectuées auprès d’autres populations d’étudiants corroborent ces résultats. Par exemple, il est rapporté que les étudiants brésiliens qui détiennent un emploi rémunéré durant le jour tout en étudiant le soir ont une durée de sommeil plus courte que ceux qui sont sans emploi durant l’année scolaire (Vinha et al., 2002; Machado et al.,1998). De plus, une étude effectuée auprès d’étudiants âgés de 17 et 18 ans a révélé que les étudiants qui travaillaient durant l’année scolaire dormaient moins durant les fins de semaines que les étudiants non travailleurs (Ledoux et al., 2008). Or, dormir plus longtemps la fin de semaine fait partie du processus de récupération des étudiants (Kim et al., 2012). Les jeunes adultes étudiants sont déjà considérés à risque élevé de problèmes de sommeil et la moitié d’entre eux travaillent alors qu’ils sont aux études; il est donc pertinent de prêter une attention particulière à la santé des étudiants travailleurs.
1.3. Les rythmes circadiens
On appelle rythmes circadiens – du latin circa = environ/presque et dies = jour – les rythmes biologiques endogènes ayant une période d’oscillation d’environ 24 h, notamment le rythme veille-sommeil (voir figure 1.1). Chez l’humain, les rythmes circadiens sont principalement générés par l’activité rythmique spontanée de neurones situés dans les noyaux suprachiasmatiques, d’où son appellation « horloge biologique » (Dijk and Lock-ley, 2002). Outre le rythme veille-sommeil, une multitude de fonctions physiologiques allant de l’expression génétique jusqu’aux phénomènes comportementaux sont sous contrôle de l’horloge biologique. Le tableau 1 présente une vue d’ensemble des systèmes sous contrôle circadien et des exemples de rythmes circadiens pour chacun des systèmes.
5 Ces rythmes s’imbriquent et se superposent les uns aux autres à différents angles de phase, i.e. à différents intervalles de temps entre les rythmes. Cette synchronisation entre les différentes fonctions physiologiques permet à l’organisme de fonctionner de manière optimale (Albrecht, 2012).
Figure 1.1 : Profil circadien typique de différentes fonctions physiologiques
chez l’humain – ici on illustre quelqu’un se couchant vers minuit. Image copyleft adaptée du site http://lecerveau.mcgill.ca.
6
Tableau 1.1 Liste de systèmes étant sous contrôle circadien chez l’humain. À titre
d’exemples, pour chaque système on cite quelques variables physiologiques possédant leur rythme circadien. Résumé et adapté à partir de l’ouvrage Regulation of Sleep and
7
1.3.1. L’horloge biologique
Les noyaux suprachiasmatiques (NSC) se situent dans l’encéphale, au-dessus du chiasma optique, dans l’hypothalamus (voir figure 1.2). Ils constituent le plus haut niveau d’organisation hiérarchique du système circadien et agissent comme synchronisateur principal de tout le système circadien (Borbely, 1982; Dunlap, 1996). Bien qu’ils aient été considérés par le passé comme les seuls oscillateurs circadiens du système nerveux central, on sait aujourd’hui que d’autres structures cérébrales présentent une activité rythmique spontanée d’environ 24 heures, tels les bulbes olfactifs, l’amygdale, l’hippocampe, l’habenula, et d’autres noyaux de l’hypothalamus (Balsalobre, 2002; Guilding and Piggins, 2007). Néanmoins, l’activité des NSC est essentielle au maintien du système circadien. En effet, les études sur modèles animaux démontrent que la lésion des NSC supprime la rythmicité de ces autres structures et a comme conséquence la désynchronisation circadienne des fonctions physiologiques (Stephan and Zucker, 1972; Yoo et al., 2004).
Les neurones du NSC exercent leur contrôle circadien sur les fonctions physiologiques principalement en régulant la production de l’hormone mélatonine (N-acetyl-5-methoxytryptamine) via un circuit reliant les NSC à la glande pinéale. Selon les directives envoyées par les NSC, la glande pinéale synthétise et relâche la mélatonine dans la circulation sanguine (voir figure 1.2). La mélatonine est une des voies les plus importantes d’entraînement de l’horloge. Plusieurs. systèmes de l’organisme se synchronisent directement ou indirectement en fonction de la présence et de la concentration de mélatonine dans la circulation sanguine (Morin and Allen, 2005).
L’horloge biologique déclenche la sécrétion de mélatonine en début de soirée (typiquement vers 21 h 00). La liaison de la mélatonine sur les sites récepteurs des cellules de l’organisme entraîne alors une cascade moléculaire menant l’organisme vers l’état de sommeil. La concentration de mélatonine s’accroîtra durant la nuit pour atteindre un pic et ensuite décroître jusqu’au matin et demeurer pratiquement nulle durant la journée (Dubocovich, 2007; Pevet & Chalet, 2011).
8
Figure 1.2 : Relation entre les noyaux suprachiasmatiques (en bleu) et de la glande
pinéale dans le cortex chez l’humain. Les noyaux suprachiasmatiques (cercle rouge) sont situés dans l’hypothalamus et surplombent le chiasma optique La glande pinéale est située au-dessus des collicules supérieurs (cercle bleu) (Harnsberger et al., 2007). Adapté de l’image copyleft tirée du site http://lecerveau.mcgill.ca.
9
1.3.2. Entraînement de l’horloge biologique
L’horloge biologique possède son propre rythme endogène, qui va persister même lorsque l’organisme est coupé des marqueurs temporels de l’environnement extérieur. La durée moyenne de la phase circadienne endogène est de 24,2 heures (Aschoff et al., 1975; Czeisler et al., 1999) et on suppose plusieurs gènes impliqués dans son activité (Kelly & Bianchi, 2012; Ralph & Menaker, 1988).
Il existe cependant un mécanisme de régulation qui permet à l’horloge biologique de se synchroniser à certains signaux extérieurs, permettant ainsi à l’organisme de se maintenir en phase avec le jour terrestre. En effet, il faut souligner que la longueur de la période endogène est rarement de 24 heures pile et décale ou avance de quelques minutes chaque jour (Czeisler & Gooley, 2007; Moore, 1997). C’est aussi ce mécanisme qui permet à l’organisme de s’adapter lors d’un changement de fuseaux horaires (Sack, 2009). Les signaux extérieurs auxquels l’horloge biologique est sensible sont appelés des zeitgebers – de l’allemand donneur de temps. On sépare les zeitgebers en deux types, soit les zeitgebers photiques, telle la lumière, et les zeitgebers non-photiques, tels les rythmes sociaux et comportementaux (Aschoff et al., 1975; Honma et al., 2003).
1.3.2.1. Zeitgebers photiques : la lumière
La lumière et plus particulièrement le cycle lumière /obscurité sont les plus puissants
zeitgebers de l’horloge biologique (Czeisler, 1989). La lumière est d’abord captée par l’oeil
et transmise jusqu’aux noyaux suprachiasmatiques via des afférences provenant de cellules ganglionnaires spécifiques de la rétine (voir figure 1.3) (Münch & Kawasaki, 2013; Pickard & Sollars, 2012; Sexton et al., 2012). Différents facteurs vont influencer l’impact que la lumière a sur l’horloge biologique : l’horloge biologique est régulée par l’interaction entre l’intensité, la durée, le patron, la longueur d’onde et le moment de la journée biologique où la lumière est captée (Chang et al., 2011). En effet, les signaux photiques n’auront pas le même impact selon qu’ils sont émis le jour, le soir ou la nuit. Par ailleurs, des courbes
10
« réponses » en fonction de la phase circadienne ont été établies et permettent d’estimer l’effet qu’aura un message photique en fonction de la période de la phase circadienne d’un sujet donné. Ces courbes nous renseignent à savoir si l’exposition à la lumière aura, par exemple, un plus grand effet lorsqu’elle est captée durant le jour ou la nuit. Chez l’humain, la lumière semble avoir un plus grand impact le matin et durant la soirée ou la nuit biologique (Khalsa et al., 2003; St-Hilaire et al., 2012). L’intensité du signal lumineux aura aussi une influence sur la réponse de l’horloge; la lumière vive de plus de 1 000 lux (s’apparentant à la lumière naturelle extérieure) est par exemple connue pour produire un impact important sur la synchronisation de l’horloge biologique (Czeisler et al. 1989).
1.3.2.2. Zeitgebers non photiques : les rythmes comportementaux et sociaux
Les rythmes comportementaux et sociaux font partie de la deuxième catégorie de synchronisateurs, les zeitgebers non-photiques. Il s’agit de l’ensemble des comportements et événements pouvant donner directement ou indirectement un input temporel à l’horloge biologique. Parmi les rythmes comportementaux, on dénote les heures de lever et de coucher, la prise de repas et de boisson, les interactions sociales, les activités sportives et cognitives, ainsi que le repos (siestes, sommeil). Bien que l’effet semble moins puissant que la lumière, on dénote plus particulièrement que la régularité de ces rythmes aura un effet synchronisateur sur l’horloge biologique (voir figure 1.3) (Aschoff et al., 1975; Monk et al., 1990).
11
Figure 1.3. Vue d’ensemble des voies des signaux photiques et non photiques sur
l’horloge biologique située dans les noyaux suprachiasmatiques (NSC) de l’hypothalamus. Les signaux (zeitgebers) photiques passent par la rétine (1) et le nerf optique (2) pour se rendre aux NSC. Les signaux (zeitgebers) non-photiques sont en fait des efférences du cortex ou d’autres parties du système nerveux (le mécanisme est encore méconnu) se rendant ultimement aux NSC. Le NSC traite l’information issue des zeitgebers. À partir des NSC seront ensuite envoyés des influx nerveux jusqu’aux autres oscillateurs de l’organisme (flèches bleues) tandis qu’une afférence se rend simultanément à la glande pinéale pour activer/inhiber la production de mélatonine, qui est relâchée dans la circulation sanguine. Image copyright utilisée avec la permission de l’auteur : F. Gauer / INCI, CNRS - Université de Strasbourg.
12
1.3.2.3. Mesurer le rythme veille-sommeil par actigraphie
S’il existe différentes techniques précises pour mesurer le rythme veille-sommeil en laboratoire (e.g. polysomnographie, détermination du rythme de sécrétion de la mélatonine, etc.), l’actigraphie est la méthode de choix lorsqu’on veut prendre des mesures dans l’environnement naturel d’un sujet. L'actigraphe est un petit appareil portatif pesant entre 15 à 20 grammes, de la taille d’une montre, se portant au poignet non-dominant. Un actigraphe contient un accéléromètre (agissant comme détecteur d’activité) et habituellement aussi un photomètre (enregistrant quantitativement le niveau d’exposition à la lumière). L’appareil contient également une puce accumulant les données enregistrées pendant son port et permet une autonomie de plusieurs jours, semaines, voire de plusieurs mois. Les données brutes peuvent par la suite être téléchargées sur ordinateur et traitées par un logiciel spécialisé afin d’en extraire différents paramètres de sommeil, d’activité et d’exposition à la lumière. Certains logiciels permettent également d’afficher graphiquement les données sous forme d’actogrammes (voir figure 1.4). L’actigraphie possède l’avantage d’être une méthode non-invasive et tout en enregistrant des données objectives (Martin & Hakin, 2011). Comparativement à la polysomnographie, il est rapporté que l’actigraphie peut manquer de précision quant à la détection du sommeil et de l’éveil chez des populations spécifiques (e.g. enfants en bas âge, adultes souffrant de troubles du sommeil ou neurologiques (Sadeh, 2011). Cependant, la validité et la fiabilité de l’actigraphie comme instrument de mesure du cycle veille-sommeil et de la phase circadienne est supporté chez les populations adultes en bonne santé (Ancoli-Israel et al., 2002; Cole et al., 2002; Middleton et al., 1997; Sadeh & Acebo, 2012; Youngstedt et al., 2001).
13
Figure 1.4. Exemple d’actogramme ou enregistrement par actigraphie (données
enregistré par Actigraph-L et actogramme tiré du logiciel Actiware-R version 5.0 (Mini-mitter, Phillips Respironics) ). Ici 15 jours d’enregistrements sont présentés; les périodes en bleu sont les période considérées comme du repos, les courbes noires représentent l’activité, les courbes jaunes représente le niveau d’exposition à la lumière (en lux). Les lignes rouges représentent l’éveil selon l’algorithme du logiciel.
14
1.4. Le chronotype
Il existe des différences entre les individus quant à leur préférence eu égard à la position de leur cycle veille-sommeil au sein du nycthémère. Certains vont préférer naturellement se lever, effectuer leurs activités et se coucher plus tôt dans la journée (environ 20 % de la population), alors que d’autres vont préférer se lever, effectuer leurs activités et se coucher plus tard (environ 20 % de la population). D’autre part, une grande portion de la population (environ 60 %) se situera dans la position intermédiaire. Cette préférence ou typologie circadienne est aussi appelée « chronotype » (Adan et al., 2012; Roenneberg et al., 2007).
La préférence circadienne est habituellement mesurée par questionnaire. Bien qu’il existe plusieurs questionnaires évaluant le chronotype, chacun d’entre aura pour but de cibler le moment dans la journée où un individu choisirait de placer son cycle veille-sommeil pour fonctionner de manière optimale (Ottoni et al., 2011). Les questions posées pourront par exemple demander à quel moment il choisirait de dormir, de faire de l’activité physique ou de se concentrer. Le questionnaire le plus utilisé est le Morningness-Eveningness
Questionnaire (Horne & Ostberg, 1976). Il classe les individus en trois catégories : les
types Matin, qui préfèrent se lever tôt et se coucher tôt, les types Soir, qui préfère se lever tard et se coucher tard et, finalement, les types Intermédiaires, qui se situent entre les deux.
Les mécanismes à l’origine de la manifestation du chronotype comme phénotype demeurent incertains. Dans certaines études, lorsqu’on a mesuré la phase circadienne endogène, les types Soir présentaient une phase circadienne plus longue que 24 heures, tandis que les types Matin présentaient une plus courte période endogène circadienne (Duffy et al., 2001). Ceci impliquerait que les types Soir se couchent plus tard parce que leur période endogène circadienne est plus longue, et vice-versa. D’autres études rapportent que la phase circadienne des types Matin débuterait en moyenne 2-3 heures plus tôt (par rapport au jour terrestre) que les types Soir, ce qui contribuerait au maintien d’un cycle circadien plus tardif chez ces derniers (Bailey & Heitkemper, 2001; Gibertini et al., 1999; Griefahn et al., 2002; Mongrain et al., 2004; 2005). Il est également possible que les chronotypes diffèrent en ce qui a trait à leurs mécanismes de synchronisation, c.à-d., que
15 leur horloge biologique ne réagisse pas de la même façon vis-à-vis des zeitgebers. Cette hypothèse semble plausible dans la mesure où dans un contexte de protocole à environnement contrôlé, les angles de phases ou relations temporelles entre les rythmes circadiens diffèrent selon la typologie des individus (Duffy et al., 1999; Mongrain et al., 2004; Randler & Schaal, 2010).
Il est admis que certains gènes impliqués dans le fonctionnement de l’horloge biologique pourraient être impliqués dans la typologie circadienne. Cependant, les résultats prometteurs d’études ayant investigué sur les polymorphismes des gènes de l’horloge tels que CLOCK, PER1, PER2 et PER3 sont souvent non répliqués dans d’autres études (Archer et al.,2003; Barclay et al., 2011; Carpen et al., 2005; 2006; Chang et al., 2011; Mishima et al., 2005; Osland et al., 2011). Ces résultats mitigés pourraient être expliqués par le fait que le cycle veille-sommeil est également régulé par le système homéostatique de sommeil (Franken & Dijk, 2009). Ainsi, la préférence circadienne pourrait s’exprimer via l’interaction entre les gènes de l’horloge et des gènes du système homéostatique de sommeil. Cette hypothèse est d’ailleurs étayée par les résultats obtenus dans des études s’étant penchées sur la régulation homéostatique du sommeil selon la préférence circadienne. En effet, il est documenté que les types Matin et Soir n’ont pas le même taux d’accumulation et de dissipation de pression homéostatique de sommeil, ce qui pourraient également contribuer à maintenir leur préférence circadienne (Mongrain et al., 2006).
1.5. Chronotype et sommeil chez les étudiants
Il est intéressant de considérer le chronotype comme un facteur pouvant moduler la présence de problèmes de sommeil chez les étudiants. Des études récentes suggèrent par exemple que les types Soir encourent un risque plus élevé de présenter à des problèmes de sommeil, incluant une moindre qualité de sommeil, un plus grand nombre de symptômes d’insomnie et une plus grande dette de sommeil (Merikanto et al., 2012b; Roepke & Duffy, 2010; Roeser et al., 2012c; Tzischinsky & Shochat, 2011). Ces problèmes de sommeil semblent aussi associés avec des problèmes de fonctionnement diurnes tels de la
16
somnolence et des difficultés de performance dues à l’horaire prescrit socialement (Onyper et al., 2012; ). De plus, des études ont indiqué que les types Soir étaient exposés à moins de lumière vive que les autres chronotypes (Goulet et al., 2007), à plus de lumière durant la nuit (Vollmer et al., 2012) et avaient un plus faible niveau de régularité dans leur rythmes sociaux (Monk et al., 2004; Soehner et al., 2011).
Parallèlement aux problèmes de sommeil, ajoutons que le fait d’être un type Soir est aussi associé avec des problèmes de santé et une préférence plus marquée pour des comportements nuisibles pour la santé (Kanerva et al., 2012). En effet, il est rapporté que les types Soir pratiquent moins régulièrement de l’activité physique, consomment plus de caféine et sont plus à risque de dépendance à la cigarette et à l’usage de drogues récréatives (Barclay et al., 2013; Hasler & Clark, 2013). Les types Soir sont également évoqués dans le domaine de la neuropsychiatrie en étant surreprésentés dans le trouble bipolaire et dans le trouble de l’attention avec ou sans hyperactivité (Ahn et al., 2008; Voinescu et al., 2012). Par ailleurs, il existe une relation entre le fait d’être un type Soir et rapporter davantage de symptômes dépressifs, rechercher davantage des émotions fortes, éprouver plus souvent des troubles de l’humeur, de l’impulsivité dysfonctionnelle et rapporter un plus faible niveau de qualité de vie (Dagys et al., 2012; Muro et al., 2012; Roeser et al., 2012a; Russo et al., 2012b). En outre, le fait d’être un type Soir a récemment été associé à un risque plus élevé de développer des troubles alimentaires, du diabète, de l’hypertension et plusieurs types de troubles coronariens (Harb et al., 2012; Merikanto et al., 2012a; Roeser et al., 2012b) .
Des études se sont penchées sur les différences entre les chronotypes chez les étudiants. D’abord, chez les adolescents, le fait d’être un type Soir a été identifié comme un facteur prédictif d’une plus courte durée de sommeil, de niveaux plus élevés de somnolence diurne et de plus nombreux problèmes de sommeil (Chung & Cheung, 2008). Aussi, d’autres études effectuées chez des étudiants universitaires rapportent que les types Soir ont une efficacité du sommeil plus faible que les autres chronotypes (Lehnkering & Siegmund, 2007) ainsi que de plus hauts niveaux de fatigue (Taylor et al., 2011). Preckel et collègues (2013) rapportaient récemment que les étudiants de types Soir étaient moins motivés à réussir sur le plan académique et qu’ils avaient de moins bons résultats scolaires et de
17 moins bonnes performances cognitives. De plus, l’étude de Korczak et collègues (2008) révèlent que les types Soir sont en privation de sommeil lorsque comparés aux types Matin et Intermédiaire et qu’ils présenteraient dès lors un plus grand désalignement entre leur cycle veille-sommeil optimal et les horaires d’école et de travail. Au final, le chronotype fait partie des facteurs ayant potentiellement une influence sur les problèmes de sommeil et la santé des étudiants. Il est donc important de préciser son rôle chez les étudiants travailleurs.
1.6. Objectifs et hypothèses de recherche
Sachant que la privation de sommeil peut avoir des effets délétères sur le cerveau et le comportement, il est pertinent d’évaluer les problèmes de sommeils des étudiants travailleurs. Aussi, ces derniers constituent une population à risque élevé de somnolence, d’accidents de travail et de décrochage scolaire (Apel et al., 2008; Breslin et al., 2005; EASHW, 2007; Lee & Staff, 2007; NIH, 1997; NIOSH, 2003; Salminen, 2004; Warren & Lee, 2003). Il est également pertinent de mesurer le chronotype et les zeitgebers photiques et non-photiques en tant que facteurs pouvant potentiellement influencer le fonctionnement diurne et le sommeil de cette population.
Le premier objectif de ce mémoire était donc de documenter dans les premiers temps les patrons de sommeil des étudiants travailleurs via des mesures objectives et subjectives. Le deuxième objectif était d’évaluer la relation entre le chronotype et le sommeil, l’exposition aux zeitgebers photiques (i.e. la lumière) et non photiques (i.e. les rythmes comportementaux et sociaux), la fatigue reliée au travail et la somnolence.
Les hypothèses de recherche étaient à l’effet que les chronotypes du soir auraient des niveaux plus élevés de problèmes de sommeil, de fatigue reliée au travail et de somnolence, de même que des niveaux plus faibles d’exposition à la lumière vive et une plus grande irrégularité dans leurs rythmes sociaux et comportementaux.
18
Les résultats de ce mémoire sont présentés sous la forme d’un article scientifique publié le 29 avril 2012 dans la revue Chronobiology International; cet article est présenté dans le chapitre suivant (Chapitre 2).
19
Chapitre 2.
2. Résultats: Relationship of Chronotype to Sleep, Light Exposure, and Work Related Fatigue in Student Workers
Jeanne Sophie Martina, b, Marc Hébertb, Élise Ledouxc, Michaël Gaudreaulta, and Luc
Labergea,d
a ÉCOBES Recherche et transfert, Cégep de Jonquière, Saguenay, Québec, Canada b Centre de recherche Université-Laval Robert Giffard, Québec, Québec, Canada
c Institut de recherche Robert-Sauvé en santé et en sécurité du travail, Montréal, Québec,
Canada
d Département des sciences de la santé, Université du Québec à Chicoutimi, Saguenay,
Québec, Canada
Source of support:
Institut de recherche Robert-Sauvé en santé et en sécurité du travail (IRSST)
Address correspondence and reprint request:
Luc Laberge, PhD
Département des sciences de la santé Université du Québec à Chicoutimi 555 Boulevard de l’Université Chicoutimi, Québec, Canada G7H 2B1
418-547-2191, 401 (tel.) / 418-542-2853 (fax) E-mail: luc.laberge@uqac.ca
20
2.1. Abstract
Students who work during the school year face the potential of sleep deprivation and its effects since they have to juggle between school and work responsibilities along with social life. This may leave them with less time left for sleep than their non-working counterparts. Chronotype is a factor that may exert an influence on the sleep of student workers. Also, light and social zeitgebers may have an impact on the sleep-related problems of this population. This study aimed to document sleep, light exposure patterns, social rhythms, and work-related fatigue of student workers aged 19-21 yrs and explore possible associations with chronotype. A total of 88 student workers (20.18 ± 0.44 yrs of age:; 36 males/52 females) wore an actigraph (Actiwatch-L, Mini-Mitter/Respironics) and filled out the Social Rhythm Metric for two consecutive weeks during the school year. Also, they completed the Morningness-Eveningness Questionnaire (MEQ), the Epworth Sleepiness Scale (ESS), the Pittsburgh Sleep Quality Index (PSQI), and the Occupational Fatigue Exhaustion/Recovery Scale (OFER). Repeated and one-way ANOVAs, Pearson’s chi-square tests, and correlation coefficients were used for statistical comparisons. Subjects slept an average of 06:28 h/night. Actigraphic sleep parameters, such as sleep duration, sleep efficiency, wake after sleep onset, and sleep latency, did not differ between chronotypes. Results also show that Evening-types (n = 17) presented lower subjective sleep quality than Intermediate-types (n = 58) and Morning-types (n = 13). Moreover, Evening-types reported higher levels of chronic work-related fatigue, exhibited less regular social rhythms, and were exposed to lower levels of light during their waking hours (between 2 to 11 h after wake time) as compared to Intermediate-types and Morning-types. In addition, exposure to light intensities between
100-500 lux was lower in Evening-types than in Intermediate-types and Morning-types. However, bright light exposure (≥1000 lux) did not differ between chronotypes. In conclusion, results suggest that student workers may constitute a high-risk population for sleep deprivation. Evening-types seemed to cope less well with sleep deprivation, reporting poorer sleep quality and higher levels of work-related fatigue than Intermediate-types and Morning-types. The higher chronic work-related fatigue of Evening-types may be linked to their attenuated level of light exposure and weaker social zeitgebers. Our results add credence to the hypothesis that eveningness entails a higher risk of health-impairing behaviors. (Author correspondence: luc.laberge@uqac.ca)
21
Keywords: Young adults; Actigraphy; Young workers; Chronotype; Chronic fatigue;
Sleep; Students; Light exposure, Social rhythms.
2.2. Introduction
In the last decade, there has been increased interest in sleep-related problems experienced by young adults attending school. In particular, college and university students have been reporting fatigue and daytime sleepiness (Oginska & Pokorski, 2006), insufficient sleep duration, and poor sleep quality (Brown et al., 2002; Buboltz et al., 2001; Lund et al., 2010). Students who work during the school year appear to face an even greater risk of having sleep problems than non-workers, since they combine school, paid work, and extracurricular activities (Franke, 2003). In this regard, Vihna et al. (2002) and Machado et al. (1998) found that Brazilian student workers exhibited shorter sleep duration than non-worker students. Moreover, a study among 17-18 yr olds revealed that students who work during the school year had shorter sleep duration on weekends than those who did not and were, therefore, at greater risk of sleep deprivation (Ledoux et al., 2008). Furthermore, a survey among Canadian students 15-19 yrs of age showed that a majority cut back on sleep when they needed more time to fulfill their day-to-day unpaid and paid work responsibilities (Marshall, 2007).
Recent studies have also highlighted the differential impact of chronotype upon sleep timing and duration (Roepke & Duffy, 2010; Tzischinsky & Shochat, 2011). Chronotype or circadian typology refers to the circadian preference in the timing of sleep-wake activity of individuals, which can be categorized as Morning-types (M-types), Intermediate-types (I-types), or Evening-types (E-types). In adolescent students, eveningness has been identified as a predictor of short sleep duration, high levels of daytime sleepiness (Chung & Cheung, 2008), and sleep-problem behaviors (Tzischinsky & Shochat, 2011). Other studies performed among university students noted that E-types had lower sleep efficiency (Lehnkering & Siegmund, 2007), higher levels of fatigue (Taylor et al., 2011), and shorter sleep duration than both I-types and M-types as well as greater misalignment between their
22
preferred sleep/wake patterns, school and work schedules, and social obligations (Beşoluk et al., 2011; Gomes et al., 2011; Korczak et al., 2008).
Other factors that may exert an effect on sleep-related issues are the pattern of environmental light exposure and regularity of social rhythms. In order to remain synchronized with the environment, the circadian system, which partly regulates sleep, relies on external synchronizers or zeitgebers (Borbely, 1982; Dijk & Lockley, 2002; Honma et al., 2003). Light exposure is the main environmental zeitgeber of the circadian system (Czeisler et al., 1989), and the interaction between its timing and its intensity has synchronizing effects on the sleep/wake cycle (Dumont & Beaulieu, 2007; Martinez-Nicolas et al., 2011). Light exposure is known to have an impact on sleepiness (Phipps-Nelson et al., 2003; Sasseville & Hebert, 2010), depressive symptomatology, and mood (aan het Rot et al., 2008; Kronfeld-Schor & Einat, 2012). Social rhythms, which can be described as daily rhythmic behaviors, also have a synchronizing effect on the circadian system (Aschoff et al., 1975). In this regard, some studies have reported that young adults both present lower levels of exposure to environmental light (Kawinska et al., 2005; Scheuermaier et al., 2010) and more irregular social rhythms compared to older adults (Monk et al., 1997). In addition, some evidence indicate that E-types are exposed to lower levels of bright light (Goulet et al., 2007) and exhibit a lower regularity in their social rhythms (Monk et al., 2004).
In view of the effects of sleep deprivation on brain and behavior, it is relevant to assess sleep-related problems of student workers, a population at high risk of problem sleepiness, school dropout, and occupational injury (Apel et al., 2008; Breslin et al., 2005; EASHW, 2007; Lee & Staff, 2007; NIH, 1997; NIOSH, 2003; Salminen, 2004; Warren & Lee, 2003). It is also pertinent to examine chronotype and social zeitgebers as factors that have the potential to positively or negatively influence sleep behavior and daytime functioning. The first aim of the present study was to document correlates and predictors of sleep-related problems, such as sleep-wake habits, light exposure patterns, and work-related fatigue in student workers 19-21 yrs of age. The second aim was to investigate the relationship between chronotype and sleep, light exposure patterns, social rhythms, and work-related
23 fatigue. We hypothesize that eveningness is associated with higher levels of sleep-related problems and work-related fatigue and with lower levels of bright light exposure and regularity of social zeitgebers.
2.3. Methods 2.3.1. Subjects
A total of 88 subjects (36 males/52 females, mean age 20.20.4 yrs) completed the study. Seven subjects were attending a professional school, 48 a college, and 33 a university. The study sample was recruited among young adults participating in an ongoing longitudinal study of health risk behaviors in the Saguenay-Lac-Saint-Jean region of the province of Québec (Canada) (latitude 48°25'N). Further details regarding this sample as well as the design and survey instruments used are published elsewhere (Laberge et al., 2011a, 2011b). A total of 535 students were contacted by mail and asked about their worker status and willingness to participate. Of the 312 subjects who returned the answer sheet, a structured telephone interview was carried out on 235 subjects who said they were both studying and working. The interview confirmed this latter information and verified whether subjects satisfied the other inclusion criteria, namely being in good physical and mental health, no current use of psychoactive agents or other drugs that may affect the sleep/wake cycle, alertness/sleepiness, or circadian parameters, having no sleep disorders, not being pregnant or having no plan of becoming pregnant during the study, and not having experienced a transmeridian flight the past 3 mo. Ninety-seven subjects were selected from the telephone interview, but nine were excluded due to protocol compliance or restrictions experienced in their workplace as regards the actigraph. This study was approved by the ethics review board of the Université du Québec à Chicoutimi and conforms to international standards (Portaluppi et al., 2010). All subjects provided written informed consent and received monetary compensation for their participation.
24
2.3.2. Protocol
Subjects were ambulatory monitored in their natural environment by actigraphy for two consecutive weeks to measure light exposure (in lux) and activity (both recorded in 1-min epochs). Subjects were instructed to wear the actigraph (Actiwatch-L, Mini-Mitter/Respironics, OR) on their non-dominant wrist 24 h/d (except while bathing and during aquatic activities) and to keep the actigraph uncovered by clothes. Ambulatory monitoring was performed during the school year, except for final exam weeks, vacations or spring/fall breaks. Sixty subjects were monitored during the winter trimester (between January and May) and 28 during the fall trimester (between September and December). Subjects also completed the Social Rhythm Metric (SRM) (Monk et al., 1990) during the 2 wks of actigraphy, in order to assess the regularity of social rhythms and to collect sleep log information. Each log page of the SRM diary contains the same 17 items, which are in fact 17 activities considered to be social zeitgebers. Each day, subjects noted the time when they completed these activities (e.g., meals, work, rest, etc.).
Chronotype was assessed with the morningness-eveningness questionnaire (MEQ) (Horne & Östberg, 1976). Subjects were categorized as M-types (scores between 59 and 86), I-types (scores between 42 and 58), and E-I-types (scores between 16 and 41). Moreover, all subjects completed the Occupational Fatigue/Exhaustion Recovery (OFER) scale (Winwood et al., 2005). The OFER scale evaluates acute and chronic work-related fatigue. Acute work-related fatigue is considered as a normal adaptive response to the work-related strain of the day, while chronic fatigue may be conceived as physical and mental exhaustion that appears when the recovery from acute fatigue is unsuccessful (Winwood et al., 2006). Also, subjects completed the Pittsburgh Sleep Quality Index (PSQI) (Buysse et al., 1989) and the Epworth Sleepiness Scale (ESS) (Johns, 1991) in order to measure sleep quality and daytime sleepiness, respectively. Psychological distress was assessed with the “Psychological Index of Santé Québec” (Ilfeld, 1976). Finally, semi-structured interviews were performed during the school term in order to assess the timing of work (day, evening, or night), type of work (indoor vs. outdoor), timing of school (day or evening), and amount of time spent working and studying (classes and homework). We also assessed the
25 commuting time between home, work, and school, the living environment (with parents, with a spouse, with roommates, in a room, in a residence hall, or alone in an apartment), and number of days off/wk, i.e. the number of days without work and school duties.
2.3.3. Ambulatory monitoring analysis
Sleep parameters, such as sleep onset, sleep offset, sleep duration, sleep latency, wake after sleep onset, and sleep efficiency, were calculated using Actiware-R software version 5.0. Sensitivity of the Actiware-R’s algorithm to detect sleep/wake was set to medium. Considering that data from the diary (SRM) and from actigraphy tightly corresponded, we used the self-reported “out of bed” and “go to bed” times to cut off active and rest intervals. We also used the item on occurrence of naps of the diary (SRM) to score naps. We used Actiware-R to compute the variables of “sleep duration”, “sleep latency”, “wake after sleep onset,” and “sleep efficiency”. Light and sleep data collected when the monitor was not worn (as reported in the SRM) were excluded. Each participant’s actigraphy data were visually inspected and compared with the SRM. Occurrences of periods of dim light during daytime that did not match with the information written in the diary as well as data spent <.1 lux were considered as artefacts caused by the actigraph being covered by clothing and, therefore, excluded from light analysis. Also, periods during daytime for which no activity was recorded for longer than 30 min were excluded, except for subjects who reported taking a nap in their diary. Each day required at least 90% of valid data in order to be considered for statistical analyses.
Calibration tests were made on all actigraphs used in this study (n = 12). Light readings on each monitor were compared with a calibrated research photometer (IL-1700, International Light, MA) after exposure to 12 different light intensities. Since all actigraphs underestimated light levels, light data were adjusted with the differences found with the photometer.
26
2.3.4. Light Data Analysis
Light exposure was first log-transformed to normalize the distribution. Daily means of bright light exposure (i.e., exposure ≥1000 lux) were calculated. In order to assess the timing of bright light over the day, the data were divided into four periods between wake time and bedtime as follow: wake time to 12:00 h, 12:00 to 16:00 h, 16:00 to 20:00 h, and 20:00 to bedtime. The mean number of minutes spent at ≥1000 lux was then averaged individually over each period. Each period had to include more than 45 valid minutes to be considered in the analysis.
The mean duration of light exposure spent under five different intervals of light intensities also was computed. These intervals were based on the common ranges of light levels found indoors and outdoors at different times of the day. The five chosen intervals were dim indoor light or outdoor light after sunset (≤14 lux); dim-moderate indoor light or dim outdoor light (15-99 lux); moderate-bright indoor light or dim-moderate outdoor light (100-499 lux); moderate-bright indoor light or moderate outdoor light (500-999 lux), and bright light (≥1000 lux).
In order to depict light exposure during the day in formal clock time, a 24-h pattern was first created with hourly means of light data containing more than 30 valid minutes. A second light exposure pattern was considered according to light levels received after wake time, with each hourly mean adjusted to subjects’ sleep/wake schedules and depicted with respect to their wake time. After a closer look at the distribution of the sleep durations, we chose to consider the 15 consecutive hours after wake time in order to avoid potential artefacts caused by an overlap of sleep periods. This pattern of light exposure after wake time theoretically reduces artefacts caused by gaps between subjects’ sleep/wake schedule.
27
2.3.5. SRM Analysis
A validated algorithm was applied to the data collected each week to compute a score of social rhythms regularity, ranging between 0 and 7, with higher SRM score indicating greater regularity of daily lifestyle (Monk et al., 1990).
2.3.6. Statistical analysis
Pearson chi-square tests were used to compare chronotypes relatively to sex, timing of work and school, school level, living environment, as well as month and season when actigraphy was performed. Chi-square tests were also used to compare subjective sleep quality (PSQI) and daytime sleepiness (ESS) between chronotypes. Cramér’s V and phi values (φc) were computed to calculate effect size estimates. Also, Bonferroni corrections
were applied to take into account multiple comparisons. The relationship between the timing of the sleep schedule and sleep quality was evaluated using Pearson’s correlation coefficients.
ANOVAs were performed to compare chronotypes and age; weekly hours of work and studying, commuting time between work, school, and home; number of days off/wk; sleep parameters (sleep offset/onset, sleep duration, sleep latency, wake after sleep onset, and sleep efficiency, mean length and numbers of nap per day and per week); SRM scores; OFER scores; psychological distress scores; and time spent under different intervals of light intensities. Tamhane’s T2 corrections were used when homogeneity of variance was not assumed and Partial Eta-squared values (η2p) were used as effect size estimates.
Repeated ANOVAs with compound symmetry were also used to compare patterns of hourly light exposure (24-h light exposure pattern and pattern of light exposure during wake hours) among chronotype, as well as bright light exposure over the day. Partial Eta-squared values (η2p) were reported to estimate effect sizes. Finally, Huynh-Feldt sphericity
28
2.4. Results
2.4.1. Subjects Demographics
Subjects spent an average of 44.6 1.1 h/wk studying (classes and homework) and working for pay (Table 2.1), with a mean of 1.0 0.1 days off/wk; one of four subjects (25%) dedicated more than 50 h/wk to these productive activities. No subject performed his/her work exclusively outdoor. Daytime sleepiness and poor sleep quality were reported by 30.6% and 47.7% of subjects, respectively. Finally, subjects were exposed to an average 38.3 min of bright light (≥1000 lux)/d.
2.4.2. Chronotype
Thirteen subjects were M-types (14.7%), 58 were I-types (65.9%), and 17 were E-types (19.3%). Table 2.1 shows that chronotypes were not different in terms of age, sex, school level, and month and season when actigraphy was performed. Also, there was no difference between chronotypes in the timing of work time (day, evening, night time), timing of school (day, evening), number of hours of school, homework, and paid work, commuting time (data not shown), and numbers of days off (data not shown).
Table 2.1 further shows that a higher proportion of E-types reported poorer sleep quality than I-types and M-types (χ22,88 =17.619, p <.001,
φ
c = .447). In addition, poorer sleepquality was associated with later sleep onsets (r = .238, p < .05) and sleep offsets (r = .246,
p < .05). Also, chronic work-related fatigue levels differed between chronotypes, with
E-types exhibiting higher levels of chronic fatigue than I-E-types and M-E-types (F2,84 = 3.341, p
< .05, η2 p=.074). No difference was found, however, between chronotypes regarding levels
29
2.4.3. Actigraphic Sleep Parameters
Table 2.2 indicates that sleep onset and sleep offset differed among the three chronotypes, being earlier for M-types compared to I-types (F2,85 = 19.837, p < .001, η2p = .318) and
earlier for I-types compared to E-types (F2,85 = 15.491, p < .001, η2p = .267). Other sleep
parameters, such as sleep duration, sleep efficiency, sleep latency, and time spent awake after sleep onset, did not differ between chronotypes (Table 2.2). Moreover, there was no difference between chronotypes in napping behavior (length and number of naps per day and per week), and in school week and weekend sleep patterns (data not shown).
2.4.4. Light Exposure
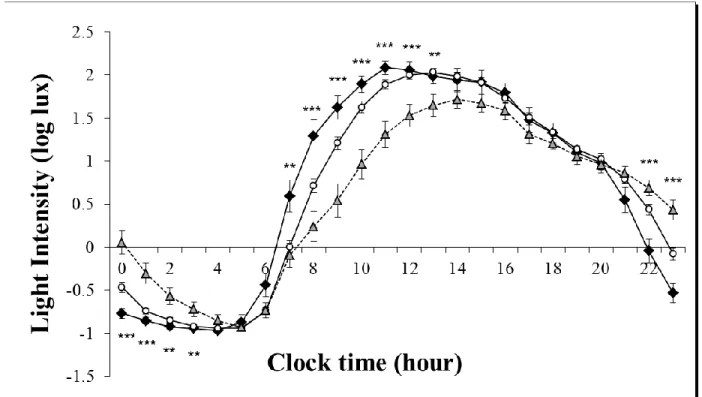
Figure 2.1 presents the duration of bright light exposure according to the period of the day for each chronotype. It shows that bright light exposure did not differ between chronotypes. However, a difference was observed between chronotypes in the mean exposition between 100-500 lux, with E-types less exposed than I-types and M-types (F2,87 = 4.967, p < .01, η2p
= .105) (Figure 2.2).
Moreover, the 24-h light exposure pattern, relative to clock time (Figure 2.3), shows that M-types were exposed to lower light intensity levels between 22:00-23:00 h (F = 9.222, p < .001, η2p= .178). M-types also received lower levels of light than I-types, and I-types, lower
levels than E-types between 23:00-00:00 h (p < .001). In addition, E-types were exposed to lower light intensity levels than I-types and M-types between 08:00-14:00 h and to higher light intensity levels between 00:00-04:00 h (p < .01). Figure 2.4 presents the pattern of light exposure according to time after wake time. It shows that E-types’ light exposure was lower than I-types and M-types from the second hour following wake time to the eleventh hour after wake time (F = 2.143; p < .05, η2p = .102).
30
2.4.5. Social Zeitgebers
SRM scores also differed between chronotypes with E-Types exhibiting more irregularity in their social rhythms than I-types and M-types (1.69 ± .14 vs. 2.14 ± .08 and 2.54 ± .17; F2,85 = 7.659, p < .001, η2p = .153).
2.5. Discussion
Overall, the present results suggest that student workers experience significant sleep deprivation. Indeed, a substantial proportion of subjects reported poor sleep quality and daytime sleepiness (50% and 30%, respectively). In addition, their average sleep duration (6:28 h) is shorter than the 7-8-h sleep duration previously reported in various student samples (Beşoluk et al., 2011; Borisenkov et al., 2010; Korczak et al., 2008; Lund et al., 2010). Yet, the relatively short sleep duration observed herein may be compared to the 6:43-h sleep duration recently reported in medical students (Lehnkering & Siegmund, 2007). Also, the present results are consistent with questionnaire studies reporting short sleep duration in student workers (Ledoux et al., 2008; Machado et al., 1998; Marshall et al., 2007).
Regarding the relationship between chronotypes and sleep quality, M-types demonstrated, as expected, earlier wake times and bedtimes compared to E-types, both during schooldays and weekends. Most E-types (76.5%) reported poor sleep quality, while none of the M-types did. Also, subjects with poor sleep quality had significantly later sleep schedules than those without sleep problems. This relationship between eveningness and poorer sleep quality concurs with previously published data from adults (Megdal & Schernhammer, 2007; Ong et al., 2007; Shiihara et al., 1998; Vardar et al., 2008). Interestingly, a recent study on young adult twins suggested that genetic components may partially explain the lower sleep quality observed in some chronotypes (Barclay et al., 2010).