Impacts de la cryopréservation sur les propriétés
immunosuppressives des cellules stromales
mésenchymateuses
Thèse
Dominique Chabot
Doctorat en biochimie
Philosophiæ doctor (Ph. D.)
Québec, Canada
Impacts de la cryopréservation sur les propriétés
immunosuppressives des cellules stromales
mésenchymateuses
Thèse
Dominique Chabot
Sous la direction de :
Renée Bazin, directrice de recherche
André Darveau, codirecteur de recherche
Résumé
Isolées à l'origine de la moelle osseuse , les cellules stromales mésenchymateuses (CSM) ont depuis été obtenues à partir de divers tissus fœtaux, postnataux et adipeux et font l'objet d'un nombre croissant d'essais cliniques en tant que traitement potentiel d’un large éventail de maladies dégénératives et de troubles auto-immuns. En effet, les CSM se sont révélées comme étant une alternative de premier plan pour la réparation tissulaire et la modulation immunitaire. Des recherches intensives ont visé à élucider leurs caractéristiques et les mécanismes par lesquelles elles provoquent leurs effets thérapeutiques. Plus précisément, dans le cadre de la transplantation de cellules souches hématopoïétiques (CSH) allogéniques chez des patients pédiatriques atteints de leucémie, les CSM ont été utilisées pour favoriser la greffe et/ou pour induire une immunosuppression dans la maladie du greffon contre l’hôte (GVH), une complication fréquente et mortelle de la greffe pour laquelle il n’y a que très peu à offrir aux patients qui en sont touchés. En effet, la première indication thérapeutique d’un produit à base de CSM approuvée par Santé Canada a été indiquée pour la gestion de la GVH chez des patients pédiatriques ayant une maladie résistante aux traitements de première intention. Traduire la recherche fondamentale en applications cliniques nécessite un approvisionnement régulier en CSM viables et préalablement évaluées quant à leur sécurité et leurs propriétés fonctionnelles. La cryopréservation des CSM est l’élément clé qui permet de répondre à ces exigences. Suivant l'exemple des CSH, qui ont été cryoconservées et transplantées avec succès ultérieurement, les CSM ont donc été entreposées et décongelées selon les besoins des études cliniques de phase III pour le traitement de la GVH réfractaire aux traitements classiques. Ces études ayant obtenu des résultats mitigés et contrastants avec les résultats obtenus à partir de cellules fraîches dans des études cliniques de phases I et II, la cryopréservation a rapidement été reconnue coupable de leur échec. Une quantité remarquable de recherches et de ressources ont ensuite été consacrées à l'optimisation des protocoles, à la composition des milieux de congélation, aux dispositifs de refroidissement et aux conteneurs de stockage, ainsi qu'au développement de bonnes pratiques de fabrication afin de garantir que les CSM conservent leurs caractéristiques thérapeutiques après la cryoconservation et qu’elles soient sécuritaires pour une utilisation clinique. L’objectif principal de cette thèse était de clarifier l’impact de la cryopréservation sur les propriétés immunosuppressives des CSM. Alors que les études publiées sur le sujet faisaient, d’une façon assez équilibrée, l’état d’une réussite ou d’un échec à la cryopréservation des CSM en lien avec la conservation de leurs différentes fonctions in vitro et/ou in vivo dans des modèles animaux, mes travaux ont permis de revisiter l'impact de la cryoconservation sur les CSM en démontrant que des épisodes de réchauffement cellulaire survenant après leur congélation, plutôt que la cryoconservation en elle-même, étaient responsables de leurs altérations fonctionnelles. Si des précautions ne sont pas prises pour éviter le
importante variation de température et ce, de façon étonnamment rapide et dommageable. Mes travaux ont démontré que l’inhibition de la prolifération lymphocytaire par les CSM diminuait drastiquement et de façon proportionnelle au réchauffement subi par les CSM pendant l’entreposage des produits cellulaires. Étonnamment, la viabilité des CSM n’était pas significativement diminuée par ces variations de température alors qu’elle est depuis toujours la principale mesure utilisée pour quantifier l’intégrité cellulaire post-décongélation. Dans une perspective de pouvoir prédire la présence d’une atteinte fonctionnelle des CSM induite par la cryopréservation, la suite de mes travaux a permis d’identifier la capacité d’adhésion des CSM comme étant un marqueur rapidement et facilement mesurable en laboratoire, mais surtout étant significativement liée à la capacité des CSM à inhiber une réponse lymphocytaire, laquelle est au cœur des symptômes de la GVH. Une grande rigueur pendant tout le processus de fabrication et de congélation des CSM ainsi que la génération de données reproductibles et fiables sont indispensables à l’obtention de preuves scientifiques de l'efficacité et de la qualité de cette thérapie cellulaire à grand potentiel dans le traitement des maladies auto-immunes.
Abstract
Originally isolated from the bone marrow, mesenchymal stromal cells (MSC) have since been obtained from various foetal, postnatal and adipose tissues and are the subject of an increasing number of clinical trials as a potential treatment for a wide range of degenerative diseases and autoimmune disorders. Indeed, MSC have proven to be a leading alternative for tissue repair and immune modulation. Intensive research has aimed to elucidate their characteristics and the mechanisms by which they induce therapeutic effects. More specifically, in the context of transplantation of allogeneic hematopoietic stem cells (HSC) in pediatric patients with leukemia, MSC have been used to promote transplantation and/or to induce immunosuppression in graft-versus-host disease (GVH), a frequent and fatal complication of transplantation for which there is very little to offer to patients who are affected. The first therapeutic indication for a MSC-based product approved by Health Canada was indicated for the management of GVH in pediatric patients with a resistant to first-line treatments disease. Translating basic research into clinical applications requires a regular supply of viable MSC that have been previously assessed for their safety and functional properties. Cryopreservation of MSC is the key to meeting these requirements. Following the example of HSC, which were cryopreserved and successfully transplanted later, MSC were therefore stored and thawed as needed in phase III clinical studies for the treatment of GVH refractory to conventional treatments. These studies having obtained mixed results and contrasting with the results obtained from fresh cells in clinical studies of phases I and II, cryopreservation was quickly found guilty of their failure. A remarkable amount of researches and resources were then devoted to the optimization of protocols, the composition of freezing media, cooling devices and storage containers, as well as the development of good manufacturing practices in order to guarantee that MSC retain their therapeutic characteristics after cryopreservation and that they are safe for clinical use. The main objective of this thesis was to clarify the impact of cryopreservation on the immunosuppressive properties of MSC. While the studies published on the subject made, in a fairly balanced way, the state of a success or a failure in cryopreservation of MSC in connection with the conservation of their different functions in vitro and/or in vivo in animal models, results presented in this thesis have allowed us to revisit the impact of cryopreservation on MSC by demonstrating that episodes of cell warming occurring after their freezing, rather than cryopreservation itself, were responsible for their functional alterations. If precautions are not taken to prevent the samples from heating up during the liquid nitrogen storage process, they will undergo a significant temperature variation, surprisingly quickly and very damagingly. My work has shown that the inhibition of lymphocyte proliferation by MSC decreases drastically and in proportion to the warming experienced by MSC during storage of cellular products. Surprisingly, the viability of MSC was not significantly reduced by these temperature variations, whereas it has
the presence of a functional impairment of MSC induced by cryopreservation, the rest of my work then made it possible to identify the adhesion capacity of MSC as being a marker quickly and easily assessable in the laboratory, but especially being significantly linked to the ability of MSC to inhibit a lymphocyte response, which is at the heart of GVH symptoms. Great rigor throughout the manufacturing and freezing process of MSC as well as the generation of reproducible and reliable data are essential to obtain scientific evidences of the efficacy and quality of this cell therapy with very high potential in the treatment of autoimmune diseases.
Table des matières
Résumé ... ii
Abstract ... iv
Table des matières ... vi
Liste des figures ... x
Liste des abréviations ... xi
Remerciements ... xvi
Avant-propos... xix
Introduction ... 1
1. Les cellules stromales mésenchymateuses ... 1
1.1 Les origines ... 1
1.2 Identification des CSM ... 2
1.3 Différentes sources de CSM ... 4
1.4 Propriétés des CSM ... 6
1.4.1 Rôle physiologique ... 6 1.4.2 Potentiel de différenciation ... 7 1.4.3 Immunomodulation ... 71.4.3.1 Système immunitaire : Un survol ... 7
1.4.3.2 Mécanismes d’action des CSM dans l’immunomodulation ... 8
1.4.3.3 Médiateurs solubles... 9
Enzyme indoleamine 2,3-dioxygénase ... 9
TGF-β ... 9
PGE2 ... 10
1.4.3.4 Contact cellule-cellule... 11
PD1-PDL1 ... 11
1.4.3.5 Les vésicules extracellulaires ... 12
1.4.3.6 Effets des CSM sur les cellules de l’immunité ... 14
Lymphocytes T ... 14
Lymphocytes B ... 16
1.6 Biodistribution ... 18
Injection locale ... 18
Injection systémique et migration... 19
2. Thérapie cellulaire basée sur les CSM ... 20
2.1 Maladies cardiovasculaires ... 21
2.2 Maladie de Crohn ... 24
2.3 COVID-19 ... 24
2.4 Cancer et greffe de CS ... 25
2.4.1 GVH ... 26
2.4.1.1 Physiopathologie, manifestations et classement ... 26
2.4.1.2 Prophylaxie ... 28
2.4.1.3 Traitements de première intention ... 28
2.4.1.4 CSM comme traitement de la GVH : Les débuts ... 29
2.4.1.5 CSM comme traitement de la GVH : Les études cliniques de phase III ... 30
3. Cryopréservation ... 31
3.1 Origine ... 32
3.2 Réponse cellulaire à la congélation ... 32
3.2.1 Cryoprotecteurs ... 35
3.3 Réponse cellulaire à la décongélation... 36
3.4 La cryopréservation des CSM ... 37
3.4.1 Viabilité ... 39
3.4.2 Adhésion ... 40
3.4.3 Immunomodulation ... 40
3.5 Bénéfices à la cryopréservation ... 40
4. Problématique, hypothèses et objectifs de recherche ... 41
Chapitre 1 : Les évènements de réchauffement cellulaire survenant après la congélation
altèrent la fonctionnalité des cellules stromales mésenchymateuses dérivées du cordon
ombilical ... 43
Résumé ... 44 Abstract ... 45 Introduction... 46 Methods ... 47 Results ... 51Discussion ... 54
Acknowledgments ... 58
Figure Legends ... 59
Figures ... 62
Supplementary Figures ... 68
Chapitre 2 : Altération fonctionnelle des CSM causée par des évènements de réchauffement
cellulaire survenant après leur congélation : Corrélation avec une perte d'adhérence et une
réduction de la taille des CSM. ... 71
Résumé ... 72 Abstract ... 73 Introduction... 74 Methods ... 75 Results ... 79 Discussion ... 83 Acknowledgments ... 86 Figure Legends ... 87 Table ... 90 Figures ... 91 Supplementary Figures ... 95 Supplementary Tables ... 99
Conclusion ... 101
Impact des évènements de réchauffement cellulaire survenant pendant le processus de congélation ... 102
Dommages de type « décongélation lente » ... 103
Dommages de type « refroidissement rapide » ... 103
La cryopréservation des CSM : Des résultats prometteurs... 104
Viable ≠ Fiable ... 105
Marqueur potentiel de l’intégrité immunosuppressive des CSM ... 107
Adhésion et intégrine β5 ... 107
Taille ... 108
Potentialisation de la thérapie à base de CSM ... 108
Liste des figures
Figure 1 : Anatomie macroscopique et microscopique du cordon ombilical. ... 5
Figure 2 : Rôle des facteurs solubles dans l'immunomodulation médiée par les CSM. ... 11
Figure 3 : Schématisation de deux types de blessures cryobiologiques potentielles lors du processus
de congélation... 34
Figure 4 : Schématisation des avantages aux solutions cryoprotectrices lors du processus de
congélation. ... 36
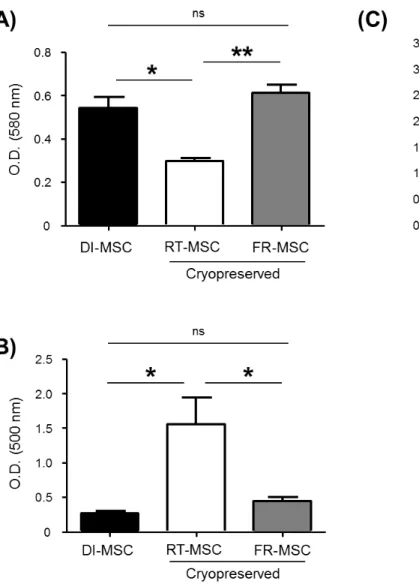
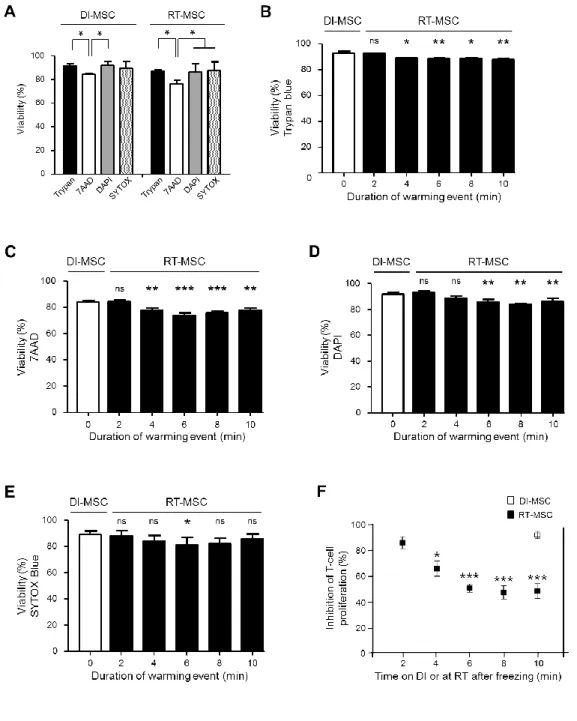
Figure 1.1 : Experimental strategy to assess the effects of transient warming events. ... 62
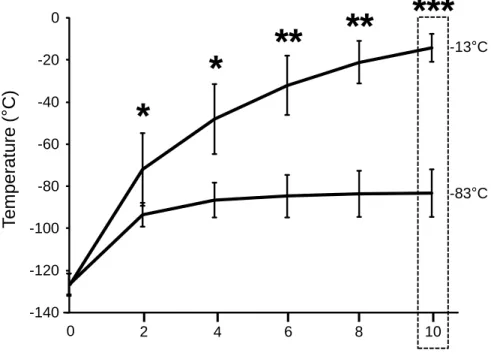
Figure 1.2 : Determination of the temperature fluctuations in MSC cryovials after freezing. ... 63
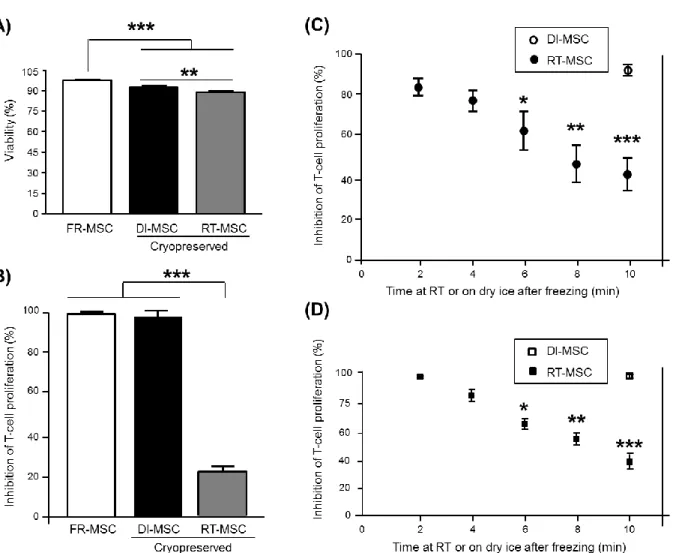
Figure 1.3 : Effect of cryopreservation and temperature fluctuations after freezing on MSC viability
and immunomodulatory potency. ... 64
Figure 1.5 : Consequence of warming events after MSC freezing on cell adhesion, membrane
integrity and actin cytoskeleton. ... 66
Supplementary Figure S1.1 : Effect of cryopreservation and temperature fluctuations after freezing
on MSC immunomodulatory potency. ... 68
Supplementary Figure S1.2 : Determination of the temperature fluctuations in MSC cryovials after
freezing at -80°C and effects on MSC immunomodulatory potency. ... 69
Supplementary Figure S1.3 : Determination of the temperature fluctuations in MSC cryovials after
freezing at -130°C. ... 70
Figure 2.1 : Post-thaw viability and immunomodulatory potency of MSC exposed or not to warming
events. ... 91
Figure 2.2 : Impact of warming events on the immunosuppressive properties of adherent and
non-adherent cells... 92
Figure 2.3 : Impact of warming events on FSC profile and expression of integrin
5 on adherent and
non-adherent MSC. ... 93
Supplementary Figure S2.1 : MSC characterization. ... 95
Supplementary Figure S2.2 : Impact of warming events on the immunosuppressive properties of
adherent and non-adherent cells subjected or not to transient warming events. ... 96
Supplementary Figure S2.3 : Gating strategy for integrin expression analysis. ... 97
Supplementary Figure S2.4 : Effect of transient warming events on the functional and adhesion
Liste des abréviations
ADN
Acide désoxyribonucléiqueARN
Acide ribonucléiqueARNm
ARN messagerBM-CSM
CSM extraites de la moelle osseuse humaineBM-MSC
MSC extracted from human bone marrow (CSM extraites de la moelleosseuse)
BSA
Bovine serum albumin (Albumine bovine sérique)CD
Differentiation cluster (Cluster de différenciation)COVID-19
Coronavirus induced disease 2019 (Maladie à coronavirus 2019)COX
CyclooxygénaseCS
Cellules souchesCSH
Cellules souches hématopoïétiquesCSM
Cellules stromales mésenchymateusesCXCR4
Récepteur de chimiokine CXC à motif 4DC
Dendritic cell (Cellule dendritique)DI-MSC
Cryopreserved MSC that were kept on dry ice after freezing at -130°C(CSM cryopréservées et gardées sur la glace sèche après congélation jusqu’à -130°C)
DMSO
DiméthylsulfoxydeELISA
Enzyme-linked immunosorbent assay (Dosage immunoenzymatique)FBS
Fetal bovine serum (Sérum bovin foetal)FOXP3
Forkhead box P3FR-MSC
Freshly harvested MSC (CSM fraîchement récoltées)FSC
Forward scatter (Diffusion vers l’avant)GVH
Maladie du greffon contre l’hôteh
Hour (Heure)HGF
Hepatocyte growth factor (Facteur de croissance des hépatocytes)HLA
Human leucocyte antigen (Antigène de leucocyte humain)HSA
Human serum albumin (Albumine humaine sérique)HSP
Heat shock protein (Protéine de choc thermique)HRP
Horseradish peroxidase-conjugated (Peroxidase de raifort)ICC
Intra-cluster correlation coefficient (Corrélation de coefficient
intraclasse)
IDO
Indoleamine 2,3-dioxygénaseIFN
InterféronIFN-γ
Interféron-gammaIL
InterleukineISCT
International society for cellular therapy (Société internationale pour la thérapie cellulaire)IP
Percent inhibition of T-cell proliferation (Pourcentage d’inhibition de laprolifération des cellules T)
iPSC
Induced pluripotent stem cell (Cellule souche pluripotente induite)IV
IntraveineuxLAL
Leucémie lymphoblastique aiguëLDH
Lactate déshydrogénaseLN2
Liquid nitrogen (Azote liquide)min
MinutesMSC
Mesenchymal stromal cells (Cellules stromales mésenchymateuses)MV
MicrovésiculeN
2 Nitrogen (Nitrogène)nd
Not done (Non fait)Ns
Not significant (Non significatif)PBMC
Peripheral blood mononuclear cell (Cellules mononuclées du sang périphérique)PBS
Phosphate-buffered saline (Tampon phosphate salin)PD-1
Programmed cell death protein-1 (Protéine de mort cellulaire programmée-1PD-L1
Programmed death-ligand 1 (Ligand 1 du récepteur de mort cellulaire programmée-1)PD-L2
Programmed death-ligand 2 (Ligand 2 du récepteur de mort cellulaire programmée-1PGE2
Prostaglandine E2ROR-γt
Récepteur de l'acide rétinoïque gamma tRT
Room temperature (Température de la pièce)RT-MSC
Cryopreserved MSC that were left at room temperature after freezing at -130°C (CSM cryopréservées et laissées à temperature de la pièceaprès congélation jusqu’à -130°C)
SD
Standard deviation (Écart-type)TGF-β
Transforming growth factor-beta (Facteur de croissance transformant-bêta)Th1
Lymphocyte T CD4 de type 1Th2
Lymphocyte T CD4 de type 2Th17
Lymphocyte T CD4 de type 17TNF-α
Tumor necrosis factor-aplha (Facteur de nécrose tumorale-alpha)TP
Température de la pièceTreg
Lymphocyte T régulateurTSG-6
Tumor necrosis factor-inducible gene 6 protein (Protéine du gène 6 inductible par le facteur de nécrose tumorale)UC
Umbilical cord (Cordon ombilical)VCAM-1
Vascular cell adhesion protein-1 (Protéine d’adhésion aux cellules vasculaires-1)VLA
Very late antigen (Antigène très tardif)À mes anges gardiens, vous qui m’avez donné
le courage et le support nécessaires à la
réalisation et à l’écriture de ce grand projet.
Remerciements
Plusieurs personnes ont, à leur façon bien singulière, contribuées à la réalisation de ce beau et grand projet qu’a été mon doctorat de 2013 à aujourd’hui.
D’abord toi, Renée, dont le rôle a été, à mes yeux, bien au-delà de la direction de mes travaux de recherche. Merci de ta patience, de ta confiance et de ton infini soutien. Bien simplement et sincèrement, sache que cette thèse n’aurait pu être écrite sans tes encouragements constants (dans mes travaux, mais également dans mes défis personnels), ta grande contribution dans des moments où j’ai failli tout abandonner et ton pilotage de mon doctorat, finement balancé entre l’encadrement rigoureux découlant de la chercheure douée que tu es et la place à l’autonomie nécessaire au développement du plein potentiel de l’apprenti. Sincèrement merci du fond du cœur. Je n’aurais pu souhaiter meilleure directrice.
Un grand merci à mon co-directeur, André Darveau, d’avoir accepté la codirection de mes travaux malgré un horaire que je présume extrêmement chargé. Merci de vos encouragements sincères à chacune de nos rencontres. Merci aux membres de mon comité d’encadrement pour votre temps et votre soutien au fil des années. Merci aux organismes subventionnaires (CRSNG, FQRNT) de m’avoir permis de réaliser ce grand projet. Merci à la Fondation Francis & Geneviève Melançon de m’avoir choisie comme récipiendaire de la bourse Ténacité pendant trois années consécutives. Merci à Héma-Québec pour leur appui dans la réalisation de mes études post-secondaires. Vous offrez un milieu d’apprentissage de haute qualité où l’épanouissement professionnel est possible à 100%. Merci à toutes ces mamans qui ont fait don des cordons ombilicaux utilisés pour mes travaux et merci à toute l’équipe qui a assuré le recrutement de celles-ci et la gestion technique et administrative de ces dons; ce travail n’aurait été possible sans vous tous. Merci à mes jurys d’avoir accepté d’évaluer cette thèse dans ces moments particuliers que sont ceux qu’entraine une pandémie mondiale. C’est très apprécié.
Jim, merci de m’avoir soutenue pendant ces sept années. Merci de m’avoir rappelé à chaque soir combien tu étais fier de moi et d’avoir toujours patiemment écouté tout mon charabia scientifique en essayant de bien déchiffrer mes propos… Rappelons-nous cette fois où tu voulais me convaincre de prendre congé pour me reposer et où tu m’as conseillé de simplement dire à Renée que mes résultats tardaient, car j’avais échappé une cytokine dans le PCR… Merci pour ta présence à chacune de mes épreuves pendant cette période, merci pour ces fleurs, pour ces petits mots, pour ton regard brillant de fierté et d’amour et pour tes conseils justes et sages lors de mes remises en question causées par un surplus de diplômes à obtenir. Merci d’être un partenaire de vie fou, immature et passionné. Merci aussi d’être un si bon père et de prendre soin de nos chéris; vous êtes
professionnelle parce que je te savais toujours aux côtés de nos mini Dupont chaque fois que je ne pouvais y être. JE T’AIME.
Merci à vous, mes précieux parents, qui n’ont JAMAIS cessé de croire en moi. Vous n’avez jamais douté de mes capacités à entreprendre ce projet de doctorat. Je n’ai même ressenti aucun doute lorsque je vous ai annoncé que j’allais mener un « double doctorat » alliant mes travaux de recherche à Héma-Québec et mes études en médecine. Vous avez tout naturellement sorti le champagne pour célébrer mon décollage vers ces nouveaux défis. Vous avez toujours cru que j’en étais capable. C’était parfois invraisemblable de recevoir autant d’encouragements. Vous voyez en moi tant d’intelligence et de compétence que je viens parfois à y croire aussi fort que vous. Et je plonge vers mes rêves, grâce au reflet que vous m’envoyez. Vous avez toujours voulu que je m’accomplisse pleinement et j’y suis arrivée. Votre support a été un pilier pendant toutes ces années. Merci. Je vous aime infiniment et prendrai soin de vous quand vous serez des petits vieux.
Merci Corinne, précieuse amie que le cancer m’a volée en ce triste janvier 2018. Ta présence positive pendant toutes ces années d’études, nos fous-rires, nos discussions philosophiques autour de Mr Apothic, ta grande confiance en mes capacités et ta personnalité de feu… tout de toi me manque cruellement. Presque tous mes souvenirs qui me reviennent de mes années à Héma-Québec sont liés à toi. Je recommencerais tout mon doctorat n’importe quand si c’était pour le refaire avec toi. Merci de tout l’estime que tu m’as donnée. Merci pour tout Coco.
Merci à mes folles de sœurs qui ont répondu présente chaque fois que j’en avais besoin. Merci de m’avoir écoutée, encouragée et d’avoir soigneusement veillé à étoffer ma vie sociale! Je n’avais jamais le temps pour toutes ces soirées festives, mais vous avez toujours su me transformer en vraie rockstar! Merci de votre folie et de votre support. Vous êtes si précieuses pour moi. Merci à ma marraine, Sonia, à mes beaux-parents, Noël et Sylvie ainsi qu’à mes deux beaux garçons, Louis-Félix et Thomas. Votre support, vos encouragements et votre confiance en moi ont été inconditionnels et ont contribué à ma réussite.
Mon passage à Héma-Québec m’a permis de rencontrer des gens extraordinaires. Cassou, mon cher coq disponible, ta seule rencontre me suffit à être heureuse de mon cheminent! Tu occupes une place plus qu’importante dans ma vie et je ne t’échangerais même pas contre une publication dans Science, c’est pour dire combien je t’aime. Merci MER de m’avoir encouragée et cultivée pendant tous ces dîners à Héma-Québec ou aux plateaux avec la plèbe. Ton amitié m’est très précieuse. Merci Lili pour tes solides coups de mains au labo quand ma gestion du temps était inadéquate. Merci de ton absolue confiance en moi lorsque je te raconte mes embûches; les autres ont toujours tort! Merci Patrick pour ton approche humoristique de la science et pour tous ces fous-rires improbables dans un environnement aussi cartésien. Merci Sarah d’avoir accepté d’être « MA stagiaire » et d’avoir rapidement assoupli ta définition de la ponctualité pendant tes quelques semaines au labo.
Nous ne sommes pas parvenues à publier notre grand savoir dans Nature tel que notre grande science le méritait, mais j’ai rencontré cet été-là une grande amie que j’adore! Merci à Lionel pour ton excellent « coaching » et ta patience coriace envers mes gaffes et ma gestion atypique de mes horaires au laboratoire. Merci à toute l’équipe de recherche d’Héma-Québec, vous côtoyer a été vraiment enrichissant et agréable. Je n’ai que de bons souvenirs de mon passage en recherche avec vous.
Merci à tous ceux que j’oublie. Je suis vraiment entourée de belles et bonnes personnes. Je suis choyée. Bonne lecture.
Avant-propos
Les principaux résultats de cette thèse ont fait l’objet de publications dans des journaux avec comité de lecture. Ils seront donc présentés sous la forme de manuscrits scientifiques en deux chapitres, les chapitres 1 et 2. Les deux articles, dont je suis la première auteure, sont reproduits avec l’autorisation des coauteurs et dans le respect des licences de diffusion.
Chapitre 1 : Les événements de réchauffement cellulaire survenant après la congélation altèrent la fonctionnalité des cellules stromales mésenchymateuses dérivées du cordon ombilical.
Ce chapitre reproduit l’article Transient warming events occurring after freezing impairs umbilical cord-derived
mesenchymal stromal cells functionality qui a été soumis le 24 janvier 2017 et publié le 9 juin 2017 dans le
journal Cytotherapy.
Les auteurs de cet article sont Dominique Chabot, Tony Tremblay, Isabelle Paré, Renée Bazin et Lionel Loubaki. J’ai participé à la conception des expériences, à leur réalisation, à la conception des moyens d’analyse, à l’analyse des résultats, à la conception et à la préparation des tableaux et des figures. J’ai rédigé l’ensemble de la première version du manuscrit et participé au peaufinage de la version finale. Tony Tremblay, Renée Bazin et Lionel Loubaki ont participé à la conception des expériences et à l’analyse des résultats. Tony Tremblay et Isabelle Paré ont réalisé certaines expériences. Lionel Loubaki et Renée Bazin ont participé à l’écriture du manuscrit et à la supervision des travaux.
Chapitre 2 : Altération fonctionnelle des CSM causée par des évènements de réchauffement cellulaire survenant après leur congélation : Corrélation avec une perte d'adhérence et une réduction de la taille des CSM.
Ce chapitre reproduit l’article Functional impairment of MSC induced by transient warming events: Correlation
with loss of adhesion and altered cell size qui a été soumis le 1er février et publié le 6 août dans Cytotherapy.
Les auteurs de cet article sont Dominique Chabot, Antoine Lewin, Lionel Loubaki et Renée Bazin.
J’ai participé à la conception des expériences, à leur réalisation, à la conception des moyens d’analyse, à l’analyse des résultats, à la conception et à la préparation des tableaux et des figures. J’ai rédigé l’ensemble de la première version du manuscrit et participé au peaufinage de la version finale. Antoine Lewin a réalisé les analyses biostatistiques. Renée Bazin et Lionel Loubaki ont participé à la conception des expériences, à l’écriture du manuscrit et à la supervision des travaux.
Introduction
Les travaux de doctorat qui sont présentés dans cette thèse portent sur les impacts de la cryopréservation des cellules stromales mésenchymateuses (CSM) sur leurs propriétés fonctionnelles et immunosuppressives. Afin de familiariser le lecteur avec ces thèmes, la première section de cette thèse sera d’abord consacrée à l’historique de la découverte des CSM et à la description de leurs propriétés biologiques d’intérêts en clinique. Par la suite, le potentiel des CSM dans le traitement de la maladie du greffon contre l’hôte (GVH) ainsi que la cryopréservation des préparations thérapeutiques préparées à partir de ces cellules seront discutés.
1. Les cellules stromales mésenchymateuses
1.1 Les origines
La recherche sur les cellules souches (CS) a débuté au cours de la seconde guerre mondiale à la suite des bombardements atomiques d'Hiroshima et de Nagasaki en 1945. L’importante radiation encaissée par la population s’est traduite par l’installation progressive d’une immunosuppression et d’un défaut de coagulation [1]. Il fut démontré un peu plus tard que des souris auxquelles on administrait des doses d'irradiation développaient une défaillance hématopoïétique quelques jours suivant l’exposition alors qu’une protection de la rate ou d’un seul os contre ces rayonnements leur permettait d’échapper au syndrome d'irradiation, établissant un premier lien entre le renouvellement des cellules sanguines, la moelle osseuse et la rate [2]. En 1956, trois laboratoires ont démontré que les cellules de moelle osseuse injectées chez des souris préalablement irradiées pouvaient régénérer le système hématopoïétique [3-5]. Ces travaux ont permis l’identification de cellules que l’on nomme aujourd’hui CS hématopoïétiques (CSH). Les CSH sont des cellules qui conservent l'aptitude à reproduire des cellules identiques à elles-mêmes, une capacité aussi nommée auto-renouvellement [6]. Elles peuvent également se différencier en un ou plusieurs tissus (neural, hématopoïétique, musculaire, hépatique, osseux, cartilagineux, etc.) selon les facteurs de croissance et les milieux dans lesquels elles sont cultivées [6]. Chez l’adulte, les CSH se retrouvent majoritairement dans la moelle osseuse et sont qualifiées de pluripotentes; elles peuvent se différencier en différentes cellules formant les lignées lymphoïde ou myéloïde et génèrent ainsi les globules blancs, les globules rouges et les plaquettes qui forment le sang [6]. Depuis leur découverte dans les années 1950, elles sont à la base de grandes avancées médicales telles que le remplacement cellulaire pour le traitement de cancers du sang (leucémie, lymphome, myélome etc.) [7]. Autour des années 1970, deux chercheurs ont démontré qu’une transplantation extra-médullaire de cellules provenant de la moelle osseuse pouvait mener à l’élaboration de tissus osseux ectopiques, établissant ainsi un lien autrefois inconnu entre les
présentes dans la moelle osseuse [9]. Lorsque ces chercheurs mirent en culture un prélèvement de moelle osseuse en milieu liquide à faible densité, ils observèrent l’expansion de cellules possédant des caractéristiques bien distinctes des CSH. En effet, en plus d’être fortement adhérentes au plastique, celles-ci avaient une morphologie s’apparentant à celle des fibroblastes [10]. Ces résultats furent parmi les premiers à suggérer l’existence de cellules non hématopoïétiques dans la moelle osseuse. Dans une autre expérience, il fut démontré qu’une transplantation de ces « autres cellules » de la moelle osseuse pouvait donner naissance aux tissus fibreux et osseux ou à de petits prolongements osseux contenant de la moelle hématopoïétique [11]. Ces travaux ayant été réalisés avec des animaux chimériques comme modèle, il fut possible de mettre en évidence que le tissu fibreux et l’os provenaient bien du donneur, tandis que le tissu hématopoïétique provenait du receveur. Deux conclusions fondamentales furent alors tirées, soit l’existence de progéniteurs multipotents pour le tissu conjonctif dans la moelle osseuse ainsi que la fonction stromale possible de ces cellules de soutenir les CSH circulantes qui trouvent des sites d’ancrage et de développement favorable dans certaines colonies issues des CSM. Il sera effectivement démontré que ces cellules médullaires non hématopoïétiques sont capables de se différencier en lignées mésodermiques telles que les ostéocytes, les adipocytes et les chondrocytes [12]. La participation des CSM dans l’organisation des niches pour les CSH est aujourd’hui largement confirmée [13].
1.2 Identification des CSM
Durant les années 1980, Arnold Caplan fut le premier à définir les CSM comme étant les cellules à l’origine non seulement de l’os et du stroma médullaire, mais aussi du cartilage, des tendons et du muscle [14]. Nous lui devons l’appellation « cellules souches mésenchymateuses », laquelle souligne le rôle fondamental de ces cellules en tant que constituantes du stroma nourricier, mais souligne également leur capacité à servir de niches pour d’autres types de CS [14]. Cette appellation a ensuite fait l’objet d’un débat quant à l’application des différents critères de CS aux CSM. En 2006, la Société internationale pour la Thérapie cellulaire et génique (ISCT) leur a préféré l’appellation « cellules stromales mésenchymateuses » en raison de leur grande hétérogénéité de potentiel de prolifération et de différenciation [15]. Tel qu’il sera discuté dans le prochain paragraphe, c’est également à ce moment que l’ISCT a publié un article concernant les critères d’identification des CSM [15]. Bien que ces critères aient été utilisés par la suite dans de nombreuses publications, certains chercheurs ont critiqué le fait que ceux-ci ne permettaient pas de distinguer adéquatement les CSM des fibroblastes [16]. Encore plus récemment, Caplan a publié son désir de voir à nouveau les CSM changer leur appellation dans un article intitulé Mesenchymal Stem Cells: Time to Change the Name! [17]. Selon lui, les CSM devraient maintenant être reconnues comme des « cellules de signalisation médicinales » afin que leur nom représente plus adéquatement un de leur rôle fondamental qu’est la sécrétion de facteurs solubles dans l’environnement dans lequel elles baignent et qui est selon lui à la base des résultats obtenus dans les études
cliniques utilisant les CSM comme thérapie cellulaire [17]. Ces notions seront davantage discutées dans la section suivante.
Dans un souci de clarification de la nomenclature et pour favoriser le développement d’études comparatives entre laboratoires, l’ISCT a proposé, en 2006, une définition de la CSM selon trois critères. Premièrement, elles doivent être fortement adhérentes au plastique. Deuxièmement, elles doivent exprimer à leur surface les molécules suivantes : « cluster de différenciation » (CD) 73, CD90 et CD105. CD73, une enzyme extracellulaire qui catalyse la déphosphorylation des adénosine monophosphates en adénosine, a été décrit comme étant un puissant inhibiteur de la réponse lymphocytaire [18]. CD90, une protéine ancrée dans la membrane plasmique, jouerait quant à elle un rôle dans l'adhésion des fibroblastes, l'organisation du cytosquelette et la migration cellulaire [19]. Enfin, CD105 est une glycoprotéine membranaire qui fait partie du complexe du récepteur transforming growth factor-beta (TGF-β) et qui jouerait un rôle important dans l'angiogenèse [20]. Les rôles de ces trois marqueurs ne sont pas encore clairement définis, mais ils confèrent une partie importante de leur identification aux CSM. Celles-ci doivent également ne pas exprimer certains marqueurs de surface, soit CD14 ou CD11b (exprimés principalement par les macrophages, les monocytes et les cellules dendritiques (DC) [21]), CD19 ou CD79α (exprimés par les lymphocytes B [22]), CD34 (marqueur de CSH [23]), CD45 (glycoprotéine exprimée par la plupart des cellules nucléées d'origine hématopoïétique, à l’exception des globules rouges et des plaquettes [24]) et les antigènes de leucocyte humain (HLA)-DR. L’absence de ce dernier marqueur cellulaire est par contre controversée puisque de récentes études ont démontré que les CSM pouvaient exprimer celui-ci lorsque stimulées avec de l’interféron-gamma (IFN-γ), mais également dans des conditions d’expansion standards [25-27], sans toutefois affecter leurs propriétés in vitro [27]. Troisièmement, elles doivent avoir la capacité de se différencier en trois lignages : chondrocytes, ostéoblastes et adipocytes [15].
Tel qu’il sera discuté dans la prochaine section, les CSM ont été identifiées dans divers tissus humains. Certaines équipes de recherche ont rapporté l’expression d’autres marqueurs de surface cellulaire que ceux discutés précédemment, lesquels seraient spécifiques à l'origine tissulaire. Stro-1 est un marqueur exprimé par les CSM extraites de la moelle osseuse [28], mais serait absent de la surface des CSM extraites de l’environnement périvasculaire du cordon ombilical [29]. Outre cette spécificité variant selon le tissu d’extraction, certaines études ont également suggéré qu’une présélection des CSM exprimant Stro-1 pourrait améliorer les résultats obtenus en clinique dans la prévention et le traitement de la GVH [30] et dans la prise de greffe de CSH [31]. De la même façon, le marqueur CD271 est exprimé par les CSM extraites de la moelle osseuse [32-34], mais absent de la surface des CSM extraites du cordon ombilical [34, 35]. L’expression de CD271 par les
protéine notamment impliquée dans l’adhésion, est exprimé à la fois par les CSM extraites de la moelle osseuse [38] et du cordon ombilical [38] et a été décrit comme étant un marqueur d’une multipotence supérieure [39]. Dans les dernières années, l’intérêt toujours croissant pour les CSM a conduit à un nombre élevé de publications décrivant continuellement de nouveaux marqueurs, de nouveaux protocoles d’isolation, de nouvelles conditions de culture, de nouvelles sources d’extraction et de nouvelles fonctionnalités potentiellement utiles en clinique. Ces efforts n’ont malheureusement pas permis d’identifier un marqueur qui serait spécifique aux CSM ou sur un marqueur dit « prédictif » qui permettrait aux chercheurs et cliniciens d’évaluer efficacement le potentiel anti-inflammatoire d’une préparation thérapeutique à base de CSM. Dans ce sens, le développement de contrôles de validation d'identité et d'activité des CSM sont des axes de recherche importants actuellement [40].
1.3 Différentes sources de CSM
Tel qu’il sera discuté dans cette section, les CSM peuvent être issues de plusieurs sources à partir de donneurs adultes, mais peuvent également être extraites des tissus néonataux.
Comme la moelle osseuse fut la première source de CSM découverte [41], elle est également celle qui a été la plus étudiée et la plus utilisée en essais cliniques. En salle d’opération, sous anesthésie générale ou épidurale, la moelle osseuse est aspirée à partir des os du bassin avec des aiguilles stériles appropriées. Cette méthode invasive, en plus d’exposer le donneur à des risques d’infections, peut être très douloureuse. Il existe des risques de contamination des cultures des CSM provenant de la moelle osseuse (BM-CSM) par d’autres cellules adhérentes au plastique présentes dans les premières monocouches de la culture, telles que les macrophages, les cellules endothéliales et les lymphocytes. Cependant, seules les cellules fusiformes d’apparence similaire au fibroblaste vont proliférer et former des colonies qui pourront ensuite être isolées [12]. Outre ces difficultés, un autre paramètre souvent négligé est à considérer : la sélection du donneur lui-même. Actuellement, la sélection des donneurs repose essentiellement sur l’absence de marqueurs positifs pour les agents infectieux transmissibles et sur des critères liés à l’âge. En effet, plusieurs études ont démontré que l’âge du donneur influence négativement les propriétés paracrines des CSM dans le traitement des lésions ischémiques cardiaques aiguës [42], dans la réparation de lésions cutanées [43] et dans la neuroprotection chez des patients souffrant de sclérose multiple [44]. De plus, il a été démontré qu’une perte des capacités proliférative et de multipotentialité des CSM pouvait être directement liée à l’âge du donneur [45]. Au cours des dernières années, plusieurs autres sources de CSM ont été identifiées chez l’adulte telles que les tissus adipeux [46] et le sang périphérique [47]. Les tissus adipeux représentent une alternative très intéressante en raison de leur plus grande accessibilité et des méthodes d’extraction qui sont moins invasives [48]. Le matériel biologique nécessaire est essentiellement recueilli à la suite de chirurgies telle la liposuccion et nécessite ensuite un traitement enzymatique à la collagénase [48].
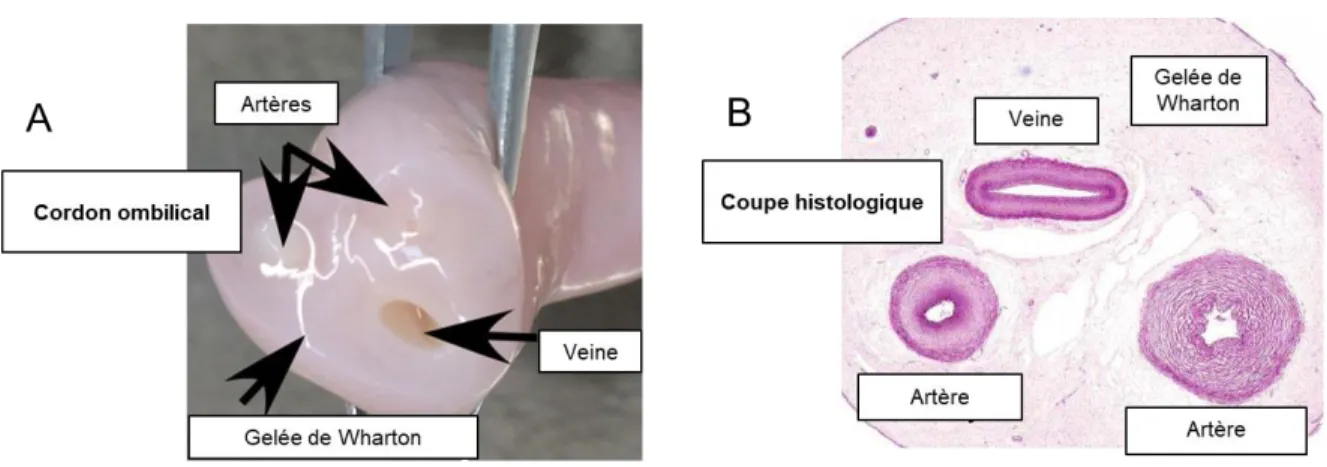
Allant dans le même sens, plusieurs études ont ensuite rapporté des avantages non négligeables à l’utilisation de tissus néonataux au lieu de tissus adultes pour l’isolement de CSM, soit la facilité d’accès, une réduction des contraintes éthiques et une meilleure capacité proliférative [49-53]. Le cordon ombilical possède un rôle important de transmetteur entre le placenta et le fœtus [54]. À terme, celui-ci mesure entre 50 et 60 cm [54]. De l’extérieur vers l’intérieur, le cordon ombilical est typiquement formé d’un revêtement amniotique et de la gelée de Wharton qui renferme une veine et deux artères (Figure 1) [54]. La gelée de Wharton est un tissu conjonctif mucoïde qui fut décrit pour la première fois par Thomas Wharton en 1656 [55].
Figure 1 : Anatomie macroscopique et microscopique du cordon ombilical.
A) Anatomie macroscopique. B) Coupe histologique. Adaptée de Ali H. et al., PLoS ONE, 2015 [56].
Quatre types de tissus forment le corps humain, soit les épithéliums, les tissus musculaires, le tissu nerveux et les tissus conjonctifs. Ces derniers correspondent principalement à des tissus d’union, de soutien et d’échange. Ces tissus conjonctifs sont constitués de cellules mésenchymateuses qui baignent dans une matrice extracellulaire constituée de fibres telles que le collagène, l’élastine et la réticuline. Dans tous les tissus conjonctifs du corps humain, on note également la présence de cellules impliquées dans la défense immunitaire telles que les plasmocytes, les lymphocytes et les macrophages. La gelée de Wharton du cordon ombilical se distingue des autres tissus conjonctifs par l’absence de ce type de cellules [57]. En effet, les seules cellules comprises dans le tissu conjonctif muqueux qui constitue le cordon ombilical sont les myofibroblastes et leurs précurseurs [57]. Ceux-ci forment un réseau tridimensionnel renfermant la substance fondamentale très riche en acide hyaluronique et des fibres de collagène [57]. Au sein de cette gelée de Wharton, deux zones particulières ont été décrites : la région périvasculaire et une région située en dessous de l’épithélium amniotique
extraites de la gelée de Wharton (WJ-CSM) possédant un potentiel d'expansion plus important que les CSM extraites de la moelle osseuse (BM-CSM) in vitro, étant plus faciles à isoler d’un point de vue technique, financier et éthique et leurs propriétés ne dépendant pas de l’âge du donneur, les études cliniques utilisant cette source de CSM se sont multipliées dans les dernières années. Les travaux présentés dans cette thèse de doctorat ont été réalisés avec des CSM extraites de la gelée de Wharton du cordon ombilical à l'aide d'une méthode de culture d'explant développée par Tissue Regeneration Therapeutics Inc (Toronto, ON, Canada). Pour ce faire, la membrane amniotique a été retirée et les vaisseaux ombilicaux ont été séparés [57]. La gelée périvasculaire de Wharton a été disséquée de la tunique de chacun des vaisseaux, coupée en dés et utilisée comme source de tissus pour la culture d'explants [57]. Cette méthode non enzymatique repose sur les capacités de migration et d’adhérence au plastique des CSM qui vont migrer spontanément dans le flacon de culture et commencer à se multiplier si elles sont incubées dans des conditions optimales [60].
1.4 Propriétés des CSM
Les CSM étant des précurseurs potentiels des trois lignages précédemment décrits (adipocytes, ostéoblastes et chondrocytes), elles ont un rôle de maintien de l’homéostasie tissulaire chez l’homme. Elles présentent également des propriétés immunosuppressives, desquelles découlent plusieurs études cliniques où elles sont utilisées comme traitement potentiel de la GVH. Cette application clinique sera discutée plus en détails dans une prochaine section, mais gardons à l’esprit qu’une fois injectées par voie intraveineuse (IV) aux patients, la migration des CSM ainsi que leur adhésion aux tissus cibles sont souhaitables, voir primordiales. Je discuterai donc ici de leur rôle physiologique, de leur potentiel de différenciation, de leurs capacités immunosuppressives et de leur biodistribution dans l’organisme lorsqu’elles sont injectées par voie IV.
1.4.1 Rôle physiologique
Bien que de nombreuses études aient caractérisé les propriétés des CSM in vitro, leurs véritables fonctions in
vivo demeurent mal définies. Les CSM semblent exercer des fonctions spécifiques dépendant du tissu d’origine
et du contexte physiologique dans lequel elles se trouvent. Elles ont tout d’abord été isolées à partir de la moelle osseuse où elles ne représentent qu’un faible pourcentage de toutes les cellules mononuclées présentes, soit environ 0,02% [61]. Malgré cela, les CSM jouent un rôle important en tant que constituant de niches pour les CSH. Dans ce contexte, une niche représente un microenvironnement qui soutient les CSH en contrôlant finement leur devenir. En fonction de facteurs locaux présents dans le microenvironnement, elles contrôlent la balance entre quiescence, auto-renouvellement, différenciation et mobilisation des CSH [62]. Ces niches vascularisées régulent l’activité des CSH en participant à la fois au contrôle de leur différenciation [63] et au recrutement des cellules hématopoïétiques matures [64]. Les CSM sont absentes de la circulation sanguine,
mais sont cependant présentes sur les vaisseaux sanguins, ce qui expliquerait leur présence dans tous les tissus vascularisés de l’organisme [65].
1.4.2 Potentiel de différenciation
Depuis leur découverte par Friedenstein et al. [9] à la fin des années 1960, plusieurs études ont démontré un rôle essentiel occupé par les CSM dans la régénération tissulaire [66].
Les CSM pouvant contribuer à la régénération de cellules osseuses lorsque transplantées en milieux extra-médullaires [8], cette propriété a été exploitée dans le développement de traitements non invasifs pour aider à la guérison de fractures dites compliquées [67] et de l’ostéonécrose [68]. Utilisant la bioluminescence pour retracer les CSM injectées chez des souris ayant subi une fracture du tibia, des chercheurs ont observé la présence de celles-ci sous forme d’ostéocytes dans la nouvelle matrice osseuse [69]. Selon ces chercheurs, les CSM participeraient à la régénération tissulaire par la synthèse de cytokines et de facteurs de croissance, mais ils proposent également l’existence d’une différenciation directe [69].
Leur capacité à se différencier en chondrocytes est mise à profit dans le traitement des blessures cartilagineuses [70], de l’arthrose du genou [71] et de la discopathie dégénérative [72]. Les résultats sont très encourageants, mais il est encore difficile d’éviter le retour d’une dégénérescence du tissu nouvellement formé et du tissu hôte environnant.
1.4.3 Immunomodulation
1.4.3.1 Système immunitaire : Un survol
Chez l’humain, l’immunité est organisée en deux segments, soit l’immunité innée et l’immunité adaptative. Les acteurs de l’immunité innée sont les cellules tueuses naturelles (NK), les neutrophiles, les macrophages et les DC [73]. Leur capacité à distinguer le soi du non soi est par contre limitée à un répertoire étroit et invariable de quelques récepteurs de reconnaissance [73]. La réponse immunitaire adaptative, plus spécifique et plus puissante, est médiée par trois acteurs principaux : les lymphocytes T, les lymphocytes B et les cellules dendritiques. Les lymphocytes T expriment des récepteurs de surface qui sont spécifiques à un seul antigène, provenant par exemple d’un agent infectieux ou tumoral. On distingue globalement deux grandes familles de lymphocytes T : celle exprimant la molécule de costimulation CD4 et celle exprimant CD8. Une fois les lymphocytes T CD4 activés, ceux-ci peuvent se différencier en différentes sous-populations : lymphocytes T CD4 de type 1 (Th1), lymphocytes T CD4 de type 2 (Th2), lymphocytes T CD4 de type 17 (Th17) et lymphocytes
produisent l’interleukine (IL)-2 et l’IFN-γ, sont impliqués dans l'immunité cellulaire alors que les lymphocytes Th2, qui produisent l'IL‐4, l'IL‐5 et l'IL‐13, participent à l'immunité humorale [75]. Les lymphocytes Th17, qui produisent la cytokine pro-inflammatoire IL-17, jouent un rôle important dans l'induction de l'inflammation et ont été décrits comme responsables de certaines maladies auto-immunes et du rejet aigu pouvant survenir lors de greffes [76, 77]. Enfin, les Treg jouent un rôle central dans l'induction de la tolérance. Les Treg sont des cellules caractérisées par l'expression du marqueur CD25 et par l'expression intracellulaire du facteur de transcription “Forkhead box” P3 (FOXP3) [78]. Ils peuvent être subdivisés en Treg naturels, qui se développent dans le thymus, ou en Treg induits, qui se différencient des lymphocytes T CD4 périphériques naïfs en présence de TGF-β [78]. Les Treg sont connus pour inhiber la prolifération et la production de cytokines par les lymphocytes T CD4 et CD8, la production d'immunoglobulines par les lymphocytes B, l'activité cytotoxique des cellules NK et la maturation des DC, entraînant globalement une franche induction de tolérance [79, 80]. Les lymphocytes T CD8 jouent quant à eux un rôle très important pour la défense immunitaire contre les agents pathogènes intracellulaires, y compris les virus et les bactéries, et pour la surveillance des tumeurs [81]. Les lymphocytes B sont responsables de l’immunité dite humorale, qui consiste en la production d’immunoglobulines ou d’anticorps capables de neutraliser les antigènes [82].
1.4.3.2 Mécanismes d’action des CSM dans l’immunomodulation
Il est important de noter que la suppression immunitaire par les CSM est causée par plusieurs mécanismes à la fois et que des études contradictoires ont été rapportées quant aux mécanismes qui régissent leur pouvoir anti-inflammatoire. Une des causes les plus probables de ces divergences serait la grande variété de modèles in
vitro utilisés. La majorité des études in vitro en lien avec l’immunosuppression lymphocytaire par les CSM se
sont faites en utilisant des modèles d’activation de cellules mononucléées du sang périphérique (PBMC) humaines par différents stimuli non antigéniques tels que les mitogènes, les anticorps anti-CD3 et anti-CD28 ou les lymphocytes allogéniques. S’ajoutent à ces divergences de stimuli de nombreuses autres variables à considérer : les temps d’incubation, les doses des activateurs utilisés, les sources de CSM utilisées ainsi que leur méthode d’extraction et leur concentration utilisée dans les essais. Considérant que bien des facteurs immunosuppressifs ne sont pas constitutivement sécrétés par les CSM en culture seules, mais qu’ils sont induits au cours des essais, l’environnement dans lequel baigne les CSM lorsqu’elles agissent comme agent anti-inflammatoire peut certainement varier d’un modèle à l’autre et contribuer aux divergences observées. Voyons d’abord les principaux médiateurs solubles sécrétés par les CSM et leurs mécanismes d’action.
1.4.3.3 Médiateurs solubles
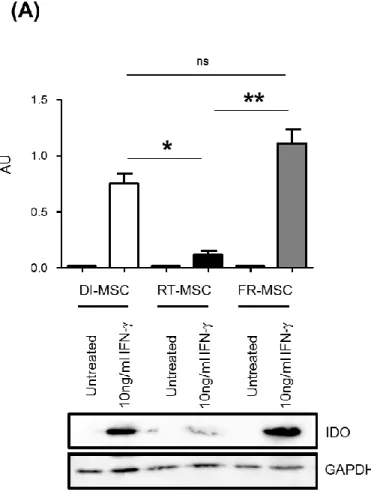
Enzyme indoleamine 2,3-dioxygénase
Plusieurs études ont montré que les CSM peuvent supprimer la prolifération des lymphocytes T par l’intermédiaire d'un mécanisme dépendant de l’enzyme indoleamine 2,3-dioxygénase (IDO) [83-85]. IDO, une enzyme intracellulaire inductible par l'IFN-γ, catalyse la première étape de la dégradation du tryptophane le long de la voie de la kynurénine [86]. Cette enzyme a d’abord été identifiée comme un mécanisme de défense contre les invasions microbiennes puisqu’elle contribuait à l'épuisement du tryptophane, un acide aminé essentiel pour la prolifération cellulaire [86]. D’autres études ont montré que certains des métabolites finaux de cette voie avaient en eux-mêmes des propriétés antimicrobiennes et immunosuppressives [87, 88], ajoutant possiblement leur touche à l’immunosuppression totale faite par les CSM par l’enzyme IDO [84, 89]. Outre ses effets par la voie de dégradation du tryptophane, l’enzyme IDO est également impliquée dans la suppression de l’activation des cellules NK, principales effectrices de l’immunité innée [90]. En effet, des chercheurs ont démontré que les CSM suppriment la prolifération des cellules NK normalement induite par l'IL-2, mais également la génération d'activité cytolytique et la production de cytokines [83]. Dans cette étude, le blocage simultané de IDO et de la prostaglandine E2 (PGE2) par des inhibiteurs appropriés restaurait presque complètement la prolifération des cellules NK, démontrant que l'inhibition de l’activité NK médiée par les CSM provenait principalement de l'activité de ces deux facteurs solubles [83]. De plus, dans une étude utilisant des anticorps anti-CD3 et anti-CD28 pour induire la prolifération de lymphocytes T, les auteurs ont observé que le blocage de l'activité enzymatique de IDO entraînait une abrogation complète de l'inhibition de la prolifération lymphocytaire [85]. Enfin, ces mêmes auteurs ont démontré que la présence de CSM dans leur modèle d’activation lymphocytaire pouvait induire la polarisation de monocytes en macrophages M2 sécrétant de l'IL-10 [85]. Expliqué brièvement, les macrophages activés par la voie classique (cytokines de type 1 et produits microbiens) sont appelés macrophages M1 alors que ceux activés par des voies alternatives sont appelés macrophages M2 [91]. Ceux-ci diffèrent en termes de récepteurs membranaires, de synthèse de cytokines et d’activité fonctionnelle [91]. Alors que les macrophages M1 sont dits « inflammatoires », les macrophages M2 sécrétant de l’IL-10 sont plutôt dits « immunosuppresseurs » [85].
TGF-β
Le TGF-β est une cytokine ayant pour rôle la modulation de la réponse immunitaire en influençant le développement, la différenciation, l'induction de tolérance et l'homéostasie des cellules responsables de l’immunité [92]. Elle est sécrétée par toutes les lignées leucocytaires et retrouvée en grande concentration in
et à la régulation immunitaire [94]. En effet, dans un modèle murin d’asthme, des chercheurs ont démontré que le TGF-β avait cette fonction clé de facteur pro-migratoire et qu’il participait activement au recrutement des CSM vers les voies respiratoires inflammées [95]. En plus de participer au recrutement des CSM vers les sites inflammatoires, il a été démontré que le TGF-β est également une cytokine sécrétée par les CSM isolées de plusieurs tissus, dont la gelée de Wharton. En effet, une fois que les CSM atteignent leur tissu cible et qu’elles sont activées par des médiateurs inflammatoires, la sécrétion de cytokines immunosuppressives par les CSM, dont le TGF-β fait partie, est significativement augmentée [96, 97]. Le TGF-β sécrété par les CSM contribue à la modulation de l'activité des lymphocytes T en participant au recrutement des Treg et en diminuant la cytotoxicité des cellules NK [98]. Certains chercheurs ont décrit la sécrétion du TGF-β par les CSM comme étant essentielle à l’inhibition de la prolifération lymphocytaire induite in vitro par des mitogènes [99]. En effet, lorsque des anti-TGF-β et anti- facteur de croissance des hépatocytes (HGF) étaient ajoutés dans leur modèle d’activation lymphocytaire, la prolifération des lymphocytes T pouvait être restaurée à des valeurs comparables à celles détectées en l'absence de CSM [99]. Cependant, la neutralisation de chaque facteur séparément a entraîné une restauration partielle de la prolifération des lymphocytes T, excluant que le TGF-β soit le seul responsable de la suppression induite par les CSM [99].
PGE2
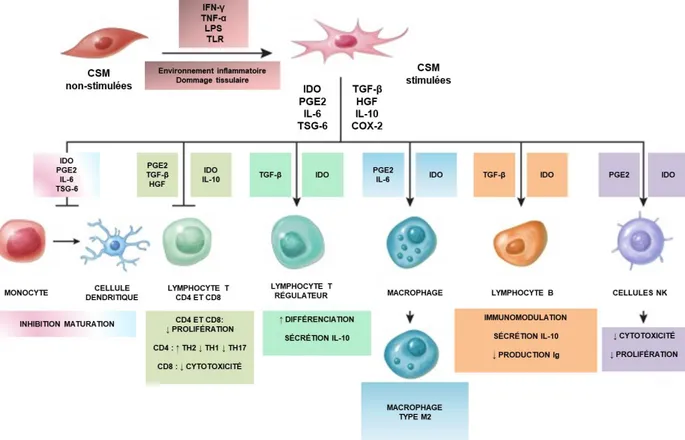
Les prostaglandines sont de petites molécules dérivées d’acides gras polyinsaturés et appartiennent à la superfamille des eicosanoïdes. Parmi celles-ci, la PGE2, une prostaglandine dont la biosynthèse est régulée par deux enzymes cyclooxygénases (COX-1 et COX-2), est la plus abondante du corps humain [100]. Ces molécules agissent localement de façon autocrine et/ou paracrine et sont considérées comme des médiateurs pro-inflammatoires ou anti-inflammatoires selon la nature de la molécule et du récepteur activé, et le contexte cellulaire [100]. Contrairement à IDO et au TGF-β, la PGE2 est sécrétée de façon constitutive par les CSM [101]. En présence d’IFN-γ, du facteur de nécrose tumorale-alpha (TNF-α) ou d’IL-1β, une augmentation de l’expression de COX-2 et de la sécrétion de PGE2 par les CSM ont été démontrées [102]. In vitro, la PGE2 serait majoritairement responsable d’une inhibition de la maturation des DC, lesquelles diminuent leur sécrétion d’IL-12, augmentent leur sécrétion d’IL-10 et perdent leur capacité à activer la prolifération lymphocytaire [103]. Dans cette étude, l’ajout d’un inhibiteur de COX-2 permettait de restaurer la fonctionnalité des DC [103]. D’autres facteurs solubles sont également impliqués dans l’activité anti-inflammatoire des CSM. Un bref aperçu des facteurs solubles sécrétés par les CSM et classés selon leur fonction est fourni à la Figure 2.
Figure 2 : Rôle des facteurs solubles dans l'immunomodulation médiée par les CSM.
Inspirée de Lee et al., Cellular Immunology, 2018 [104].
1.4.3.4 Contact cellule-cellule
La nécessité d’un contact cellule-cellule dans l’établissement d’une suppression de la réponse immune par les CSM a longtemps été controversée. En effet, alors que certains chercheurs ont démontré que les CSM agissaient par la seule intermédiaire de facteurs solubles [105], d’autres soutiennent que le contact est nécessaire à l’inhibition de la prolifération lymphocytaire [106-108]. Parmi les molécules d’adhésion proposées comme étant au cœur des effets des CSM, voyons plus en détail la voie impliquant l’interaction du récepteur de mort cellulaire programmée-1 (PD-1) avec son ligand (PD-L1).
PD1-PDL1
Le récepteur PD-1 est exprimé à la surface des lymphocytes T activés. Ses ligands, PD-L1 et PD-L2, sont exprimés à la surface des DC ou des macrophages. PD-1 et PD-L1/PD-L2 appartiennent à la famille des protéines du point de contrôle immunitaire et agissent en limitant le développement de la réponse des
entre lymphocyte T/CSM avaient un rôle dans l'inhibition par les CSM de la prolifération des lymphocytes T et dans la modulation de leurs fonctions effectrices [110]. Plus récemment, une étude a permis de démontrer que les CSM sont également capables de sécréter des molécules PD-1 et que ces facteurs solubles joueraient un rôle important dans la modulation du comportement des lymphocytes T et dans l’induction de la tolérance périphérique [111].
1.4.3.5 Les vésicules extracellulaires
Les vésicules extracellulaires (VE) ont été observées pour la première fois dans le plasma il y a un peu plus de 50 ans [112]. Initialement décrites comme des déchets cellulaires [112], il est aujourd’hui reconnu qu’elles jouent un rôle essentiel dans la communication intercellulaire [113]. Les VE proviennent des cellules de divers tissus de l’organisme et circulent dans les fluides biologiques tels le sang, le liquide céphalo-rachidien, la salive, l’urine, le lait maternel et le liquide amniotique [114]. Elles sont d’un grand intérêt en recherche depuis quelques années puisqu’elles ont le potentiel d’influencer les cellules cibles par le biais d'interactions avec les récepteurs de surface et le transfert de protéines, d'acide ribonucléique (ARN) messager (ARNm) et de microARN [115]. La diversité du contenu des VE dépend de leur cellule d'origine et peut être influencée par un stress physiologique ou d'autres conditions telles que le cancer, les maladies inflammatoires et les maladies auto-immunes [115, 116]. Les VE sont libérées par plusieurs types de cellules, y compris les CSM [117]. En effet, plus de 150 microARN [118] et plus de 850 protéines [119] ont été identifiés dans les VE dérivées des CSM.
Il existe trois types de VE qui diffèrent selon leur taille, leur biogenèse et leurs fonctions, soit les corps apoptotiques, les microvésicules (MV) et les exosomes [113]. Les corps apoptotiques, libérés par les cellules en apoptose, ont une taille comprise entre 800 nm et 5 μm de diamètre et contiennent des débris cellulaires, des organites et de l’acide désoxyribonucléique (ADN) fragmenté. Les MV proviennent du bourgeonnement de la membrane plasmique et possèdent des tailles hétérogènes comprises entre 100 et 1000 nm. Les exosomes sont de petites vésicules de 30 à 200 nm de diamètre dérivant de la voie endosomale [113]. Bien que le terme exosome soit réservé à la fraction de VE générées par la voie endosomale, il demeure difficile de prouver hors de tout doute l’origine exacte des VE à moins d’avoir recours à des techniques d’imagerie qui permettent une visualisation en temps réel de la biogénèse et de l’excrétion des VE par les cellules [120]. De plus, il n’y a aucun consensus actuellement sur l’utilisation de marqueurs qui permettent de distinguer les trois types de VE et les techniques d’isolation varient énormément d’une étude à l’autre [120]. Dans cette section, les termes utilisés pour désigner les VE isolées des CSM sont ceux utilisés par les auteurs dans les études citées.
Les activités immunosuppressives des exosomes dérivés des CSM seraient principalement liées à leur capacité à réduire les niveaux de cytokines pro-inflammatoires, telles que l’IL-1β et le TNF-α, et à augmenter ceux du
TGF-β [121]. Dans un modèle animal de la maladie inflammatoire de l’intestin, une étude a montré que le traitement avec des exosomes dérivés de CSM pouvait atténuer la sévérité de la maladie via l'induction de l'IL‐ 10 et la suppression de l'IL‐1β, de l’IL‐6 et du TNF-α dans le côlon [122].
Dans un modèle porcin d’infarctus du myocarde induit par la ligature temporaire de l’artère circonflexe gauche proximale, il a été démontré que l’injection du milieu conditionné de CSM avait le même potentiel cardioprotecteur que l’injection de CSM et qu’elle permettait de diminuer de 60% la taille de l'infarctus [123]. Dans cette même étude, les auteurs ont démontré que l'effet cardioprotecteur était médié par les vésicules mesurant entre 100 et 220 nm contenues dans ce milieu [123].
Quelques études sur des modèles animaux ont également été faites dans le but de comparer le potentiel des CSM avec le potentiel des exosomes dans le traitement des lésions rénales induites par une ischémie temporaire. Parmi celles-ci, mentionnons celle de He et al. où les auteurs ont démontré que des souris traitées avec des CSM ou avec des exosomes provenant d’un milieu conditionné présentaient des avantages étonnamment similaires, notamment une réduction de la fibrose et de l'infiltration des lymphocytes interstitiels ainsi qu’une réduction de l’atrophie tubulaire par rapport au groupe témoin non traité [124]. Des effets protecteurs sur la fonction rénale ont également été rapportés chez des rats traités avec des CSM ou avec des exosomes isolées de CSM avant de subir des lésions rénales ischémiques [125]. Les auteurs ont également rapporté que l'effet protecteur était spécifique aux exosomes isolées des CSM et que les exosomes isolées de fibroblastes n’avaient pas ce pouvoir protecteur [125].
L’utilisation d'exosomes de CSM dans un modèle murin de GVH aiguë a permis de prolonger la survie du groupe traité par rapport au groupe témoin non traité [126, 127]. Une prolifération lymphocytaire plus faible et des concentrations moins importantes de cytokines pro-inflammatoires (IL-2, TNF-α et IFN-γ) ont été mesurées chez les souris traitées par des exosomes de CSM [126, 127]. Fait intéressant, des exosomes de CSM extraites de la moelle osseuse ont été prescrites pour un usage compassionnel à un patient souffrant de GVH sévère et résistante au traitement de première intention [128]. Les symptômes du patient ont été significativement améliorés et les doses de corticostéroïdes ont été réduites [128]. Le patient est demeuré dans un état stable pendant des mois et est malheureusement décédé des suites d’une pneumonie [128].
Les exosomes de CSM ont également un effet anti-inflammatoire bénéfique dans la prise en charge du syndrome de détresse respiratoire aiguë retrouvé chez certains patients atteints de la maladie à coronavirus 2019 (COVID-19) [129]. En effet, dans une étude menée en avril 2020 aux États-Unis, 24 patients atteints de COVID-19 sévère ont reçu une dose d'ExoFlo TM (Direct Biologics, Saint-Louis, MO, États-Unis), un produit à