Quantification en thérapie radionucléique par
radiopeptides au 177 Lu
Thèse
Andrea Frezza
Doctorat en physique
Philosophiæ doctor (Ph. D.)
Québec, Canada
Quantification en thérapie radionucléique par
radiopeptides au
177Lu
Thèse
Andrea Frezza
Sous la direction de:
Philippe Després, directeur de recherche Jean-Mathieu Beauregard, codirecteur de recherche
Résumé
Le présent travail de thèse concerne la quantification en imagerie moléculaire en trois dimensions (3D), en particulier, dans le cadre de la thérapie radionucléique par radiopeptides (TRRP) au
177Lu pour les tumeurs neuroendocrines (TNE). Le177Lu est un radioisotope émetteur beta, à
courte portée dans les tissus (2 mm), et gamma, avec des énergies utilisables pour l’imagerie de tomographie par émission mono-photonique (TEM). Ces caractéristiques font de celui-ci un bon radioisotope pour la TRRP des TNE : de petite taille et répandues dans le corps. De plus, avec plusieurs images de TEM prises lors d’un traitement, il est possible de quantifier la distribution du radioisotope dans le corps du patient et même d’évaluer la progression du traitement.
L’objectif principal du projet est le développement et la validation des outils, expérimentaux et informatiques, pour la quantification de la dose absorbée lors d’une TRRP au 177Lu, avec
la possibilité d’étendre les méthodes à d’autres radioisotopes. Deux étapes principales ont été nécessaires. La première était la calibration et la caractérisation de l’appareil d’imagerie de TEM. Dans ce contexte, plusieurs techniques d’acquisitions et d’analyse ont été testées et un protocole de calibration simplifié a été proposé. Un accent particulier est mis sur la détermination du facteur de calibration (CF) et du temps mort (τ) de l’appareil de TEM pour la correction et la quantification des images acquises. D’une évaluation de l’équation qui gouverne le comportement de détection de l’appareil de TEM, une nouvelle formulation plus concise et analysable mathématiquement a été proposée. Celle-ci permet l’extraction des deux facteurs de façon approximative, mais simple ainsi que la proposition d’un nouveau protocole de calibration.
Avec des images bien quantifiées en activité (biodistribution du radiopeptide dans le corps), il est possible, par simulations Monte Carlo (MC), de calculer le dépôt de dose. Une deuxième étape a été la validation du code irtGPUMCD. Il s’agit d’un code MC, fonctionnant sur processeur graphique (GPU), pour le calcul de la dose absorbée lors d’une TRRP et précédemment développé au sein du Groupe de recherche en physique médicale du CHU de Québec - Université Laval. Le code irtGPUMCD a été adapté pour l’utilisation dans des conditions standard et validé sur les modèles informatiques de la International Commission on Radiological Protection (ICRP110), non seulement pour le177Lu, mais aussi pour le131I et99mTc. Avec les simulations
exécutées sur une géométrie de référence et une comparaison avec d’autres résultats présents en littérature, le code a été validé. Dans le cadre de l’optimisation en termes de temps et exactitude des résultats fournis par irtGPUMCD, un algorithme de traçage de rayons (raytracing) ainsi qu’une technique de réduction de variance ont été implémentés, testés et validés. Ces changements de code ont permis une réduction d’un facteur dix du temps de calcul pour une simulation.
Les images/cartes de dose absorbée tridimensionnelle bien quantifiées donnent la possibilité de calculer les histogrammes dose-volume (DVH) et d’extraire toutes les informations dosimétriques intéressantes tel que fait dans d’autres branches de la radiothérapie. Une petite section de cette thèse est consacrée à la proposition de techniques statistiques, qui permettent, en associant les données dosimétriques avec celles du patient, de construire des modèles de probabilité de complication des tissus normaux (NTCP).
Le principal impact de cette étude est l’introduction de toute une chaîne, bien validée, pour la quantification dans les TRRP. Avec une calibration adéquate de l’appareil d’imagerie de TEM et l’utilisation du code MC irtGPUMCD, il sera possible d’effectuer des études dosimétriques et statistiques plus avancées, par rapport à l’état de l’art en médicine nucléaire, et se diriger vers une personnalisation plus poussée des traitements.
Abstract
The present thesis work concerns quantification in three-dimensional molecular imaging (3D), in particular, in the context of peptide receptor radionuclide therapy (PRRT) with 177Lufor
neuroendocrine tumors (NET). The 177Luis a beta emitting radioisotope, with short-range
in tissue (2 mm), and gamma, with energies usable for single-photon emission computed tomography (SPECT) imaging. These characteristics make 177Lua good radioisotope for the
PRRT of NETs: small and widespread in the body. In addition, with several SPECT images taken during a treatment, it is possible to quantify the distribution of the radioisotope in the patient body and assess the progress of the treatment itself.
The main objective of the project is the development and validation of tools, experimental and computational, for the absorbed dose quantification during a177LuPRRT, with the possibility
to extend the methods to other radioisotopes. Two main steps were necessary. The first step was the calibration and characterization of the SPECT imaging device. In this context, several acquisition and analysis techniques were tested and a simple calibration protocol was proposed. Particular emphasis is given to the determination of the calibration factor (CF) and dead time (τ) constant of the SPECT device for the correction and quantification of the acquired images. From an evaluation of the equation describing the behavior of the SPECT system, a new, more concise and mathematically tractable formulation has been proposed. This formulation allows the extraction of the two factors in an approximate but simple way as well as the proposal of a new calibration protocol.
With well-quantified images in activity (bio-distribution of the radio-peptide in the body) it is possible to calculate the dose deposition by Monte Carlo simulations (MC). A second step was the validation of the irtGPUMCD code. It is a MC code, operating on a graphics processing unit (GPU), previously developed within the Research Group in Medical Physics of the CHU de Québec, which allows the calculation of the absorbed dose received during a PRRT. The irtGPUMCD code has been used and validated under standard conditions with International Commission on Radiological Protection (ICRP110) phantoms, not only for the177Lu, but also for the 131I and99mT c. With the simulations performed on a referenced geometry and with a
comparison to other results present in literature, the code was validated. In the context of the optimization in time and accuracy of the results provided by irtGPUMCD, a new raytracing
algorithm and a variance reduction technique were introduced, tested and validated. These code changes have led to a reduction in execution time of a factor ten for a simulations. The well quantified three-dimensional absorbed dose images/maps give the possibility of calculating dose-volume histograms (DVH) and extracting all the dosimetric information of interest as done in other branches of radiotherapy. A small part of this thesis is dedicated to the proposal of statistical techniques, which allow, by linking the dosimetric data with patient outcomes, to build models of normal tissues complication probability (NTCP).
The main impact of this study is the introduction of a whole chain, well validated, for the quantification in PRRT. With an accurate calibration of the SPECT imaging system and the use of the irtGPUMCD MC code, it will be possible to carry out more advanced dosimetric and statistical studies, compared to the state of the art in nuclear medicine, and to head towards a more personalized treatment.
Table des matières
Résumé iii
Abstract v
Table des matières vii
Liste des tableaux x
Liste des figures xi
Liste des symboles xiii
Remerciements xvii Avant-propos xix Introduction 1 0.1 Principes physiques . . . 6 0.1.1 Désintégration radioactive . . . 6 0.1.2 Types de rayonnement . . . 6 0.1.3 Rayonnement beta . . . 7
0.1.4 Interaction électrons matière . . . 9
0.1.5 Rayonnement gamma . . . 11
0.1.6 Interaction photons matière . . . 11
Effet photoélectrique . . . 11
Effet Compton . . . 13
Effet Rayleigh. . . 14
0.1.7 Atténuation des photons . . . 14
0.1.8 Dose . . . 15 0.2 Principes de la TRRP . . . 15 0.2.1 Peptide pour la TRRP . . . 16 0.2.2 Radiopeptides. . . 16 0.3 TRRP avec le 177Lu-octréotate . . . . 17 0.3.1 Choix du177Lu . . . . 17 0.3.2 Production du177Lu . . . . 18 0.3.3 TRRP au CHU de Québec . . . 18
1 Imagerie TEM quantitative en TRRP au 177Lu 20 1.1 Tomographie d’émission mono-photonique (TEM). . . 21
1.1.1 Caméra gamma . . . 22 1.1.2 Événement enregistré . . . 25 1.2 Tomodensitométrie (TDM) . . . 27 1.3 Reconstruction tomographique . . . 28 1.4 TEM/TDM . . . 29 1.4.1 Recalage d’images . . . 31 1.5 Quantification en TEM . . . 32
1.5.1 Correction atténuation et diffusé . . . 32
1.5.2 Sensibilité (S), facteur de calibration (CF) et temps mort (TM) . . . 34
1.5.3 Images quantitatives . . . 38
2 Monte Carlo sur GPU et irtGPUMCD 40 2.1 Principes du Monte Carlo (MC). . . 41
2.2 Le Monte Carlo pour le calcul de la dose . . . 41
2.3 MC en médecine nucléaire : histoire, développement et utilisation . . . 42
2.4 Monte Carlo sur GPU . . . 44
2.4.1 Matériel . . . 45
2.4.2 Exécution . . . 47
2.4.3 Codes MC sur GPU . . . 47
2.4.4 GPUMCD. . . 48
2.4.5 Déroulement d’une simulation . . . 49
2.5 irtGPUMCD . . . 50 2.5.1 Électrons et β- . . . . 51 2.5.2 Photons . . . 51 2.6 Validation irtGPUMCD . . . 54 2.7 Évaluation de la dose. . . 55 2.7.1 Dose cumulative . . . 55
2.7.2 DVH, S-values et index dosimétriques . . . 57
3 Comprehensive SPECT/CT system characterization and calibration for 177Lu quantitative SPECT (QSPECT) with dead time correction 60 3.1 Résumé . . . 60
3.2 Abstract . . . 62
3.3 Background . . . 63
3.4 Materials and Methods. . . 64
3.4.1 SPECT/CT system . . . 64
3.4.2 Energy windows . . . 64
3.4.3 Phantoms . . . 65
3.4.4 Acquisitions and reconstruction . . . 67
3.4.5 Segmentation . . . 69
3.4.6 Camera calibration factor and dead time constant . . . 69
3.4.7 Accuracy . . . 71
3.5 Results. . . 71
3.5.1 Planar-derived calibration factor and dead-time constant . . . 71
3.5.2 Tomographic-derived calibration factor and dead-time constant . . . 73
3.5.3 Segmentation . . . 76
3.5.4 Impact of the width of wide-spectrum window and scatter correction method . . . 77
3.6 Discussion . . . 78
3.7 Conclusion . . . 84
4 Validation of irtGPUMCD, a GPU-based Monte Carlo internal dosi-metry framework for radionuclide therapy 85 4.1 Résumé . . . 85
4.2 Abstract . . . 86
4.3 Purpose . . . 87
4.4 Materials and Methods. . . 88
4.4.1 Benchmarking geometry . . . 88
4.4.2 irtGPUMCD setup . . . 88
4.4.3 Simulations setup. . . 90
4.4.4 Linear and exponential Track Length Estimator (TLElin, TLEexp) . 91 4.4.5 Dosimetric parameters : S-values and DVH . . . 92
4.4.6 Uncertainty . . . 93
4.4.7 Execution time . . . 93
4.5 Results. . . 95
4.5.1 S-values comparison between irtGPUMCD and IDAC-DOSE . . . . 95
4.5.2 DVH comparison with GATE . . . 95
4.5.3 Uncertainty . . . 97 4.5.4 Execution time . . . 97 4.6 Discussion . . . 97 4.6.1 S-values and DVHs . . . 97 4.6.2 Uncertainty . . . 101 4.6.3 Execution time . . . 101 4.7 Conclusion . . . 101 Conclusion 103 A Nouvelle formulation de l’équation paralysable pour les contrôles de qualité en TEM quantitative 108 A.1 Développement mathématique. . . 108
A.2 Validation de la nouvelle formulation avec des mesures expérimentales . . . 112
A.3 Protocole planaire par régression linéaire . . . 114
B Protocoles de mesure avec hautes activités et radioprotection 117 B.1 Matériels . . . 118
B.2 Activité, remplissage et positionnement des fantômes . . . 118
B.3 Aspects de radioprotection. . . 119
C Modèles logistiques et guidées par les données 122
Liste des tableaux
0.1 Énergies et probabilités de désintégration du 177Lu.. . . . 7
1.1 Propriétés de certains matériaux scintillateurs utilisés en médecine nucléaire . . 24
3.1 Energy window settings . . . 64
3.2 Ranges of activity and count rates, per phantom . . . 68
3.3 Calibration factor and dead-time constant derived from planar images . . . 74
3.4 Calibration factor and dead-time constant derived from SPECT data . . . 77
3.5 Camera calibration factor and dead-time constant (± SE) derived from segmented SPECT images . . . 80
3.6 Camera calibration factor and dead-time constant derived using a reduced wide-spectrum window width . . . 82
4.1 List of selected structures and organs for ICRP adult phantoms . . . 89
4.2 Image characteristics of the ICRP adult phantoms and patient study . . . 89
4.3 ICRP107 [1] energies and branching ratios for 177Lu,99mT cand 131I . . . . 91
4.4 Total simulation and kernel calculation times (108 primaries) for irtGPUMCD . 100 A.1 Activités à utiliser lors d’un contrôle de qualité avec méthode linéaire. . . 115
Liste des figures
0.1 Étapes nécessaires pour la quantification lors d’une TRRP au 177Lu. . . . . 4
0.2 Diagramme (N,Z) de Segré . . . 8
0.3 Exemple de spectre d’énergie pour les particules β− (émis par le 14C) . . . . . 9
0.4 Types d’interactions des particules chargées . . . 10
0.5 Dominance des interactions photons/matière et coefficients d’atténuation massique 12 0.6 Schéma de l’effet photoélectrique . . . 12
0.7 Schéma effet Compton . . . 13
0.8 Schéma effet Rayleigh . . . 14
0.9 Composition chimique du 177Lu-octréotate. . . . 17
1.1 Example acquisition TEM d’un patient après injection du 177Lu-octréotate . . 22
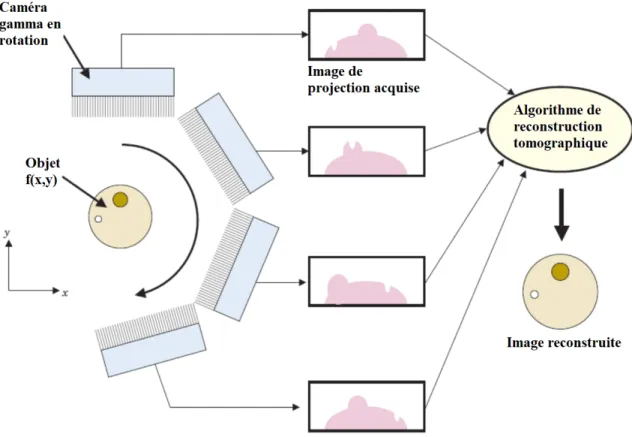
1.2 Schéma d’une acquisition tomographique par TEM . . . 23
1.3 Schéma composants et image de l’intérieur d’une gamma caméra . . . 26
1.4 Types d’événements détectés par une caméra gamma . . . 27
1.5 Schéma d’une acquisition tomographique par TDM . . . 28
1.6 Schéma d’acquisition des projection et reconstruction topographique par TEM 30 1.7 Image de l’appareil TEM/TDM Symbia T6, Siemens (Munich, Allemagne). . . 31
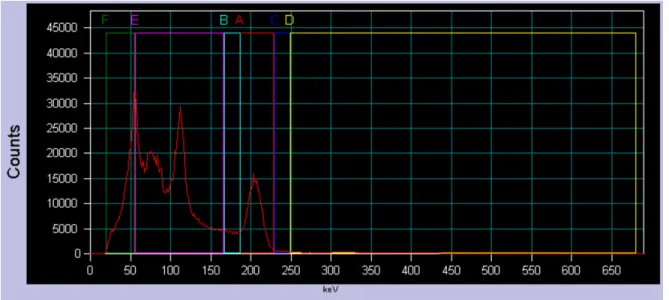
1.8 Spectre et fenêtres énergétiques définies avec l’appareil de TEM . . . 33
1.9 Schéma signaux d’un système paralysable et un non-paralysable . . . 36
1.10 Courbes de taux de comptage pour les systèmes paralysables et non paralysables 36 1.11 Courbe des taux de comptage mesurés pour une caméra gamma Symbia . . . . 37
2.1 Composition d’un multi-processeur (SM) . . . 46
2.2 Interface graphique irtGPUMCD. . . 50
2.3 Exemple de courbe bi-exponentielle du débit de dose en fonction du temps . . . 56
2.4 Exemple d’histogrammes dose-volume . . . 57
3.1 177Luenergy spectrum acquired. . . . 65
3.2 Schema and picture of capillary sources disposition for planar acquisitions . . . 67
3.3 Schema and picture of cylindrical phantoms used in SPECT acquisitions . . . . 67
3.4 Planar sensitivity vs. activity, photopeak or wide-spectrum count rate . . . 72
3.5 Observed primary photons count rate vs. activity for planar acquisitions . . . . 72
3.6 Observed photopeak and wide-spectrum count rates vs. XW for planar acquisitions 73 3.7 Dead-time-corrected planar sensitivity vs. activity, photopeak or wide-spectrum count rate . . . 74
3.8 SPECT sensitivity vs. activity, photopeak and wide-spectrum count rate . . . . 75
3.10 Dead-time-corrected SPECT sensitivity vs. activity, photopeak and wide-spectrum
count rate . . . 78
3.11 Artefacts on SPECT images . . . 79
3.12 Dead-time-corrected SPECT sensitivity vs.wide-spectrum count for segmented
images . . . 81
3.13 Accuracy of recovered activity using phantom-specific calibration factor and
dead-time constant . . . 81
3.14 Accuracy of recovered activity using calibration factor and dead-time constant
derived from planar data. . . 83
4.1 Gammas S-value relative differences between irtGPUMCD and IDAC-DOSE for
adult ICRP phantoms . . . 94
4.2 Electrons S-value relative differences between irtGPUMCD and IDAC-DOSE
for adult ICRP110 female phantom . . . 95
4.3 Gamma dose volume histograms of twelve target organs of ICRP110 adult female
phantom (liver as organ source) . . . 96
4.4 Dose volume histograms of kidneys in clinical patient acquisition . . . 97
4.5 Uncertainty distributions for twelve target organs of ICRP110 adult female
phantom. . . 98
4.6 Uncertainty map GATE and irtGPUMCD while liver is the source organ . . . . 99
A.1 Graphique représentant la fonction paralysable reformulé. . . 110
A.2 Graphique des acquisitions planaires avec régression non-linéaire et linéaire . . 113
A.3 Graphique des acquisitions de la mire Jaszczak avec régression non-linéaire et
linéaire . . . 114
B.1 Image du scellage d’un capillaire avec de la cire et source radioactive complète. 120
B.2 Résultat du débit de dose obtenu avec RadProCalculator. . . 121
Liste des symboles
AF Adult Female AM Adult Male
CAN Convertisseur Analogique-Numérique CCSN Commission canadienne de sûreté nucléaire CF Calibration Factor
CNRC Conseil national de recherches du canada CPU Central Prossessing Unit
CTDI Computed Tomography Dose Index DEW Double Energy Window
DICOM Digital Imaging and COmmunications in Medicine DVH Dose Volume Histogram
EBRT External Beam Radiotherapy
ELP - TLE Estimateur de longueur de parcours - Track Length Estimator EM Expectation-Maximization
FBP Filtered Back Projection
FTM Facteur de correction de temps mort GPU Graphics Processing Unit
GRPM Groupe de recherche en physique médicale
ICRP International Commission on Radiological Protection
IRM - MRI Imagerie par résonance magnétique - Magnetic Resonance Imaging irtGPUMCD internal radiotherapy GPU Monte Carlo Dose
MIRD Medical Internal Radiation Dose ML Maximum Likelihood
MN - NM Médecine nucléaire - Nuclear Medicine
NIST National Institute of Standards and Technology NTCP Normal Tissue Complication Probability
OS Ordered Subsets PM Photomultiplicateur
QTEM - QSPECT Quantitative TEM - Quantitative SPECT ROI Region Of Interest
RSST Récepteur de la somatostatine SIMD Single Instruction Multiple Data SM Streaming Multiprocessor SUV Standardized Uptake Value S Sensibilité
TCP Tumor Control Probability
TDM - CT Tomodensitométrie - Computed Tomography
TEM - SPECT Tomographie d’émission mono-photonique - Single Photon Emission Computed Tomography
TEP - PET Tomographie par émission de positron - Positron Emission Tomography TEW Triple Energy Window
TM - DT Temps mort - Dead Time
TNE - NET Tumeurs neuroendocrines - NeuroEndocrine Tumors
TRRP - PRRT Thérapie radionucléique par radiopeptide - Peptide Receptor Radionu-clide Therapy
À mes parents et à tous ceux qui ont cru en moi
Dicette o pappice vicino a’ noce, ramm’ o tiemp’ ca te spertose. (proverbe napolitain)
Remerciements
Un travail de thèse surtout loin de son pays, loin de la famille et des amis d’enfance (et de la bonne bouffe) n’est jamais un parcours simple. Un doctorat te met face à toi-même et ce n’est jamais facile de regarder dans ce miroir. Tout au long de ce chemin plusieurs personnes contribuent à te former, t’aider, te faire sourire comme te faire souffrir et grandir en même temps. Il est possible de comparer un travail de thèse à un parcours de vie résumé ou du moins c’est comme ça que je l’ai vécu. Dans ce parcours, en essayant de n’oublier personne, j’aimerais citer certains des personnages principales avec leur contribution. J’introduirai chaque personne avec un « je me souviens » (hommage au Québec) qui vaut pour un « je remercie » car ces remerciements c’est pour vous/eux mais aussi pour moi et mes souvenirs.
In primis, je me souviens de mon directeur Philippe Després pour m’avoir accepté comme étudiant dans un projet entre deux mondes : la physique médicale et la médecine nucléaire. C’est par lui que j’ai appris beaucoup sur le monde de la recherche et sur les difficultés que cela comporte ainsi que sur les satisfactions. En même temps, je me souviens de Jean-Mathieu Beauregard, mon codirecteur, pour m’avoir transmis la cure du détail et pour les discussions sur le côté expérimental de mon projet. Encore, du côté de la physique médicale, je me souviens de Nicolas Varfalvy pour m’avoir montré la passion pour ce type de profession ainsi que Carl Coté, un des meilleurs professionnels que j’ai rencontré dans ma vie et également pour m’avoir donné la chance de travailler en clinique en plus de mon doctorat. Du coté étudiants, je me souviens du temps passé ensemble et des expériences partagées avec tous ceux qui sont passés pour le GRPM dans ces années. En particulier, je me souviens de Romain Espagnet et Ophélie Piron avec leurs familles respectives : des collègues, des amis et presque comme un frère et une sœur. Je me souviens de Corentin Desport (alias le stagiaire) et des séances de « bronzage », comme il disait, en médecine nucléaire suivi d’une bonne bière québécoise. Aussi, je me souviens des moments de pause dédiés aux discussions scientifiques devant une bonne tasse de café (napolitain bien sûr, qui fait des miracles pour la science) avec Daniel Maneval, Reza Moosavi Askari et Charles Joachim Paquet. D’un autre côté, je me souviens de Jonathan Boivin et le BBQ/pizzas fais chez lui ou chez moi avec discussions sur la vie et la physique médicale. Je me souviens de Maude Demers (alias l’Auvergnate) qui m’a accueilli dans sa vie quand dans la mienne « il faisait froid » et avec qui j’ai rejoint des niveaux de discussion et une connexion incroyable qui restera.
Ed ora dal lato italiano. Vorrei ringraziare innanzitutto i miei genitori, primi supporter e presenti costantemente ; credo che per questa mia esperienza, tra tutte le difficoltà, siano cresciuti anche loro ed il nostro rapporto. Vorrei ringraziare tutti i componenti della famiglia, mia nonna in primis che non si è mai dimenticata del suo nipote « preferito » ed ancora finge (credendo che io mi offenda) di non aver cucinato gli gnocchi per cinque anni perché io non c’ero. Vorrei ringraziare le mie zie Olga, Stella e Luisa così come mia cugina Antonella per tutto l’appoggio che mi hanno sempre dato. In seguito, vorrei ringraziare il mio migliore amico/fratello, Emanuele Sclafani, una costante nella mia vita quotidiana che anche a distanza mi ha tenuto compagnia, mi ha sempre supportato, criticato costruttivamente ed aiutato. Vorrei ringraziare Caterina, la mia confidente più cara con la quale sono cresciuto e che nei momenti difficili era sempre presente. Purtroppo, nonostante questi siano dei ringraziamenti, ci sono persone che non citerò e che hanno contribuito inevitabilmente al mio percorso e non sempre positivamente ma che comunque non dimenticherò.
Avant-propos
Les résultats présentés dans ce manuscrit sont issus de mes travaux de doctorat réalisés au cours des dernières années au sein du Groupe de recherche en physique médicale du CHU de Québec - Université Laval sous la direction du professeur Philippe Després et la codirection du Dr
Jean-Mathieu Beauregard. Ces travaux ont mené à deux publications et les informations relatives aux coauteurs et leurs contributions aux documents ainsi que sur l’état de ces publications sont fournis ci-après.
Chapitre 3 : Comprehensive SPECT/CT system characterization and calibration for177Lu QSPECT with dead time correction
Andrea Frezza1,2,3, Corentin Desport1,2,3, Carlos Uribe4, Wei Zhao4, Anna Celler4, Philippe
Després1,2,3,5 and Jean-Mathieu Beauregard1,3,6,7
1Cancer Research Center, Université Laval, Quebec City, QC, Canada
2Department of Physics, Engineering Physics and Optics, Université Laval, Quebec City, QC,
Canada
3Oncology Division, CHU de Québec – Université Laval Research Center, Quebec City, QC,
Canada 4Medical Imaging Research Group, Department of Radiology, University of British Columbia, Vancouver, BC, Canada
5Department of Radiation Oncology, CHU de Québec – Université Laval, Quebec City, QC,
Canada
6Department of Radiology and Nuclear Medicine, Université Laval, Quebec City, QC, Canada 7Department of Medical Imaging, CHU de Québec – Université Laval, Quebec City, QC, Canada
État : Cet article a été soumis le 29 août 2019 et accepté pour publication dans le journal European Journal of Nuclear Medicine and Molecular Imaging (EJNMMI Physics) en date du 26 janvier 2020. Il a été publié en ligne en date du 14 février 2020 avec le DOI suivant 10.1186/s40658-020-0275-6.
Contributions : Pour cet article, j’ai participé à la conception de l’étude, j’ai développé les méthodes et les protocoles de mesures. J’ai également effectué les mesures, analysé les
résultats et accompli la rédaction de l’article. Jean-Mathieu Beauregard a également participé à la conception de l’étude et il a supervisé le projet, analysé les données et édité le manuscrit. Corentin Desport a participé à la collection et l’analyse d’une partie des données. Philippe Després, Anna Celler, Carlos Uribe et Wei Zhao ont participé à la conception de l’étude. Tous les coauteurs ont participé à l’élaboration du plan de recherche, à l’analyse des résultats et ont pris part à la révision du manuscrit.
Chapitre 4 : Validation of irtGPUMCD, a GPU-based Monte Carlo internal dosimetry framework for radionuclide therapy
Andrea Frezza1, Charles Joachim Paquet1, Maxime Chauvin2 and Philippe Després1,3
1Department of Physics, Engineering Physics and Optics and Cancer Research Center,
Univer-sité Laval, Quebec City QC, G1V 0A6 Canada.
2CRCT, UMR 1037, Inserm, Université Toulouse III Paul Sabatier, Toulouse, France
3Department of Radiation Oncology and Research Center of CHU de Québec - Université Laval,
Quebec City, QC, G1R 2J6 Canada.
État : Cet article a été soumis le 31 octobre 2019 et accepté pour publication dans le journal Physica Medica en date du 12 avril 2020. Il a été publié en ligne en date du 22 avril 2020 avec le DOI suivant 10.1016/j.ejmp.2020.04.010.
Contributions : Pour cet article, j’ai développé les méthodes et les protocoles de mesures. J’ai également effectué les mesures, analysé les résultats et accompli la rédaction de l’article. Philippe Després a également participé à la conception de l’étude, a supervisé le projet et a édité le manuscrit. Charles Joachim Paquet a participé à la modification et conception du code (irtGPUMCD). Maxime Chauvin a partagé les données produites avec GATE. Tous les coauteurs ont participé à l’élaboration du plan de recherche, à l’analyse des résultats et ont pris part à la révision du manuscrit.
Introduction
Mise en contexte
La plupart des patients atteints de cancer sont traités grâce à des modalités thérapeutiques traditionnelles : la chirurgie, la radiothérapie externe et la chimiothérapie. Pourtant, ces types de thérapies échouent pour un grand pourcentage de patients (un tiers en considérant tous les types de cancer) [2,3]. En effet, pour certains types de pathologies, il est encore difficile d’identifier tous les sites de développement de la maladie ce qui est d’autant plus vrai dans les cas de développement de métastases.
En médecine nucléaire, la tomographie d’émission mono-photonique (TEM) et la tomographie par émission de positron (TEP) sont deux techniques d’imagerie très répandues (en plus de la scintigraphie). Ces techniques permettent d’enrichir substantiellement l’information de nature anatomique issue d’autres modalités d’imagerie (e.g. la tomodensitométrie (TDM) et l’imagerie par résonance magnétique (IRM)). Elles offrent la possibilité de mettre en lumière les processus biologiques dans le diagnostic, dans la planification des traitements et dans l’évaluation de la réponse thérapeutique de certains cancers. Dans cette branche de la physique médicale, de nouvelles méthodes de thérapie guidée par imagerie moléculaire/fonctionnelle deviennent de plus en plus importantes [4–7]. Contrairement aux techniques traditionnelles, ces types de traitements ciblent un mécanisme métabolique particulier par injection d’un radio-marqueur qui, ayant une affinité biochimique avec des récepteurs particuliers surexprimés par les cellules cancéreuses, s’accumulera sur les sites actifs. De cette manière, les tumeurs sont ciblées et la quantité de tissus sains irradiés est minimisée, répondant à l’objectif d’un traitement : éradiquer les cellules cancéreuses et préserver les cellules saines.
Le sujet principal de ce travail de recherche concerne l’utilisation de la TEM avec le177Lupour
le traitement des tumeurs neuroendocrines (TNE) de petite taille. Les TNE se développent à partir de cellules neuroendocrines du corps et le plus souvent, dans les poumons et dans le système gastro-intestinal. Ces caractéristiques font des TNE des candidates idéales pour des traitements alternatifs comme la thérapie radionucléique par radiopeptides (TRRP). Le choix du 177Lu est dû à ses propriétés d’émission qui le rendent utile à deux objectifs :
image de la biodistribution (gammas) du radio-marqueur. Historiquement, les protocoles de traitement au 177Luétaient basés sur une injection d’une valeur standard (7.4 GBq) d’activité
de radioisotope [5]. Actuellement, bien que certains protocoles utilisés aient migré vers une personnalisation de l’activité injectée [6], la plupart sont encore basé sur une interprétation semi-quantitative avec la valeur de captation normalisée (SUV pour Standardized Uptake Value) [8–10] et avec les facteurs de dose, standardisés et non spécifiques aux patients, du logiciel Olinda (Vanderbilt University, Nashville, TN) [4, 6, 11]. Pourtant, des approches quantitatives basées sur des images bien quantifiées, sur des calculs de la dose absorbée spécifiques au patient et sur des données dosimétriques (e.g. radio-oncologie traditionnelle) peuvent être utilisées. Ces procédés peuvent contribuer à assurer une compréhension plus approfondie de certaines pathologies ainsi qu’une trajectoire optimale du patient dans le parcours de soins.
Pour quantifier des images, une analyse approfondie des techniques de calibration des appareils utilisés est nécessaire. En 2015, la collaboration de référence numéro 26 du MIRD (Medical Internal Radiation Dose) [12] a proposé des standards de calibration de l’appareil TEM, de quantification des images ainsi que de la dosimétrie associée dans la TRRP au 177Lu.
Depuis cette publication, l’intérêt envers ce type de traitement est en augmentation [13–18]. Aujourd’hui encore, la recherche de techniques de calibration continue intensivement avec de nouvelles propositions [12, 14, 18] parmi lesquelles le temps mort (TM) de la caméra TEM est majoritairement ignoré [15, 18, 19]. Or, dans le cadre d’une personnalisation du traitement, de très haut niveaux d’activité injectée pourraient amener à une évaluation faussée de la réponse de la caméra et à des subséquentes erreurs dans la quantification.
Avec une calibration opportune et précise, il est possible d’avoir des images quantifiées en termes d’activité fixée dans le corps du patient à un moment déterminé (acquisition de l’image). À partir de celles-ci, un outil pour le calcul de dose absorbée pour la TRRP, conçu au sein du Groupe de recherche en physique médicale (GRPM) de l’Université Laval peut être utilisé. Cet outil est basé sur des techniques de calcul Monte Carlo (MC) sur processeur graphique (en anglais Graphics Processing Unit, GPU). Il simule le transport de la radiation et le dépôt de la dose dans le patient à partir des images (fonctionnelles et anatomiques, TEM/TDM) acquises lors d’une TRRP [20]. Cet outil de calcul, nommé irtGPUMCD (internal radiotherapy GPU Monte Carlo Dose) et dérivant d’autres versions dédiées à la radiothérapie conventionnelle (faisceau externes et curiethérapie), nécessitait une validation. Pour éviter tous biais dans la validation du code, des conditions standardisées et partagées dans la communauté scientifique en MC sont nécessaires [21]. Dans ces conditions contrôlées, il serait donc possible de valider ce code par une analyse comparative à des résultats publiés et à d’autres codes MC testés et entérinés (i.e. GATE [22,23]).
Avec des simulations MC basées sur des images bien quantifiées en activité et à la suite d’un premier cycle de traitement, il sera possible d’ajuster les traitements successifs en fonction de la dose absorbée par le patient, tout en préservant les organes à risque. En intégrant la
mesure de l’activité dans le sang du patient (avec compteur sanguin) et l’utilisation des modèles pharmacocinétiques (pas considérés dans ce travail) [24] avec les information issus des images, une quantification plus robuste peut être obtenue. Le dessein à long terme sera de permettre la personnalisation pour les TRRP, sans se limiter aux TNE, et d’offrir au médecin la possibilité d’ajuster l’activité injectée lors des différents cycles de traitement.
Objectifs et plan de thèse
Ce travail a pour but de construire et de valider certaines des étapes fondamentales pour la quantification en TRRP au 177Lu. La chaîne de quantification dans laquelle s’inscrit ce projet
est décrite dans la figure0.1 où sont indiqués les étapes constituants les objectifs de ce travail. Le premier objectif a été de tester et d’établir une méthode de calibration appropriée de l’appareil de TEM parmi celles proposées dans la littérature [12–15, 25, 26]. La première étape a été la conception d’une méthode de calibration rapide et simple (fantôme et acquisition planaire) permettant une quantification fidèle dans des condition standardisées et similaires aux acquisitions des patients (fantôme et acquisition volumétrique, i.e. Jaszczak [27]). Dans le cadre de la calibration de la caractérisation complète de la TEM, une attention particulière a été portée sur le phénomène du TM. Cette méthode qui comporte des techniques de mesures, d’acquisitions et les analyses associées a été développée en s’inspirant du travail de Beauregard et al. [28]. De plus, l’utilisation de grandes valeurs d’activité (similaires à celles injectées aux patients) était requise et a demandé le développement d’un protocole sécuritaire d’un point de vue de la radioprotection.
Le deuxième objectif a été de valider/vérifier le code Monte Carlo, irtGPUMCD, pour la quantification dosimétrique en TRRP dans des conditions référencées et contrôlées. Le code a ainsi été testé pour évaluer les performances avec des images cliniques.
Dans cette section introductive sont présentées les notions et les définitions théoriques nécessaires pour la compréhension et la mise en contexte du présent projet. Le lecteur expert dans le domaine peut passer rapidement aux chapitres suivants ou, selon sa propre branche d’expertise, s’attarder sur des aspects liés à la physique ou aux TRRP. En particulier, les sections suivantes abordent les notions de désintégration radioactive, les principaux types de rayonnement et les principes physiques qui gouvernent l’interaction radiation-matière. Ceux-ci sont indispensables à la compréhension du fonctionnement de l’imagerie TEM/TDM ainsi que du code MC pour le calcul de la dose absorbée qui seront présentés dans les chapitres suivants. Ensuite, le concept de radionucléides, de radio-pharmaceutiques et de TRRP avec l’historique associé et l’évolution de ce traitement est présenté. Après cette introduction, ce manuscrit est divisé en quatre chapitres.
Figure 0.1 – Étapes nécessaires pour la quantification lors d’une TRRP au 177Lu. Les enjeux de chaque étape sont indiqués ainsi que les objectifs associés à ce travail de thèse (achevés en rouge ou partiellement abordés en orange).
de mon sujet de doctorat liés au premier objectif. Dans ce chapitre est présenté l’arsenal technologique à disposition pour l’acquisition et la formation des images tridimensionnelles, TDM et TEM. Le fonctionnement de la gamma caméra pour la TEM est approfondi en abordant les phénomènes qui peuvent affecter la quantification de l’image et une attention particulière est portée sur la calibration du système et l’évaluation du TM.
Dans le chapitre 2, après avoir exposé l’historique et les notions théoriques du calcul MC ainsi que l’utilisation des GPUs en MC, le code irtGPUMCD et les étapes pour se rendre à des images de dose sont présentés. Les modifications apportées au code avec l’introduction d’un nouvel algorithme de réduction de variance, l’estimateur de longueur de parcours exponentiel, sont aussi décrites.
Les chapitres3 et 4contiennent les résultats relatifs aux objectifs et sont présentés sous forme d’articles publiés. Dans ces chapitres, la numérotation des figures, tableaux et bibliographie de l’article ont été changés pour une intégration adéquate dans le manuscrit.
D’une réécriture des équations qui gouvernent la calibration et le temps mort de la caméra de TEM [25, 28] est dérivée une technique simplifiée. Cette technique, présentée dans l’AnnexeA, permet une calibration et caractérisation du temps mort encore plus rapide par rapport à la méthode présentée au chapitre3. Dans l’AnnexeBsont décrits les enjeux liés à la radioprotection lors des expériences au177Lu. Les mises en place des protocoles d’expérience et de sécurité ont
constitué une part conséquente du temps de préparation des expériences qui ont servi pour la caractérisation en TM de la gamma caméra, du fait des niveaux d’activité très élevés. Par ailleurs, l’acceptation de ces protocoles de mesure par la Commission canadienne de sûreté nucléaire (CCSN) a ouvert de nouvelles possibilités de recherche et d’exploration pour les expériences exécutées avec des valeurs d’activités très élevées. Enfin, dans l’Annexe C sont décrites les étapes pour l’application de méthodes statistiques pour les variables dosimétriques et cliniques ainsi que l’introduction d’études rétrospectives utilisées en radio-oncologie mais pas encore en médecine nucléaire (MN). Ces méthodes statistiques pourraient être intégrées dans les études cliniques dédiées aux TRRP.
La conclusion est une synthèse des résultats liés au projet, notamment sur la proposition d’une calibration simple mais adéquatement précise et de la validation du code irtGPUMCD ainsi que la chaîne de quantification qui le précède. En partant de cette première validation du code, des pistes de simplification et d’extension à d’autres applications sont proposées pour ajuster/améliorer les performances et la versatilité du système. Les perspectives d’avenir d’études quantitatives basées sur valeurs dosimétriques extraites du MC en médecine nucléaire sont aussi évoquées.
0.1
Principes physiques
0.1.1 Désintégration radioactive
La désintégration radioactive est un processus spontané et probabiliste qui survient dans certains atomes se trouvant dans des condition d’instabilité énergétique. Ces atomes, dit radionucléides, se transforment en d’autres atomes dans des formes plus stables. Dans les prochaines sections, les types de désintégration radioactives beta et gamma seront abordées plus en détails. Étant donné la nature statistique de ce phénomène, il n’est pas possible de savoir quand un atome particulier se désintégrera, mais, parmi une multitude d’atome, il est possible de quantifier la proportion qui se désintégrera dans un temps donné (t) [29]. La loi suivante gouverne la désintégration ou décroissance radioactive en partant d’un nombre initial d’atomes radioactifs (N0) qui constituent l’échantillon.
N = N0e−λt. (1)
Dans cette équation N est le nombre d’atomes à un temps donné et λ, la constante de décroissance, a les dimensions de l’inverse du temps. Le taux de désintégration moyen est défini avec le nom de activité [30] :
˙ N (t) = dN dt = λN (t) = A(t). (2) L’unité de mesure de cette quantité dans le Système International d’unités est le Becquerel (Bq). Un radionucléide est caractérisé par sa durée de demi-vie (T1/2) qui représente le temps
nécessaire à une décroissance de 50% de son niveau d’activité initial. Cette quantité est liée à la constante de désintégration par la relation suivante :
T1 2 =
ln2
λ . (3)
0.1.2 Types de rayonnement
Lorsqu’un radioisotope se désintègre il émet des particules chargées ou neutres qui interagissent avec la matière environnante. Le type d’interaction dépend du type de particule/rayonnement, de l’énergie de ces particules et du milieu dans lequel ils se déplacent. Ces particules transfèrent leur énergie au milieu en causant des phénomènes d’ionisation et d’excitation/vibration d’atomes et de molécules [30]. Lors de ce transfert, la partie dominante d’énergie est dégradée en chaleur sans effets importants sur la matière biologique ; cependant, l’ionisation avec libération conséquente de particules chargées peut avoir comme conséquence la rupture de l’ADN des cellules (cancéreuses et saines) et la mort de celles-ci.
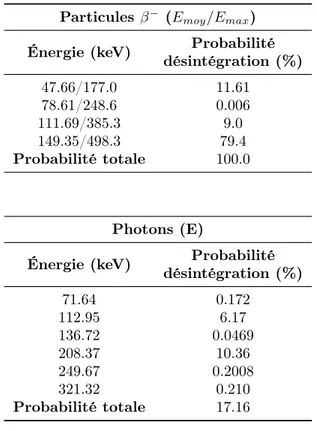
Particules β− (Emoy/Emax)
Énergie (keV) Probabilité désintégration (%) 47.66/177.0 11.61 78.61/248.6 0.006 111.69/385.3 9.0 149.35/498.3 79.4 Probabilité totale 100.0 Photons (E)
Énergie (keV) Probabilité désintégration (%) 71.64 0.172 112.95 6.17 136.72 0.0469 208.37 10.36 249.67 0.2008 321.32 0.210 Probabilité totale 17.16
Table 0.1 – Énergie et probabilité des particules produites lors de la désintégration d’un noyau de 177Lu.
Les types de rayonnement étudiés dans le cadre de ce projet sont le rayonnement β (en particulier β−) et le rayonnement γ. Comme montré dans la tableau 0.1ceux-ci représentent
les principales voies d’émission du 177Lu qui, toutefois, est caractérisé par un schéma de
désintégration plus complexe (rayon X et électrons Auger) qui peut être trouvé dans les publications de référence [1,31].
0.1.3 Rayonnement beta
Tous les noyaux connus à ce jour, stables ou instables, sont classés dans ce qui est appelé le diagramme (N, Z) de Segré : chaque nucléide occupe un point de coordonnées (N, Z) dans un diagramme cartésien. Sur la figure 0.2, on constate que les nucléides stables de faible masse ont des N ' Z ' A/2, tandis que les nucléides plus lourds ont un excès de neutrons. Généralement, les noyaux ayant un excès de neutrons ont tendance à émettre un électron (β− particule).
D’autre part, les noyaux ayant un excès de protons émettent généralement un positon (β+).
Dans les deux cas, le nombre total de nucléons A (protons plus neutrons) reste constant, de sorte que le noyau fils est isobare au noyau parent. Souvent l’émission de rayons β laisse les noyaux fils dans un état excité ce qui a comme effet l’émission d’un ou plusieurs rayon γ jusqu’à atteindre un état de repos. À cause de l’émission de ce rayon β, ces types de processus sont appelés désintégration β [32]. L’équation qui suit représente une désintégration β− :
A
ZX −→AZ+1X + β−+ ¯νe+ Q. (4)
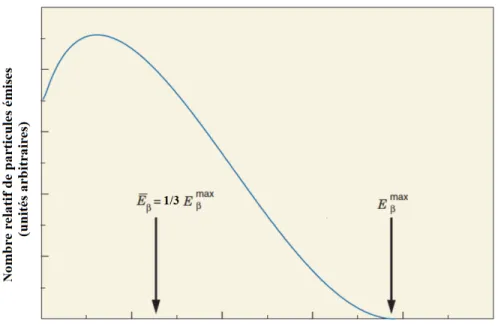
Le rayonnement β a un spectre qui s’étend de zéro à une énergie maximal Emax, avec une
distribution de forme asymétrique (figure 0.3). Une grandeur d’intérêt pour la caractérisation de l’émission du rayonnement β est l’énergie moyenne dont une approximation est représentée par un tiers de l’énergie maximale du spectre [30]. Pour cette raison, cette valeur de l’énergie moyenne est souvent indiquée dans les publications de référence [1] et utilisée pour les calculs de dose absorbée (e.g. dans les simulations MC). La portée de ce rayonnement dans le tissu humain est généralement de quelques millimètres, vu le haut taux d’interaction avec la matière, ce qui permet de considérer un dépôt local de l’énergie (et ultimement la dose absorbée). Ceci est le cas envisagé dans ce projet pour le calcul de la dose déposée par les électrons (sans transport par Monte Carlo). Cependant, pour complétude, les principales interactions entre les électrons (particules chargées) et la matière sont expliquées dans la section suivante.
Figure 0.3 – Exemple de spectre d’énergie pour les particules β− (émis par le14C). L’énergie maximale des particules β−est donnée par Q (équation 4). L’énergie moyenne ( ¯E
β) est environ
un tiers de l’énergie maximale (Emax
β ) ; (adapté de [30]).
0.1.4 Interaction électrons matière
Les interactions des électrons avec la matière sont présentées dans cette section. Dans le cadre de ce projet, le dépôt de dose pour les particules β− du177Luest fait de façon locale sans un
transport de la radiation : la taille de la géométrie (voxel 4.8x4.8x4.8mm3) et les énergies en
jeux (< 500keV ) permettent de utiliser cette approximation. Une discussion plus détaillée peut être trouvée dans certains livres de référence en physique médicale [29,32].
Les interactions des particules chargées avec la matière peuvent être subdivisées en trois types. Les deux premières sont souvent appelées avec le nom « collisions » entre les particules et l’atome. Cependant, il ne s’agit pas de collisions mécaniques réelles entre les particules, mais plutôt de interactions par forces coulombiennes avec les électrons orbitaux [30].
Le premier type d’interaction a lieu en cas de passage rapprochée de la particule chargé à l’atome du milieu. Dans ce cas la force de l’interaction peut être suffisante pour causer la séparation d’un électron de l’atome, provoquant ainsi une ionisation. La particule chargée lors de la collision perd de l’énergie qui est utilisée pour vaincre l’énergie de liaison et mettre en mouvement l’électron éjecté avec l’énergie restante. Si l’électron éjecté est assez énergétique il peut produire des ionisations successives.
Le deuxième type d’interaction arrive dans le cas de rapprochement lointain de la particule à l’atome du milieu. Dans ces conditions, une excitation de l’atome peut se produire. Ces interactions entraînent généralement des transferts d’énergie mineurs et cette énergie est dissipée par d’autres phénomènes d’émission (vibrations moléculaires, rayonnement dans l’ultraviolet ou visible, etc.).
Figure 0.4 – Types d’interactions particules chargées. A) Collision et B) perte radiative (Bremsstrahlung) ; (adapté de [30]).
Le troisième type d’interaction se vérifie lorsque la particule chargée est assez énergétique pour pénétrer dans le nuage d’électrons orbitaux d’un atome et elle interagit avec son noyau. Si la particule chargée a une énergie suffisamment élevée, cela peut aussi entraîner des réactions nucléaires. Pour la gamme d’énergies en médecine nucléaire, il arrive que la particule chargée soit déviée par les fortes forces exercées par le noyau et subit un ralentissement immédiat avec perte d’énergie. Celle-ci se transforme en un rayonnement électromagnétique appelé Bremsstrahlung ("rayonnement de freinage"). L’énergie des photons de Bremsstrahlung qui se produisent peut aller de zéro jusqu’à un maximum de l’énergie totale de la particule incidente dépendamment de la déviation de la particule (petite déviation ou arrêt complet). La probabilité de cette
interaction est proportionnelle à Z2 de l’atome (milieu) et à l’inverse du carré de la masse de
la particule chargée.
Pour la gamme d’énergie et la composition atomique de la matière biologique (petite nombre Z), les pertes par collisions sont le facteur dominant en médecine nucléaire [30].
0.1.5 Rayonnement gamma
Un noyau atomique peut se retrouver dans un état excité à cause de l’arrangement de ses composantes (nucléons) et des forces d’interactions entre celles-ci. Ce noyau a tendance à passer dans un état d’énergie plus faible au moyen du phénomène de désexcitation. Pendant cette désexcitation un photon peut être émis :
A
ZX∗ −→AZ X + γ. (5)
Un des radionucléides le plus utilisé en médecine nucléaire et utilisé en partie dans cette étude est le 99mT c. Celui-ci émet un photon avec une énergie de '140 keV. À cette énergie,
le libre parcours moyen (section 0.1.7) dans les tissus humains est de 6.5 cm [32, 34, 35]. Le177Lu, comme mentionné précédemment, est caractérisé par deux voies de désintégration
d’intérêt (figure ??), avec des énergies de 113 keV (6%) et de 208 keV (11%) correspondant respectivement à un libre parcours moyen de 6.1 cm et de 7.4 cm [32,34,35].
0.1.6 Interaction photons matière
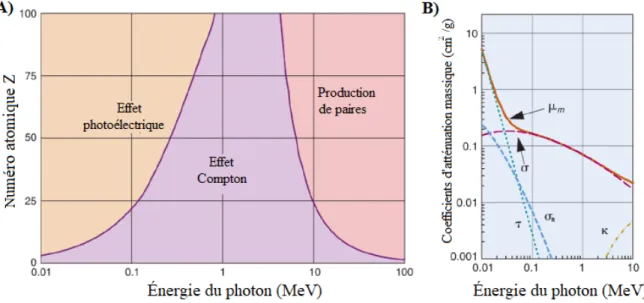
Les interactions des photons avec la matière peuvent être de différente nature : effet pho-toélectrique, effet Compton, production de paires (et de triplets) et diffusion Rayleigh. Or, pour les énergies en jeu et pour les milieux avec lesquels ils interagissent, soit le corps hu-main (Zef f ' 7 [32]), les principaux sont l’effet photoélectrique et l’effet Compton. L’effet
Rayleigh sera aussi abordé car il est pris en compte dans la partie de ce document relative aux simulations.
Effet photoélectrique
L’effet photoélectrique est un processus d’absorption complète d’énergie d’un photon incident par un électron des couches internes de l’atome considéré. L’électron avec lequel l’interaction a lieu est expulsé et est appelé photo-électron. Celui-ci aura une énergie cinétique (T) qui est égale à celle du gamma incident (hν) moins l’énergie utilisée pour l’expulsion de l’électron (Eb) [32] :
T = hν − Eb. (6)
Étant donné que l’atome a perdu un électron, il peut arriver qu’un électron d’une couche supérieure vienne se placer dans le trou laissé par le photo-électron. Face à ce phénomène,
il peut suivre l’émission d’un rayon X ou d’un électron Auger [30]. Enfin, comme il peut être déduit du graphique (figure 0.5), la probabilité d’absorption photoélectrique varie en fonction de l’énergie (E) du photon et du Z du matériau cible. Cette probabilité d’absorption photoélectrique par unité de masse est proportionnelle à Z3/E3 pour E ≤ 0.1MeV [32]. Cet
effet est donc dominant dans les interactions des photons de faible énergie avec des milieux de Z élevé.
Figure 0.5 – A) Dominance des interactions en fonction de l’énergie et du nombre atomique de l’absorbeur. B) Coefficients d’atténuation massique pour les interactions radiation/matière dans l’eau (photoélectrique (τ), Compton (σ), Rayleigh (σR), production de paires (κ), totale
(µm)) ; (adapté de [30]).
Effet Compton
L’effet Compton ou diffusion incohérente est un phénomène physique prédominant pour les énergies des γ utilisés en médecine nucléaire. Il est caractérisé par un transfert partiel de l’énergie du photon incident. Cet effet de diffusion a lieu lorsqu’un photon d’énergie hν interagit avec un électron d’une couche externe d’un atome (figure0.7). Après la collision, l’électron (de masse au repos m0c2) part à un angle de diffusion θ, avec l’énergie cinétique T et momentum
p. Le photon diffuse à l’angle φ avec une nouvelle énergie hν0 inférieur et momentum hν0/c. Par conservation des quantités de mouvement et d’énergie, l’énergie du photon diffusé est dépendante de son angle de diffusion φ.
À partir des paramètres énoncés précédemment, les équations qui régissent la cinématique pour le photon et l’électron de recul sont les suivantes :
hν0 = hν 1 + (hν/m0c2)(1 − cosφ) . (7) T = hν − hν0. (8) cotθ = (1 + hν m0c2 )tanφ 2. (9)
Figure 0.7 – Schéma effet Compton (adapté de [30]).
Pour ce qui est de la probabilité d’interaction, il est considéré que l’effet Compton (section efficace, cf.0.1.7) est approximativement indépendant de l’énergie du photon incident et du Z d l’atome [32].
Effet Rayleigh
L’effet Rayleigh ou aussi diffusion cohérente est un type d’interaction qui survient entre un photon et l’atome entier. À cause de la grande masse d’un atome, très peu d’énergie de recul est absorbée par celui-ci. Donc, l’événement est élastique dans le sens que le photon perd une partie infinitésimale de son énergie. Le photon est généralement dévié d’un petit angle qui augmente si l’énergie du photon est petite [32]. L’effet Rayleigh a une importance à basse énergie car l’angle de diffusion est majeur ; la probabilité de cet effet, par unité de masse, est approximativement proportionelle au nombre Z de l’atome du milieu et au carré de l’énergie du photon incident [32].
Figure 0.8 – Schéma effet Rayleigh (adapté de [30]).
0.1.7 Atténuation des photons
Lorsqu’un photon passe à travers un matériau absorbant, la probabilité d’interaction dépend de son énergie, de la composition et l’épaisseur de l’absorbeur. Après une interaction le photon peut être complètement absorbé ou changer de trajectoire en perdant de l’énergie. En considérant un faisceau de photons d’intensité I0 qui passe dans une couche de matériel d’épaisseur x, à
cause des interactions des photons, une réduction de l’intensité est observée. Cette atténuation est décrite à l’aide de la loi de Beer-Lambert :
Ix = I0e−µx. (10)
Donc, l’atténuation est gouvernée par une loi de type exponentiel et dépend du coefficient d’atténuation µ du milieu absorbant (dont l’inverse est le libre parcours moyen). Ce coefficient est donné par la somme des coefficients d’atténuation dus aux différents types d’interactions des photons avec la matière. La probabilité d’interaction de chacune de ces interaction est appelée section efficace (σ) et dépend de l’énergie du photon et du matériel traversé [32]. Les coefficients d’atténuation sont souvent présentés et tabulés [35] avec une normalisation par la densité du matériel traversé (µ/ρ). Dans cette dernière forme ces facteurs sont appelés coefficient
d’atténuation de masse et facilite la comparaison des valeurs du coefficient d’atténuation des différents matériaux. Ces coefficients restent toutefois dépendants de la composition atomique [36].
0.1.8 Dose
Les interactions des particules directement ou indirectement ionisantes avec la matière mettent en mouvement les particules chargées qui sont responsables du dépôt de dose. Ces rayonnements peuvent provoquer des dommages directs, rompant les liaisons chimiques des biomolécules constituant l’ADN ou peuvent induire des dommages indirects en produisant des particules secondaires, principalement des radicaux libres (issus de la radiolyse de l’eau) [30]. Les radicaux libres sont très réactifs d’un point de vue chimique et interagissent avec les biomolécules (bases azotées qui composent l’ADN) en les modifiant. L’effet d’endommagement de la chaîne nucléo-tidique entraîne des conséquences potentiellement permanentes (e.g. mutation) et mortelles pour les cellules irradiées.
La dose est définie comme l’énergie déposée par le champ de radiation se propageant dans un milieu par unité de masse [32] :
D = dE
dm. (11)
L’unité de mesure de la dose absorbée est le Gray (Gy) et représente l’absorption de radiation d’un Joule pour un kilogramme de matière. Pour le calcul de la dose la définition d’autres coefficients est nécessaire : les coefficients d’absorption massique, µen/ρ. Ceux-ci permettent
d’évaluer la fraction d’énergie transférée par les particules chargées et absorbée localement dans milieu sans considérer les pertes radiatives [29,32]. Ces coefficients d’absorption massique sont tabulés, pour chaque matériel et type d’interaction, dans la base de données du NIST [37] et seront utilisées dans la section de cette thèse relative aux simulation MC.
0.2
Principes de la TRRP
Les premières tentatives expérimentales et cliniques de ce qui pourrait être appelée thérapie radio-métabolique remontent au début des années 40 du XXesiècle avec des application au 32P produits par cyclotron [38].
Cependant, la majeure partie de la production de radionucléides était conçue principalement pour une utilisation dans le domaine de l’imagerie. Dans ce cadre, les premières applications de la technique de scintigraphie impliquaient l’utilisation exclusive de radionucléides à longue demi-vie physique, comme le 131I (un des radionucléides traités dans ce travail), dont la
production est faite dans des réacteurs nucléaires à une grande distance du lieu d’utilisation. La disponibilité des radionucléides à courte demi-vie a été rendue possible par l’introduction des
générateurs. Ceux-ci consistent en un radionucléide parent, avec une vie relativement longue, qui se désintègre en un radionucléide fille à courte demi-vie ; les deux radionucléides sont séparables par procédure chimique simple [39]. Le plus couramment utilisé est le générateur de
99M o/99mT c (un autre des radionucléides traités dans ce travail) [40].
Lorsque les radionucléides sont liés à des molécules biologiques, l’assemblage est nommé radiopharmaceutique. Normalement, ceux-ci sont utilisés pour l’imagerie fonctionnelle de type diagnostique, mais ils peuvent aussi être utilisés dans le cadre de certains traitements. Le cas envisagé dans le présent document est celui des TNE dont le traitement, effectué à l’aide de radiopeptides, est nommé thérapie radionucléique par radiopeptides (TRRP).
0.2.1 Peptide pour la TRRP
Un peptide est une molécule constituée de deux ou plusieurs acides aminés. Leur utilité dans le cadre de la TRRP est liée à une surexpression sur les cellules cancéreuses de récepteurs particuliers à ces peptides (RSST, récepteur de la somatostatine). Dans le cas des tumeurs neuroendocrines ces récepteurs (de RSST1 à RSST5) peuvent former des liens biochimiques avec la somatostatine. La somatostatine est un peptide qui a comme fonction principale de tenir sous contrôle la prolifération des cellules en se liant à des récepteurs impliquées dans ce mécanisme [41]. Comme la somatostatine n’est pas facile à manipuler, en raison de sa courte demi-vie qui demanderait des infusions continues, des analogues ont commencé à être utilisés [42], soit l’octréotide et ses dérivés.
0.2.2 Radiopeptides
Les analogues de la somatostatine sont utilisés comme première étape du traitement des TNE pour leur fonction de contrôle de la tumeur. Ils stabilisent sa progression et diminuent les symptômes. Cependant, ils remplissent partiellement l’objectif d’une thérapie, à savoir l’éradication de la maladie. Pour cette raison, des analogues de la somatostatine radio-marqués ont commencé à être synthétisés. Au début, des analogues radio-marqués de la somatostatine ont été utilisés pour des fins diagnostiques à l’aide des isotopes de l’iode [43]. Ensuite, l’introduction au niveau commercial de nouveaux analogues marqués a permis l’utilisation de l’111In et du 99mT c[44,45].
Les traitements des tumeurs neuroendocrines avec des analogues de la somatostatine radio-marqués ont commencé dans la dernière décade du XXème siècle. Au cours de ces années,
de multiples essais avec différents types de combinaisons peptides/radionucléides ont été faites [46–52]. Depuis les vingt dernières années l’utilisation de radiopeptides marqués au177Lu
a été envisagée. Ceux-ci ont démontré avoir un meilleur effet et moins de toxicité dans les traitements des TNE [34, 53–56] par rapport à d’autres radioisotopes caractérisés par des énergies d’émission supérieures (e.g.90Y). Un type particulier de radiopharmaceutique sera
considéré pour ce projet : le 177Lu-octréotate. Comme montré dans la figure0.9, pour lier le 177Luau peptide l’utilisation d’un chélateur est nécessaire [57].
Figure 0.9 – Composition chimique du 177Lu-octréotate [57].
0.3
TRRP avec le
177Lu-octréotate
0.3.1 Choix du 177Lu
Dans le passé, différents analogues de la somatostatine marqués avec le177Luont été utilisés [53, 58, 59]. Le choix de ce radionucléide est dû à ses caractéristiques d’émission. En effet, le177Lu
qui a une demi-vie de 6.65 jours, est un émetteur β− avec une énergie maximale de 0.5 MeV et
donc une portée maximale dans le tissu de 2 mm [60]. Ceci fait de lui un bon candidat pour le traitement des petites tumeurs. Après sa désintégration β−, le 177Luse transforme en un
atome de177Hf qui peut se trouver dans des états excités. Celui-ci se désexcite en émettant
des photons de différentes énergies et avec différentes probabilités de désintégration [1, 31,61]. Parmi cet éventail de photon émis, deux sont utilisés pour l’imagerie par TEM. Il s’agit des photons aux plus hautes probabilités de désintégration, soit 208 keV et 113 keV. Dans le tableau0.1 ont été déjà rapportées les énergies et les probabilités de désintégration du177Lu
extraits de la publication de la ICRP107 et qui seront utilisés plus tard dans ce travail. Ces caractéristiques du 177Lurendent possible l’utilisation d’un seul radiopeptide qui accomplit
deux tâches simultanément : cibler les tumeurs avec des rayonnement β− et obtenir des images
0.3.2 Production du 177Lu
La production du177Lupeut être effectuée par deux voies principales, à savoir une voie directe
qui se base sur l’irradiation avec neutron de cibles de 176Luet une voie indirecte basé sur
irradiation avec neutrons de cible de ytterbium suivi par une séparation chimique du 177Lu
des isotopes de l’ytterbium.
Dans la voie directe (176Lu(n,γ) 177Lu) le177Lupeut être produit directement par capture
neutronique dans les réacteurs nucléaires à partir de cibles de 176Ludû à la grande section
efficace de ce dernier [62]. Avec cette méthode une bonne activité spécifique peut être obtenue. Toutefois, cette voie comporte la production de l’isomère177mLu, qui a une longue demi-vie
(160 jours), baisse la pureté des échantillons de 177Lu en présentant des problèmes pour
l’imagerie [63] très tardive et pour la disposition des déchets radioactif dans les hôpitaux [64]. De plus, cette méthode demande des cibles de 176Luenrichies à cause de sa faible présence
naturelle.
Dans la production pour voie indirecte, il est possible d’obtenir du 177Lude la désintégration
bêta de 177Y b [62]. Celui-ci est produit par capture de neutrons sur des cibles de 176Y b dans
un réacteur nucléaire. Pour supprimer la formation d’isotopes concurrents (169Y b et 175Y b) et
augmenter l’efficacité du processus, un matériau cible enrichi est nécessaire. Dans ce procédé le 177Ludoit être séparé de la cible d’ytterbium, car ce dernier entre en compétition avec le
lutétium lors de la production du radiopharmaceutique.
Enfin, récemment, des études théoriques basées sur simulations numériques ont montré la possibilité de produire du 177Lu à partir des faisceaux de deutons via cyclotrons [65]. Ce
résultat est de grand intérêt et peut ouvrir des nouvelles voies de recherche visant la production du 177Lu, et d’autres radioisotopes utiles pour la TRRP, avec des cyclotrons et près du site
d’utilisation.
0.3.3 TRRP au CHU de Québec
Depuis l’année 2012, au CHU de Québec, les traitements avec le177Lu-octréotate ont commencé
pour des patients atteints de TNE. Le protocole de traitement initial suivait les indications empiriques suggérées par certaines études effectuées sur ce radiopharmaceutique [55,66,67]. Le traitement est composé de quatre cycles avec en plus, dans certains cas, une autre séance de "consolidation" ou "maintenance" [6]. L’intervalle entre les différents cycles peut varier de six à dix semaines. Chaque cycle de traitement, dans sa version empirique, consistait en l’injection de 177Lu-octréotate, d’une activité d’environ 7.4 GBq.
À partir d’avril 2016, le protocole empirique a été substitué par un protocole personnalisé avec des injection d’une activité variée selon le patient. Le protocole a été conçu en partant d’une simulation rétrospective sur une cohorte de patient traités avec le protocole empirique
(injection fixe de 7.4 GBq) [6]. Ensuite, une étude prospective [68] a montré les bénéfices d’une personnalisation du traitement qui augmentait la dose à la tumeur en respectant les limites de dose aux organes à risques, à savoir les reins et la moelle osseuse.
Pour chaque cycle, trois séances d’imagerie TEM et TDM sont effectuées. Le protocole actuel prévoit que celles-ci soient effectuées au jour de l’injection (jour 0, après quatre heures), le jour suivant (jour1) et le quatrième jour (jour3) : généralement avec un champ de vue dans la zone du thorax, mais parfois, si la tumeur est répandue, des séances corps entier sont ajoutées. Dans certains études l’acquisition de points de mesure tardifs (jour 7) a été proposée pour augmenter l’exactitude de la quantification absolue d’activité accumulée dans le patient [69]. Des études récentes ont toutefois démontré la possibilité d’effectuer juste une ou deux séances d’imagerie pour améliorer le parcours du patient sans toutefois réduire significativement l’exactitude dans l’évaluation de la distribution d’activité dans le temps [16, 70]. En effet, pour un radiopharmaceutique, en plus de la demi-vie physique due à la désintégration et décroissance du radioisotope (section 0.1.1), il faut considérer aussi la demi-vie biologique. Celle-ci est liée à l’élimination biologique du composé et est très variable d’un patient à l’autre ainsi que pour les différents sites de captation. Avec plusieurs jours d’acquisition d’images il est possible de suivre et de quantifier l’activité accumulé dans le patient. Avec une quantification de l’activité, il est possible de procéder aux calculs de dose absorbée cumulative.
Conclusion
Le présent projet se situe dans le cadre de l’amélioration de la quantification lors d’une TRRP. Les éléments présentés jusqu’ici permettent de comprendre l’utilisation des systèmes d’imagerie lors du traitement et d’appréhender les enjeux de la quantification ainsi que de l’utilité du code MC développé.
Chapitre 1
Imagerie TEM quantitative en TRRP
au
177
Lu
Dans ce chapitre sera présentée une introduction à l’imagerie et en particulier à l’imagerie moléculaire quantitative. Le premier objectif du présent projet est le développement de techniques simples et précises de calibration et de correction du temps mort pour l’imagerie TEM. Ainsi ce chapitre abordera de manière concise l’état de l’art de ces techniques [28] et en quoi elles représentent deux sources d’erreur dans la quantification ; une attention particulière sera portée sur la quantification en activité à partir des images acquises (QTEM ou QSPECT en anglais). Bien que de multiples effets dus au fonctionnement de la TEM (effet de volume partiel, réponse du détecteur/collimateur, algorithme de reconstruction) peuvent avoir un impact significatif sur la quantification de l’image, ils ne seront pas rapportés dans ce travail et peuvent être trouvés dans d’autres travaux de référence dans ce domaine [12,30,71].
Introduction
L’histoire de l’imagerie diagnostique a fait son début en 1895 avec la découverte des rayons X par Wilhelm Conrad Röntgen. Cette découverte et l’invention de la radiographie a marqué le commencement d’une série d’inventions au cours du dernier siècle. Cette branche de la médecine diagnostique a rejoint son sommet avec l’invention de la technique de reconstruction d’images tomographiques à l’aide d’un ordinateur qui offre une visualisation tridimensionnelle/volumique des structures à l’intérieur du patient. De nos jours, de nombreuses techniques d’imagerie médicale sont disponibles, allant de la radiographie conventionnelle à la tomodensitométrie (TDM), en passant par l’imagerie par résonance magnétique (IRM) et les techniques d’écho-graphie jusqu’aux techniques de médecine nucléaire, avec la tomod’écho-graphie par émission de positrons (TEP) et tomographie par émission mono-photonique (TEM). L’imagerie fournit des informations utiles dans pratiquement tous les domaines de la médecine clinique. Ces images sont utilisées pour deux objectifs principaux, à savoir le diagnostic de la maladie et la
![Figure 0.2 – Diagramme (N,Z) de Segré (adapté de [ 33 ]).](https://thumb-eu.123doks.com/thumbv2/123doknet/2790091.65741/28.918.124.764.460.970/figure-diagramme-n-z-segré-adapté.webp)
![Figure 0.7 – Schéma effet Compton (adapté de [ 30 ]).](https://thumb-eu.123doks.com/thumbv2/123doknet/2790091.65741/33.918.260.781.429.956/figure-schéma-effet-compton-adapté.webp)
![Figure 0.9 – Composition chimique du 177 Lu -octréotate [ 57 ].](https://thumb-eu.123doks.com/thumbv2/123doknet/2790091.65741/37.918.181.744.183.506/figure-composition-chimique-lu-octréotate.webp)
![Table 1.1 – Propriétés de certains matériaux scintillateurs utilisés en médecine nucléaire (adapté de [ 30 ]).](https://thumb-eu.123doks.com/thumbv2/123doknet/2790091.65741/44.918.131.791.164.411/table-propriétés-matériaux-scintillateurs-utilisés-médecine-nucléaire-adapté.webp)