En vue de l’obtention du
DOCTORAT DE L’UNIVERSITE DE TOULOUSE Délivré par Université Toulouse III – Paul Sabatier
Ecole doctorale Sciences de la Matière
Discipline ou spécialité : Chimie Organométallique et de Coordination Présentée et soutenue
Par
Arnaud GLARIA
Le 19 décembre 2007
Généralisation d'une approche de synthèse par voie organométallique, à
température ambiante, de nanoparticules monocristallines d’oxydes métalliques.
Etude de leurs propriétés optiques ou magnétiques
_____________Directeur de Thèse : Bruno Chaudret _____________
JURY
Mme M. Gomez Simon Professeur, U.P.S., Toulouse, France Présidente M T. Gacoin Chargé de recherches au CNRS, Palaiseau, France Rapporteur M O. Tillement Professeur, U.C.B.L., Villeurbanne, France Rapporteur Mme C. Chanéac Maître de conférences, U.P.M.C., Paris, France
Mme M. Kahn Chargée de recherches au CNRS, Toulouse, France M B. Chaudret Directeur de recherches au CNRS, Toulouse, France
_____________
Laboratoire de Chimie de Coordination 205, route de Narbonne
En vue de l’obtention du
DOCTORAT DE L’UNIVERSITE DE TOULOUSE Délivré par Université Toulouse III – Paul Sabatier
Ecole doctorale Sciences de la Matière
Discipline ou spécialité : Chimie Organométallique et de Coordination Présentée et soutenue
Par
Arnaud GLARIA
Le 19 décembre 2007
Généralisation d'une approche de synthèse par voie organométallique, à
température ambiante, de nanoparticules monocristallines d’oxydes métalliques.
Etude de leurs propriétés optiques ou magnétiques
_____________Directeur de Thèse : Bruno Chaudret _____________
JURY
Mme M. Gomez Simon Professeur, U.P.S., Toulouse, France Présidente M T. Gacoin Chargé de recherches au CNRS, Palaiseau, France Rapporteur M O. Tillement Professeur, U.C.B.L., Villeurbanne, France Rapporteur Mme C. Chanéac Maître de conférences, U.P.M.C., Paris, France
Mme M. Kahn Chargée de recherches au CNRS, Toulouse, France M B. Chaudret Directeur de recherches au CNRS, Toulouse, France
_____________
Laboratoire de Chimie de Coordination 205, route de Narbonne
Ce travail a été réalisé au Laboratoire de Chimie de Coordination du CNRS à Toulouse, dans le cadre d’une bourse ministérielle. Je remercie la direction du LCC de m’avoir accueilli, ainsi que l’ensemble des personnes avec qui j’ai eu le plaisir de travailler pendant plus de trois ans.
Je tiens à remercier les membres du jury et plus particulièrement les rapporteurs d’avoir accepté de juger mon travail.
Merci Bruno pour les discussions et l’encadrement général de cette thèse. Bien que le planning des derniers mois fut très chargé, merci d’avoir trouvé un petit créneau pour la correction de cette thèse.
Merci Myrtil pour plus de quatre ans de discussions diverses et variées et heureusement pas seulement scientifiques. J’ai beaucoup appris et je t’en suis très reconnaissant. J’espère que les espaces temps de la chimie et de la physique vont un jour converger, tiens moi au courant. Bon courage pour la suite et je serai toujours dispo pour venir déguster un petit cabri bien que ce soit maintenant fini.
Merci à Pierre Lecante, Marc Respaud, Thierry Cardinal et Bernard Barbara d’avoir collaboré à ce travail.
Merci à André, Karine, Catherine, Pierre et aux membres de l’équipe L.
Léna, Clément dernière ligne droite. Bon courage, ça ne peut que bien se passer. Merci à tous ceux avec qui j’ai partagé de très bons moments aussi bien au labo qu’en dehors (ski, île de Ré, Corse, beach, foot, etc). Merci Steph, Phil, Greg, Céline, Olivier, Léna, Clément, Mary, Gilles, Sylviane, Jérôme, Diana, Seb, Vincent, Jeff, Mar, Jordi, Ana...et tous ceux que j’oublie.
Chapitre I – Introduction générale et bibliographique
I Introduction ... 13
II Présentation des principaux modes de synthèse par voie chimique... 14
II.1 Synthèses par voie thermique ou en autoclave... 14
II.2 Synthèses par chimie « douce » ... 17
III Quelques rappels : structure et propriétés des oxydes étudiés ... 30
III.1 Cas de l’oxyde de zinc ... 31
III.2 Cas des oxydes magnétiques ... 36
IV Conclusion... 44
Chapitre II - Oxyde de zinc: contrôle de la croissance
I Introduction ... 59II Méthode de synthèse ... 59
II.1 Particules de référence ... 59
II.2 Particules contenant des ions alcalins ... 61
III Stabilisation par l’amine seule ... 62
III.1 Caractérisations ... 63
III.2 Propriétés optiques ... 73
IV Stabilisation par le mélange acide/amine ... 78
IV.1 Synthèse et caractérisations... 79
V Conclusion... 87
Chapitre III - Oxyde fer, de cobalt et ferrite de cobalt
I Introduction ... 95II Synthèse ... 95
III Particules de maghémite... 97
III.1 Caractérisations structurales... 97
III.2 Propriétés magnétiques ... 105
IV Particules d’oxyde de cobalt et de ferrite de cobalt ... 114
IV.1 Particules d’oxyde de cobalt ... 114
IV.2 Particules de ferrite de cobalt ... 116
V Conclusion... 123
Chapitre IV - Monoxydes de fer et de cobalt
I Introduction ... 131 II Synthèse ... 131 III Caractérisations ... 133 III.1 HRTEM... 133 III.2 WAXS ... 136 IV Magnétisme ... 141IV.1 Particules de FeO ... 142
IV.2 Particules de CoO... 153
V Conclusion... 154
Chapitre IV - Réduction par un complexe amine-borane
I Introduction ... 163II Synthèse ... 166
III Les précurseurs de zinc ... 167
III.1 Caractérisation... 167
III.2 RMN et proposition d’un mécanisme ... 170
IV Les précurseurs de fer et de cobalt ... 174
IV.1 Caractérisation et magnétisme ... 175
IV.2 Stabilisation des particules de fer et de cobalt par une amine. Propriétés magnétiques... 183
V Conclusion... 186
Conclusion générale
Partie expérimentale
Chapitre I :
I Introduction ... 13
II Présentation des principaux modes de synthèse par voie chimique... 14
II.1 Synthèses par voie thermique ou en autoclave... 14
II.2 Synthèses par chimie « douce »... 17
II.2.1 Méthodes
par
précipitation et méthodes sol-gel... 18
II.2.2 Utilisation de ligands organiques et/ou de précurseurs
organométalliques... 22
III Quelques rappels : structure et propriétés des oxydes étudiés ... 30
III.1 Cas de l’oxyde de zinc... 31
III.2 Cas des oxydes magnétiques ... 36
Dans ce chapitre bibliographique, l’accent sera mis dans un premier temps sur les principales méthodes de synthèse développées dans la littérature pour l’obtention des particules d’oxyde de zinc, de fer et de cobalt. Dans un second temps, nous présenterons les propriétés de luminescence ou de magnétisme associées à ces oxydes.
I
Introduction
Depuis plusieurs décennies, un effort important de la recherche sur les nanomatériaux est consacré au développement et à l’amélioration des méthodes de synthèse. En effet, l’obtention de matériaux de taille et de forme contrôlées à l’échelle nanométrique est un prérequis nécessaire à de nombreuses applications dans des domaines aussi variés que l’électronique (stockage de l’information[1]…), l’optique (effet laser[2]…), la catalyse (état intermédiaire entre catalyse homogène et hétérogène[3]…) ou bien encore la médecine (marquage cellulaire,[4, 5] traitements par hyperthermie[5]…).
De nombreuses méthodes de synthèse aussi bien physiques que chimiques ont été développées pour permettre l’obtention de tels matériaux. Les méthodes physiques dites "top-down" telles que l’ablation laser,[6] le magnetron sputtering[7] et l’électrodéposition[8] sont basées sur la décomposition d’un matériau massif afin d’en réduire la taille. Ces méthodes demandent généralement des installations lourdes et coûteuses sans pour autant toujours assurer l’obtention de particules homogènes. Les méthodes chimiques dites "bottom-up", quant à elles, sont plus aisées à mettre en oeuvre et consistent à faire croître les particules en utilisant des molécules comme entités de départ. Les principales voies utilisées sont la réduction de sels métalliques[9] ou la décomposition de précurseurs inorganiques.[10] Une particularité de ces techniques reste tout de même la présence de molécules, des stabilisants, autour des particules n’offrant pas une surface « nue ». Les particules obtenues sont des matériaux hybrides constitués d’un cœur inorganique habillé par une couche de molécules organiques. La présence de molécules organiques en surface des nanoparticules va en assurer la stabilisation par encombrement stérique ou par répulsions électrostatiques.[11] De plus, ce matériau hybride pourra être manipulé aussi bien en milieu aqueux qu’organique en fonction des molécules greffées sur sa surface.[12]
Les particules d’oxydes métalliques peuvent être obtenues directement par l’une de ces méthodes[13] ou bien après oxydation de particules métalliques déjà formées.[14] La stabilité de la plupart des particules d’oxydes métalliques dans des conditions standard de pression et de température permet d’envisager leur utilisation directe dans de nombreux domaines, sans avoir recours à un traitement a posteriori tel que leur enrobage par un matériau isolant.
II Présentation des principaux modes de
synthèse par voie chimique
Dans cette partie, les principales méthodes utilisées pour la synthèse par voie chimique de particules d’oxyde de zinc ainsi que de particules d’oxyde de fer et de cobalt sont présentées.
II.1 Synthèses par voie thermique ou en autoclave
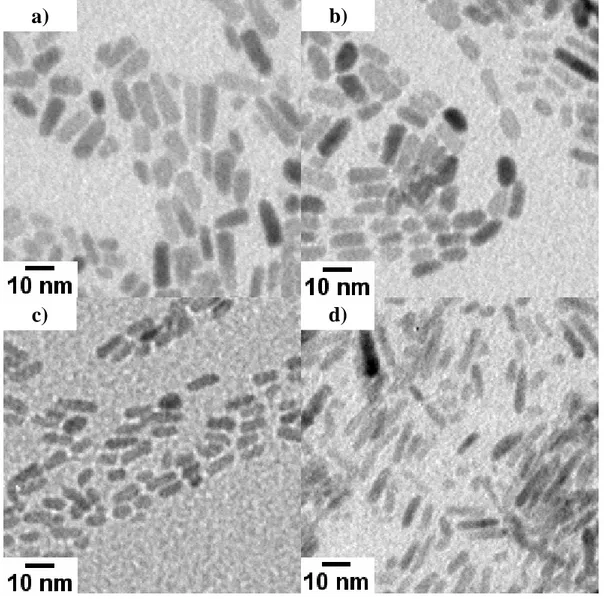
Parmi les nombreuses techniques développées pour la synthèse de particules d’oxydes métalliques, certaines font appel à des températures élevées (supérieures à 500°C) ou bien à des pressions supérieures à la pression atmosphérique. Citons à titre d’exemple les méthodes dites hydrothermales ou solvothermales,[15-21] les méthodes de dépôt en phase vapeur (CVD)[22, 23], « d’évaporation thermique »[2, 24-29] ou de pyrolyse par laser[30] ou par spray,[31] pour ne citer que les plus répandues. Ces modes de synthèse conduisent souvent à la formation d’objets micrométriques pouvant avoir des formes particulières telles que des bâtonnets, des rubans, des fleurs, etc (Figure I-1).[17, 28]
Figure I-1 : Images représentant diverses formes pouvant être obtenues pour ZnO.[32]
♦ L’oxyde de zinc
Qian et ses collaborateurs ont développé plusieurs protocoles de synthèses en autoclave pour obtenir des particules d’oxyde de zinc en milieu aqueux .[15, 17, 19] Le choix du précurseur (chlorure de zinc, acétate de zinc ou zinc métallique) ainsi que des agents oxydants ou stabilisants (ammoniac, citrate de sodium, hydrazine, soude et peroxyde d’hydrogène) leur permet d’obtenir sélectivement des bâtonnets ou des plaquettes de ZnO.
En ce qui concerne les méthodes de CVD et « d’évaporation thermique » le principe est d’évaporer un précurseur (zinc métallique ou alkylzinc) sous flux d’argon en contrôlant la quantité d’air ou d’oxygène introduite dans le milieu réactionnel. Ce genre de synthèse a généralement pour but de faire croître l’oxyde de zinc directement sur un substrat en silicium,[24] avec ou sans l’assistance d’une couche d’accrochage préalablement formée, telle que de l’or.[2, 26, 27] La formation de nanobâtonnets est privilégiée bien que des architectures plus variées telles que des tétrapodes[29] ou des opales[22, 23] puissent être obtenues.
♦ Les oxydes magnétiques
Différents oxydes magnétiques sont obtenus par voie hydrothermale. Le choix des conditions de synthèse détermine la nature de la phase obtenue. Les précurseurs pouvant être
utilisés sont souvent des sels tels que les chlorures, les nitrates, les sulfates de fer et de cobalt.[33-36] La présence d’amine, d’acide ou de sulfonate conduit à la formation de particules de forme et de taille relativement bien contrôlées. Il est toutefois possible, à la différence de ZnO, de modifier la phase oxyde obtenue par un traitement a posteriori (oxydation ou réduction).[34, 37] D’autres précurseurs tels que les acétates,[38] les acétylacétonates[39] ou
encore les cupferronates (N-nitroso-N-phenylhydroxylamine)[40, 41] de fer ou de cobalt sont
aussi utilisés. Ces derniers permettent de synthétiser aussi bien les phases γ-Fe2O3, CoFe2O4
que CoO avec des tailles de particules inférieures ou égales à 10 nm.
Wang et al. ont développé une méthode hydrothermale généralisable à la formation de nombreux oxydes, dont la magnétite et la ferrite de cobalt, à partir de linoléate de fer ou de cobalt. La procédure consiste à utiliser un milieu comportant trois phases différentes, les réactions se produisant aux interfaces (Figure I-2). Les particules obtenues sont uniformes en taille et ont un diamètre moyen de 9 nm pour Fe3O4 et 12 nm pour CoFe2O4.[42]
Figure I-2 : Schéma représentant le protocole expérimental suivit par Wang et al.[42]
Des particules de taille supérieure à quelques dizaines de nanomètres peuvent être obtenues aussi bien par voie hydrothermale que par évaporation. Zhao et al. ont synthétisé des
nanobâtonnets d’hématite de 500 nm à 2 μm de long en utilisant ces deux méthodes de synthèse différentes.[43] Ce groupe a aussi montré que ce genre de particules peut être obtenu par traitement thermique de particules de fer en présence de vapeur d’eau.[43, 44]
Des méthodes de pyrolyse, soit par laser[30] soit par spray,[31, 45, 46] ont aussi été
développées en choisissant des précurseurs comme des chlorures, des acétylacétonates ou des carbonyles. De nombreux exemples peuvent être trouvés dans la littérature sur l’obtention de particules de maghemite de tailles allant de 5 à 180 nm en fonction des conditions expérimentales.[31, 45, 47] Les particules obtenues peuvent être étudiées directement après leur synthèse ou être enrobées par une couche de silice ou de dextran, assurant ainsi leur dispersion et leur stabilité dans le temps.[30, 31]
Dans la suite de cette partie, l’accent sera mis sur les synthèses réalisées par voie chimique. Plus précisément, nous nous focaliserons sur les méthodes de synthèse utilisant des conditions de pression et de température qualifiées de douces, c’est-à-dire à pression atmosphérique et à des températures inférieures ou égales à 300°C.
II.2 Synthèses par chimie « douce »
De nombreuses méthodes de synthèse par voie dite de chimie « douce » ont été développées. Dans les paragraphes suivants, les synthèses faisant intervenir la réaction d’une base sur un sel métallique en milieu aqueux ou organique ainsi que des méthodes de décomposition d’un précurseur organométallique en présence de solvants à haut point d’ébullition seront présentées.
II.2.1 Méthodes par précipitation et méthodes sol-gel
♦ L’oxyde de zinc
Une méthode très répandue dans la littérature consiste à effectuer la décomposition d’un sel de zinc par ajout, dans le milieu, d’une base à des températures le plus souvent inférieures à 100°C.[48-50] Cette méthode peut être modifiée en fonction du choix du sel de départ,[51] de la base (forte[48] ou faible[52]) et de l’ajout de polymères pour stabiliser les particules.[53] En effet, dans ce type de synthèse, les particules ne sont que très rarement stabilisées par des ligands autres que les espèces provenant de la décomposition des réactifs.[51]
Le sel de zinc le plus utilisé est l’acétate de zinc anhydre ou dihydraté. La précipitation de l’oxyde de zinc s’effectue généralement en milieu alcoolique par addition d’une base forte. Ce protocole, élaboré par Spanhel et al., consiste à dissoudre le sel de zinc par ultrasons puis à ajouter une solution d’hydroxyde de lithium (LiOH).[54] Les synthèses sont réalisées à 0°C et
directement à l’air. L’utilisation d’autres bases telles que NaOH ou KOH ne leur a pas permis d’observer la formation de particules. La taille des particules obtenues évolue au fil du temps, passant de 3,5 nm après dix minutes à 5,5 nm après 5 jours. Toutefois, en faisant varier la quantité de base dans le milieu ainsi que la température de synthèse, les particules synthétisées sont décrites comme étant de forme et de taille légèrement différentes.[54] La stabilisation des particules étant assurée uniquement par les ions acétate présents dans le milieu, la taille moyenne des particules augmente par mûrissement d’Ostwald.[55]
Cette méthode a été reprise et améliorée quelques années plus tard par Meulenkamp.[49] Le mélange des réactifs préalablement dissous dans l’éthanol est réalisé en contrôlant le taux d’eau présent dans le milieu. La taille des particules initialement obtenues à 0°C est de 2 nm. Le diamètre moyen des particules évolue tout de même rapidement, atteignant 7 nm après quelques jours. Cet auteur et son groupe ont réalisé de nombreuses études portant sur la croissance, la dissolution et les propriétés de luminescence des particules obtenues suivant cette méthode de synthèse.[56-58]
Bien que Spanhel et al. n’aient pas réussi à mettre en évidence la possibilité d’obtenir des particules d’oxyde de zinc en utilisant d’autres bases que LiOH, plusieurs groupes ont reporté dans la littérature que l’utilisation de bases fortes telles que NaOH ou KOH permettait l’obtention de particules de taille inférieure à dix nanomètres.[59-61] Comme dans le cas précédent, l’absence de ligands capables de bloquer la croissance des particules induit une augmentation de leur taille en fonction du temps de réaction et de la température. Pacholski et al. ont en effet montré que des particules sphériques, obtenues par addition d’hydroxyde de potassium à de l’acétate de zinc en milieu alcoolique, peuvent devenir des nanobâtonnets si le milieu est porté à reflux pendant au moins deux heures.[50] L’utilisation d’une base plus faible, telle que l’hydroxyde de tétraméthylammonium, est aussi décrite dans la littérature et conduit à la formation de particules pouvant avoir des tailles allant de 1 à 15 nm.[52, 62] Toutefois, bien que cette méthode apparaisse être plus rapide à mettre en oeuvre que la méthode de Spanhel grâce, notamment, à une meilleure solubilisation des réactifs et l’absence d’utilisation des ultrasons, la taille des particules reste soumise au mûrissement d’Ostwald.
L’acétate de zinc n’est pas le seul précurseur à pouvoir être utilisé dans ce genre de synthèses. En effet, des travaux reportent l’utilisation des halogénures ou des perchlorates de zinc comme réactifs.[13] Des particules sphériques sont ainsi obtenues en présence d’hydroxyde de potassium et ont un diamètre moyen compris entre 2 et 5 nm. Ces valeurs sont comparables à celles obtenues lors de l’utilisation de l’acétate de zinc dans les mêmes conditions.[13] Hu et al. ont réalisé une étude comparative entre les trois précurseurs de zinc précédemment cités (acétate, bromure et perchlorate).[13] Il en résulte que la vitesse de croissance des particules, à température constante, dépend du contre-ion libéré dans le milieu lors de la décomposition du précurseur. La constante de vitesse qui lui est associée augmente du bromure à l’acétate de zinc et atteint la valeur la plus élevée pour les ions perchlorates. La vitesse de croissance dépend donc de l’adsorption de l’anion sur la surface des particules.
Parmi les méthodes sol-gel, Pillaï et al. ont utilisé une voix de synthèse faisant intervenir non pas une base mais un acide.[63] Une fois le mélange de l’acétate de zinc et de
l’acide oxalique réalisé dans l’éthanol, le matériau est calciné jusqu’à une température de 500°C. Le principe de cette méthode est basé sur la substitution des ions acétates par les ions oxalates afin d’obtenir un gel. Ce gel est en suite chauffé à des températures élevées pour obtenir des poudres nanostructurées.
Ainsi que nous l’avons déjà mentionné, les méthodes présentées précédemment utilisent comme agent stabilisant uniquement les ions libérés dans le milieu par la décomposition du précurseur métallique. Comme ont pu le montrer Hu et al., ces ions peuvent être des ions acétate, bromure ou perchlorate.[13] Il est important de noter que quelques groupes ont réalisé la décomposition de l’acétate de zinc en milieu basique en présence d’un polymère. Les polymères utilisés peuvent être de la polyvinilpyrrolidone (PVP) ou bien des dérivés du polyéthylèneglycol (PEG).[64, 65] Les particules obtenues ont des tailles inférieures à 10 nm. Malgré la présence du polymère dans le milieu, les particules semblent ne pas conserver une taille constante en fonction du temps. De plus, après réaction, le milieu contient toujours des traces des réactifs utilisés et notamment de lithium, vraisemblablement sous forme d’oxyde.[65]
♦ Les oxydes magnétiques
Une méthode simple et très répandue dans la littérature consiste à réaliser la précipitation ou la coprécipitation, en milieu aqueux, de sels de fer et/ou de cobalt en présence d’une base.[66, 67] Les sels utilisés sont principalement des chlorures de fer (II) ou (III) et de cobalt (II). La taille et la forme des particules obtenues dépendent grandement des conditions de synthèse et plus particulièrement : 1) du rapport entre les ions métalliques, 2) de la température, 3) du pH et 4) de la présence dans le milieu de molécules pouvant se coordiner à la surface des particules.[68]
Le mélange de chlorures de fer (II) et de fer (III) dans un rapport 1/2 en présence d’hydroxyde de sodium (pH compris entre 11 et 12) conduit à la formation de nanoparticules de magnétite comme a pu le montrer Kang et ses collaborateurs.[69] Après précipitation et lavage à l’eau distillée, des particules de 8,5 nm sont isolées. L’oxydation de ces particules peut être réalisée par acidification du milieu à un pH de 3,5 suivi d’un reflux sous air. Des aiguilles de maghémite, 50 x 6 nm, sont ainsi obtenues. Morales et al. ont mis en évidence l’effet de l’utilisation de bases différentes lors de la phase de précipitation sur la taille des particules.[70] En effet, lorsque les hydroxydes de sodium, de potassium ou d’ammonium sont utilisés, le diamètre moyen des particules de magnétite varie de 8,9 à 13,5 nm. La phase maghémite est obtenue par recuit à 250°C sous air. La taille peut être réduite en introduisant
1% de poly(vinyl alcool) (PVA) dans le milieu réactionnel mais n’atteint pas les tailles obtenues par pyrolyse laser, comme le montrent les auteurs.
L’utilisation d’ions oléates permet à Fried et al. de réaliser des films Langmuir-Blodget de particules de magnétite ou de ferrite de cobalt.[71] Un dernier exemple de stabilisation peut être cité : il s’agit des travaux de Bonacchi et al., qui utilisent la γ-cyclodextrine. Des cristaux de particules de γ-Fe2O3 ou de CoO sont ainsi obtenus.[72, 73]
La taille des particules n’est pas aisément contrôlée par la méthode de coprécipitation décrite précédemment. Le groupe de Jolivet a cependant montré que la synthèse de nombreux oxydes, et notamment les oxydes de fer, peut être réalisée de manière contrôlée en milieu aqueux. [74, 75] L’ajustement des conditions de synthèse, notamment du taux d’hydroxylation et du rapport Fe(II)/Fe(III), conduit à la formation de différentes phases oxyhydroxyde. Les complexes hydroxylés ne sont pas stables en phase aqueuse et se condensent de deux manières différentes en fonction de la sphère de coordination environnant les cations métalliques. Le premier mécanisme est un mécanisme d’olation, c’est-à-dire l’élimination d’une molécule d’eau suivie par la formation d’un pont hydroxo entre deux monomères. Le deuxième mécanisme, appelé oxolation, consiste en la formation d’un pont oxo par élimination d’une molécule d’eau. La température ainsi que le pH de la solution vont favoriser l’un de ces deux mécanismes et donc permettre de contrôler la phase et la taille des particules obtenues. [67]
La stabilisation des particules peut aussi être réalisée par une réaction sol-gel qui consiste à structurer le milieu réactionnel par la décomposition de précurseurs le plus souvent silylés.[76] Il se forme une matrice qui assure la croissance contrôlée des particules. Des particules de maghémite ou de ferrite de cobalt sont ainsi facilement obtenues par décomposition de nitrate de fer et/ou de cobalt en présence de tétraéthoxysilane (TEOS) en milieu aqueux ou alcoolique, avec l’ajout d’acide citrique, d’éthylène glycol ou bien encore d’urée. [77] Après une phase de gélation, le matériau est séché pendant plusieurs heures à une
température avoisinant les 50°C. Ainsi, l’utilisation d’un précurseur de silice permet de créer des cavités dans le milieu et favorise le contrôle de taille des particules. Cannas et al. obtiennent aussi des particules de magnétite par imprégnation directe d’une matrice de silice déjà préformée.[78] Dans ce cas, la taille des particules est assujettie à la taille des pores de la silice contrairement au cas où le TEOS est utilisé comme précurseur, et dans lequel la taille des particules dépend principalement du temps dédié à la formation du gel. Le TEOS peut
facilement être remplacé par l’oxyde de propylène ou l’épichlorohydrine (respectivement 1,2-époxypropane et 1-chloro-2,3-1,2-époxypropane) pour initier la phase de gélation. [79, 80] Des nanobâtonnets ainsi que des nanosphères sont alors obtenus par cette méthode.
La méthode de microémulsion peut conduire à des résultats similaires par formation de cavités dues aux surfactants utilisés. Le groupe de Pileni a largement utilisé cette méthode pour obtenir des particules de maghémite ou de ferrite de cobalt en milieux aqueux.[11, 81] Le
principe repose sur la décomposition par une base faible, par exemple la diméthylamine, des dodécylsulfates de fer et/ou de cobalt. Dans ce cas, les ions dodécylsulfates assurent la formation de micelles au cours de leur libération dans le milieu réactionnel. L’utilisation de dodécylbenzènesulfonates de fer et/ou de cobalt conduit à des résultats identiques comme l’ont montré Lee et al.[82] La formation de micelles est aussi obtenue à l’aide de bromure de cétyltriméthylammonium (CTAB).[83] Par exemple, dans ces conditions, des bâtonnets de ferrite de cobalt de taille micrométrique sont obtenus.[83] Woo et al. ont aussi montré que les méthodes sol-gel et de microémulsion peuvent être combinées en mileux aqueux. [84] La phase de gélation est assurée par l’oxyde de propylène et l’ajout de l’acide oléique comme surfactant leur permet de réaliser des microémulsions. La taille des nanobâtonnets formés dépend alors de la concentration de surfactant durant la phase de gélation.
Cette étude bibliographique montre qu’il est difficile d’obtenir des particules de taille et de forme bien contrôlées par le biais des méthodes de précipitation ou sol-gel. L’utilisation de conditions de synthèse différentes, accompagnées de l’ajout d’agents stabilisants dans le milieu, semble donc nécessaire pour un contrôle efficace de la morphologie des particules.
II.2.2 Utilisation de ligands organiques et/ou de précurseurs
organométalliques
Notre étude bibliographique montre que l’utilisation de ligands organiques (amines, acides carboxyliques et oxydes de phosphine) permet l’obtention aussi bien de particules métalliques que d’oxydes métalliques dont la taille et la forme peuvent être contrôlées de manière précise. Les agents stabilisants les plus couramment utilisés possèdent des groupements fonctionnels amine,[85] acide carboxylique[10] ou bien encore oxyde de
phosphine.[86] La cristallinité des particules obtenues est améliorée par rapport aux synthèses par précipitation, grâce à une température de synthèse plus élevée pouvant avoisiner, dans certains cas, les 300°C.[87-89] Les modes d’utilisation des agents stabilisants sont variés. En effet, ces ligands peuvent être utilisés soit comme solvants de réaction,[90] soit en quantité stœchiométrique[91] ou en léger excès par rapport au précurseur métallique,[92] ou bien encore
peuvent provenir de la décomposition du précurseur métallique.[91] Le choix du précurseur
métallique est tout aussi important. Il peut être un acétylacétonate[93] ou bien un autre précurseur organométallique.[89]
Murray et al. ont développé une méthode consistant à injecter une solution contenant le précurseur organométallique dans un solvant organique à reflux, en présence du ou des stabilisant(s) (Figure I-3).[94]
Figure I-3 : Schéma de la méthode de synthèse développée par Murray et al.[94]
La thermolyse du précurseur conduit à la formation de germes. Le nombre de germes formés dépend de la stabilité des précurseurs employés. Ainsi, les phases de nucléation et de croissance peuvent être contrôlées. Les ligands organiques présents dans le milieu contrôlent la dispersion en taille des particules par une interaction plus ou moins forte avec la surface des particules. Des particules de 5 nm comme des architectures 3D peuvent facilement être obtenues. Les facteurs clés de cette méthode sont 1) le rapport entre les réactifs, 2) la température de synthèse et 3) le temps de réaction. Si le précurseur utilisé est à l’état zérovalent, la thermolyse conduira à la formation de particules métallique qui seront oxydées soit par reflux sous air, soit par addition dans le milieu d’un oxydant.
Injection
Chauffage et agitation
♦ L’oxyde de zinc
Précédemment, nous avons vu que l’acétate de zinc est largement utilisé dans les synthèses hydrothermales. L’ajout de ligands dans le milieu réactionnel apparaît donc comme une suite logique à ces méthodes de décomposition. En effet, l’utilisation d’agents stabilisants va, a priori, permettre une stabilisation plus efficace des particules que les groupements acétates. La décomposition de ce précurseur est réalisée à des températures comprises entre 150 et 300°C en fonction du solvant utilisé.[95-97] Des particules de tailles et de formes variées peuvent être obtenues en fonction du stabilisant. Par exemple, O’Brien et al. ont mis en évidence la formation de bâtonnets, de triangles ou de sphères lors de l’utilisation de trioctylamine, hexadécanol ou octadécène, respectivement, en plus de l’acide oléique.[97] Récemment Zhang et al. ont mis en évidence l’interaction de l’oléylamine avec l’acétate de zinc et son rôle lors du chauffage du milieu réactionnel entre 180 et 320°C.[98] Dans ce cas, l’amine réalise une attaque nucléophile sur le groupement carbonyle de l’acétate et induit ainsi la formation d’oxyde de zinc et de l’amide correspondant. L’oléylamine en excès agit comme stabilisant des particules formées. Dans le même ordre d’idée, Joo et al ont montré que l’utilisation du 1,12-dodecanediol (méthode polyol[94]) conduit à l’élimination d’un ester par réaction du diol sur la fonction acétate.[99]
La mise en évidence de l’interaction des ligands avec l’acétate de zinc a conduit certains auteurs à envisager de façonner des précurseurs organométalliques avec des ligands carboxyliques possédant une chaîne alkyle plus longue que celle de l’acétate.[100-102] L’objectif
de cette approche est d’agir sur les paramètres de formation des particules tels que les vitesses de nucléation ou de croissance.
Dans cet but, la synthèse de complexes comme l’éthylhexanoate,[100] l’oléate[101] ou le stéarate de zinc[102] a été effectuée. Ces deux derniers complexes sont décomposés en présence de l’acide correspondant, respectivement l’acide stéarique et l’acide oléique, à des températures supérieures à 250°C. Des nanoparticules en forme de pyramides sont obtenues. La méthode développée par Choi et al. leur permet de synthétiser, à partir de l’oléate de zinc, des quantités importantes (supérieures à 2g) de particules de taille et de forme contrôlées.[101]
La présence d’une fonction carboxylique dans le précurseur de zinc n’est pas une condition nécessaire pour l’obtention de particules. Par exemple, le groupe de Driess a
synthétisé de nombreux précurseurs organométalliques basés sur la formation d’un cœur inorganique sous forme de cubane. Ce cœur est composé de quatre atomes de zinc et de quatre atomes d’oxygène.[103, 104] Récemment, ce groupe a montré que la thermolyse du tétramère (méthyl-tert-butoxyde)zinc ([MeZnOtBu]4) conduit à la formation de particules de ZnO.[104]
L’utilisation de tels précurseurs permet, en contrôlant les paramètres de synthèse, d’étudier les défauts structuraux responsables de la luminescence ainsi que les propriétés catalytiques des nanoparticules de ZnO. La méthode de synthèse développée par ce groupe lui permet d’obtenir des poudres nanostructurées, sans toutefois obtenir des particules isolées de taille bien contrôlée. La synthèse de ZnO par thermolyse de ce précurseur ne permet pas la stabilisation des particules.[104] En revanche, en utilisant des précurseurs similaires mais en réalisant leur décomposition à reflux dans le N-méthylimidazole, Boyle et al. ont synthétisé des particules de taille supérieure à 10 nm ainsi que des bâtonnets de 50 à 100 nm de long et 7 à 13 nm de large.[105] Les particules sphériques sont obtenues par décomposition d’un précurseur mononucléaire tandis que les bâtonnets proviennent de la décomposition d’un précurseur polynucléaire.[105] Bien que la dispersion en taille reste importante, l’utilisation d’une entité pouvant agir comme stabilisant (dans ce dernier cas le méthylimidazole) permet d’isoler des particules.
La thermolyse de précurseurs possédant des groupements alkyles et/ou alkoxydes a aussi été développée par d’autres groupes mais en utilisant cette fois l’oxyde de trioctylphosphine (TOPO) comme ligand. Par exemple, Kim et al. ont montré que la décomposition du [EtZnOiPr] en présence de deux équivalents de TOPO à 160°C conduit à la formation de particules d’environ 3 nm.[106] Le précurseur utilisé rappelle ceux employés par Driess et son groupe. L’ajout dans le milieu de TOPO permet effectivement de contrôler la taille des particules et empêche tout grossissement des particules au cours du temps. La stabilisation des particules par l’intermédiaire du TOPO peut aussi être réalisée en utilisant le diéthylzinc, comme a pu le montrer Shim et ses collaborateurs.[107] Le mélange de [Zn(Et)2] et
d’octylamine injecté dans un large excès de TOPO conduit à la formation de particules de 3 nm de diamètre. Cette taille reste stable en fonction du temps, contrairement aux particules synthétisées directement dans l’amine.
Bien que moins fortement liées à la surface des particules que les groupements TOPO, les amines servent efficacement à la stabilisation des particules de ZnO. O’Brien et collaborateurs ont ainsi pu montrer qu’en utilisant l’acétate de zinc ou des complexes organométalliques tels que le zinc cupferronate [bis(N-nitroso-N-phénylhydroxylamine)zinc]
ou cétoacidoximate [bis(2-(méthoxyimino)propanoate) de zinc (II)] des nanoparticules de ZnO stabilisées par des amines peuvent être obtenues.[108] Le choix du précurseur couplé à la variation de la température d’injection permet d’obtenir des tailles comprises entre 3,9 et 13,0 nm.
Les travaux de cette thèse s’inscrivent dans la continuité de ceux développés par le groupe. Ils sont basés sur la synthèse de particules par voie organométallique. En effet, le groupe a acquis depuis de nombreuses années un savoir faire important dans la synthèse de particules métalliques dans des conditions douces de pression et de température. Ces particules sont obtenues par réduction d’un précurseur organométallique en milieu organique en présence de stabilisants. Ainsi, des particules métalliques (fer,[109] cobalt,[110] ruthénium[3]…) ou d’alliages métalliques (fer-cobalt,[111] fer-rhodium…) peuvent être obtenues (Figure I-4). La stabilisation de ces particules par des polymères ou des ligands organiques (amines et/ou acides carboxyliques à longues chaînes alkyles) permet d’obtenir des organisations dans des réseaux à trois dimensions.[109, 112] Ceci permet d’en étudier les propriétés chimiques et physiques (catalyse, magnétisme). Les oxydes métalliques tels que l’oxyde d’étain,[113] d’indium[114] et de cobalt[115] ont été obtenus par oxydation de particules métalliques.
Figure I-4 : Images d’organisations a) de nanocubes de fer[109] et b) de particules de fer-cobalt.[111]
b)
a)
Plus récemment, le groupe a développé une autre voie de synthèse permettant l’obtention de particules de ZnO, basée sur l’hydrolyse contrôlée du précurseur organométallique bis(cyclohexyl)zinc, ([Zn(Cy)2]), (Figure I-5).[116-119]
ZnCy
2+ x Ligand
ZnO:Ligand
x+
H2O, T.A.
2
Figure I-5 : Schéma réactionnel pour l’obtention de particules de ZnO.
La décomposition du précurseur a lieu directement à l’air lors de l’évaporation du solvant. La stabilisation des particules est assurée par des amines et/ou des acides carboxyliques, ce qui permet d’obtenir des particules de taille et de forme contrôlées ainsi que des organisations en deux et trois dimensions (Figure I-6).
Figure I-6 : Nanoparticules de ZnO obtenues suivant la méthode de Kahn et al.[118]
♦ Les oxydes magnétiques
Il a été montré, dans la partie précédente de cette étude, qu’une grande variété de précurseurs organométalliques pouvaient être utilisés pour l’obtention de particules de ZnO. Il en est de même pour les particules d’oxyde de fer et de cobalt.
Tout d’abord, des particules d’oxyde de fer, de cobalt ou de ferrite de cobalt peuvent être obtenues par la décomposition d’un précurseur carbonyle suivie par l’oxydation des particules.[120, 121] Cette dernière étape peut être réalisée par aération de la solution contenant
oxydant. L’oxyde de triméthylamine ((CH3)3NO) apparaît dans la littérature comme l’agent
oxydant principalement utilisé.[85] Sa présence lors de l’injection du précurseur conduit à l’oxydation directe des particules lors de leur formation. Le groupe de Hyeon a montré que cette méthode est efficace avec les précurseurs carbonyles de fer et de cobalt tels que Fe(CO)5, Co2(CO)8 ou bien encore CpCoFe2(CO)9.[123, 124] D’autres réactifs comme l’acide
3-chloropéroxybenzoïque (mCPBA)[121] ou le N-oxyde de 2,2,6,6-tétraméthylpipéridine
(TEMPO)[125] peuvent être employés pour oxyder les particules dans des conditions de synthèse similaires. L’oxydation des particules peut aussi être réalisée en présence d’un diol (méthode polyol).[87, 93] Il s’agit généralement de l’hexadécane-1,2-diol ou du dodecane-1,2-diol. Cette méthode permet d’obtenir des oxydes de fer et de cobalt à partir de précurseurs acétylacétonates[93] ou carbonyles[87]. Les particules obtenues peuvent avoir des formes diverses telles que des sphères, des cubes ou des tétrapodes, comme a pu le montrer récemment le groupe de Manna.[126-129] Il est important de noter que le rapport de concentration entre le précurseur et le surfactant, notamment le diol, conditionne la taille des objets obtenus. Les nanoparticules obtenues par la méthode polyol ont une dispersion en taille ainsi qu’une cristallinité comparables à celles obtenues pour des particules synthétisées par ajout d’oxyde de triméthylamine.[122, 126]
Ainsi, la décomposition des précurseurs joue un rôle important dans l’obtention des particules de taille et de forme contrôlées. C’est pourquoi certains groupes essaient d’utiliser d’autres complexes organométalliques. Par exemple, Rockenberger et al. ont utilisé un cupferronate de fer afin d’obtenir des particules de maghémite d’environ 7 nm.[130] Une étude comparative de la décomposition des précurseurs acétylacétonate et carbonyle de fer a été menée par Redl et al.[131]. Différentes conditions expérimentales ont été testées : les paramètres comme la température de synthèse, l’utilisation de différents surfactants ou encore l’introduction dans le milieu du N-oxyde de pyridine comme agent oxydant ont été variés.[131] Les particules obtenues ont une taille inférieure à 30 nm. Cependant, certaines synthèses sont constituées de particules polycristallines. Pour une même synthèse, les phases Fe3O4, γ-Fe2O4
et Fe1-xO ont pu être identifiées.[131]
Par ailleurs, l’analyse du milieu réactionnel a permis, dans certains cas, de mettre en évidence la formation de complexes entre le métal et les surfactants. C’est notamment le cas avec l’acide oléique.[132, 133] Il a ainsi été montré que l’utilisation directe de complexes d’oléate de fer ou de cobalt permet un meilleur contrôle de la phase de nucléation, et donc la réduction de la dispersion en taille des nanoparticules.[10, 134] Cette approche, développée par
le groupe de Hyeon, lui permet ainsi de synthétiser des particules d’oxyde de fer ou de cobalt à l’échelle du gramme.[10, 134] La taille des particules est modulée par ajout successif de précurseur dans le milieu réactionnel jusqu’à obtention de la taille désirée. Cette taille varie de 6 à 15 nm.[91] Dans le cas de la synthèse de particules de CoO, des sphères, des triangles ainsi que des bâtonnets sont obtenus par la même méthode.[135]
Un avantage des méthodes utilisant des solvants à haut point d’ébullition est l’obtention de particules monodisperses, c’est-à-dire des nanoparticules possédant une déviation standard de leur taille inférieure à 5 %. Ceci permet notamment de réaliser des dépôts homogènes et d’envisager leur utilisation dans des systèmes destinés au stockage de l’information.[10, 136-138] Un autre avantage des synthèses par voie chimique est la fonctionnalisation de la surface des particules. En effet, le passage dans des milieux aqueux des particules synthétisées dans des solvants organiques reste un challenge en vue d’applications biologiques.[12, 139, 140] Certains groupes ont donc développé des techniques permettant la fonctionnalisation de la surface des particules après synthèse pour réaliser le transfert de phase.[12] Cette fonctionnalisation peut aussi être réalisée en une seule étape. En effet, Hui et al. réalisent directement la synthèse des particules de magnétite à reflux dans la 2-pyrrolidone ou dans un polyéthylène glycol fonctionnalisé qui sert à la fois de solvant et de ligand.[141, 142] Les particules ainsi obtenues sont directement solubles dans l’eau.
III Quelques rappels : structure et propriétés
des oxydes étudiés
Quelles que soient les applications visées, la taille des particules va être déterminante. Par exemple, le rendement quantique ainsi que la longueur d’onde de la luminescence dépendent de la taille des particules.[143] De même, le contrôle de la taille des particules est important puisque le passage au travers des barrières physiologiques de l’organisme n’est possible que pour les objets de quelques nanomètres. Cette partie présente l’influence de la taille des particules sur certaines propriétés physiques telles que la luminescence pour ZnO ou le magnétisme pour les oxydes de fer, de cobalt ou mixtes fer-cobalt.
III.1 Cas de l’oxyde de zinc
Les études concernant l’oxyde de zinc et ses propriétés physiques ont connu un regain d’intérêt depuis quelques années avec la découverte d’effets tels que l’émission laser observée sur des nanobâtonnets,[2] l’intégration de nanoparticules de ZnO dans des cellules photovoltaïques[144] ou des diodes électroluminescentes.[145] En effet, dans le cas des cellules photovoltaïques, le rayonnement solaire va être absorbé par les particules de ZnO. Ceci va générer un déplacement d’électrons et donc former un courant électrique. A l’inverse, dans le cas des diodes électroluminescentes, le courant électrique crée le mouvement des électrons. Celui-ci génère l’émission d’une lumière blanche. Des particules d’oxyde de zinc peuvent également être utilisées dans les cosmétiques, notamment en tant qu’absorbant ultraviolet.[146,
147] Enfin, en incorporant au sein des particules des ions dopants tels que des ions alcalins ou
de métaux de transition, d’autres propriétés telles que la ferroélectricité[148] ou le ferromagnétisme[149] peuvent être observées.
Les caractéristiques principales de l’oxyde de zinc sont les suivantes. ZnO cristallise principalement dans un système hexagonal (würtzite). Les structures blende et rock-salt peuvent toutefois être obtenues, mais dans des conditions bien spécifiques de température et de pression,[150] et ne feront pas l’objet de cette étude. La structure würtzite est une maille hexagonale (groupe d’espace P63mc) où chaque atome d’oxygène est entouré par quatre
atomes de zinc et réciproquement (Figure I-7). Les paramètres de maille dans l’état massif sont : a = 3.25Å et c = 5.21Å. La croissance selon l’axe c, et donc la formation de bâtonnets, pourra être privilégiée en contrôlant des paramètres tels que la température, la pression ou les ligands présents dans le milieu.[118, 151] Par exemple, les ligands sont généralement plus labiles suivant l’axe c, privilégiant ainsi l’insertion dans le réseau des atomes de zinc et d’oxygène et favorisant la croissance selon c.[152]
Figure I-7 : représentation schématique de la structure würtzite. Les atomes de zinc sont représentés en noir, les atomes d’oxygène en rouge. Fiche JCPDS maille P63mc.
L’oxyde de zinc a comme caractéristique physique d’être un semi-conducteur à grand gap direct possédant un écart entre la bande de valence (BV) et la bande de conduction (BC) de 3,34 eV à température ambiante. L’irradiation de ce matériau par une source ultraviolette conduit au passage d’un électron de la BV à la BC et à la formation d’un trou dans la BV. La recombinaison de cette paire électron-trou peut se faire directement. L’énergie libérée conduit à l’émission d’un photon vers 380 nm à température ambiante, nommé exciton. La recombinaison de la paire électron–trou peut aussi se faire de manière simultanée par l’intermédiaire de niveaux de moindre énergie. L’écart entre les niveaux énergétiques étant moins grand, l’énergie libérée sera plus faible et donc la longueur d’onde du photon émis sera plus grande. La luminescence sera observée dans le visible et principalement dans le jaune (Figure I-8).
400 500 600 700 800 In t. (u .a .) λ / nm
Figure I-8 : Luminescence jaune de particules de ZnO sous une longueur d’onde d’excitation de 320 nm.[153]
De nombreuse études concernant la luminescence des particules de ZnO sont reportées dans la littérature comme l’ont montré en 2006 Djurisic et al.[154] Les causes de cette luminescence ne sont toujours pas clairement identifiées et peuvent être dues à plusieurs phénomènes : premièrement à la déviation par rapport à une structure würtzite idéale, c’est-à-dire à la présence de défauts d’oxygène ou encore d’atomes de zinc ou d’oxygène interstitiels ;[58, 154] deuxièmement, à la coordination de molécules à la surface des particules.[153] Van Dijken et ses collaborateurs ont effectivement montré que les défauts d’oxygène peuvent conduire à cette luminescence jaune.[58] Toutefois, la présence de zinc interstitiel et/ou d’hydroxydes de surface est aussi reportée dans la littérature comme pouvant être la cause de la luminescence.[52] Bien que la luminescence jaune soit la plus fréquemment rencontrée, une émission dans le bleu est aussi décrite dans la littérature.[60, 153, 155] Ces deux
luminescences n’avaient jusqu’alors jamais été observées simultanément sur un même matériau. Or, notre groupe a pu montrer que la méthode de synthèse par voie organométallique conduit à des particules dont la luminescence est blanche, ce qui correspond à la superposition des luminescences bleu et jaune.[153] La coordination d’amines à la surface des particules conduit à cette émission particulière. En effet, la formation du niveau énergétique responsable de la luminescence bleue est attribuée à l’augmentation de la densité électronique à la surface des particules grâce au doublet électronique porté par la fonction amine. Cette interaction a été mise en évidence aussi bien pour des particules sphériques que
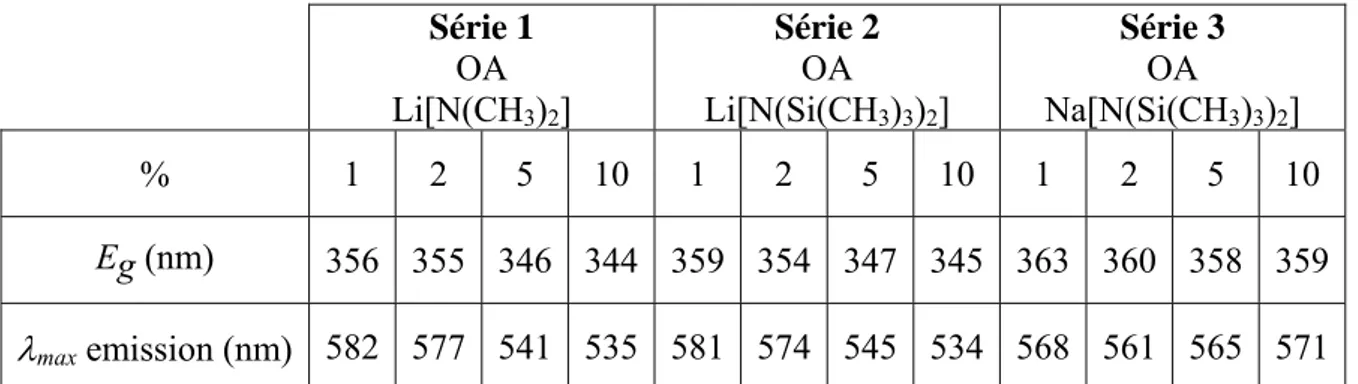
pour des nanobâtonnets. L’intensité de la luminescence bleue a pu être directement corrélée à la quantité d’amine présente à la surface des particules. Les niveaux énergétiques ont été déterminés en diminuant la longueur d’onde d’excitation de 380 à 360 nm pour induire le passage de l’électron directement de la bande de valence aux niveaux intermédiaires. Une représentation des différents niveaux énergétiques responsables de la luminescence des nanoparticules est reportée Figure I-9. Les figures sont les suivantes : a) recombinaison directe de la paire électron-trou, b) luminescence jaune due à l’écart entre les niveaux 1 et 3, c) luminescence bleue due à l’écart entre les niveaux 2 et 4 et d) présence des deux luminescence avec possibilité pour l’électron excité de passer du niveau 1 au niveau 2.
λexc λem= 370nm
a
λem= 580nm 1 3b
λem= 440nm 1 2 4c
λem= 580nm λem= 440nm 1 2 3 4d
λexc λem= 370nma
λexc λem= 370nm λexc λem= 370nma
λem= 580nm 1 3b
λem= 580nm 1 3 λem= 580nm 1 3b
λem= 440nm 1 2 4c
λem= 440nm 1 2 4 λem= 440nm 1 2 4c
λem= 580nm λem= 440nm 1 2 3 4d
λem= 580nm λem= 440nm 1 2 3 4 λem= 580nm λem= 440nm 1 2 3 4d
Figure I-9 : Représentation schématique des niveaux d’énergie associés à la luminescence de ZnO.[153]
Comme il a été montré précédemment, les défauts sont responsables de la luminescence de ZnO dans le visible. Cependant, il est bien connu que la réduction de taille des particules entraîne également une modification des propriétés de luminescence.[49] Dans le cas d’un matériau massif, la représentation des niveaux énergétiques est réalisée par un modèle de bandes. Les niveaux occupés et vacants sont représentés sous forme de deux continuums d’énergie séparés par un écart plus ou moins grand appelé band-gap. Seuls les défauts sont représentés comme des niveaux discrets d’énergie et sont localisés entre les bandes. Lorsque la taille du matériau diminue et atteint une valeur inférieure à 10 nm,[49, 156] le
passage dans un état dit de « confinement quantique » s’effectue. Cette transition a pour conséquence d’accroître l’écart entre BV et BC (Figure I-10) comme ont pu le montrer les travaux de Brus et de Meulenkamp.[49, 157]
Eg E
BC
BV
Figure I-10 : Représentation schématique du passage de l’état massif à l’état de confinement quantique.
Bien que l’écart entre BV et BC augmente, l’énergie des niveaux liés aux défauts reste identique (Figure I-9).[57] L’accroissement de l’écart entre BV et BC conduit à l’émission de photons de plus haute énergie, c’est-à-dire de longueur d’onde plus faible, lorsque l’électron revient dans l’état fondamental. Ceci est observé à la fois pour la bande excitonique et pour la ou les bandes liée(s) aux défauts.[62, 158] Par exemple, la luminescence jaune décrite précédemment tend vers le bleu lorsque la taille des particules diminue.[49, 158] La variation du band-gap peut être reliée à la variation de la taille des particules par plusieurs méthodes de calcul, comme il a été montré par Brus[156] puis par Kayanuma[159] (Equation I-1). Ces calculs ont été utilisés par de nombreux groupe tels que ceux de Meulenkamp,[49] Mulvaney[62] et en 2006 par O’Brien.[108] * 248 , 0 572 , 3 * 2 2 y B y B g R R a R R a E E ⎟− ⎠ ⎞ ⎜ ⎝ ⎛ − ⎟ ⎠ ⎞ ⎜ ⎝ ⎛ + =
π
Les différents paramètres de cette équation sont : Eg valeur du band-gap pour l’oxyde
de zinc massif, Ry* constante de Rydberg effective, R rayon de la particules et aB rayon de
Bohr. L’accord entre cette équation et les résultats expérimentaux apparaît satisfaisant, bien que des incertitudes sur les valeurs des paramètres utilisés subsistent toujours. Selon Wood et al., les valeurs de aB et Ry* peuvent varier de 1,5 à 3 Å et de 30 à 160 mV respectivement.[62]
Un autre facteur conduisant à une incertitude de calcul est l’estimation expérimentale du band-gap. En effet, Wang et ses collaborateurs préconisent d’utiliser le maximum de la bande excitonique.[108] Toutefois, Meulenkamp et sont groupe ont, pour leur part, préféré utiliser le point d’inflexion de la bande d’absorption avec des résultats comparables.[49]
Nous avons vu dans cette partie que les propriétés optiques des particules de ZnO vont dépendre de la taille, de l’état de surface et des défauts structuraux, paramètres qui dépendent du choix de la méthode de synthèse. L’incidence du contrôle de la taille des particules de ZnO sur les propriétés optiques sera montrée dans le chapitre II, relatif à l’incorporation d’ions alcalins dans le milieu réactionnel.
III.2 Cas des oxydes magnétiques
L’utilisation de particules d’oxydes magnétiques de taille nanométrique suscite beaucoup d’intérêt dans des domaines aussi variés que l’électronique ou la médecine. En effet, des appareils composés de particules d’oxydes magnétiques présentent un fort potentiel dans le stockage de l’information (disque dur), la spintronique ou en magnétorésistance.[160] Dans ce dernier cas, l’effet d’un champ magnétique va conditionner le passage ou non d’un courant électrique dans le matériau grâce aux interactions entre les électrons et le moment magnétique des particules.[138, 160] Dans le cas d’applications médicales, des particules superparamagnétiques sont déjà testées et utilisées dans le traitement des tumeurs par hyperthermie.[5] Il s’agit principalement d’oxydes de fer (SPION, acronyme anglais). Cette méthode consiste à injecter les particules fonctionnalisées dans un organisme vivant et à les soumettre à l’action d’un champ magnétique alternatif. Les particules fixées à la région cible créent localement une augmentation de température sous l’effet du champ magnétique, détruisant ainsi la tumeur. La réduction de taille permet d’envisager le passage des particules au travers de certaines barrières de l’organisme et de traiter ainsi des zones jusqu’alors
inaccessibles. La littérature reporte aussi le développement d’applications ne faisant pas intervenir le magnétisme de ces oxydes. Il s’agit notamment de l’utilisation dans le domaine de la catalyse[161] et dans le stockage de l’énergie.[162, 163] Dans ce dernier cas, l’oxyde de cobalt est principalement utilisé comme anode des batteries au lithium. L’établissement d’un courant engendre l’oxydation du lithium en Li2O. L’objectif de ces recherches reste de
pouvoir construire un système réversible. En effet, le système n’a un intérêt technologique qu’à la condition de pouvoir réaliser un nombre important de cycles d’oxydation et de réduction.
Contrairement au cas de l’oxyde de zinc, la détermination structurale de particules d’oxyde de fer, de cobalt ou mixte fer-cobalt est rendue difficile par la possible formation de nombreuses phases cristallines composées des ions métalliques à différents degrés d’oxydation.[164] En effet, dans le cas des oxydes de fer, pas moins de six phases différentes peuvent être synthétisées, dont quatre sans avoir recours à des conditions particulières de pression ou de température. Les phases couramment rencontrées sont la magnétite (Fe3O4), la
maghémite (γ-Fe2O3), l’hématite (α-Fe2O3) ou encore la wüstite (FeO). Le cas des oxydes de
cobalt est similaire : il est possible de synthétiser les phases Co3O4, Co2O3 et CoO. Seul la
ferrite de cobalt ne possède qu’une unique structure cristalline.
Parmi ces différentes phases cristallines, la plupart (CoFe2O4, Co2O3, Co3O4, Fe3O4,
γ-Fe2O3 ) adoptent la structure spinelle, caractérisée par un empilement cubique face centrée
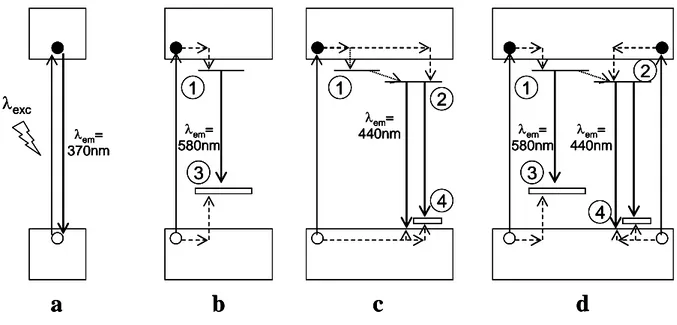
(cfc) d’atomes d’oxygène, dont tout ou partie des sites tétraédriques et octaédriques est occupée par des atomes métalliques (Figure I-11). La structure spinelle peut être composée d’atomes métalliques au degré d’oxydation II et/ou au degré d’oxydation III. On parle de spinelle normale ou inverse lorsque les atomes divalents occupent respectivement les sites tétraédriques ou octaédriques. Quand tous les atomes métalliques sont trivalents, les sites tétraédriques et octaédriques sont occupés. Des lacunes en ions métalliques assurent cependant la compensation de charge.[164] Cette classification en spinelle normale ou inverse
n’est cependant pas rigide. En effet, des ions d’une certaine valence peuvent se retrouver à la fois dans des sites tétraédriques ou octaédriques pour un même matériau qui sera qualifié de spinelle mixte. L’occupation relative des sites va dépendre de nombreux facteurs tels que la composition ou bien encore les conditions de synthèse.[164, 165]
Figure I-11 : Représentation schématique de la phase spinelle (atomes de fer en gris et atomes d’oxygène en rouge). Fiche JCPDS maille Fd3m.
Les monoxydes de fer et de cobalt, pour leur part, cristallisent dans des structures de type NaCl (Figure I-12). Dans le cas idéal, ces structures sont constituées d’atomes métalliques au degré d’oxydation II. Cependant, ces structures présentent généralement des défauts d’atomes métalliques. Ceci est particulièrement vrai pour FeO, ce qui conduit généralement à noter cette phase Fe1-xO.[164]
Figure I-12 : Représentation schématique de la phase NaCl. (atomes de fer en gris et atomes d’oxygène en rouge). Fiche JCPDS maille Fm-3m.
La présence d’ions métalliques porteurs d’un moment magnétique va conférer aux structures décrites dans la partie précédente des propriétés magnétiques. L’interaction de ces moments magnétiques va se faire au travers des atomes voisins, non magnétiques, que sont les atomes d’oxygène. La valeur de cette interaction, appelée superéchange, dépend fortement des orbitales mises en jeu, du nombre d’électrons ainsi que de l’angle M1-O-M2. Ce
superéchange peut conduire à des températures d’ordre magnétique élevées.[166] Le
magnétisme des nanoparticules peut varier selon la nature chimique des matériaux mais aussi selon les conditions de synthèse. Pour une même phase cristalline, la taille, la cristallinité ainsi que les interactions entre les particules vont modifier les propriétés magnétiques.[9]
Le magnétisme associé aux phases spinelles est de type ferrimagnétique, tel que l’a démontré Néel en 1948.[167] En effet, dans une structure idéale, les moments magnétiques des deux sous-réseaux d’atomes métalliques (sites tétraédriques et sites octaédriques) sont orientés antiparallèlement. La compensation magnétique n’étant pas totale, il en résulte un moment magnétique avoisinant les 70 et 90 emu/g, respectivement, pour la maghémite et la magnétite dans l’état massif.[164] Toujours à l’état massif, l’établissement de l’ordre ferrimagnétique a lieu entre 850 et 900 K pour ces deux oxydes de fer. La réduction de taille va conduire à une diminution importante de ces valeurs et à l’existence d’une transition entre un état superparamagnétique et un état ferrimagnétique.[168] Le comportement magnétique des phases monoxydes de fer et de cobalt est différent de celui des spinelles. Ces phases sont répertoriées comme étant antiferromagnétiques à l’état massif. Une température d’ordre TN
égale à 211 et 298 K est effectivement enregistrée respectivement pour FeO et CoO.[164, 169] Toutefois, les écarts à la stœchiométrie idéale vont engendrer des défauts en ions métalliques et l’établissement d’un ordre ferrimagnétique. Les nanoparticules de monoxyde de fer et de cobalt seront aussi sujettes au superparamagnétisme.[168] Comme pour les phases spinelles, des particules de quelques nanomètres n’auront pas une aimantation, une température de blocage et une anisotropie effective identiques à celles du matériau massif. En effet, l’alignement imparfait des moments magnétiques à l’intérieur ou à la surface des particules conduira à une non-compensation des moments magnétiques et à des écarts par rapport au magnétisme observé pour les matériaux à l’état massif.[70]
Le modèle principalement utilisé dans la littérature pour décrire le magnétisme de nanoparticules magnétiques a été énoncé par Stoner et Wohlfarth en 1948.[170] Ce modèle
décrit le comportement de particules 1) monodomaines, 2) possédant une anisotropie uniaxiale et 3) sans interactions.
Premièrement, la formation de particules monodomaines n’est vérifiée qu’au dessous d’une taille critique déduite de l’Equation I-2.
2 8 18 s p c M E d
π
=Equation I-2 : Taille critique pour l’obtention de particules monodomaines.[169]
Cette taille critique dépend de l’aimantation spontanée du matériau Ms et de l’énergie
totale des parois Ep. Lorsque la taille des particules diminue, il sera énergétiquement
défavorable de former des parois à l’intérieur de ces particules. A titre d’exemple, la taille critique pour Fe3O4 et γ-Fe2O3 est respectivement de 128 et 166 nm.[9]
L’anisotropie est un autre facteur influençant les propriétés magnétiques.[166, 169] Elle peut être de plusieurs types : magnétocristalline, de forme ou de surface, pour ne citer que les plus couramment reportées dans la littérature. L’anisotropie magnétocristalline, tout d’abord, est liée au type de la structure cristalline considérée. L’aimantation d’un monocristal est en effet sensible à l’orientation du champ magnétique par rapport aux axes cristallographiques.[166] Les directions privilégiées d’aimantation sont appelées « axes de facile aimantation ». L’anisotropie magnétocristalline dépend à la fois du champ cristallin et du couplage spin-orbite. Ce dernier, reliant les spins au réseau cristallin, est dans le plupart des cas faible et sera traité comme une perturbation.[166] L’anisotropie magnétocristalline peut être de symétrie cubique, ou bien de symétrie uniaxiale. L’anisotropie de forme, quant à elle, intervient dans le cas d’un matériau non-sphérique.[166] Son origine provient de l’interaction dipolaire entre l’aimantation et le champ démagnétisant lié à la forme du cristal. Cette contribution à l’anisotropie totale du matériau peut même être du même ordre de grandeur que l’anisotropie magnétocristalline et peut conduire à l’absence de parois dans des particules dépassant la taille critique énoncée précédemment. L’anisotropie de surface, pour finir, a été démontrée par Néel[171] et trouve son origine dans la rupture de symétrie à laquelle sont
lors que le nombre d’atomes de surface devient important, c’est-à-dire dès que la taille devient faible.
Il est généralement difficile de différencier chacune des composantes de l’anisotropie totale d’un matériau, et il est d’usage d’introduire la notion d’anisotropie effective, notée Keff,
rendant compte des observations expérimentales. Cette valeur de l’anisotropie magnétique nous renseigne directement sur les qualités magnétiques du matériau considéré : matériau magnétique « dur » si la constante d’anisotropie est élevée, ou « mou » si elle est faible.[9] Dans le cas de la théorie Stoner-Wohlfarth, cette anisotropie effective peut être modélisée comme possédant un caractère uniaxial et sera représentée dans sa forme simplifiée selon l’Equation I-3. Keff représente l’anisotropie uniaxiale effective, θ l’angle entre le moment
magnétique et l’axe de facile aimantation et V le volume de la particule.
θ
2 sin V K E = effEquation I-3 : Anisotropie effective dans la théorie Stoner-Wohlfarth.[169]
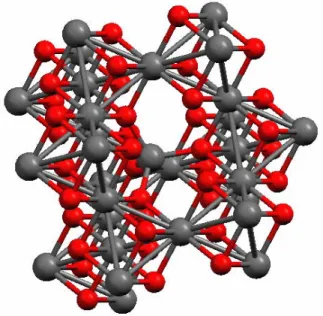
Ainsi, une particule peut se représenter comme un macrospin qui va se retourner au cours du temps sous l’effet de la température. La barrière énergétique entre deux positions opposées est égale à KeffV (Figure I-13). Lorsque la taille des particules est réduite, l’énergie
thermique kBT fournie au système va permettre le retournement du macrospin.[169] Le schéma
représenté ici est vrai pour un champ magnétique nul. L’application d’un champ magnétique va dissymétriser le potentiel et peut engendrer le retournement du macrospin.
Figure I-13 : Représentation de la fluctuation du macrospin associé à une particule d’anisotropie uniaxiale.
Cette fluctuation liée à la température va empêcher l’établissement d’une aimantation stable au dessus de la température de blocage, notée TB. Ce comportement a été nommé
superparamagnétisme par Néel.[172] La valeur du temps de relaxation, τ, d’une particule dans
l’état superparamagnétique suit une loi d’Arrhénius (Equation I-4), avec τ0 le temps de
relaxation intrinsèque au matériau étudié et kB la constante de Boltzmann.
⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ = T k V K B eff exp 0
τ
τ
Equation I-4 : Temps de relaxation associé à une particule dans l’état superparamagnétique.[172]
Le retournement du macrospin étant un phénomène dynamique, le temps de relaxation observé va dépendre de la méthode de mesure utilisée et plus particulièrement du temps de mesure.[9] Plus le temps de mesure sera court, plus la température de blocage sera élevée. Par
0 0,0 0,2 0,4 0,6 0,8 1,0
θ
Ene rgieK
effV
τ
H=0 T
0 π/2 π 3π/2 −π/2exemple, le temps de mesure en spectroscopie Mössbauer est de 10-8 s et est de l’ordre de la seconde lors de mesures statiques réalisées par l’intermédiaire du SQuID (Super Quantum Interference Device). Par conséquent, la valeur de TB en spectroscopie Mössbauer est plus
élevée que la valeur observée par SQuID.
Un facteur important influençant les propriétés magnétiques est la présence d’interactions magnétiques entre les particules. Tout d’abord, l’établissement d’interactions dipolaires peut avoir lieu lorsque la concentration des particules dans un échantillon est élevée. En effet, l’intensité des interactions entre les particules, considérées comme des macrospins, va dépendre de leur éloignement réciproque. Les travaux de Dormann, Cannas et de leurs collaborateurs ont effectivement montré que la dispersion des particules de maghémite dans des polymères[173, 174] ou des matrices de silice[76, 175] avait une influence importante sur les propriétés magnétiques de ces matériaux. Il apparaît difficile de donner une expression de l’énergie d’interaction puisqu’elle dépend de l’arrangement particulier des particules dans l’échantillon. Toutefois, Dormann et al. ont montré que l’énergie d’interaction pouvait être représentée par l’Equation I-5[173]. M représente l’aimantation des particules, V leur volume, L la fonction de Langevin, kB la constante de Boltzmann et d et ξ représentent
respectivement la distance entre particules et un paramètre angulaire associé.
(
)
∑
≈ j B j jL M Va k T a V M E 2 2int avec
(
3cos2 1)
3j j j d V a =
ξ
−Equation I-5 : Equation représentant l’énergie des interactions dipolaires entre particules.[173]
Lorsque les particules sont suffisamment proches les unes des autres voire en contact, un couplage d’échange peut s’établir entre les spins situés à leur surface. L’état de surface des particules ainsi que l’orientation réciproque des spins à leur surface, influencera donc l’intensité de ce couplage. Ce couplage peut s’établir en plus de l’interaction dipolaire magnétique décrite précédemment.
![Figure I-1 : Images représentant diverses formes pouvant être obtenues pour ZnO. [32]](https://thumb-eu.123doks.com/thumbv2/123doknet/2177166.10342/17.892.109.787.118.318/figure-images-representant-formes-pouvant-obtenues-zno.webp)


![Figure II-7 : Pic XPS pour la raie 1s du lithium dans des particules synthétisées à partir de 10 % de précurseur [Li(N(SiMe 3 ) 2 )]](https://thumb-eu.123doks.com/thumbv2/123doknet/2177166.10342/74.892.186.707.545.826/figure-pic-lithium-particules-synthetisees-partir-precurseur-sime.webp)