Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS École nationale supérieure d'ingénieurs (Poitiers)
Laboratoire de chimie et microbiologie de l eau - LCME (Poitiers) (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac Secteur de recherche : Chimie et microbiologie de l'eau
Présentée par :
Nasma Hamdi El Najjar
Cinétiques et mécanismes d'oxydation
de composés pharmaceutiques par le chlore, l'ozone et les radicaux hydroxyle
Directeur(s) de Thèse :
Nathalie Karpel Vel Leitner, Marie Deborde Soutenue le 20 septembre 2012 devant le jury Jury :
Président Bernard Legube Professeur des Universités, Université de Poitiers Rapporteur Naim Ouaini Professeur, Université Saint Esprit de Kaslik, Liban Rapporteur Stéphane Bouchonnet Ingénieur de recherche, École Polytechnique de Palaiseau Membre Nathalie Karpel Vel Leitner Directeur de recherche CNRS, Université de Poitiers Membre Marie Deborde Maître de conférences, Université de Poitiers
Membre Jean-Pierre Duguet Directeur de recherche, Véolia Environnement, Paris
Pour citer cette thèse :
Nasma Hamdi El Najjar. Cinétiques et mécanismes d'oxydation de composés pharmaceutiques par le chlore, l'ozone et les radicaux hydroxyle [En ligne]. Thèse Chimie et microbiologie de l'eau. Poitiers : Université de Poitiers, 2012. Disponible sur Internet <http://theses.univ-poitiers.fr>
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(ECOLE NATIONALE SUPERIEURE d’INGENIEURS de POITIERS) (Diplôme National - Arrêté du 7 août 2006)
Ecole Doctorale : Sciences pour l'environnement GAY LUSSAC
ED n°523
Secteur de Recherche : CHIMIE ET MICROBIOLOGIE DE L'EAU
Présentée par
NASMA HAMDI EL NAJJAR
Maitre ès sciences
************************
Cinétiques et mécanismes d'oxydation de composés
pharmaceutiques par le chlore, l'ozone et les radicaux hydroxyle
************************Soutenue le 20 septembre 2012, devant la Commission d’Examen ************************
JURY
Rapporteurs : M. S. BOUCHONNET M. N. OUAINI Examinateurs : M. J-P. DUGUET M. B. LEGUBEDirecteurs de Thèse : Mme N. KARPEL VEL LEITNER
A mes parents
Pour tout ce que vous m’avez inculqué et appris.
A ma mère, pour ta persévérance.
A mon père, pour ta confiance.
Recevez ce mémoire en guise de remerciement
et témoignage de mon amour.
ii
Ce travail a été réalisé à l'Institut de Chimie des Milieux et des Matériaux (IC2MP), UMR CNRS 7285, Équipe Chimie de l'Eau et Traitements des Eaux.
J'exprime ma sincère reconnaissance à Monsieur le Professeur Bernard LEGUBE, Directeur de l'Ecole Nationale Supérieure d'Ingénieurs de Poitiers, ancien directeur du laboratoire de Chimie et Microbiologie de l'Eau, pour m'avoir accueillie au sein de son équipe. Je le remercie pour sa gentillesse et pour l'honneur qu'il me fait en participant au jury de cette thèse.
J'adresse mes plus vifs sentiments de gratitude à mes directeurs de thèse Mme Nathalie Karpel Vel Leitner, Directeur de Recherche à l'IC2MP, et Mme Marie Deborde,
Maîtres de Conférences à l'IC2MP, sans qui cette thèse n’aurait pas vu le jour. Au travers de
nos discussions, elles m'ont apportée une compréhension plus approfondie des divers aspects du sujet. Je salue aussi leur souplesse et leur ouverture d'esprit qui m'ont laissé une marge de liberté pour bien mener à ce travail de recherche.
Je remercie la société SANOFI AVENTIS pour avoir financée ce travail et tout particulièrement Monsieur Romain JOURNEL, Ingénieur direction HSE environnement Sanofi Aventis, pour l'intérêt qu'il a porté à mon sujet de recherche et pour avoir suivi de plus près l'avancement du travail.
Je tiens à remercier Monsieur Stéphane BOUCHONNET, Professeur à l'Ecole Polytechnique, et Monsieur Naïm OUAINI, Professeur à l'Université Saint-Esprit de Kaslik (USEK-Liban), pour avoir bien voulu juger ce travail et accepter d'en être rapporteurs.
Je remercie également Monsieur J-Pierre DUGUET, Conseiller scientifique à Veolia Environnemnt, pour avoir accepté d'être examinateur de ce travail.
J'adresse toute ma reconnaissance et mes vifs remerciements à Monsieur Naïm OUAINI, Professeur à l'Université Saint-Esprit de Kaslik, et à Mme Claude DAOU, Docteur
iii
m’avoir fait confiance et m'avoir encouragée dès le début de mon parcours.
Je tiens à remercier la mémoire de Monsieur Bernard Parinet qui m'a écoutée et m'a encouragée dès les premiers jours de mon arrivée à Poitiers et qui aurait bien aimé être présent parmi nous ce jour-là.
Je remercie également Monsieur Joseph De Laat, Professeur à l'Ecole d'ingénieurs Supérieurs de Poitiers, avec qui j'ai fait mes premiers pas dans le domaine de la recherche scientifique.
Un travail de thèse est le fruit d’un travail collectif, je tiens à remercier ici toutes les personnes m’ayant aidée tout au long de mon parcours.
Merci aux personnels permanents du laboratoire, pour leur gentillesse mais aussi pour leur soutien et leur encouragement, Florence, Hervé, Jérôme, Sahidou, Nathalie R.,
Karine, Noémie, Béatrice, Bertrand, Sandra, Audrey, Elodie, Sylvie ….
Bien sûr merci aux doctorants (et docteurs) du laboratoire que j’ai côtoyé et avec qui
j’ai passé de bons moments. Merci de m'avoir supportée, encouragée et aidée, dans tous les sens du terme, tout au long de cette thèse. Merci à Leslie, Turki, Justine, Nicolas, Emilie, Babak, Quynh, Manal, Yen, Julien, Elodie, Gaëlle, Emmanuelle, Clémence, Mélissa, Diab,
Ghizlane, Manhal, Patrick, Pamela, Alice, Odissa, Aude, Céline, …
Je remercie particulièrement Arnaud Touffet pour son amitié, pour avoir pu faire des manipulations ensemble et pour avoir contribué énormément à l'avancement du travail.
J’aimerais remercier également Cristina Soïca qui m’a soutenue et encouragée, qui m’a comblée avec ses câlins, bisous et son inestimable gentillesse.
Ces remerciements ne seraient pas complets sans une pensée pour mes amis et amies,
les jumelles Nadine et Fatim, pour nos rêves d'adolescentes et pour m’avoir encouragée,
Khodr, pour m’avoir fait découvrir la ville de poitiers dès les premiers jours de mon arrivée,
iv
plus moments les plus importants de ma vie poitevine, les bons comme les mauvais, et pour avoir supporter mes sauts d'humeur, Elias pour ton optimisme et ta confiance, Elie pour m’avoir supportée et pour avoir su me redonner le courage et la confiance qui me manquaient pour affronter ces derniers mois difficiles, Raëd pour ton aide précieux dans la relecture de la thèse, Soumaya, pour ta confiance, ton aide précieux en informatique et
surtout tes délicieux plats au moment où je n’avais pas le temps de cuisiner, Zeinab pour
m'avoir encouragée et soutenue.
Je remercie chaleureusement mon frère et mes sœurs. Mon frère Haissam pour avoir faire le trajet Berlin-Paris en voiture afin de m'accueillir dès mon arrivée en France, mes sœurs Nada et Raghda pour m'avoir fait confiance, encouragée et soutenue même de loin, ma sœur Sara pour m'avoir soutenue, écoutée et supportée tous les soirs à 21h et pour nos sorties « shopping » à Kalsruhe, Baden Baden et Achern. Mes remerciements vont également à mes beaux frères Souheil, Ali et Hachem.
Je ne saurais terminer sans remercier mes nièces, Lea, Aya et Lynn et mes neveux
Kamil, Amin et Nasri, aux regards coquins, pour m’avoir apportée le sourire et
l’enthousiasme.
Mes plus profonds remerciements vont à mes parents Sleiman et Fatima. Tout au long
de mon cursus, ils ont veillé sur moi, m'ont apporté un soutien sans faille, m’ont encouragée
et aidée. Ils ont su me réconfronter et me donner toutes les chances pour réussir. Qu'ils trouvent dans la réalisation de ce travail, l'aboutissement de leurs efforts ainsi que l'expression de ma plus affectueuse gratitude.
v
Les travaux décrits dans ce manuscrit de thèse ont été réalisés dans le cadre d'une convention entre la société SANOFI-AVENTIS, représentée par Mr. Pierre Jomier et Mr. Romain Journel, et l'équipe Chimie de l'Eau et Traitement des Eaux du Laboratoire de
Chimie des Milieux et des Matériaux de Poitiers (IC2MP, UMR 7285), représenté par
vi
REMERCIEMENTS ... II AVANT-PROPOS ... V
INTRODUCTION ... 1
CHAPITRE I : SYNTHÈSE BIBLIOGRAPHIQUE ... 1
I. Présence des composés pharmaceutiques dans les eaux ... 4
II. Composés pharmaceutiques étudiés ... 7
III. Dégradation des produits étudiés par les principaux procédés d’oxydation appliqués en traitement des eaux ... 13
CHAPITRE II : MATÉRIELS ET MÉTHODES ... 30
I. Réactifs et solutions ... 30
II. Protocoles expérimentaux ... 31
III. Méthodes analytiques ... 39
CHAPITRE III : OXYDATION DU MÉTRONIDAZOLE PAR LE CHLORE, L'OZONE ET LES RADICAUX HYDROXYLE ... 49
I. Etude cinétique d’oxydation ... 49
II. Etude de la toxicité et suivi des sous-produits d'ozonation ... 55
CHAPITRE IV : OXYDATION DU PARACÉTAMOL PAR LE CHLORE, L'OZONE ET LES RADICAUX HYDROXYLE ... 60
I- Projet d'article n° 1 : Kinetic and by-products of paracetamol oxidation by ozone and hydroxyl radicals ... 60
II- Projet d'article n° 2 : Aqueous chlorination of paracetamol : kinetic study, transformation products and toxicity ... 76
vii
L'OZONE ET LES RADICAUX HYDROXYLE ... 88
I- Projet d'article n° 3 : Oxidation of levofloxacin by ozone and hydroxyl radicals: kinetic study, transformation products and toxicity ... 88
II- Projet d'article n° 4 : Aqueous chlorination of levofloxacin: kinetic and mechanistic study, transformation product identification, and toxicity ... 105
CHAPITRE VI : SYNTHÈSE DES RÉSULTATS ET DISCUSSION ... 121
I. Approche cinétique ... 121
II. Etude des sous-produits d’oxydation et de la toxicité ... 128
RÉFÉRENCES BIBLIOGRAPHIQUES ... 140
RESUME ... 149
1
INTRODUCTION
Dans la vaste gamme de polluants d’origine anthropique qui atteignent nos ressources en eau, les produits pharmaceutiques et notamment les médicaments en vente libre constituent des sources de pollution continue vers l’environnement. Ces composés ont été mis en évidence dans l'environnement pour la première fois dans les années 80 et de nombreuses études réalisées en Europe et aux Etats-Unis depuis 1988 confirment cette présence. La plupart des médicaments modernes sont des composés organiques à faible poids moléculaire (inférieur à 500 Da) conçus pour avoir des effets pharmacologiques et physiologiques à de faibles doses. Ils sont donc intrinsèquement puissants et peuvent avoir des effets non intentionnels sur la faune naturelle. De plus, certains composés non biodégradables peuvent persister dans l’environnement pendant plusieurs années. Les concentrations retrouvées sont de l’ordre de la dizaine de nanogrammes par litre dans les eaux de surface. De même, certains de ces produits ont été observés dans les eaux souterraines et les eaux potables.
La chloration et l'ozonation sont fréquemment employées dans les filières de traitement de l'eau notamment pour la production de l'eau potable. Ces procédés bien que généralement utilisés pour leur action désinfectante présentent également un pouvoir oxydant vis-à-vis de la matrice organique et inorganique de l'eau. L'influence de tels traitements sur les produits pharmaceutiques a été rapportée à plusieurs reprises dans la littérature. Ces études ont montré que certains composés peuvent être éliminés facilement par les traitements oxydants, alors que d'autres y sont réfractaires. Il est à noter, pour les composés les moins réfractaires, que l'élimination ne signifie pas leur minéralisation complète et que nombreux d'entre eux peuvent être dégradés en d'autres produits également actifs et/ou toxiques vis-à-vis de l'environnement aquatique.
Ainsi, dans ce contexte, par soucis d'élargissement et d'approfondissement des connaissances actuelles sur l'occurrence de tels composés dans l'environnement aquatique, la société Sanofi-Aventis, première entreprise de l’industrie pharmaceutique en France, a souhaité connaître le devenir de produits pharmaceutiques lors de l'oxydation dans les filières de traitement d'eau.
2 La réactivité des oxydants sur les polluants émergents est l'une des principales thématiques de recherche développées au sein de l'équipe Chimie de l'Eau et Traitement des Eaux de l'UMR 7285. Ainsi, dans le cadre d'un partenariat avec la société Sanofi-Aventis, cette thèse s'est portée sur les cinétiques et mécanismes d'oxydation de composés pharmaceutiques par le chlore, l'ozone et les radicaux hydroxyle. Pour cela, Sanofi-Aventis a proposé d'étudier trois principes actifs médicamenteux: (i) le paracétamol (PRC) appelé aussi acétaminophène, un antalgique; (ii) le métronidazole (MNZ), un antibiotique appartenant aux nitroimidazoles; (iii) la lévofloxacine (LVF), un antibiotique de la famille des fluoroquinolones.
Tout d'abord, les travaux ont été conduits sur le plan cinétique par la détermination des constantes de premier et second ordre. Le suivi de l'élimination du composé initial a été accompagné par l'identification des sous-produits de réaction et par une étude de la toxicité. Ensuite, de manière à estimer la dégradation des composés étudiés au cours des étapes de chloration et d’ozonation, à partir des constantes cinétiques obtenues, une modélisation de leur oxydation dans les conditions de traitement de l’eau a été réalisée.
Ce mémoire s'est articulé directement autour de l'étude de l'oxydation des trois composés choisis par le chlore, l'ozone et les radicaux hydroxyle.
Le premier chapitre est consacré à des rappels bibliographiques portant sur la problématique des produits pharmaceutiques dans l'environnement aquatique. Dans ce chapitre, une attention particulière est portée sur les trois composés pharmaceutiques sélectionnés. Les connaissances actuelles concernant l'oxydation de ces composés par le chlore, l'ozone et les radicaux hydroxyle sont également présentés (en français).
Le second chapitre consiste en une description des protocoles de manipulation, et des méthodes analytiques mises en œuvre pour le dosage des différents composés pharmaceutiques et de leurs sous-produits d'oxydation, et pour le dosage des oxydants et le suivi de la toxicité (en français).
Le chapitre III est consacré à l'étude de l'oxydation du métronidazole par le chlore, l'ozone et les radicaux hydroxyle. L'ensemble des résultats obtenus allant de l'étude
3 cinétique jusqu'à l'identification des sous-produits et le suivi de la toxicité sont rapportés et comparés avec les données de la littérature (en français).
Les chapitres IV et V constituent le cœur de cette étude. Ces deux chapitres présentés sous forme de publications soumises ou en cours de soumission (en anglais), abordent les études d'oxydation du paracétamol et de la lévofloxacine respectivement par le chlore, l'ozone et les radicaux hydroxyle.
Enfin, dans le dernier chapitre de ce travail, l'ensemble des résultats obtenus sont récapitulés et discutés. Une approche comparative sur le devenir des trois composés sélectionnés au cours des étapes d’oxydation est alors abordée (en français).
CHAPITRE I
Chapitre I : Synthèse Bibliographique
I. Présence des composés pharmaceutiques dans les eaux ... 4
I.1. Origine des flux de produits pharmaceutiques vers les milieux aquatiques... 4
I.2. Principaux composés pharmaceutiques retrouvés dans les eaux ... 5
I.3. Risques potentiels dus à la présence des composés pharmaceutiques dans les eaux ... 6
I.4. Devenir au sein des stations d’épuration et dans l’environnement ... 7
II. Composés pharmaceutiques étudiés ... 7
II.1. Structures et propriétés physico-chimiques ... 7
II.2. Utilisation ... 8
II.2.1. Le paracétamol... 8
II.2.2. La lévofloxacine ... 9
II.2.3. Le métronidazole ... 9
II.3. Présence dans l’environnement ... 10
II.3.1. Le paracétamol... 10 II.3.2. La lévofloxacine ... 10 II.3.3. Le métronidazole ... 10 II.4. Toxicité ... 11 II.4.1. Le paracétamol... 11 II.4.2. La lévofloxacine ... 11 II.4.3. Le métronidazole ... 12
III. Dégradation des produits étudiés par les principaux procédés d’oxydation appliqués en traitement des eaux ... 13
III.1. Procédé de Chloration ... 13
III.1.1. Chloration du paracétamol ... 14
III.1.2. Chloration de la lévofloxacine ... 16
III.1.3. Chloration du Métronidazole ... 20
III.2. Ozonation et oxydation radicalaire ... 20
III.2.1. Ozonation et oxydation radicalaire du Paracétamol ... 22
III.2.2. Ozonation et oxydation radicalaire de la lévofloxacine ... 25
4
I. Présence des composés pharmaceutiques dans les eaux
I.1. Origine des flux de produits pharmaceutiques vers les milieux aquatiques
Les médicaments à usage humain atteignent l’environnement aquatique à l'issu de différentes voies. Tout d'abord, après administration à l’homme par voie orale, parentérale et/ou par voie locale, le composé pharmaceutique est en partie métabolisé par le foie et les reins. Un mélange de la molécule mère non métabolisée et des métabolites généralement plus polaires et plus hydrophiles que le composé parent peut alors être excrété via l’urine et les fèces dans les eaux usées (Silverman, 1992). D'autre part, les médicaments non utilisés jetés avec les déchets ménagers peuvent également polluer les sols et les eaux souterraines en cas d’enfouissement en décharge (Figure 1). Outre les médicaments à usage humain, les médicaments à usage vétérinaire constituent également une source de contamination des eaux. Dans ce second cas, ces composés présents dans les excréments des animaux et déversés dans le fumier (utilisé comme engrais dans le domaine de l'agriculture) peuvent ainsi ruisseler ou s’infiltrer à travers les sols pour rejoindre les eaux de surface (les eaux de rivière et les lacs) ou les eaux souterraines (Figure 1).
Par ailleurs, pour l'ensemble des composés pharmaceutiques, des rejets via les industries pharmaceutiques dans les eaux peuvent également être envisagés.
Concernant les eaux usées, contrairement aux attentes, les déchets d’hôpitaux ne constitueraient pas la principale source de contamination des eaux usées municipales par les produits pharmaceutiques (Kümmerer, 2008 ; Shuster et al., 2008). Des analyses d’antibiotiques dans une station d’épuration locale à Oslo ont montré que moins de 10 % de certains antibiotiques détectés proviennent des hôpitaux (Thomas et al., 2007). Cependant, les déchets d'hôpitaux seraient la source majeure des antibiotiques de la famille des céphalosporines (Kümmerer, 2008).
5 Médicaments à usage humain Médicaments à usage vétérinaire Effluents hospitaliers et domestiques Stations d’épuration municipales Médicaments non utilisés Déchets domestiques Décharges Boues d’épandage Fumier Sols
Eaux de surface Eaux souterraines
Eaux de boisson RISQUES ENVIRONNEMENTAUX RISQUES SANITAIRES excretion Eaux rejet excretion infiltration
Figure 1 : Origine des composés pharmaceutiques dans l’environnement (Defert et Huart, 2009)
I.2. Principaux composés pharmaceutiques retrouvés dans les eaux
La recherche des substances médicamenteuses actives dans l’environnement aquatique est devenue un sujet « émergent » en chimie environnementale. De nombreuses classes pharmaceutiques telles que des antibiotiques, des analgésiques, des anti-inflammatoires, des normolipémiants, des antihypertenseurs, des β-bloquants, des agents de contraste ou des antiépileptiques ont été retrouvées dans les eaux (Kolpin et al., 2002 ; Daughton et Ternes, 1999 ; Heberer, 2002 ; Boyd et al., 2003, Wiegel et al., 2004, Zwiener et al., 2000 ; Ternes, 1998 ; Zuccato et al., 2000 ; Stumpf et al., 1999 ; Halling-Sorensen et al., 1998 ; Paffoni et
al., 2006).
Les concentrations en produits pharmaceutiques retrouvées dans l’environnement varient d’un site à l’autre mais également d’un composé à l’autre. D’une manière générale, les concentrations rapportées dans les effluents de stations d’épuration vont du ng/L à quelques µg/L (Rosal et al., 2010 ; Togola et Budzinski, 2008 ; Mompelat et al., 2009 ; Yu et Wu, 2011 ; Shao et al., 2009 ; Paffoni et al., 2006). Dans les eaux de surface, des concentrations de l’ordre de 10 à 500 ng/Lont été rapportées (Kolpin et al., 2002 ; Daughton et Ternes, 1999 ; Heberer, 2002 ; Calamari et al., 2003 ; Paffoni et al., 2006 ; Tam tam et al.,
6 2008 ; Togola et Budzinski, 2008 ; Madureira et al., 2010 ; Silva et al., 2011). Enfin dans les eaux potables, des concentrations de l'ordre du ng/L ont parfois été retrouvées (Togola et Budzinski, 2008 ; Mompelat et al., 2009). Les différences régionales d’utilisation des médicaments ainsi que la biodégradabilité des produits pharmaceutiques et de leurs métabolites pourraient expliquer les différences de concentrations retrouvées dans l’environnement (Halling-Sorengen et al., 1998).
I.3. Risques potentiels dus à la présence des composés pharmaceutiques dans les eaux
De nos jours, l’évaluation des risques engendrés par la présence de composés chimiques dans l’environnement est prise en compte par les instances nationales et internationales (Agence nationale de sécurité sanitaire de l'alimentation, de l’environnement et du travail ANSES, Agence européenne du médicament). Des analyses effectuées dans le cadre de programmes de recherches sur les systèmes aquatiques naturels et non naturels permettent de répertorier ces molécules actives dans le milieu et d’évaluer les risques. De même, des études toxicologiques sont utilisées afin de déterminer différents paramètres comme l’EC50 (effective concentration, c'est-à-dire la dose de médicaments capable d’inhiber 50 % de la population témoin), le NOEC (no observable effect concentration) et le LOEC (lowest observable effect concentration), (Henschel et al., 1997 ; Hernando et al., 2006 ; Santos et al., 2010).
Concernant les produits pharmaceutiques, les effets potentiels engendrés par la présence des médicaments à l’état de traces dans les compartiments environnementaux sont encore peu connus. Toutefois, la présence de tels composés dans l'environnement est aujourd'hui avérée. De plus dans certains sites, des études antérieures ont montré que ces composés pouvaient nuire à l'environnement aquatique via des phénomènes de résistantes bactériennes ou de perturbation du système endocrinien (Sumpter, 1998 ; Kümmerer, 2004). Concernant le risque humain, une exposition aux substances pharmaceutiques via l'eau de boisson est envisageable si de telles substances ne sont pas suffisamment éliminées au cours des étapes de production d'eau potable. Selon certains auteurs, cette exposition de l'homme à de très faibles concentrations (de l'ordre de ng/L) ne présenterait pas de risque direct si l'on tient compte de l'effet individuel des substances, les doses ingérées via l'eau étant significativement inférieures aux doses thérapeutiques (Joyeux, 2006 ; Boulanger, 2011 ; Delagdo Zambrado et Albasi, 2009). Toutefois, aucune donnée sur les effets des substances en mélange ou des effets
7 à long terme pour ces doses absorbées n'est actuellement disponible. De plus dans le cas des antibiotiques des effets indirects sur l'homme via l'apparition de phénomènes de résistance bactérienne à certains antibiotiques peuvent être envisagés (Moubarek et al., 2003 ; Smith et
al., 1999).
I.4. Devenir au sein des stations d’épuration et dans l’environnement
La persistance d’une substance dans l’environnement dépend de nombreux facteurs tels que notamment ses propriétés physico-chimiques et ses caractères écosystémiques (nature, concentration des populations microbiennes, des matières dissoutes et en suspension, température, degré d’ensoleillement,…). Les principaux mécanismes d’élimination physique généralement attendus dans les écosystèmes aquatiques sont :
- la volatilisation et l’adsorption sur les solides en suspension et les sédiments, - la dégradation ou la transformation chimique et photochimique,
- l’absorption et la transformation par les micro-organismes.
Au sein des stations d’épuration, en plus de l’adsorption possible sur les boues et les sédiments, la principale étape d’élimination des polluants organiques pharmaceutiques est la biodégradation (Kümmerer et al., 2000 ; Joss et al., 2006 ; Yu et al., 2006). Toutefois, des études récentes ont montré que l’élimination des produits pharmaceutiques et/ou de leurs métabolites de moyenne et haute polarité par les stations d’épuration est souvent incomplète, de l’ordre de 60 à λ0 % (Ternes, 1λλ8 ; Ternes et Hirsch, 2000). D’autre part, d’autres études ont également montré que ces composés ne subiraient pas ou peu de biodégradation dans l’environnement.
II. Composés pharmaceutiques étudiés
II.1. Structures et propriétés physico-chimiquesTrois composés pharmaceutiques ont été retenus pour cette étude. Ces composés reportés dans le tableau 1, englobent deux antibiotiques (le métronidazole (MNZ) et la lévofloxacine (LVF)) et un antalgique (le paracétamol (PRC)).
8 Tableau 1 : Caractéristiques physico-chimiques des composés étudiés
Composé Formule
brute Formule moléculaire
Masse molaire (g/mole) Solubilité (g/L) log kOW pKa Métronidazole (MNZ) C6H9N3O3 171,16 10 -0,1 2,55 Lévofloxacine (LVF) C18H20FN3O4 361,37 > 50 -0,25 5,33 et 8,07 Paracétamol (PRC) C8H9NO2 151,16 14 0,46 9,5 II.2. Utilisation II.2.1. Le paracétamol
Le paracétamol, aussi appelé acétaminophène, est le principe actif de nombreuses spécialités médicamenteuses de la classe des antalgiques. Il est indiqué dans le traitement symptomatique de la fièvre et des douleurs d'intensité faible à modérée, seul ou en association à d'autres analgésiques. Le paracétamol est le médicament le plus prescrit en France. En 1998, sa consommation a été estimée à 2294 tonnes par an (Beausse, 2004).
Aux doses thérapeutiques, 90 à 100 % du paracétamol sont retrouvés dans les urines sous forme conjuguée avec l’acide glucuronique (60 %), sulfurique (35 %) ou la cystéine (3 %). Toutefois, des surdosages de paracétamol peuvent être mortels. En effet, à de fortes doses, le foie oxyde le paracétamol en N-acetyl-p-benzoquinone imine (NAPQI), un métabolite toxique qui entraîne une nécrose hépatique. Le NAPQI est instable et a tendance à s’hydrolyser en milieu aqueux pour former un composé aussi toxique le 1,4-benzoquinone (Dahlin et Nelson, 1982).
9 II.2.2. La lévofloxacine
La lévofloxacine est un antibiotique de la famille des fluoroquinolones. Ce composé est un énantiomère de la forme L, isomère de l’ofloxacine. Son action est d'empêcher la réplication bactérienne en bloquant les enzymes ADN gyrases nécessaires à l'ouverture de la double hélice d'ADN bactérienne. Ce traitement est largement utilisé sur les germes hospitaliers responsables d'infections nosocomiales.
La lévofloxacine fait partie des médicaments les plus consommés au Japon avec environ 14 à 16 tonnes de consommation annuelle. 85 % de la lévofloxacine administrée à l’organisme humain est éliminée sous forme inchangée dans les urines (Pharmaceuticals and Medical Device Agency).
II.2.3. Le métronidazole
Le métronidazole est un antibiotique de la famille des nitroimidazoles utilisé pour le traitement des infections causées par des bactéries anaérobies et des protozoaires. Il agit en inhibant la synthèse des acides nucléiques. Le métronidazole possède un faible poids moléculaire lui permettant de passer à travers les parois cellulaires des bactéries aérobies et anaérobies (Tally et Sullivan, 1λ81). A l’intérieur de la cellule, le métronidazole est réduit pour former des intermédiaires réactifs qui seront ensuite responsables de l’altération de l’ADN cellulaire (Andersen et al., 1982 ; Dobias et al., 1994 ; Tally et Sullivan, 1981). Aux Etats-Unis, ce composé fait partie des 100 médicaments les plus prescrits (Bendesky et al., 2002). Il est aussi largement employé en Europe par exemple au Danemark où 0,75 tonne de substance active est consommée annuellement (Lanzky et Halling Sorensen, 1997).
Dans l’organisme humain, le métronidazole est largement métabolisé par le cytochrome P-450 dans le foie (Dobias et al., 1994 ; Siegmund et al., 1992). La métabolisation consiste en une oxydation de la chaîne latérale et une formation primaire de 3 métabolites. Pour ce composé, une grande partie de la dose administrée est excrétée dans les urines (Dobias et al., 1994 ; Lau et al.,1992 ; Tally et Sullivan, 1981). Environ 6 à 18 % de la dose administrée est excrétée sous forme inchangée, 44 à 60 % sous forme de métabolites. 14 % de la dose est excrétée via les fèces (Lau et al., 1992 ; Andersen et al., 1982). Des études montrent qu’un
10 des métabolites du métronidazole est aussi actif que la molécule mère contre les microorganismes (Lau et al., 1992 ; Pendland et al.,1994).
II.3. Présence dans l’environnement
II.3.1. Le paracétamol
Dans une étude conduite par Ternes et al. (1998) en Allemagne, le paracétamol a été détecté à des concentrations allant jusqu’à 6 µg/L dans les effluents des stations d’épuration. Kolpin et al. (2002) ont détecté le paracétamol dans 24 % des échantillons d’analyses pour 13λ cours d’eau différents aux Etats Unis. Les concentrations retrouvées étaient de l’ordre de 0,11 µg/L avec des concentrations maximales de 9,97 µg/L.
Les domaines de concentration généralement retrouvés dans les effluents hospitaliers, les eaux usées traitées et les eaux de surface pour le paracétamol sont respectivement de l’ordre de 0,5 à 29 µg/L (Gomez et al., 2006), 0,032 à 4,3 µg/L (Gomez et al., 2007) et 4 à 73 ng/L (Kim Sang D. et al., 2007).
II.3.2. La lévofloxacine
Le domaine de concentration de la lévofloxaxine dans les eaux semble être peu répertorié à ce jour. Toutefois, dans un travail réalisé par Yasojima et al. (2006), le suivi de la lévofloxaxine dans les influents et les effluents d’une station d’épuration a été réalisé. Après un traitement classique par boues activées, la lévofloxacine a été détectée à une concentration de 301 ng/L dans les effluents alors qu'une concentration de 502 ng/L avait été observée en entrée de la station d'épuration. Le rendement d’élimination proche de 42 % a donc été noté. Dans une autre étude réalisée par Kim et al. (a), en 2009, des concentrations de l’ordre de 87,4 ng/L ont été reportées dans les eaux de rivière en Corée du Sud.
II.3.3. Le métronidazole
Les domaines de concentration généralement retrouvés dans les eaux usées non traitées et dans les eaux de surface pour le métronidazole sont respectivement de l’ordre de 10 à 126
11 ng/L (Kümmerer et al., 2000 ; Santos et al., 2010). Dans les effluents hospitaliers, des concentrations plus élevées, de l’ordre de 70 à 110 µg/L ont été relevées (Kümmerer et al., 2000).
II.4. Toxicité
II.4.1. Le paracétamol
De nombreuses études toxicologiques du paracétamol sur différents taxons (algues, poissons, bactéries…) ont été effectuées à ce jour (Santos et al., 2010). Par exemple, en 1997, Henschel et al., ont déterminé une EC50 de 650 mg/L sur Vibrio fischeri après 30 minutes de contact avec les bactéries. Selon Santos et al. (2010), l’espèce la plus sensible serait
Daphnia magna pour laquelle des valeurs d’EC50 de l’ordre de 30 à 50 mg/L ont été
rapportées. Pour ce composé une valeur de PNEC (predicted no-effect concentration) de 9,2 µg/L a été estimée (Santos et al., 2010).
II.4.2. La lévofloxacine
Pour la lévofloxacine, dans une étude réalisée au Japon par Yamashita et al. (2006), des tests de toxicité sur la bactérie marine Vibrio fisheri, l’algue verte d’eau douce
Pseudokirchneriella subcapitata et les crustacés planctoniques Daphnia magna ont été
menées. Dans ce travail, une évaluation des risques écologiques a été discutée par comparaison des concentrations retrouvées dans l’environnement et des résultats de tests d’écotoxicité obtenus. Pour des concentrations comprises entre 0,032 et 8,2 ng/L, la lévofloxacine ne semblerait pas provoquer d'inhibition de la luminescence bactérienne après 15 minutes d’exposition sur Vibrio fisheri. Concernant l’algue Pseudokirchneriella
subcapitata, la lévofloxacine présenterait un effet toxique pour des concentrations supérieures
à 630 µg/L après 96 heures d’exposition, la valeur d’EC50 calculée serait de 1200 µg/L. Pour ce qui est de la toxicité vis-à-vis de Daphnia magna, pour des concentrations allant de 0,1 à 10 mg/L et pour un temps d’exposition de 48 heures, aucune toxicité aiguë n'a été montrée dans le cas de la lévofloxacine.
Toutefois, afin de prouver la possible présence d’une toxicité chronique, des tests de reproduction sur la même espèce exposée à 0,5 mg/L de lévofloxacine pendant 21 jours ont
12 également été réalisés. Ces tests ont montré une diminution du taux de descendance d'environ 56 % par parent. Dans cette étude, l’effet toxique de la lévofloxacine sur la reproduction des crustacées a été mis en évidence pour des concentrations supérieures à 63 µg/L. Une valeur d’EC50 de 340 µg/L a été calculée. De même, des valeurs de LOEC et NOEC de 63 et 31 µg/L respectivement ont été rapportées; une valeur de PNEC de 310 ng/L a été ensuite calculée à partir du NOEC (Yamashita et al., 2006). Dans ce même travail, le suivi de la présence de la lévofloxacine dans les effluents secondaires de 5 stations d’épuration d’eaux usées différentes a montré des concentrations allant de 152 à 323 ng/L. En tenant compte de l’écotoxicité de la lévofloxacine sur la reproduction de Daphnia magna (résultats les plus sensibles), un rapport de risque ([LVF]/PNEC) proche de 1 pour les 5 effluents testés a été obtenu. Selon ces auteurs, ce rapport indiquerait un faible impact de la lévofloxacine sur l’environnement aquatique (Yamashita et al., 2006)
Concernant les fluoroquinolones en général, des tests de toxicités sur 5 types d’espèces aquatiques différentes ont été menés par Robinson et al. (2005) sur 7 fluoroquinolones (ciprofloxacine, lomefloxacine, ofloxacine, lévofloxacine, clinafloxacine, enrofloxacine et flumequine). Selon ces auteurs, la lévofloxacine serait la fluoroquinolone la plus toxique vis-à-vis d’une cyanobactérie d’eau douce Microcystis aeruginosa et d’une plante d’eau douce flottante Lemna minor avec des valeurs respectives de EC50 de 7,9 et 51 µg/L. Cependant, la lévofloxacine serait beaucoup moins toxique vis-à-vis de Pseudokirchneriella
subcapitata avec une valeur d’EC50 de 7400 µg/L. Dans cette étude, aucune fluoroquinolone
testée n'a montré d'effet sur l’espèce Daphnia magna (i.e. moins de 10 % de mortalité après exposition à des concentrations de 10 mg/L). Ces résultats sont cohérents avec les résultats de Yamashita et al. (2006) sur la lévofloxacine. Enfin, les tests effectués sur des poissons d’eaux douces Pimephales promelas ont montré que la plupart des fluoroquinolones testées ne présentaient pas des effets mortels sur ces espèces (i.e. moins de 8 % de mortalité observé après une exposition à 10 mg/L de fluoroquinolone).
II.4.3. Le métronidazole
Selon Macri et al. (1988), les effets des imidazolés sur l’environnement pourraient provenir: i) d'une action négative sur les bactéries nitrifiantes du sol, ii) d'une perturbation des procédés de purification par les boues activées (i.e. production de méthane) dans les stations
13 d’épuration, iii) ou de diverses effets toxiques sur l’écosystème aquatique et terrestre en raison de leur tendance à s’accumuler dans les systèmes aquatiques.
Concernant le métronidazole, une étude conduite par Lanzky et Halling Sorensen en 1997 a montré une toxicité de ce composé vis-à-vis des algues. Or, les algues étant à la base des chaînes trophiques alimentaires, une diminution de la population des algues pourrait perturber l’écosystème aquatique.
Pour ce composé, une étude de la toxicité aigüe et chronique sur l'espèce Daphnia magna a été réalisée par Wollenberger et al. (2000). Dans ce travail, aucune toxicité du métronidazole sur Daphnia magna n'a été observée. Une LOEC sur 48 heures de 1000 mg/L et une NOEC sur 21 jours de 250 mg/L ont été déterminées (Wollenberger et al., 2000). Aucune détermination de l’EC50 de ce composé sur la bactérie Vibrio fischeri ne semble avoir été effectuée à ce jour. Toutefois, une étude menée par Bendesky et al. (2002) a montré que ce composé pourrait être potentiellement cancérigène pour l'homme.
III. Dégradation des produits étudiés par les principaux procédés
d’oxydation appliqués en traitement des eaux
III.1. Procédé de Chloration
Le Chlore est un oxydant puissant fréquemment utilisé comme désinfectant dans les filières de traitement des eaux. Aux Etats-Unis, en effet, les effluents des eaux usées municipales sont souvent désinfectés au chlore avant d’être rejetés (Pinkston et Sedlak, 2004). De même, dans de nombreux pays tels que la France principalement, le chlore est fréquemment utilisé en tant que désinfectant dans le traitement de l’eau potable (Morris, 1986 ; Doré, 1989).
En solution, le chlore se présente sous deux formes : l’acide hypochloreux (HOCl) et l’ion hypochlorite (ClO-), ces deux formes constituent ce que l’on appelle le chlore libre (pKa = 7,5; Doré, 1989). En plus de ses propriétés biocides le chlore exerce une action oxydante sur de nombreux composés minéraux (NH4+, Br-,…) et organiques. Concernant les molécules organiques, les différents modes d’action du chlore généralement observés sont des réactions d’oxydation sur les fonctions réductrices, des réactions d’addition sur les liaisons
14 insaturées et des réactions de substitution électrophile sur les sites nucléophiles (Doré, 1989 ; Deborde et Von Gunten, 2008). Ce dernier type de réactions est celui généralement décrit sur les cycles aromatiques des composés phénoliques (Burttshell et al., 1959) ou sur les amines primaires et secondaires conduisant à la formation de chloramines (Abia et al., 1998 ; Pinkston et Sedlak, 2004 ν Deborde et Von Gunten, 2008). D’un point de vue cinétique, pour la plupart des réactions de chloration avec les composés organiques ou minéraux, une cinétique d’ordre 2 a été montrée (Deborde et Von Gunten, 2008). Concernant les produits pharmaceutiques, de nombreuses études ont montré une réaction possible avec le chlore (Pinkston et Sedlak, 2004 ; Dodd et al., 2005 ; Chamberlain et Adams, 2006 ; Dodd et Huang, 2007 ; Acero et al., 2010). De même dans le cadre du projet européen Poseidon en 2004, l’oxydation par le chlore de quelques composés pharmaceutiques a été abordée. Il a été montré dans ce projet que tous les composés pharmaceutiques ne présentaient pas la même réactivité vis-à-vis du chlore.
Afin d’estimer le devenir des composés pharmaceutiques durant une étape de désinfection au chlore, il est nécessaire de déterminer les constantes cinétiques de chloration. De même, une étude des produits formés peut être réalisée.
Dans ce paragraphe, une synthèse bibliographique des données présentes dans la littérature sur la chloration des 3 composés pharmaceutiques étudiés durant ce travail, sera présentée.
III.1.1. Chloration du paracétamol
Pour le paracétamol, plusieurs études récentes ont montré une dégradation possible de ce composé au cours des étapes de chloration de l’eau (Pinkston et Sedlak, 2004 ; Glassmeyer et Shoemaker, 2005 ; Westerhoff et al., 2005 ; Bedner et Maccrehan, 2006 ; Gibs et al., 2007 ; Xagoraraki et al., 2008).
D’un point de vue cinétique, HOCl semblerait la forme réactive prédominante du chlore avec le paracétamol. Les constantes cinétiques de la réaction de HOCl avec les formes protonée et déprotonée de ce composé (pKa = 9,7) ont été estimées à 3,1 et 7.103 M-1.s-1 (Pinkston et Sedlak, 2004). A partir de ces résultats, une constante cinétique de réaction de 13 M-1.s-1 a pu alors être estimée à pH 7 (Deborde et Von Gunten, 2003).
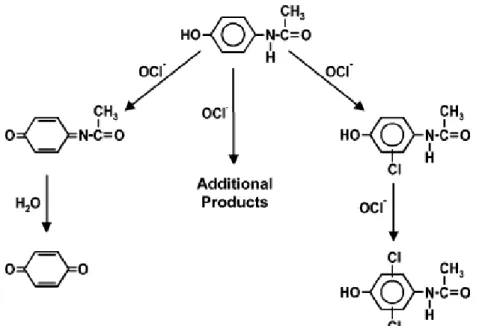
D’un point de vue sous-produits de dégradation, dans une étude conduite par Bedner et Maccrehan (2006), la chloration du paracétamol a été suivie dans de l’eau pure ainsi que dans
15 des eaux usées. Dans les mêmes conditions de traitement des eaux usées, les résultats montrent que le paracétamol est susceptible d’être transformé durant le procédé de chloration. Dans ce travail, 11 sous-produits de chloration du paracétamol ont été observés en LC/UV/MS. Parmi ces produits, deux composés toxiques ont été clairement identifiés (la 1,4-benzoquinone et le N-acetyl-p-1,4-benzoquinone imine (NAPQI)). De même, deux sous-produits chlorés (le chloro-4-acetaminophenol et le dichloro-4-acetaminophenol) ont été mis en évidence. Dans cette étude, les auteurs ont noté que le NAPQI et la benzoquinone pourraient être réduits durant les étapes de déchloration (i.e. par ajout de sulfite) pour redonner le composé parent alors qu’aucun effet n’est observé sur le 4-acetaminophenol et le dichloro-4-acetaminophenol. Pour la benzoquinone et le NAPQI, les auteurs ont suivi à pH 7 leur évolution au cours de la chloration (Figure 2).
Figure 2 : Evolution de la dégradation du paracétamol (acetaminophen) (courbe A) et de ces sous-produits, le
1,4 benzoquinone et le NAPQI (courbes B, C et D), en fonction du temps de chloration ; [PRC]0 = 10 µM,
[HOCl]0= 57 µM, [Tampon phosphate] = 1 mM, pH 7, T°C = 23 ± 1 (Bedner et Maccrehan, 2006)
Dans ces conditions, une grande stabilité de la benzoquinone a été observée. Pour l’ensemble des produits identifiés, un chemin réactionnel de chloration du paracétamol a été proposé (Figure 3).
16 Figure 3 :Différentes voies réactionnelles possibles du paracétamol avec l’ion hypochlorite
(Bedner et Maccrehan, 2006).
III.1.2. Chloration de la lévofloxacine
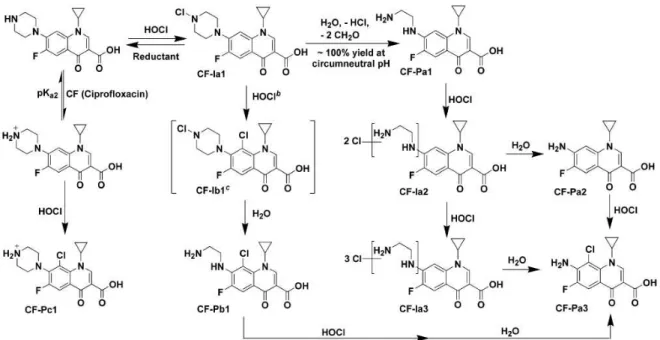
A ce jour, aucune étude sur la chloration de la lévofloxacine ne semble être reportée dans la littérature. Cependant, la cinétique, les sous-produits et les mécanismes réactionnels de chloration de plusieurs autres fluoroquinolones dont la ciprofloxacine, l’enrofloxacine et la fluméquine ont été déjà étudiés par Dodd et al. en 2005. Ces molécules présentent des structures chimiques proches de celle de la lévofloxacine (Tableau 2).
17 Tableau 2 :Structures chimiques de quelques fluoroquinolones cités durant cette étude
Molécule Formule brute Formule moléculaire Masse molaire
(g/mole) Lévofloxacine (LVF) C18H20FN3O4 361,37 Ciprofloxacine (CIP) C17H18FN3O3 331,13 Enrofloxacine (ENF) C19H22FN3O3 359,16 Fluméquine (FLM) C14H12FNO3 261,25
Dans ce travail, en plus de la réaction possible du chlore sur la partie quinolone de ces molécules, les auteurs ont montré que le chlore réagissait très rapidement avec la fonction amine secondaire de la ciprofloxacine pour former un intermédiaire chloramine pouvant se dégrader lentement par fragmentation du noyau pipérazine (Figure 4).
18 Figure 4 :Mécanisme réactionnel de chloration de la ciprofloxacine proposé par Dodd et al. (2005)
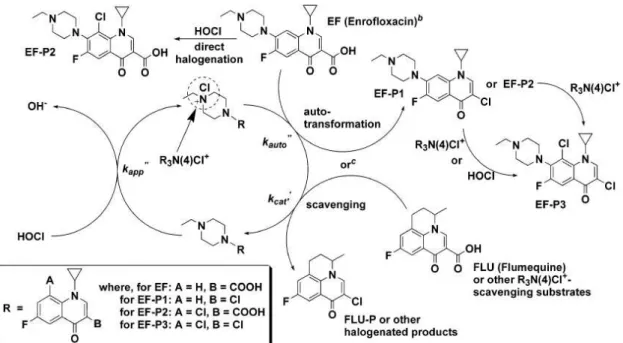
Dans le cas de l’enrofloxacine, le chlore réagirait principalement sur la fonction amine tertiaire pour former un intermédiaire chloramonium (R3N4Cl+). Cet intermédiaire très réactif, pourrait catalyser l’halogénation de l’enrofloxacine ou d’autres substrats présents en solution. Dans cette étude, afin de confirmer cette hypothèse, les auteurs ont alors également étudié la chloration de la fluméquine (dépourvue de noyau piperazine). Pour ce composé aucune réaction avec le chlore n’a été observée. La chloration de ce même composé en présence d’enrofloxacine conduit à une décarboxylation de celui-ci par action de l’ion chloramonium présent dans le milieu réactionnel. Ainsi, dans le cas de la chloration de l’enrofloxacine, le chemin réactionnel suivant a été proposé (Figure 5).
19 Figure 5 : Mécanisme réactionnel de la chloration de l’enrofloxacine proposé par Dodd et al., 2005
D’un point de vue cinétique, les constantes de réaction de HOCl avec les différentes formes de la ciprofloxacine (pKa = 6,2 et 8,8) et l’enrofloxacine (pKa = 6,1 et 7,7) ont été déterminées (Tableau 3).
Tableau 3 :Constants cinétiques de second ordre pour les réactions de HOCl avec les différentes espèces de la ciprofloxacine (à 22°C) et l’enrofloxacine (à 25°C) (Dodd et al., 2005).
k (M-1.s-1)
Composé cation zwitterion anion
Ciprofloxacine 4,3 (± 6,6).103 3,8 (± 2,4).105 4,9 (± 1,9).107
Enrofloxacine 2,9 (± 0,5).10 5,4 (± 0,2).102 1,6 (± 0,1).103
A partir de ces résultats, des constantes de l’ordre de 3,8.105 et 5,4.102 M-1.s-1 peuvent être attendus pour la ciprofloxacine et l’enrofloxacine à pH 7 (Dodd et al., 2005).
D’après ces résultats, les auteurs suggèrent une dégradation rapide des fluoroquinolones contenant des amines secondaires durant les étapes de chloration dans les eaux réelles. Dans le cas de l’enrofloxacine la plus lente cinétique de chloration avec le chlore libre et la participation au processus de dégradation d’un intermédiaire réactionnel réactif capable de réagir avec la matrice de l’eau laisse attendre une plus grande stabilité des fluoroquinolones à amine tertiaire durant les processus de chloration.
Ainsi, l’étude de la chloration de la lévofloxacine semble être intéressante dans le cadre de notre étude.
20 III.1.3. Chloration du Métronidazole
A ce jour, aucune étude cinétique sur la chloration du Métronidazole n’a été reportée dans la littérature.
III.2. Ozonation et oxydation radicalaire
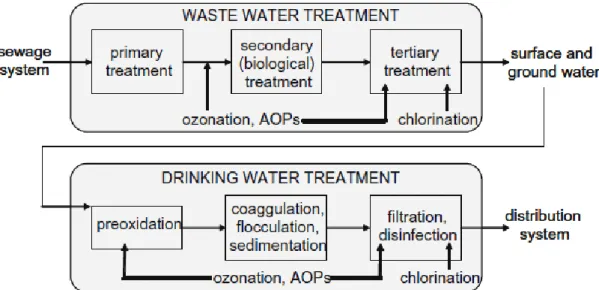
L’oxydation par voie chimique faisant appel à l’ozonation et aux procédés avancés d’oxydation est largement employée dans le traitement des effluents secondaires et dans les étapes de prétraitement et de désinfection de l’eau potable. La figure 6 montre quelques exemples d’application de ces procédés lors du traitement des eaux usées et de la production d’eau potable.
Figure 6 :Possibles applications de l’ozonation et des procédés avancés d’oxydation (AOPs) dans le traitement
des eaux usées et de l’eau potable (Radjenovic et al., 2009)
L’ozone est un gaz produit à partir de l’oxygène, par décharge électrique dans l’air, l’oxygène pur ou l’air enrichi en oxygène. Sa solubilité dans l’eau dépend de différents paramètres dont la température et la pression partielle en ozone. En raison de son fort potentiel d’oxydo-réduction (E0 = 2,07 V), l’ozone est un très bon désinfectant dans le traitement de l’eau potable. L’ozone employé en préozonation joue un rôle principal dans l’élimination du fer et du manganèse, l’amélioration des qualités organoleptiques des eaux (goût, odeur, couleur), l’amélioration de l’efficacité de l’étape de coagulation-floculation et l’élimination des algues. En outre, au cours de la potabilisation des eaux l’ozone peut être
21 aussi employé en post-ozonation ou plus fréquemment en inter-ozonation de façon à permettre, en plus des applications précédentes, l’oxydation de composés organiques et la désinfection.
En eau pure, l’ozone instable, se décompose en radicaux hydroxyle (HO•) suite à une réaction en chaine initiée par les ions hydroxyde (Staehelin et Hoigné, 1985 ; Staehelin et al., 1984). Ainsi, durant l’ozonation, les composés organiques et minéraux sont oxydés soit par voie directe par l’ozone soit par voie indirecte par les radicaux hydroxyle HO• plus oxydants (E0 = 2,74 V; Klaning et al., 1985) et moins sélectifs que l’ozone. A des pH faibles, les réactions radicalaires sont généralement négligeables. Toutefois à pH > 8 la concentration des radicaux HO• augmente dans le milieu et l’ozonation est considéré comme un procédé d’oxydation avancé.
D’un point de vue réactionnel, l’ozone se comporte généralement comme un dipôle actif engendrant des réactions de cyclo-addition 1,3 dipolaire ou un agent électrophile. Contrairement aux radicaux hydroxyle, l’ozone réagit sélectivement avec les solutés ; les vitesses de réaction dépendent fortement des groupements fonctionnels et de la protonation des molécules ν les cinétiques d’oxydation généralement observées sont d’ordre 2.
Les procédés avancés d’oxydation par lesquels les radicaux hydroxyle sont générés constituent également une technique employée en traitement de l’eau potable et des eaux usées. Ces procédés englobent le procédé H2O2/UV, O3/UV, H2O2/O3/UV, H2O2/Fe2+(Fe3+)/UV et TiO2/UV. Durant ce travail, nous nous intéressons au procédé H2O2/UV pour générer les radicaux hydroxyle.
La réaction primaire de photolyse du peroxyde d’hydrogène conduit à la libération de deux radicaux hydroxyle par molécule de peroxyde d’hydrogène décomposé et pour deux photons absorbés. Les radicaux HO• libérés peuvent ensuite réagir avec le peroxyde d’hydrogène résiduel ou avec le composé pharmaceutique P. Les principales réactions prises en compte sont présentées dans le tableau 4.
22 Tableau 4 :Principales réactions mises en jeu au cours de la photolysede H2O2
H2O2 + H2O HO2
+ H3O
+
(1) pKa = 11,7
H2O2 + 2 h → 2 HO• (2) Réaction primaire de photolyse du peroxyde
d’hydrogène, rendement quantique Φ = 0,5 HO• + H2O2→ HO2• + H2O (3) 2 2O H k = 2,7.107 M-1.s-1 (Christensem, 1982) HO• + HO2- → HO2• + OH- (4) 2 HO k = 7,5.109 M-1.s-1 (Christensem, 1982) HO2• + HO2• → H2O2 + O2 (5) k = 8,6.10 5 M-1.s-1 (Weinstein et Bielski, 1979)
2 H2O2 + 2 h → 2H2O + O2 (6) Réaction globale de décomposition du peroxyde
d’hydrogène HO•+ P → Produits (7) kP
L'oxydation des composés organiques par le système H2O2/UV résulte de l’action des radicaux hydroxyle, issus de la photolyse du peroxyde d’hydrogène, mais l’action directe des rayonnements UV peut également contribuer à l’élimination de ces composés. La détermination de la constante cinétique de réaction d’un composé (P) vis-à-vis des radicaux HO• par le système H2O2/UV est généralement réalisée dans des conditions expérimentales particulières (forte concentration en H2O2) permettant de simplifier les équations cinétiques. Plusieurs recherches ont porté sur l’oxydation des composés pharmaceutiques par l’ozone et les procédés avancés d’oxydation (Esplugas et al., 2007; Kim et al., 2009(a); Kim et al., 2009(b)). Les travaux reportés dans la littérature sur l’ozonation et l’oxydation radicalaire des trois composés pharmaceutiques étudiés durant ce travail seront présentés ci-dessous.
III.2.1. Ozonation et oxydation radicalaire du Paracétamol
L’oxydation du paracétamol par l’ozone et le procédé H2O2/UV a été abordée par Andreozzi et al. (a) en 2003. Selon ces auteurs, les 2 systèmes seraient capables de détruire le noyau aromatique du paracétamol. Une minéralisation de 30 et 40 % respectivement pour l’ozonation et l'oxydation radicalaire par le couplage H2O2/UV a été montrée. Durant ce travail, une étude cinétique ainsi qu’un suivi des sous-produits ont été reportés pour les 2 procédés.
Concernant l’ozonation, les constantes cinétiques ont été déterminées à différents pH. Les constantes obtenues pour les formes neutre de type phénol et dissociée sont de 1,41.103 M-1.s-1 et 9,91.108 M-1.s-1. A partir des résultats obtenus, une constante d’ozonation
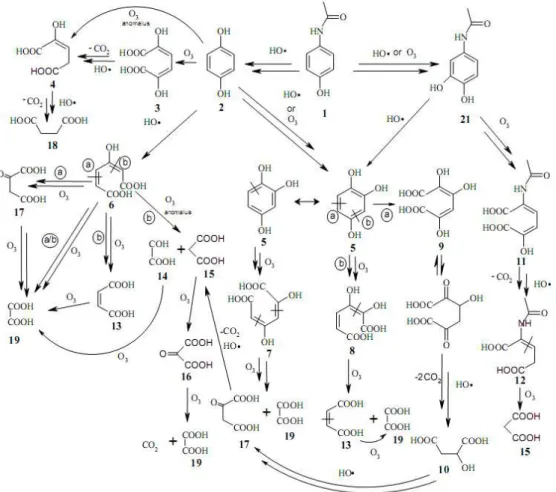
23 du paracétamol de l’ordre de 6,51.106 M-1.s-1 est attendue à pH 7,2. Pour ce composé, 14 sous produits d’ozonation ont été identifiés par GC/MS et un mécanisme de dégradation du paracétamol par l’ozone a été proposé (Figure 7).
Figure 7 : Mécanisme proposé pour l’ozonation et l’oxydation radicalaire du paracétamol
(Andreozzi et al., 2003(a))
Dans ce même travail, à pH 2 et 7, un suivi de l’évolution de certains sous-produits au cours de l’ozonation ainsi que l’élimination du COT a été réalisée (Figure 8). Dans les conditions expérimentales étudiées, 30 % d’élimination du COT et la persistance de plusieurs sous-produits après 2h d’ozonation ont été observés.
24 Figure 8 : Ozonation du paracétamol et des intermédiaires de réactions; [PRC]0= 5,3 x 10-3 M, pH 2 (a)
et pH 7 (b); ◊ paracétamol; ■ acide oxalique; ● acide formique (/10); ○ peroxyde d'hydrogène; ∆ acide glyoxalique; + glyoxal; □ hydroquinone; ♦ acide kétomalonique; ▲ élimination du COT
(Andreozzi et al., 2003(a))
Concernant l’oxydation radicalaire, dans ce même travail, Andreozzi et al. (2003(a)) se sont basés sur le procédé H2O2/UV pour étudier l’oxydation du paracétamol. En présence d’un excès de peroxyde d’hydrogène, une constante cinétique des radicaux HO• égale à 2,2.109 M-1.s-1 a été obtenue à pH 5,5. Une comparaison de la dégradation du paracétamol ainsi que l’élimination du COT en présence et en absence de peroxyde d’hydrogène a été réalisée (Figure 9). Dans les conditions expérimentales étudiées, pour une plus grande concentration en peroxyde d’hydrogène, 40 % d’élimination du COT et une dégradation totale du paracétamol a été observée après 4 minutes de réaction.
● UV seul ■ [H2O2] = 5 mM ▲ [H2O2] = 20 mM ○ UV seul □ [H2O2] = 5 mM ∆ [H2O2] = 20 mM Symboles pleins : suivi du paracétamol; Symboles creux : suivi du carbone organique total. Figure 9 :Oxydation du Paracétamol par le procédé H2O2/UV
25 Au cours de l’oxydation radicalaire du paracétamol, 7 sous-produits ont été identifiés par GC/MS (Andreozzi et al., 2003(a)). Un mécanisme réactionnel de dégradation du paracétamol par le procédé H2O2/UV a été proposé (Figure 7). Dans ce mécanisme, les premières réactions d’oxydation consistent en une attaque directe des radicaux hydroxyle sur le noyau aromatique et la formation de l’hydroquinone et du 2-hydroxy-4-(N-acetyl)-aminophenol. Une succession de réactions radicalaires se produisent ensuite conduisant à la formation d’autres sous-produits.
A ce jour, aucune étude de la toxicité des sous-produits identifiés lors de l’ozonation ou l’oxydation radicalaire du paracétamol ne semble avoir été menée.
III.2.2. Ozonation et oxydation radicalaire de la lévofloxacine
A ce jour, aucune constante cinétique de dégradation de la lévofloxacine par l’ozone ne semble avoir été reportée dans la littérature. Cependant, des constantes d’ozonation ont été déterminées sur d’autres fluoroquinolones et notamment sur l’enrofloxacine, une molécule qui présente certaines similitudes avec la lévofloxacine (Tableau 2) Pour cette molécule, une constante d’ozonation à pH 7 de 1,5.105
M-1.s-1 a été rapportée (Dodd et al., 2006).
Pour la lévofloxacine, deux études cinétiques d’ozonation ont été menées par De Witte et al., en 2009 et Nasuhoglu et al., en 2012. Dans le travail de De Witte et al. (2009), les temps de demi-vie ainsi que la constante cinétique de dégradation à 10 % de la lévofloxacine k10% ont déterminés, à différents pH dans des conditions expérimentales données (Tableau 5). Dans ces conditions, à pH 10, une plus grande vitesse de réaction montrant une plus grande réactivité de l’ozone avec la forme déprotonée des amines a été observée.
Tableau 5 : Temps de demi-vie et constantes de dégradation de 10 % de la Levofloxacine pour différents pH
De Witte et al. (2009)
pH t1/2 (min) k10% (mM.min-1) Consommation O3 en 1h (mmol)
3 16,0 1,77 ± 0,05 0,55
7 12,8±0,2 1,96 ± 0,10 0,61 ± 0,01
26 Pour ce composé, 9 sous-produits d’ozonation ont été identifiés par analyse CLHP/MS/UV. A partir de calculs ab initio, De Witte et al. (2008 et 2009) ont proposé un mécanisme d’ozonation de la lévofloxacine (Figure 10).
Figure 10 : Mécanisme d’ozonation proposé pour la lévofloxacine (De Witte et al., 2009)
Dans ce schéma réactionnel, une attaque initiale de l’ozone sur la fonction amine tertiaire (position 4’) du noyau pipérazine et/ou sur la double liaison (2-3) du noyau quinolone de la lévofloxacine a été envisagée (Figure 10).
Plus récemment, Nasuhoglu et al. (2012) ont étudié la cinétique de dégradation de la lévofloxacine par l’ozonation et la photocatalyse. Les résultats des expériences d’ozonation montrent une élimination complète de la lévofloxacine après 2 minutes d’ozonation (55 mg/L d’ozone transféré), et un temps de demi-vie de 6 secondes a été calculé. Pour ce même temps d’ozonation, un abattement en DCO (demande chimique en oxygène) compris entre 46 et 59 % a été aussi observé. Finalement, une élimination de l’activité antibactérienne de la
27 lévofloxacine contre Escherichia coli et Pseudomonas fluorescens a été aussi démontrée. Durant cette étude aucune constante cinétique ou identification des sous-produits n’a été proposée.
Comme pour le paracétamol, malgré l’identification des sous-produits d’ozonation de la lévofloxacine par De Witte et al. (2009), aucune étude de toxicité ne semble avoir été effectuée à ce jour.
Concernant l’oxydation radicalaire, la photolyse directe et indirecte de la lévofloxacine a été étudiée par Lam et Mabury en 2005. Dans ce travail, étant donnée la sensibilité de la lévofloxacine à la lumière, les radicaux HO• ont été générés en utilisant la méthode Dark Fenton (Haag et Yao, 1992). Dans ces conditions, une constante cinétique des radicaux HO• de 6,6.109 M-1.s-1 a été obtenue (Lam et Mabury, 2005) et un sous-produit hydrolysé dont la structure est présenté dans la figure 11 a été identifié. Ce sous-produit, formé suite à une attaque directe des radicaux HO• sur la molécule de la lévofloxacine a été aussi détecté pour des expériences de photolyse d’une eau synthétique chargée dont les caractéristiques s’approchent des matrices des eaux réelles. A l’issu de ces résultats, les auteurs suggèrent une action directe des radicaux libres sur la molécule de lévofloxacine dans les processus de photodégradation des eaux de surface.
Figure 11 :Spectre de masse observé pour le sous-produit IV de la lévofloxacine avec :
378 > 36O correspond à une perte d’une molécule d’H2O ; 378 > 334 correspond à une perte d’une molécule
28 III.2.3. Ozonation et oxydation radicalaire du métronidazole
Des expériences d’ozonation menées par Sánchez-Polo et al. (2008), sur plusieurs composés de la famille des nitroimidazolés (métronidazole, dimétridazole, tinidazole et ronidazole) pour différents pH allant de 2 à 10, ont montré une faible réactivité de l’ozone moléculaire sur cette famille de composés (
3
O
k < 350 M-1.s-1). Pour le métronidazole, une constante d’ozonation de 253 ± 7 M-1
.s-1 a été déterminée à pH 7 (Sanchez-Polo et al., 2008).
Les sous-produits d’ozonation du métronidazole identifiés par Sánchez-Polo et al. (2008) sont les nitrates (identifiés par chromatographie échangeuse d’ions) ainsi que le 3-acétyl-2-oxazolidinone (identifié par GC-MS, TOF-MS et RMN 1H) (Figure 12). Aucun autre sous-produit ne semble avoir été identifié jusqu’à présent.
Figure 12 : Structure chimique du 3-acetyl-2-oxazolidinone
D’après Sánchez-Polo et al. (2008), les deux sous-produits identifiés ne présentent pas de toxicité vis-à-vis de Vibrio fisheri aux concentrations détectées dans leurs conditions expérimentales d’ozonation. Cependant, en effectuant le suivi de la toxicité par ce même test au cours de l’ozonation du métronidazole, une augmentation progressive de la toxicité (marquée par une augmentation des pourcentages d’inhibition de la luminescence des bactéries) est observée (Figure 13). Selon ces auteurs et d’après les travaux de Choji et al. (1λλ6), cette augmentation pourrait s’expliquer par la formation de dérivés de l’acide isocyanique. En effet, une valeur de LC50 (léthal concentration) de l’ordre de 18 mg/m3 (exprimée en masse équivalente de groupement N-C=O) a été rapportée dans la littérature pour le méthylisocyanate (Pauluhn, 1989).
29 Figure 13 : Pourcentage d’inhibition de la bactérie Vibrio Fisheri et suivi de COT au cours de l’ozonation,
[MNZ]0=30 mg/L, pH=6 (Sanchez-Polo et al., 2008)
Dans ce même travail, un suivi du carbone organique total (COT) a également été réalisé au cours de l’ozonation du métronidazole (figure 13). Après 1 heure d’ozonation, une diminution de 10 % du COT a été observée (Sánchez-Polo et al., 2008).
L’oxydation radicalaire du MNZ par le procédé H2O2/UV a été abordée par Johnson et Mehravar en 2008. Durant ce travail, une dose optimale en H2O2 a été déterminée de manière à optimiser la dégradation du métronidazole. Dans ces conditions, une constante cinétique de 1,98.109 M-1.s-1 a été obtenue. Pour ce composé, Shemer et al. (2006) ont aussi étudié l’oxydation radicalaire par le procédé H2O2/UV en utilisant des lampes UV basses ou moyenne pression (Energie des lampes : 1,5 et 1,9 mW/cm2). Quelle que soit la lampe employée, les résultats ont montré que 60 et 65 % du métronidazole pourrait être éliminé après 2,5 minutes de réactions en présence de 25 et 50 mg/L de H2O2 respectivement.
Aucune identification des sous-produits d’oxydation radicalaire du métronidazole ni de leur toxicité ne semble avoir été effectuée à ce jour.
CHAPITRE II
Chapitre II : Matériels et Méthodes
I. Réactifs et solutions ... 30 II. Protocoles expérimentaux ... 31
II.1. Etude cinétique ... 31 II.1.1. Chloration ... 31 II.1.2. Ozonation ... 32 II.1.3. Photolyse et procédé combiné H2O2/UV (radicaux HO•) ... 35 II.2. Etude des sous-produits d’oxydation et suivi de la toxicité ... 38 II.3. Etude de la chloration du paracétamol dans les eaux réelles ... 39
III. Méthodes analytiques ... 39
III.1. Dosage du chlore, de l'ozone et du peroxyde d'hydrogène ... 39 III.1.1. Dosage du chlore ... 40 III.1.2. Dosage de l’ozone ... 41 III.1.3. Dosage du peroxyde d’hydrogène ... 42 III.2. Dosage des composés pharmaceutiques et compétiteurs... 43 III.3. Identification des sous-produits d’oxydation ... 46 III.4. Etude et suivi de la toxicité ... 47 III.5. Autres méthodes d'analyse ... 48
30 Après l’étude bibliographique détaillée dans le chapitre I, le chapitre II présente une description des protocoles de manipulation et des techniques analytiques employées pour l’ensemble des expériences réalisées lors de cette étude.
I. Réactifs et solutions
Toutes les solutions ont été préparées dans l’eau ultra-pure (EUP) délivrée par un système Millipore MilliQ fournissant une eau dont la résistivité est de 18 MΩ.cm et dont la teneur en carbone organique total est inférieure ou égale à 0,1 mg C/L.
Les solutions des composés pharmaceutiques étudiés, des composés de référence (phénol et carbamazépine) et des composés étalons ont été réalisées par simple mise en solution des produits commercialisés fournis par Aldrich et Fluka (pureté > 97 %) dans l’eau MilliQ. Pour les solutions de fluméquine (composé moins soluble dans l'eau), 130 mg de fluméquine par litre d’eau MilliQ ont été mis en contact pendant 48 heures sous agitation. Les solutions ont ensuite été filtrées sur membrane de 0,45 µm pour éliminer la partie non solubilisée du composé. Les concentrations en fluméquine ont été déterminées par chromatographie liquide haute performance (CLHP) à partir de gammes étalons obtenues par dilution dans l’eau MilliQ de solutions mères préparées dans le méthanol (solutions à 1 mM). Dans ces conditions, la concentration moyenne obtenue est de 53 µM.
Pour les expériences de chloration, des solutions mère de chlore à 14 mM ou à 100 mM ont été obtenues par dilution dans l’eau MilliQ d’une solution commerciale d’hypochlorite de sodium (Acros) contenant 13 % (m/V) de chlore actif. Elles ont été contrôlées comme renfermant une quantité équimolaire d’ions hypochlorite (ClO
-) et chlorure (Cl-).
Des solutions d’eau ozonée ont été utilisées pour les cinétiques d’ozonation. Ces solutions ont été préparées dans un réacteur semi-continu d’une contenance de 800 mL. L’ozone gaz introduit en continu dans le réacteur a été produit à partir d’oxygène (Air Liquide, industriel) soit par un ozoneur Trailigaz réglé à une puissance de 100 W, soit par un ozoneur Ozonia réglé à une puissance de 900 W.
Pour les expériences de photolyse en présence de H2O2, une solution non stabilisée (Fluka) de peroxyde d’hydrogène à 30 % massique (~10 M) a été employée.
![Figure 8 : Ozonation du paracétamol et des intermédiaires de réactions; [PRC] 0 = 5,3 x 10 -3 M, pH 2 (a) et pH 7 (b); ◊ paracétamol; ■ acide oxalique; ● acide formique (/10); ○ peroxyde d'hydrogène; ∆ acide](https://thumb-eu.123doks.com/thumbv2/123doknet/8040942.269556/37.892.149.751.102.331/ozonation-paracétamol-intermédiaires-réactions-paracétamol-oxalique-formique-hydrogène.webp)



