Étude des mécanismes régulant le guidage axonal des
neurones dopaminergiques du mésencéphale en aval
du récepteur PlexinC1
Mémoire
Caroline Lafrechoux
Maîtrise en neurobiologie - avec mémoire
Maître ès sciences (M. Sc.)
Étude des mécanismes régulant le guidage axonal des
neurones dopaminergiques du mésencéphale en aval
du récepteur PlexinC1
Mémoire
Caroline Lafréchoux
Maîtrise en Neurosciences
Maître ès Sciences (MSc)Sous la direction de:
Résumé
Sémaphorine 7A est une molécule de guidage axonal pour les neurones dopaminergiques en développement. Elle permet de ségréguer les neurones de la voie nigrostriée et mésolimbique. Nous montrons dans cette étude qu’elle participe également à l’organisation de la voie mésocorticale. L’effet chémorépulsif de la molécule Sémaphorine 7A se fait via sa liaison avec le récepteur membranaire PlexinC1, présent tout au long du développement embryonnaire dans les neurones de l’aire tegmentale ventral. Il se manifeste in vitro par une modulation morphologique du cône de croissance, ainsi qu’une réduction de l’arborisation dendritique. Les kinases de la famille des Src sont les médiatrices de ces effets. En forçant leur inactivation, on peut empêcher l’apparition des effets chémorépulsifs de Sémaphorine 7A. Il est intéressant de noter que les kinases de la famille des Src sont également activées in vivo dans les cônes de croissance de neurones dopaminergiques en développement. La liaison de Sémaphorine 7A à PlexinC1 mène aussi à une inactivation de la protéine de liaison à l’actine cofiline. L’identification de cet acteur moléculaire permet de faire un lien entre l’activation du récepteur et la modulation subséquente du cytosquelette, une étape essentielle afin de médier le mouvement du cône de croissance. En somme, cette étude permet de mettre en évidence certains mécanismes moléculaires agissant au niveau du cône de croissance, et dont l’effet est nécessaire au guidage des neurones dopaminergiques par Sémaphorine7A.
iii
Abstract
Semaphorin7A is an important axon guidance molecule for developing dopaminergic neurons. It allows to segregate the neurons of the nigrostriate and mesolimbic pathway. In this study, we bring to light its role in the organization of the mesocortical pathway. The chemorepulsive effect of Semaphorin 7A occur via its binding with the PlexinC1 membrane receptor, present throughout embryonic development in the neurons form the Ventral Tegmental Area. These effects include, in vitro a morphological modulation of the growth cone, as well as a reduction of the dendritic arborization. Src family kinases mediate these effects and when inactivated, they prevent both chemorepulsion and growth cone morphology changes induced by Séma7A. Interestingly, Src family kinases are also activated in vivo in growth cones of developing dopaminergic neurons. The binding of Séma7A to PlexinC1 also leads to inactivation of the actin binding protein cofilin. The identificatio;n of this molecular actor links the activation of the receptor and the subsequent modulation of the cytoskeleton, an essential step in order to mediate the movement of the growth cone. In sum, this study reveals the molecular mechanisms acting at the level of the growth cone in midbrain dopaminergic neurons during axonal guidance by Semaphorin7A.
Table des matières
Résumé ____________________________________________________________________________________________ ii Abstract __________________________________________________________________________________________ iii Table des matières _____________________________________________________________________________ iv Liste des illustrations __________________________________________________________________________ vi Liste des abréviations ________________________________________________________________________ vii Introduction ______________________________________________________________________________________ 1 Introduction générale _____________________________________________________________________________ 1 Les neurones dopaminergiques du mésencéphale ______________________________________________ 2 Noyaux dopaminergiques du mésencéphale : _______________________________________________________ 2 Projections dopaminergiques : ________________________________________________________________________ 3 La dopamine : synthèse et transmission _________________________________________________________ 5 Voie de synthèse de la dopamine _____________________________________________________________________ 5 Les récepteurs dopaminergiques : ____________________________________________________________________ 7 Induction et développement de l’identité dopaminergique dans le mésencéphale __________ 9 Développement des neurones dopaminergiques : _________________________________________________ 10 Spécification de la zone ventrale et induction des neurones dopaminergiques : ________________ 10 Développement de l’identité des neurones dopaminergiques: ____________________________________ 12 Connectivité du circuit dopaminergique : ___________________________________________________________ 13 Le guidage axonal, un processus essentiel à l’établissement de connexions neuronales ___ 14 Introductions aux grandes familles de molécules de guidage axonal : ____________________________ 14 Trajet des axones dopaminergiques au cours du développement : état des connaissances actuelles : ______________________________________________________________________________________________ 19 Importance de Séma7A dans le guidage axonal des neurones dopaminergiques : ______________ 26 Le guidage axonal dans les cônes de croissances : intégration des signaux moléculaires et modulation du cytosquelette ____________________________________________________________________ 27 Mécanismes de guidage axonal : _____________________________________________________________________ 27 Organisation et composition du cône de croissance : adaptations pour la mobilité _____________ 29 Rôle central de l’actine dans le guidage axonal _____________________________________________________ 30 Navigation du cône de croissance : intégration des signaux de guidage axonal et modèle de traduction différentiel ________________________________________________________________________________ 31 Messagers secondaires entre récepteur et cytosquelette : intégration du guidage axonal par les sémaphorines : ________________________________________________________________________________________ 33 Les kinases de la famille des Src : des candidats importants pour le guidage axonal des neurones mDA _________________________________________________________________________________________ 35 Problématique et objectifs ___________________________________________________________________ 37 Chapitre 1 : Matériel et Méthodes __________________________________________________________ 39 Lignée de souris _______________________________________________________________________________________ 39 Culture primaire de neurones mDa __________________________________________________________________ 39 Explants ________________________________________________________________________________________________ 40 Immunofluorescence _________________________________________________________________________________ 41 Caractérisation des projections dopaminergiques dans le CPF de souris adultes _______________ 43 Analyses de complexité dendritique _________________________________________________________________ 43 Hybridation in situ ____________________________________________________________________________________ 44v Culture de lignée cellulaire (HEK) : stimulation à la Séma7A et transfection ____________________ 45 Western blotting ______________________________________________________________________________________ 45 Tests comportementaux ______________________________________________________________________________ 46 Analyses statistiques __________________________________________________________________________________ 47 Chapitre 2 : Résultats _________________________________________________________________________ 48 Les deux récepteurs de Sémaphorine 7A : PlexinC1 et ß1-intégrine sont exprimés au cours du développement embryonnaire et après la naissance chez la souris ______________________________ 48 L’absence de Sémaphorine7A induit un réarrangement des projections dopaminergiques au niveau du cortex préfrontal __________________________________________________________________________ 51 L’absence de Sémaphorine7A au cours du développement semble diminuer l’anxiété parmi les murins __________________________________________________________________________________________________ 54 Les kinases de la famille des Src sont impliquées dans la voie de signalisation en aval du récepteur PlexinC1 dans les cônes de croissance de neurones dopaminergiques du mésencéphale _________________________________________________________________________________________ 58 L’inhibition des kinases de la famille des Src prévient l’effet de Sémaphorine 7A sur l’arborisation dendritique et la morphologie du cône de croissance des neurones dopaminergiques de l’ATV in vitro __________________________________________________________________ 62 L’inhibition des kinases de la famille des Src prévient l’effet de Sémaphorine 7A sur la morphologie du cône de croissance des neurones dopaminergiques de l’ATV in vitro _________ 65 Chapitre 3 : Discussion _______________________________________________________________________ 69 Conclusions et perspectives _________________________________________________________________ 76 Bibliographie __________________________________________________________________________________ 78
Liste des illustrations
Figure 1 : Distribution des neurones catécholaminergiques dans le cerveau d’un rongeur en développement. ___________________________________________________________________________________________________ 3 Figure 2: Représentaion des origines des projections mésolimbiques, nigrostriée et mésocorticales chez le rat. _________________________________________________________________________________________________________________ 4 Figure 3 : Voie de synthèse des catécholamines. ________________________________________________________________ 6 Figure 4: Représentation schématique d’une synapse dopaminergique. ______________________________________ 9 Figure 5: Séquence d’expression de gènes menant au développement de neurones dopaminergiques au cours du développement. ________________________________________________________________________________________ 12 Tableau 1: Résumé des spécificités de forme et de liaison des 8 sous-classes de sémaphorines. (Negishi, Oinuma and Katoh, 2005). ______________________________________________________________________________________ 18 Figure 6: Résumé schématique des interactions ligand/récepteur régissant le guidage axonal des neurones dopaminergiques au niveau du mésencéphale. ________________________________________________________________ 21 Figure 7: Résumé des interactions ligand/récepteur régissant le guidage axonal des neurones dopaminergiques au niveau du diencéphale. __________________________________________________________________ 23 Figure 8: Résumé des interactions ligand/récepteur régissant le guidage axonal des neurones dopaminergiques au niveau du télencéphale. __________________________________________________________________ 25 Figure 9: Modèle de déplacement du cône de croissance selon ses interactions avec les molécules de guidage. __________________________________________________________________________________________________________ 28 Figure 10: Représentation schématique du cône de croissance, structure digitale au bout de l’axone. _____ 29 Figure 11: Modèle de « traduction différentiel ». ______________________________________________________________ 32 Figure 12: Modèle de regulation de la croissance de mélanocytes par Séma7A. _____________________________ 35 Figure 13 : Représentation schématique des domaines structuraux des kinases de la famille des Src. _____ 36 Figure 14: Modèle hypothétique de la voie de signalisation activée en aval de PlexinC1. ___________________ 38 Figure 15: Les deux récepteurs de Sémaphorine 7A : PlexinC1 et ß1-intégrine sont exprimés au cours du développement embryonnaire et après la naissance chez la souris ___________________________________________ 49 Figure 16: L’absence de Sémaphorine7A induit un réarrangement des projections dopaminergiques au niveau du Cortex. ________________________________________________________________________________________________ 52 Figure 17 : L’absence de Sémaphorine7A au cours du développement diminue l’anxiété chez les murins _ 55 Figure 18: Les kinases de la famille des Src sont activées par la liaison Séma7A/PlexinC1. _________________ 59 Figure 19: L’inhibition des kinases de la famille des Src prévient l’effet de Sémaphorine 7A sur l’arborisation dendritique et la morphologie du cône de croissance des neurones dopaminergiques de l’ATV in vitro. ____________________________________________________________________________________________________ 63 Figure 20: Une exposition à Sémaphorine7A induit une altération morphologique du cône de croissance dans les neurones in vitro _______________________________________________________________________________________ 66vii
Liste des abréviations
Actine-G : Actine globulaire
AMPc : adénosyl monophosphate cyclique ATV : Aire Tegmentale Ventrale
BDNF (brain-derived neurotrophic factor) CPF : Cortex préfrontal
CNS : système nerveux central DIV: jour in vitro (« day in vitro”)
DRG : Ganglion spinal (« Dorsal Root Ganglion ») E: jour emryonnaire
Eph : Ephrine
FAK : Kocal Adhesion Kinase FGF8 : Fibroblast Growth Factor 8
GABA : acide γ-aminobutyrique (γ-aminobutyric acid; 4-aminobutanoic acid) IF : Immunofluorescence
KO : « knockout » (inactivaiton génétique)
LIMK : kinase de l famille des LIM (« LIM kinase »)
Lmx : facteur de transcription à homéodomaine LIM (LIM Homebox Transcription Factor)
MC : mésencéphale caudal MD : mésencéphale dorsal
mDA : neurones dopaminergique du mésencéphale MV : mésencéphale ventral
Npn : Neuropiline P : jour postnatal
PACAP (pituitary adenylate cyclase-activating polypeptide) PBS : tampon phosphate salin (phosphate buffer saline) PFA : paraformaldehyde
PKA : protéine kinase A PlxC1 : PlexinC1
RTK : Récepteur Tyrosine Kinase
SEM : Erreur Standard de la Moyenne (Standard Error of the Mean) Séma7A : Sémaphorine 7A
SHH: Sonic hedgehog
SNc : substance noire compacte (substantia nigra pars compacta) TH : tyrosine hydroxylase
VGAT : « vesicular GABA transporter »
VM : mésencéphale ventral (ventral mesencephalon) VMAT2 : Vésicular monoamine transporter 2
VP : noyau ventropostérieur
VTA : aire tegmentale ventral (« ventral tegmental area ») VZ : zone ventriculaire (« ventricular zone »)
Remerciements
Voilà qui conclût presque trois années de travail. Douloureux. Libérateur. Nostalgique? Déjà? Pas encore. Ça ne saurait tarder.
Ces années représentent des techniques de laboratoire acquises, des étoiles sur quelques graphiques, 2To de données récoltées, des centaines de cerveaux, des milliers de cellules. Mais bien plus que cela ils représentent une évolution. Si les expériences influencent le façonnement de nos connexions neuronales, alors il doit y avoir une différence significative, en termes physiologiques et psychologiques, entre l’étudiant qui entre, et celui qui sort de sa maîtrise en sciences.
Pour cette expérience, je tiens premièrement à remercier mon laboratoire. D’abord ces collègues qui ont rendu mes journées plus agréables, qui ont su cultiver ma curiosité scientifique par des discussions des plus terre-à-terre aux plus farfelues, et qui plus que quiconque m’ont comprise. Merci aussi à Martin de m’avoir accueillie et offert une liberté quasi-totale dans la construction de mon projet de recherche. L’indépendance, la ténacité et la rigueur qui en ont résulté compensent largement les longues journées et les allers-retours.
Merci aussi à tous ceux qui, sans faire partie de mon laboratoire, ont influencé indirectement mon travail. Parce qu’un étudiant malheureux est un étudiant perdu (et donc peu productif), je tiens à remercier ma famille. Perrine pour ses leçons de ténacité, Didier pour ses conseils et Dominique pour son soutien sans faille. Merci aussi à Jérôme dont la « positive attitude » saurait rendre heureux un ours polaire en pleine savane africaine.
Introduction
Introduction générale
Bien que les neurones dopaminergiques ne représentent que 0.3% des neurones du cerveau humain, le nombre d’études à leur sujet ne fait qu’augmenter. En effet, les neurones dopaminergiques sont impliqués dans un grand nombre de fonctions, allant de la locomotion au circuit de la récompense. L’établissement des réseaux qu’ils forment, soit la voie nigrostriée, mésolimbique et mésocorticale débute dès le stade embryonnaire, et prend, chez l’humain, 20 à 25 ans avant d’arriver à maturation.
Le développement de l’identité neuronale à partir des précurseurs de l’ectoderme, puis leur maturation et enfin la formation de leurs connexions sont des processus complexes et d’une importance capitale. Dès 1995, on met en évidence la présence des facteurs de transcription LIM à homéodomaines lmx1a et lmx1b dans le mésencéphale (Riddle et al., 1995; Vogel et al., 1995). Dans les dernières année, le rôle des facteurs de transcription Lmx1a et Lmx1b dans l’induction et l’identité des neurones dopaminergiques du mésencéphale a été mis en lumière (Perrier et al., 2004; Doucet-Beaupré, Ang and Lévesque, 2015; Chabrat et al., 2017). En plus, Lmx1a et Lmx1b jouent un rôle fondamental dans le guidage axonal des neurones dopaminergiques. En effet, en 2017 Chabrat et al., montrent que ces facteurs régulent l’expression de PlexinC1, un récepteur exprimé différentiellement dans le mésencéphale. La liaison de PlexinC1 avec Sémaphorine7a dans le striatum mène en effet à la ségrégation des voies nigrostriées et mésolimbique (Chabrat et al., 2017). Toutefois, on en sait encore très peu sur la voie de signalisation en aval du récepteur.
Dans notre étude, nous nous intéressons donc, non seulement à la régulation du guidage axonal des réseaux de neurones dopaminergiques, mais aussi aux mécanismes moléculaires qui le régissent au niveau du cône de croissance. Notre étude porte sur l’interaction entre l’arborisation dendritique des neurones
dopaminergiques et leur guidage au cours du développement dans des modèles in vitro et in vivo.
Les neurones dopaminergiques du mésencéphale
Noyaux dopaminergiques du mésencéphale :
Dans le mésencéphale, les neurones dopaminergiques sont répartis en trois noyaux que sont l’ATV, la substance noire et l’aire rétrorubrale. Ces structures contiennent non seulement des neurones dopaminergiques, mais également des neurones co-exprimant la dopamine avec l’acide aminobutyrique (GABA) ou le glutamate notamment (Tsuyoshi, Hui-Ling and Marisela, 2013; Bray, 2014; Tsuyoshi et al., 2015). On désigne sous la taxonomie de groupes A8, A9 et A10 les neurones dopaminergiques du mésencéphale (Figure 1) Ils représentent à eux seuls 75% des neurones dopaminergiques du cerveau. Cette nomenclature en noyaux sera importante dans la description du développement des neurones dopaminergiques au cours de l’embryogénèse.
D’autres noyaux catécholaminergiques ont été identifiés dans le cerveau de souris, ils se classent en 17 groupes. Les groupes A1 à A12 sont distribués de la médulla oblongata à l’hypothalamus. Les groupes A13 à A17 sont répartis dans la rétine, le bulbe olfactif et le diencéphale. Trois groupes de neurones adrénergiques : C1 à C3 ont été ajoutés par la suite (Bhat and Ganesh, 2017).
Figure 1 : Distribution des neurones catécholaminergiques dans le cerveau d’un rongeur en développement.
Dix-sept noyaux catécholaminergiques se répartissent entre le télencéphale et le mésencéphale. Il existe neuf noyaux de neurones dopaminergiques, se distribuant entre le bulbe olfactif et le mésencéphale. Ils sont représentés dans un schéma de coupe saggitale de cerveau en développmement en (a) et le cerveau adulte en (b). Les flèches représentent les projections de ces groupes de neurones (Björklund and Dunnett, 2007) .
Projections dopaminergiques :
La dopamine est un neurotransmetteur appartenant à la famille des catécholamines (CA). Dans un cerveau humain, seul 0.3% des neurones en produisent, ce qui en fait un messager chimique relativement rare. Les sources principales de ces neurones (75% d’entre eux) se trouvent dans le mésencéphale. Chez l’humain, cela représente 400,000 à 600,000 neurones et 20,000 à 30,000 chez la souris (S. V. Hegarty, Sullivan and O’Keeffe, 2013).
Le circuit dopaminergique est composé de quatre voies principales (Figure 1). La voie tubéro-infundibulaire va de l’hypothalamus à l’hypophyse, elle influence la sécrétion de certaines hormones et hémoprotéines, comme le cytochrome P450 (Wójcikowski and Daniel, 2009) ou la prolactine (Fitzgerald and Dinan, 2008) .
La voie nigrostriée comprend les neurones de la substance noire (SN) (noyau A9 sur la Figure 1) qui projettent vers la partie dorsale du striatum (Noyau Caudé et Putamen). Cette voie est impliquée dans la motricité et c’est la principale région qui dégénère dans la maladie de Parkinson (FEARNLEY and LEES, 1991). Plus récemment, il a aussi été démontré que cette région était impliquée dans la prise
de nourriture (Sotak et al., 2005; Narayanan, Guarnieri and DiLeone, 2010).
La voie mésolimbique comprend les neurones de l’Aire Tegmentale Ventrale (ATV) (correspondant à la région A10) qui projettent vers le noyau accumbens (NA), le tubercule olfactif innervant le septum ainsi que l’amygdale et l’hippocampe (Lindvall and Stenevi, 1978; McNamara and Dupret, 2017). Cette voie est impliquée dans les processus de récompense naturelle et en relation avec la prise de psychostimulants, la motivation, les émotions, la mémoire, l’olfaction ainsi que le contrôle de la prise de nourriture et les cycles d’éveil (Pierce and Kumaresan, 2006; Oishi and Lazarus, 2017).
La voie mésocorticale comprend les neurones de l’ATV projetant vers le cortex préfrontal (CPF). Cette voie est à l’origine de la régulation de processus cognitifs, de la prise de décision (Friston et al., 2014; Ang et al., 2018), et semblerait impliquée dans le développement de la créativité chez l’humain (Boot et al., 2017). Elle est également impliquée dans la régulation du stress, de l’anxiété et de la dépression (Furuyashiki, 2012; Sesack, 2014) .
Figure 2: Représentaion des origines des projections mésolimbiques, nigrostriée et mésocorticales chez le rat.
Les cellules localiées dans la portion dorsale de la SNc innervent à la fois les aires limbiques et corticales telles que représentées en (b) et en (c). En revanche, les cellules du tiers ventral de la SNc (points rouges en (a)) innervent la portion sensori-motrice du caudé-putamen (région rougen en (a)). (Björklund and Dunnett, 2007)
Bien que ces trois voies décrites ci-dessus soient distinctes au niveau des structures cérébrales dans lesquelles les neurones projettent, leur inter-connexions font l’objet d’études récentes et nombreuses. En effet, il semble de plus en plus évident que les processus moteurs, cognitifs et d’addiction qu’elles contrôlent sont liés afin de guider les comportements complexes que présentent les êtres humains. Il s’agit notamment des processus de l’implication de la mémoire et de la prise de décision dans l’addiction (Bickel et al., 2018), du rôle de prise de décision dans le contrôle du conditionnement à la peur (Pezze and Feldon, 2004) ou encore du lien entre le stress et le développement de la maladie de Parkinson (Dallé and Mabandla, 2018).
La dopamine : synthèse et transmission
Voie de synthèse de la dopamine
Les neurones dopaminergiques synthétisent tous de la dopamine. La dopamine (DA) (ou 3-hydroxytyramine ou P-(3,4-dihydroxyphényl)-éthylamine) est un neurotransmetteur de la famille des aminés biogènes comprenant les catécholamines et la sérotonine.
La tyrosine hydroxylase (TH) est l’enzyme limitante dans la synthèse des catécholamines (Molinoff and Axelrod, 1971). Elle catalyse l’hydroxylation c’est-à-dire l’ajout d’un groupement –OH, de la L-DOPA. Ensuite, l’enzyme L-Aromatic amino acid decarboxylase (L-AADC) intervient afin de former la dopamine. Par la suite, les enzymes dopamine-ß-hydroxylase et phenylethanolamine N-methyltransférase peuvent agir successivement afin de produire respectivement la norépinéphrine puis l’épinéphrine (Figure 2)
Figure 3 : Voie de synthèse des catécholamines.
La dopamine est synthétisée grâce à trois réactions enzymatiques importantes. Il s’agit d’abord d’une hydroxylation de la phénylalanine par la phelylalanine hydroxylase. Puis d’une nouvelle hydroxylation par la tyrosine hydroxylase (TH), formant ainsi le produit L-DOPA. Enfin une décarboxylation par la L-Aromatic amino acid decarboxylase (L-AADC) permet de former la dopamine. Les reste des catécholamines, soit nerépinéphrine et épinéphrinse, sont produites par l’intervention successives de la dopamine-ß-hydroxylase puis de la phenylethanolamine N-methyltransférase (Daubner, Le and Wang, 2011).
Les catécholamines sont importantes non seulement dans le système nerveux central en tant que neurotransmetteurs, mais également dans le système nerveux périphérique en tant qu’hormones. Dans ce dernier, elles sont synthétisées dans la glande médullosurrénale (Barchas et al., 1975).
Au niveau du système nerveux périphérique, la dopamine est impliquée dans la régulation de l’olfaction, la régulation hormonale, des fonctions cardiovasculaires,
du système immunitaire ainsi que des fonctions rénales (MISSALE et al., 1998; Iversen and Iversen, 2007).
Considérant le rôle varié des catécholamines et leur importance dans des réactions de combat ou fuite primordiales pour la survie de l’individu, il est nécessaire que leur niveau de synthèse soit finement régulé. Ainsi, une surproduction ou un déficit de ces molécules peut mener à des pathologies telles qu’une pression sanguine élevée, la bipolarité, l’addiction ainsi que les dystonies (HONDA et al., 1975; Koob, 2005; M. et al., 2007).
Une fois la dopamine synthétisée, elle est stockée au niveau du cytoplasme des neurones dopaminergiques dans des vésicules synaptiques grâce au Transporteur Vésiculaire des Monoamines (VMAT2). Un influx de calcium lors de la génération d’un potentiel d’action induit une libération des neurotransmetteurs dans la fente synaptique. Une fois libérés, ceux-ci peuvent se lier aux récepteurs spécifiques situés sur la membrane de l’épine dendritique du neurone post-synaptique ; se faire dégrader dans l’espace post-synaptique ou encore être recapturés par le neurone présynaptique afin d’être recyclés puis réutilisés (Giros and Caron, 1993).
Les récepteurs dopaminergiques :
Dans le système nerveux central les effets de la dopamine sont médiés par cinq types de récepteurs de la famille des GPCR (récepteurs liés à une protéine G). Les récepteurs dopaminergiques se divisent alors en deux sous-types : les récepteurs de type-D1 ou de type-D2, que l’on distingue par leurs propriétés structurelles, pharmacologiques et biochimiques. Le sous-type de récepteurs de classe D1 englobe les récepteurs D1 et D5 (Tiberi et al., 1991). Celui de la classe D2 comprend les récepteurs D2, D3 et D4 (Andersen et al., 1990; Tiberi et al., 1991; MISSALE et al., 1998). Bien qu’ils partagent un haut niveau d’homologie au niveau de leur domaine transmembranaire, les récepteurs de type D1 et D2 se distinguent par les voies de signalisation cytoplasmiques qu’ils activent. En effet, de façon générale, les deux sous-types de récepteurs activent
l’adényl cyclase, l’adénosyl monophosphate cyclique (AMPc), la protéine kinase A (PKA). Par la suite les protéines de la famille des récepteurs de protéines G (GRK) et la ß-arrestine sont recrutés pour former le complexe GPCR/AP2/βarrestine/clathrine. Le complexe est ensuite internalisé dans des vésicules. Enfin, il sera soit recyclé à la membrane, soit dégradé dans le protéosome (Beaulieu and Gainetdinov, 2011).
Contrairement aux récepteurs de type-D2, les récepteurs de classe D1 activent les protéines G de la famille des Gαs (Gs) et Gαolf (Golf) afin d’enclencher la production d’AMPc par l’adényl cyclase (Yano et al., 2018).
Les récepteurs de classe D2 quant à eux sont couplés à des protéines G de type Gαi ou Go (Jiang et al., 2001; Bibb, 2005) et induisent une inhibition de l’adényl cyclase.
Enfin, les récepteurs type-D1 et type-D2 se différencient par leur localisation dans le cerveau et au niveau des synapses. Ainsi les récepteurs type-D1 se retrouvent exclusivement sur les neurones post-synaptiques. Les récepteurs type-D2 sont exprimés à la surface de neurones post-synaptiques mais aussi pré-synaptiques pour lesquels ils régulent la synthèse, relâche et recapture de dopamine (Mizuno, Schmauss and Rayport, 2007; De Mei et al., 2009; Ford, 2014).
Dans le cerveau, les récepteurs type-D1 se retrouvent en fortes densités dans le noyau caudé et le putamen (striatum), noyau accumbens, substance noire, bulbe olfactif, amygdale et cortex préfrontal. Ils se retrouvent également en moins grande densité dans les régions de l’hippocampe, cervelet, l’hypothalamus. Les récepteurs D5 sont exprimés en faible quantité dans le cortex préfrontal, cortex cingulaire et entorhinal, substance noire, hypothalamus et gyrus denté (Kebabian and Calne, 1979; MISSALE et al., 1998) .
Les récepteurs type-D2 sont quant à eux retrouvés dans les régions du striatum, tubercule olfactif et noyau accumbens. Ils sont fortement exprimés dans l’ATV, la substance noire, le septum, hypothalamus, l’hippocampe ainsi que diverses aires corticales (Beaulieu and Gainetdinov, 2011).
Figure 4: Représentation schématique d’une synapse dopaminergique.
La dopamine est synthétisée à partir de la L-Tyrosine dans le neurone présynaptique. Elle est ensuite mise en véhicules qui sont amenées vers la membrane présynaptique et l’espace synaptique. La membrane de la vésicule y fusionne pour libérer son contenu dans l’espace. Le neurotransmetteur une fois libéré ira se lier sur les récepteurs dopaminergiques de la membrane post-synaptique. Il peut aussi être dégradé dans l’espace synaptique, récupéré par le neurone présynaptique grâce au transporteur DAT, ou encore se lier aux autoérécepteurs dopaminergiques du neurone présynaptique (Blackstone, 2009).
Induction et développement de l’identité dopaminergique dans
le mésencéphale
Développement des neurones dopaminergiques :
L’ontogénèse des neurones dopaminergiques du mésencéphale comprend une série d’évènement complexes qui déterminent leur localisation, spécification, différenciation, migration et leur connectivité. Chacun de ces évènements est régulé dans le temps et dans l’espace par des facteurs intrinsèques tels que l’expression différentielle de divers facteurs de transcription, mais aussi par des facteurs extrinsèques tels que la diffusion de molécules de guidage axonal et autres ligands.
Spécification de la zone ventrale et induction des neurones dopaminergiques : Les groupes de neurones dopaminergiques A8, A9 et A10 originent de progéniteurs situés dans la plaque du plancher du tube neural (Ono et al., 2007). Cette plaque s’étend de la moelle épinière jusqu’à la partie postérieure du diencéphale. Au niveau de la ligne médiane de cette plaque naissent les neurones dopaminergiques après 10.5 jours de développement embryonnaire. Dès le début du développement embryonnaire, la notochorde définit l’orientation dorso-ventrale. En même temps, la limite entre le mésencéphale et le rhombencéphale est déterminée par l’organisateur isthmique (ou isthme) (Rhinn and Brand, 2001). Chacun de ces centre organisateur produit des morphogènes qui vont jouer un rôle important dans l’induction des neurones dopaminergiques du mésencéphale (Joyner, Liu and Millet, 2000; Bissonette and Roesch, 2016) (Figure 5).
Pour commencer, dès E7.5 la partie antérieure de l’épiblaste en développement exprime la protéine Otx2 tandis que l’épiblaste postérieur exprime Gbx2. Otx2 est essentiel à la formation du prosencéphale et mésencéphale (Acampora et al., 1995; Ang et al., 1996; Beby and Lamonerie, 2013) . La région caudale du mésencéphale et le rhombencéphale, quant à elles, se trouvent dans la région d’expression du gène Gbx2 (Wassarman et al., 1997; Wang et al., 2018). Ensemble, Otx2 et Gbx2 sont ainsi essentiels à la formation du mésencéphale et du cervelet (Wassarman et al., 1997; Wang et al., 2018). À l’intersection des zones d’expression de ces deux facteurs de transcription se trouve l’isthme.
Dès E9.5, l’isthme synthétise le facteur Wnt1. Il synthétise et diffuse aussi FGF8 (Fibroblast growth factor 8) jusqu’à E12.5, et son expression semble dépendante de Wnt1 (McMahon et al., 1992). FGF8 a un rôle essentiel comme morphogène afin de déterminer l’axe antéro-postérieur du cerveau en développement. Il est également essentiel pour l’induction et le maintien de l’identité des neurones dopaminergiques.
Au niveau de la plaque neurale, c’est la synthèse du morphogène Sonic hedgehog (Shh) qui va définir l’axe dorso-ventral. Son expression, régulée finement à la fois dans le temps et dans l’espace, est elle aussi essentielle pour le développement des neurones dopaminergiques en induisant l’expression de facteurs de transcription spécifiques (Joksimovic et al., 2009; Belgacem et al., 2016). Parmi ceux-ci, on retrouve les membres de la famille Engrailed : En1/2 (Joyner, 1996), Pax2/5 (Urbánek et al., 1997), Lmx1a/b (Yan et al., 2011), Msx1 (Roybon et al., 2008) et FoxA(Friedman and Kaestner, 2006; Ferri et al., 2007). Ce sont des marqueurs génétiques des précurseurs de neurones dopaminergiques.
Figure 5: Séquence d’expression de gènes menant au développement de neurones dopaminergiques au cours du développement.
Le développement des neurones dopaminergiques suit une série d’évènements commençant par la spécification régionale, l’induction de signaux moléculaires dans la région de la plaque neurale, la naissance des précurseurs dopaminergiques et enfin la différenciation neuronale (S. V. Hegarty, Sullivan and O’Keeffe, 2013).
Développement de l’identité des neurones dopaminergiques:
Les premiers neurones dopaminergiques apparaissent dans la partie la plus ventrale du neuro-épithélium, le long de l’inflexion du mésencéphale. Les marqueurs génétiques de leur identité sont les gènes Nurr1, immédiatement suivi par l’expression de Ngn2 à E10.5. Dès E11.5, l’expression de l’enzyme Tyrosine Hydroxylase débute, scellant l’identité dopaminergique (Armstrong et al., 2003). En même temps, ils initient l’expression du facteur de transcription Pitx3. Son expression est limitée aux neurones dopaminergiques du mésencéphale (Nunes et al., 2003; Smidt, Smits and Burbach, 2003; Veenvliet et al., 2013). Les progéniteurs sont alors devenus des neurones post mitotiques. Cette transition est régulée notamment par Neurogenin 2 (Kele et al., 2006), un facteur de
transcription régulant la neurogenèse et la différenciation spécifique de divers sous-types neuronaux dans le système nerveux central. Son rôle ici est d’induire la transcription de Nurr1 (Andersson et al., 2006; Rodríguez-Traver et al., 2016). Ce dernier quant à lui est exprimé depuis E10.5 jusqu’à l’âge adulte (Bäckman et al., 1999). Sans Nurr1, les protéines TH, l-aromatic acid decarboxylase (AADC), le vésicule monoamine transporteur 2 (VMAT2) et le transporteur de dopamine (DAT), essentiels à l’identité dopaminergique, ne sont pas exprimés (Castillo et al., 1998; S. V Hegarty, Sullivan and O’Keeffe, 2013; Rodríguez-Traver et al., 2016). Les facteurs de transcription Lmx1a et Lmx1b jouent également un rôle fondamental dans le développement des neurones dopaminergiques. Exprimés dès E8.5, ils régulent en effet la prolifération spécification et la différenciation des neurones dopaminergiques (Ang, 2006; Yan et al., 2011). L’expression de Lmx1a seule est nécessaire dans le mésencéphale pour la génération et le maintien des progéniteurs et des neurones dopaminergiques. De plus il a été montré que Lmx1a joue un rôle compensatoire pour Lmx1b, et vice-versa (Yan et al., 2011).
L’étude de ces morphogènes permet de mieux comprendre les étapes de développement de neurones dopaminergiques. Avec une meilleure connaissance de ces étapes finement régulées, les scientifiques sont de mieux en mieux capables de générer en laboratoire des neurones dopaminergiques les plus proches possibles de leur identité in vivo.
Connectivité du circuit dopaminergique :
L’établissement et le développement de sous-types neuronaux est essentiel pour établir l’identité du cerveau. Toutefois sa fonctionnalité est basée sur les connexions que font entre elles ces diverses populations. De ce fait, la quantité de neurotransmetteur reçue par les cibles du circuit dopaminergique va gravement influencer le comportement individuel. On sait qu’une modification de ces liens au cours du développement par l’utilisation de psychostimulants et de l’alcool notamment peut induire des effets sur la motivation et la cognition (Robinson and Kolb, 2004). Afin de construire les connexions nécessaires à la
fonctionnalité du cerveau, les neurones en développement répondent à des molécules de guidage qui favorisent le mouvement des axones vers une trajectoire prédéterminée. Un dysfonctionnement dans ces voies de régulation au cours du développement peut avoir de graves conséquences sur la fonctionnalité du cerveau.
Ainsi les voies de guidage axonal sont régulées par des familles de grands acteurs moléculaires.
Le guidage axonal, un processus essentiel à l’établissement de connexions
neuronales
Introductions aux grandes familles de molécules de guidage axonal :
Nétrines
Nétrine-1 est la première molécule de guidage diffusible identifiée pour le guidage des neurones commissuraux dl1 (Kennedy et al., 1994). Nétrine, sécrété par le plancher neural, forme un gradient de l’axe ventral vers dorsal qui est chémoattractant pour les neurones commissuraux. Cet effet est médié par son récepteur qui, chez les vertébrés, est DCC (Deleted in Colorectal Carcinoma)(Kim et al., 2015). Cependant des études plus récentes ont démontré d’autres modes d’action des Nétrines. Ainsi le couple Nétrine/DCC exerce un pouvoir attractif sur les neurones du corps calleux en modulant l’effet normalement répulsif de Slit2 (Fothergill et al., 2014). Nétrine peut également avoir un effet chémorépulsif sur les neurones moteurs trochléaires (Colamarino and Tessier-Lavigne, 1995) ainsi que d’autres neurones moteurs du rhombencéphale (Manitt et al., 2011). Nétrine semble également importante pour le développement, migration et promouvoir l’arborisation dendritique des neurones dopaminergiques du mésencéphale (Lin, Rao and Isacson, 2005; Lin and Isacson, 2009; Xu et al., 2010).
Slits
Les membres de la famille des Slits se retrouvent chez la plupart des vertébrés et sont très conservées entre les espèces (Hummel, Schimmelpfeng and Klämbt, 1999) . Elles peuvent être sécrétées ou encore attachées à la membrane cellulaire ou à la matrice extracellulaire et leurs récepteurs sont les protéines Roundabouts (Robo) (Hummel, Schimmelpfeng and Klämbt, 1999). Les Slits sont connues pour médier la répulsion des axones commissuraux qui croisent la ligne médiane au cours du développement (Rothberg et al., 1988; Seeger et al., 1993; Hummel, Schimmelpfeng and Klämbt, 1999). Toutefois au fil des années, de nouvelles fonctions ont été découvertes pour le couple Robo/Slit, notamment dans la prolifération cellulaire, angiogenèse, le développement de divers organes, la prolifération des cellules souches, le développement des tumeurs ainsi que diverses autres pathologies. De la même façon, il a été montré que l’effet de la liaison Slit/Robo n’est pas exclusivement chémorépulsive mais plutôt dépendante du contexte (Hummel, Schimmelpfeng and Klämbt, 1999).
En ce qui concerne les neurones dopaminergiques du mésencéphale, Slit-2 a été identifié comme un inhibiteur de développement de l’arborisation dendritique en empêchant la croissance des neurites. Cet effet est médié par les récepteurs de type Robo (Lin, Rao and Isacson, 2005).
Ephrines
Les Ephrines sont essentielles pour le développement et sont exprimées dans l’ectoderme, mésoderme et endoderme. Elles sont importantes pour la ségrégation cellulaire ainsi que le positionnement cellulaire. Il semblerait que ce mécanisme se fasse par la régulation de l’adhésion cellulaire ou leur répulsion (Klein, 2012). Elles jouent également un rôle fondamental dans la migration cellulaire, le guidage axonal et la mise en place d’une organisation topographique, (sur le tectum optique (ou collicule supérieur chez les mammifères) par exemple (Yates et al., 2001; Rodger et al., 2004)). Leur rôle est également important dans des mécanismes vasculaires et de morphogénèse squelettique (Klein, 2012).
Il existe deux classes d’éphrines, la classe A qui sont liés à la membrane cellulaire par un lien glycosylphosphatidylinositol (GPI) ; et la classe B qui sont des ligands transmembranaires (Kullander and Klein, 2002).
Les récepteurs des Ephrines, Eph, sont des récepteurs tyrosine-kinases (RTKs) ne peuvent être activés que par un contact direct. Après activation, des voies de signalisation peuvent être induites à la fois en aval du récepteur Eph, et en aval du ligand présenté (Kullander and Klein, 2002). On parle alors respectivement de signalisation directe et inverse. Il a été reporté qu’à la fois éphrine et son récepteur Eph peuvent être exprimés par la même cellule, et sur le même cône de croissance (Marquardt et al., 2005) . Dans la majorité des cas, éphrine a un effet répulsif sur les cellules exprimant Eph. Cependant, la signalisation inverse peut favoriser l’adhésion de cellule à cellule, ou de cellule à matrice extracellulaire. C’est le cas pour ephrin-A5 qui favorise l’adhésion à la fibronectine par exemple (Davy and Robbins, 2000).
Le mécanisme de signalisation en aval du récepteur et de son ligand est activé par la formation d’un hétérotétramère (deux Ephs et deux éphrines). En aval de Eph (voie directe), il implique la phosphorylation de tyrosine kinases qui recrutent ensuite les Rho-GTPases, ce qui a pour effet de moduler le cytosquelette et les propriétés adhésives des cellules en question (Kullander and Klein, 2002; Park and Lee, 2015). Les protéines Nck1, Vav-RhoGEFs et l’adapteur SH2 sembles aussi impliqués dans cette voie puisqu’ils induisent l’endocytose des récepteurs Ephs (Park and Lee, 2015).
Sémaphorines
Les sémaphorines forment une large famille de molécules sécrétées ou attachées à la membrane de divers types cellulaires. Elles possèdent un rôle fondamental dans le développement du système nerveux central (SNC), mais leur distribution (ainsi que celle de leurs récepteurs intégrines et Plexins) dans le corps, indiquent une fonction dans divers autres processus. En effet, ils semblent avoir un effet sur les cellules endothéliales (Lin, Rao and Isacson, 2005), les
fibroblastes, la glie, macrophages, cellules du poumon, os, cartilage, méninges, muscles squelettiques, cœur, etc. (résumé dans (Lin, Rao and Isacson, 2005)). La famille des sémaphorines se compose de 8 classes de molécules, subdivisées en catégories allant jusqu’à 6 membres. Elles sont conservées entre les espèces et sont notamment exprimées par des virus ainsi que diverses espèces d’invertébrés (telles que la drosophile et Caenorhabditis elegans) et de vertébrés (incluant les murins et les humains) (Yazdani and Terman, 2006). Ainsi, on retrouve les classes 1 et 2 chez les invertébrés, 3 à 7 chez les vertébrés alors que les membres de la classe 5 ne sont exprimées que chez les virus.
Dès 1993 on découvre que les sémaphorines ont la propriété de provoquer l’effondrement du cône de croissance. En l’occurrence, Sémaphorine 3a a été la première découverte avec ces propriétés dans le cerveau de la poule et a été appelée « Collapsine » en référence à cette propriété (Lin, Rao and Isacson, 2005). Depuis, les propriétés chémorépulsives des sémaphorines ont été mises en évidence sur des neurones moteurs, sensoriels, olfactifs ainsi que ceux de l’hippocampe (Shepherd et al., 1996; Kobayashi et al., 1997; Koppel et al., 1997; Chedotal et al., 1998; Tran et al., 2009).
Chaque membre des huit classes de sémaphorines partage une région structurale commune. Cette portion extracellulaire N-terminale de 500 acides aminés est désignée sous le nom de domaine sémaphorine (Sema) (Yazdani and Terman, 2006). Ce domaine très conservé entre les phylums est essentielle pour la liaison Sémaphorine/Plexin (Koppel et al., 1997). Par l’analyse des structures cristallographiques de Sémaphorine3A et Sémaphorine4D, on a déterminé que le domaine Sema possède une forme en hélice ß à sept pales. Il peut se retrouver sous forme d’homodimère (Gherardi et al., 2004).
La première famille de récepteurs des sémaphorines découverte furent les Neuropilines (Npn) (He and Tessier-Lavigne, 1997; Kitsukawa et al., 1997). Par des expériences de mutants KO, on a découvert qu’en l’absence de Npn1, les souris présentaient une défasciculation marquée des faisceaux nerveux ,et des projections aberrantes de certains nerfs sensoriels et moteurs crâniens (Kitsukawa et al., 1997; Chedotal et al., 1998). De la même façon, les souris
Npn2 KO présentent des défauts dans la formation des nerfs oculomoteur, trochléaire, ainsi que le trigéminal et le nerf facial (Chen et al., 2000). L'affinité de chacune des sémaphorines pour les deux types de Neuropilines varie en fonction de leur proximité et de la compétition de liaison. Toutefois, à ce jour les mécanismes à l’origine des préférences de liaison ne sont pas toujours claires (Chen et al., 1998; Nakamura, Kalb and Strittmatter, 2000).
La seconde famille de récepteurs découverte fut celle des Plexins. Toutefois, il semble que la liaison Sema/Plexin soit en fait un complexe évolutivement plus ancien et que les Neuropilines soient intervenues plus tard pour renforcer ce complexe signalétique. Ainsi, on retrouve la liaison Sema/Plexin déjà chez la Drosophile (Winberg et al., 1998; Nogi et al., 2010).
Chez les mammifères il existe trois sous-classes de Plexin : Plexin-A1 – 4, Plexin-B1 – 3, Plexin-C1 et Plexin-D1 (Tamagnone et al., 1999). Le domaine extracellulaire des récepteurs Plexin contient un domaine d’homologie Sema, qui peut s’associer aux Neuropilines pour former un complexe de récepteur fonctionnel. Ainsi, Sema3A à Sema3G s’associent soit à Npn1, Npn2, ou les deux (Tableau 1).
Tableau 1: Résumé des spécificités de forme et de liaison des 8 sous-classes de sémaphorines. (Negishi, Oinuma and Katoh, 2005).
La formation Plexin/Neuropiline peut encore être plus complexe avec l’ajout d’une troisième protéine transmembranaire : L1. L1 peut en effet bloquer l’effet chémorépulsif de Sema3A (mais pas Sema3B) sur les cellules exprimant
PlexinA/neuropiline1, voir même induire un effet attractif en agissant sur le mécanisme d’endocytose des récepteurs (Castellani, Falk and Rougon, 2004; Bechara et al., 2008). Pour Sema3B et Sema3F, un membre différent de la famille L1, NrCAM, peut aussi se joindre au complexe Plexin/Neuropiline (Falk et al., 2005).
Dans le cas exceptionnel de Sémaphorine 7A, le ligand peut s’associer à une Plexin, au récepteur ß1-intégrine, mais pas à une Neuropiline. La liaison Séma7A/ß1-intégrine participe à la réaction inflammatoire (HOLMES et al., 2002; Kikutani and Kumanogoh, 2003; Suzuki et al., 2007) mais elle a aussi un rôle notamment dans le contrôle du développement du tract olfactif et des neurones de l’hippocampe (Jeroen Pasterkamp et al., 2003; Jongbloets et al., 2017). Il est essentiel de noter que l’effet de Sémaphorine7A sur la croissance axonale et l’arborisation dendritique varie drastiquement selon le récepteur impliqué dans la transmission de son effet (Parkash et al., 2015; Jongbloets et al., 2017).
Trajet des axones dopaminergiques au cours du développement : état des connaissances actuelles :
Tel qu’évoqué précédemment, la première molécule de guidage intervenant dans l’établissement de la voie mésotélencéphalique au cours de l’embryogenèse est Sonic Hedgehog (Shh). Dès E10 il est exprimé dans la ligne ventrale (Hynes et al., 1995). Les neurones migrent ensuite vers le mésencéphale ventral en suivant la glie radiale (Smidt and Burbach, 2007; Tang, Miyamoto and Huang, 2009). Les corps cellulaires des neurones dopaminergiques s’orientent grâce à la signalisation de Wnt (Fenstermaker et al., 2010).
L’élongation axonale à partir de ce moment se découpe en trois phases. La première va de E11.5 à E13.5, période pendant laquelle les axones s’étendent dorsalement et puis rostralement. Ensuite, dès E13.5 ils vont former le faisceau médial du télencéphale en s’étendant longitudinalement au travers du mésencéphale et le diencéphale. Enfin de E14.5 à E18.5, ils atteignent le
télencéphale et ce qui deviendra le striatum, le système limbique et le néocortex (Voorn et al., 1988; Specht et al., 2018).
La première phase (Figure 6) se fait principalement grâce à des messages locaux de guidage axonal (Gates et al., 2004). En 2009, Yamauchi et collègues ont montré que Sema3F, dont la production est induite par FGF8, repousse les neurones qui remontent vers le diencéphale (Gates et al., 2004). D’autres membres de la famille des Sémaphorines sont impliqués dans le guidage des neurones dopaminergiques à ce stade. Ceux-ci exprimant à la fois 1 et Npn-2, ils sont repoussés par la présence de Sema3F et Sema3C dans le prétectum (Gates et al., 2004). À la fin de la première phase de guidage, les récepteurs Npn-1, Npn-2, Plexin-A1, Plexin-A3, NrCAM et L1CAM sont aussi exprimés par les neurones dopaminergiques, ce qui laisse à croire que ceux-ci pourraient répondre à la présence de Sema3A dans le mésencéphale ventral également (Torre, Gutekunst and Gross, 2010).
Dès E14.5 la molécule de guidage Nétrine-1 participe dans l’orientation des axones dopaminergiques exprimant le récepteur DCC en forte quantités (Lin, Rao and Isacson, 2005; Flores, 2011).
De E15 à E20, les récepteurs Robo1 et Robo2 sont exprimés au cours du développement chez le rat. On les retrouve dans la SNc ainsi que dans la VTA cependant ils ne sont présents que dans des sous-populations distinctes (Dugan et al., 2011; S. V. Hegarty, Sullivan and O’Keeffe, 2013). Slit-1 et Slit-3 étant exprimés au niveau du mésencéphale dorsal et caudal, ils repoussent les neurones dopaminergiques, et vont ainsi contribuer à les orienter sur l’axe rostro-caudal (Marillat et al., 2001; Lin, Rao and Isacson, 2005). Il semble également que Wnt5 ait une action chémorépulsive sur les neurones exprimant les récepteurs Frizzled (Andersson et al., 2008a, 2008b; Blakely et al.).
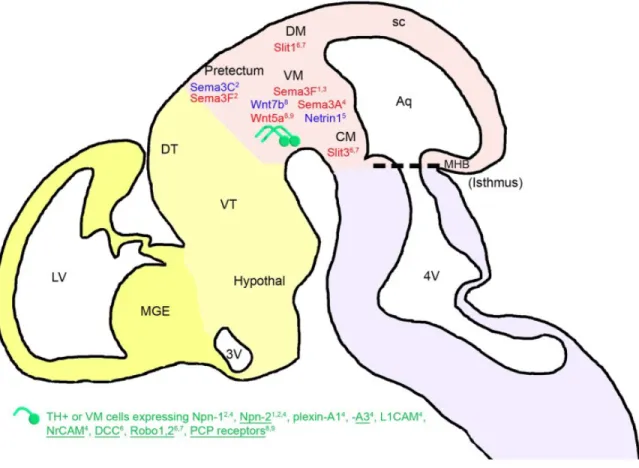
Figure 6: Résumé schématique des interactions ligand/récepteur régissant le guidage axonal des neurones dopaminergiques au niveau du mésencéphale.
Ce schéma représente la première phase de l’élongation axonale des neurones dopaminergiques. Ceux-ci représentés en verts sur le schéma, répondent à l’expression de molécules répulsives (en rouge) telles que Sema3F dans le mésencéphale ventral (MV) et le prétectum, Sema3A et Wnt5 dans le MV; Slit 1 dans le mésencéphale caudal (MC); et Slit dans le mésencéphale dorsal (MD). Ils répondent également à des molécules attractives telles que Nétrine1 et Wnt7 dans le MV et Sema3C dans le prétectum. Des sous-groupes de neurones dopaminergiques répondent spécifiquement à un éventail de ces molécules, en fonction des récepteurs qu’ils expriment à E13.5. La liste de ces récepteurs est présentée en vert. Les noms soulignés représentent les récepteurs exprimés par la plupart des neurones TH+. Les autres ne sont exprimés que par une fraction de cette population. Les portions céphaliques télencéphale, diencéphale, mésencéphale et rhombencéphale sont délimités en jaune, beige, rose et violet. Aq, aqueduc; Hypothal, hypothalamus; LGE, éminence ganglionnaire latérale; LV, ventricule latéral; MFB, faisceau médial du cerveau antérieur; MGE, éminence ganglionnaire médiale; RM, mésencéphale rostral; sc, colliculus supérieur; Thal, thalamus; VM, mésencéphale ventral; 4V, quatrième ventricule (Prestoz, Jaber and Gaillard, 2012).
La seconde phase de guidage commence à E13.5 (Figure 7). Ainsi, lors de leur sortie du mésencéphale, les axones mDA (dopaminergiques du mésencéphale) vont former les fascicules médians télencéphaliques (MFBs). Ces deux faisceaux d’axones parcourent la portion ventrolatérale du télencéphale. Ils contiennent à la fois des fibres ascendantes et descendantes des régions olfactives basales,
periamygdoïdales, du noyaux septal et du tronc cérébral à destination du cortex et du striatum (Van den Heuvel and Pasterkamp, 2008)
Afin de guider les neurones dans cette voie, on retrouve Sema3F et Sema3A qui maintiennent par leur action chémorépulsive les neurones dopaminergiques sur une trajectoire ipsilatérale (Kolk et al., 2009; Torre, Gutekunst and Gross, 2010). Au niveau de la ligne médiane, Slit-1 et Slit-2 empêchent les neurones dopaminergiques exprimant Robo1 et Robo2 de traverser (Lin, Rao and Isacson, 2005). La présence de molécules répulsives comme Ephrin–A5 au niveau du thalamus limite l’extension des projections vers cette région (Deschamps et al., 2009, 2010). Au niveau du thalamus, les murins n’exprimant pas Pax6 présentent un défaut de migration des neurones dopaminergiques qui, au lieu de se diriger ventralement dans la MFB, remontent dans le prétectum et la zone de transition du thalamus (Vitalis et al., 2000). La présence du facteur de transcription Nkx2.1 empêche les neurones dopaminergiques de se diriger vers la ligne médiane de l’hypothalamus (Marín et al., 2002).
Dans l’hypothalamus, Shh constitue une source chémoattractive pour les axones dopaminergiques en croissance depuis la section médiane du mésencéphale (Marín et al., 2002).
Bien que les neurones mDA n'expriment pas Pax6 à E13,5 (Vitalis et al., 2000), les souris dépourvues de Pax6 présentent une modification de l'orientation des projections mDA et ne suivent pas la voie du MFB ventralement. Au contraire, ils se dirigent rostralement et dorsalement vers le niveau de la zone de transition prétecto-dorsale thalamique et dans la plaque alar thalamique dorsale, s’éloignant ainsi de la région anormalement étendue chez ces mutants, de Nétrine-1. La plupart des neurones dopaminergiques exprimant à ce stade le récepteur DCC, ils répondent à l’action chémorépulsive de Nétrine-1 (Xu et al., 2010).
Enfin, Wnt-5, est exprimé au cours du développement, et joue le rôle de chémorépulsif pour les neurones mDAs (Blakely et al., 2011).
Figure 7: Résumé des interactions ligand/récepteur régissant le guidage axonal des neurones dopaminergiques au niveau du diencéphale.
Les molécules de guidage à l’effet attractif sont représentés en bleu alors que ceux à l’action répulsive sont en rouge. Les axones mDA (en vert) fasciculent dans une direction ventrorostrale pour former le MFB. Ceux-ci répondent aux signaux environnementaux via des récepteurs spécifiques (en vert). Les noms de récepteurs soulignés sont exprimés dans la totalité ou la plupart des cellules TH (TH +). Les autres ne sont exprimés que dans une fraction de ces neurones. Nkx2.1 dans l’hypothalamus a une action répulsive indirecte sur les axones mDA par l'activation de l'expression de Slit-2. Pax6 dans le thalamus et l’hypothalamus permet aux fibres mDA de naviguer de manière ventrale à travers l'expression d'une action répulsive de la nétrine-1. Les portions céphaliques télencéphale, diencéphale, mésencéphale et rhombencéphale sont délimités en jaune, beige, rose et violet. Aq, aqueduc; Hypothal, hypothalamus; LGE, éminence ganglionnaire latérale; LV, ventricule latéral; MFB, faisceau médial du cerveau antérieur; MGE, éminence ganglionnaire médiale; RM, mésencéphale rostral; sc, colliculus supérieur; Thal, thalamus; VM, mésencéphale ventral; 4V, quatrième ventricule. (Prestoz, Jaber and Gaillard, 2012)
Finalement au cours de la troisième phase de guidage, les neurones dopaminergiques atteignent le télencéphale et ce qui deviendra le striatum, le système limbique et le néocortex (Figure 8) (Voorn et al., 1988; Specht et al., 2018). Durant cette période, Ephrin-A5 est exprimé au niveau rostral et ventral dans le striatum sous forme d’un gradient (Deschamps et al., 2009). Il y a donc répulsion des neurones mDA exprimant EphA, qui innervent donc la partie
dorsale du striatum, alors que les autres se dirigent vers la partie dorsale et vers le cortex (Alves et al., 2008).
EphrinB1, exprimé de façon plus prononcé dans les neurones de la SNc, exerce une action répulsive envers les neurones exprimant EphrineB2 dans le striatum ventral (Janis, Cassidy and Kromer, 1999). Enfin, la présence d’Ephrine-A2, -A3 et –A5 dans les striosomes et la matrice suggèrent un rôle éventuel des Ephrines pour le guidage axonal des neurones mDAs dans le striatum (Janis, Cassidy and Kromer, 1999). Les neurones de la SNc expriment les ARNm de Robo1 et Robo2 alors que ceux de la VTA n’expriment que Robo1. Or on retrouve dans le putamen, Slit-1 et Slit-2, ainsi que Slit-2 dans le septum (Marillat et al., 2001). Donc les Slits empêchent la croissance des axones dans le domaine ventral du télencéphale. De plus, in vitro Slit-1 inhibe la croissance des neurones mDA (Lin, Rao and Isacson, 2005).
Alors que Nétrine-1 est exprimé dans le striatum et le cortex, DCC est exprimé dans les neurones mDA au cours de leur développement dans le télencéphale (Hamasaki et al., 2001; Xu et al., 2010) La liaison Nétrine-1/DCC induit un effet attractif sur les neurones (Hamasaki et al., 2001). Un autre récepteur de Nétrine-1 : UNC5, est également exprimé dans les neurones mDA de rats dès ENétrine-18, et leur liaison a un effet chémorépulsif (Hamasaki et al., 2001). Puisque ces deux récepteurs sont exprimés dans les neurones mDA, c’est la modulation dans l’équilibre de leur expression qui va réguler l’effet de Nétrine-1 sur les cônes de croissance en migration (Hamasaki et al., 2001).
Les morphogènes Wnt semblent maintenir des effets sur les neurones mDA jusqu’à leur projection dans le télencéphale. Ainsi, les mutants pour les récepteurs de Wnt5 Frizzled3 et Celsr3 présentent des anomalies dans leurs projections au niveau du cortex et du striatum (Fenstermaker et al., 2010). Toutefois les mutants de Wnt5 seuls ne présentent que très peu de projections aberrantes au niveau du télencéphale. Il est donc probable que d’autres Wnt interviennent dans le guidage des axones dopaminergiques en migration et compensent la perte de Wnt5 (Fenstermaker et al., 2010).
Le guidage axonal dans le télencéphale des neurones mDA est aussi affecté par des Sémaphorines. En effet, certains récepteurs des Sémaphorines tels que Npn-1, Npn-2, Plexin- A1 et Plexin-A3 sont exprimés par les neurones mDA dès E15.5 (Tang, Miyamoto and Huang, 2009; Torre, Gutekunst and Gross, 2010). Dès E15.5, les neurones de la VTA expriment PlexinC1, alors que Sémaphorine7A, son ligand, est exprimé par les neurones de la SNc ainsi que dans le striatum dorsal et dans les couches moyennes du cortex (Pasterkamp et al., 2007). L’influence de Sémaphorine7a dans le guidage des neurones dopaminergiques a été proposé dès 2007 par (Pasterkamp et al., 2007).
Figure 8: Résumé des interactions ligand/récepteur régissant le guidage axonal des neurones dopaminergiques au niveau du télencéphale.
Les axones mDA (en vert) se connectent aux régions télencéphaliques via des récepteurs spécifiques (en vert). Les récepteurs exprimés dans la totalité ou la plupart des cellules TH (TH +) du cerveau moyen sont soulignés, alors que les récepteurs exprimés dans une petite fraction des cellules TH ne le sont pas. EphB1 a été détecté au niveau de l'ARNm dans la VM. L'effet répulsif de Séma7A sur les axones mDA reste à déterminer. Les portions céphaliques telles que le télencéphale, le diencéphale, le mésencéphale et le rhombencéphale sont délimités en jaune, beige, rose et violet. Cx, cortex; LGE, éminence ganglionnaire latérale; SN, substance noire; OT, tractus olfactif; CPF, cortex préfrontal; sc, colliculus supérieur; Thal, thalamus; VTA, zone tegmentale ventrale.(Prestoz, Jaber and Gaillard, 2012)
Importance de Séma7A dans le guidage axonal des neurones dopaminergiques : Sémaphorine 7A est une molécule de guidage axonal aux propriétés chémorépulsives. Elle est ancrée à la membrane par un GPI (Alto and Terman, 2017). L’ARN messager de Sémaphorine7a est exprimé dans le cerveau dès E15 (Pasterkamp et al., 2007). Dans les neurones dopaminergiques du mésencéphale, son expression est faible et limitée à une sous-population dans la SNc. Celle de PlexinC1 en revanche, est présente dans la VTA uniquement, et est forte dès le stade embryonnaire. Alors que l’expression de PlexinC1 diminue après la naissance, celle de Séma7A au contraire, s’accentue au cours du développement et se maintient à l’âge adulte (Pasterkamp et al., 2007). Sémaphorine7a est également exprimé dans les régions cibles des projections dopaminergiques telles que le striatum dorsal et le cortex cérébral, particulièrement les couches 2 à 5 (Pasterkamp et al., 2007; Chabrat et al., 2017). Bien que le rôle chémorépulsif de la liaison PlexinC1/Sémaphorine7A dans le guidage des neurones dopaminergiques ait été suggérée dès 2007 par Pasterkamp et al., celle-ci n’a été étudiée dans le striatum que plus récemment. En effet, en 2017, Chabrat et al., montrent que l’expression de PlexinC1 dans le mésencéphale est sous le contrôle des facteurs de transcription Lmx1a/b et Otx2. Ainsi les neurones de la SNc n’expriment pas le récepteur PlexinC1 et ne sont pas affectés par Séma7A, en gradient dans le striatum. Par conséquent, on retrouve les axones de la SNc dans la partie dorsale du striatum. Les neurones de la VTA, expriment PlexinC1 et ne se retrouvent par conséquent que dans la partie ventrale du striatum (Chabrat et al., 2017).
L’implication du second récepteur de Sémaphorine7a, ß1-intégrine a été très peu étudié dans les neurones dopaminergiques. Or il a été montré dans d’autres sous-types neuronaux que l’effet de Sémaphorine7a dépend largement du récepteur auquel il se lie (Parkash et al., 2015; Jongbloets et al., 2017).
Le guidage axonal dans les cônes de croissances : intégration des signaux
moléculaires et modulation du cytosquelette
Mécanismes de guidage axonal :
Le cône de croissance est une structure clé pour le guidage axonal. En effet, c’est la région du neurone qui perçoit, intègre et réagit aux signaux environnementaux sensés guider l’axone.
Ces signaux sont soit des signaux de contact, agissant sur de courtes distances, soit des signaux diffusibles, agissant sur des distances plus grandes.
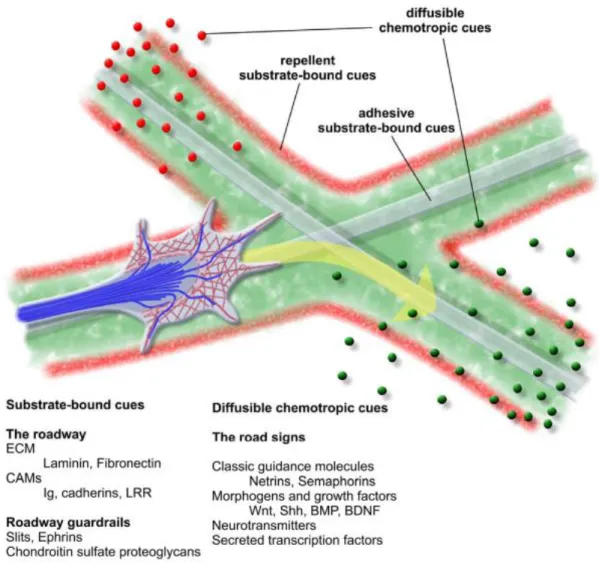
Pour le guidage de contact, le cône de croissance s’attache sur un substrat grâce à des molécules adhésives : les CAMs (Cell Adhesion Molecules) (Maness and Schachner, 2006), se trouvant à la surface de cellules avoisinantes ; ou bien les ECM assemblés en une matrice extracellulaire dense et compacte (comme la laminine ou la fibronectine) (Evans et al., 2007). À l’inverse, le cône de croissance rencontre des molécules antiadhésives, telles que les Slits et les Ephrines (Chilton, 2006; Seiradake, Jones and Klein, 2016) qui vont l’empêcher de dévier de sa trajectoire.
Ensuite, le guidage à longue distance se fait de deux façon (Sperry, 1963). Il peut s’agir d’un guidage chémoattractif. Dans ce cas, le cône de croissance est attiré vers sa cible. Dans le cas contraire, le cône répond à un message chémorépulsif et il s’éloigne de la cible qui lui transmet ce message (voir Figure 9).
Figure 9: Modèle de déplacement du cône de croissance selon ses interactions avec les molécules de guidage.
Le cône de croissance (bleu) se déplace sur des molécules d’adhésion (zone verte) et ne peut sortir de sa trajectoire à cause des molécules antiadhésives (rouges). Il répond à un message chémorépulsif (billes rouges) dont il s’éloigne et à un message chémoattractif (billes vertes) dont il se rapproche (Lowery and Van Vactor, 2009).
Afin de pouvoir répondre à tous ces signaux extérieurs, le cône de croissance possède des récepteurs particuliers, dont l’expression peut changer en fonction du stade de développement (Thomas, 1998; Kidd, Bland and Goodman, 1999). Ainsi, à un temps donné, le cône de croissance pourra répondre de façon à se rapprocher d’une région ou de s’en éloigner.