UNIVERSITE DE ROUEN
FACULTE MIXTE DE MEDECINE ET DE PHARMACIE
Année 2018 N°THESE POUR LE DIPLOME D’ETAT
DE DOCTEUR EN MEDECINE
Mémoire valant lieu de thèse pour l’obtention du titre de docteur en médecine et du diplôme d’études spécialisées en biologie médicale
Présentée et soutenue publiquement le 21 juin 2018 Par
BLONDEL Gaëtan
Né le 19 octobre 1990 à Mont Saint Aignan
Etude des principaux paramètres de la phase
préanalytique pouvant affecter la qualité du
résultat de prélèvements
urinaires, respiratoires, de selles et de liquides
de ponction
Présidente du jury :
Madame le Professeur Soumeya BEKRI
Directrice de thèse :
Madame le Docteur Sophie BOYER
Membres du jury :
Madame le Professeur Martine PESTEL-CARON
Monsieur le Docteur Gérard BUCHONNET
Monsieur le Docteur François GUERIN
Par délibération en date du 3 mars 1967, la faculté a arrêté que les
opinions émises dans les dissertations qui lui sont présentées
doivent être considérées comme propres à leurs auteurs et qu’elle
n’entend leur donner aucune approbation ou désapprobation.
ANNEE UNIVERSITAIRE 2017 - 2018 U.F.R. DE MEDECINE ET DE-PHARMACIE DE ROUEN
---
DOYEN : Professeur Pierre FREGER
ASSESSEURS : Professeur Michel GUERBET
Professeur Benoit VEBER Professeur Pascal JOLY Professeur Stéphane MARRET
I - MEDECINE
PROFESSEURS DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mr Frédéric ANSELME HCN Cardiologie
Mme Gisèle APTER Havre Pédopsychiatrie
Mme Isabelle AUQUIT AUCKBUR HCN Chirurgie plastique
Mr Fabrice BAUER HCN Cardiologie
Mme Soumeya BEKRI HCN Biochimie et biologie moléculaire
Mr Ygal BENHAMOU HCN Médecine interne
Mr Jacques BENICHOU HCN Bio statistiques et informatique médicale
Mr Olivier BOYER UFR Immunologie
Mme Sophie CANDON HCN Immunologie
Mr François CARON HCN Maladies infectieuses et tropicales Mr Philippe CHASSAGNE (détachement) HCN Médecine interne (gériatrie) – Détachement Mr Vincent COMPERE HCN Anesthésiologie et réanimation chirurgicale
Mr Jean-Nicolas CORNU HCN Urologie
Mr Antoine CUVELIER HB Pneumologie
Mr Pierre CZERNICHOW (surnombre) HCH Epidémiologie, économie de la santé Mr Jean-Nicolas DACHER HCN Radiologie et imagerie médicale
Mr Stéfan DARMONI HCN Informatique médicale et techniques de communication
Mr Pierre DECHELOTTE HCN Nutrition
Mr Stéphane DERREY HCN Neurochirurgie
Mr Fabien DOGUET HCN Chirurgie Cardio Vasculaire
Mr Jean DOUCET SJ Thérapeutique - Médecine interne et gériatrie
Mr Bernard DUBRAY CB Radiothérapie
Mr Philippe DUCROTTE HCN Hépato-gastro-entérologie
Mr Frank DUJARDIN HCN Chirurgie orthopédique - Traumatologique
Mr Fabrice DUPARC HCN Anatomie - Chirurgie orthopédique et traumatologique
Mr Eric DURAND HCN Cardiologie
Mr Bertrand DUREUIL HCN Anesthésiologie et réanimation chirurgicale
Mme Hélène ELTCHANINOFF HCN Cardiologie
Mr Manuel ETIENNE HCN Maladies infectieuses et tropicales
Mr Thierry FREBOURG UFR Génétique
Mr Pierre FREGER HCN Anatomie - Neurochirurgie
Mr Jean François GEHANNO HCN Médecine et santé au travail
Mr Emmanuel GERARDIN HCN Imagerie médicale
Mme Priscille GERARDIN HCN Pédopsychiatrie
M. Guillaume GOURCEROL HCN Physiologie
Mr Dominique GUERROT HCN Néphrologie
Mr Olivier GUILLIN HCN Psychiatrie Adultes
Mr Didier HANNEQUIN HCN Neurologie
Mr Fabrice JARDIN CB Hématologie
Mr Luc-Marie JOLY HCN Médecine d’urgence
Mr Pascal JOLY HCN Dermato – Vénéréologie
Mme Bouchra LAMIA Havre Pneumologie
Mme Annie LAQUERRIERE HCN Anatomie et cytologie pathologiques Mr Vincent LAUDENBACH HCN Anesthésie et réanimation chirurgicale
Mr Joël LECHEVALLIER HCN Chirurgie infantile
Mr Hervé LEFEBVRE HB Endocrinologie et maladies métaboliques
Mr Thierry LEQUERRE HB Rhumatologie
Mme Anne-Marie LEROI HCN Physiologie
Mr Hervé LEVESQUE HB Médecine interne
Mme Agnès LIARD-ZMUDA HCN Chirurgie Infantile
Mr Pierre Yves LITZLER HCN Chirurgie cardiaque
Mr Bertrand MACE HCN Histologie, embryologie, cytogénétique
M. David MALTETE HCN Neurologie
Mr Christophe MARGUET HCN Pédiatrie
Mme Isabelle MARIE HB Médecine interne
Mr Jean-Paul MARIE HCN Oto-rhino-laryngologie
Mr Stéphane MARRET HCN Pédiatrie
Mme Véronique MERLE HCN Epidémiologie
Mr Pierre MICHEL HCN Hépato-gastro-entérologie
M. Benoit MISSET HCN Réanimation Médicale
Mr Jean-François MUIR (surnombre) HB Pneumologie
Mr Marc MURAINE HCN Ophtalmologie
Mr Philippe MUSETTE HCN Dermatologie - Vénéréologie
Mr Christophe PEILLON HCN Chirurgie générale
Mr Christian PFISTER HCN Urologie
Mr Jean-Christophe PLANTIER HCN Bactériologie - Virologie
Mr Didier PLISSONNIER HCN Chirurgie vasculaire
Mr Gaëtan PREVOST HCN Endocrinologie
Mr Jean-Christophe RICHARD (détachement) HCN Réanimation médicale - Médecine d’urgence
Mr Vincent RICHARD UFR Pharmacologie
Mme Nathalie RIVES HCN Biologie du développement et de la reproduction
Mr Horace ROMAN HCN Gynécologie - Obstétrique
Mr Jean-Christophe SABOURIN HCN Anatomie - Pathologie
Mr Guillaume SAVOYE HCN Hépato-gastrologie
Mme Céline SAVOYE–COLLET HCN Imagerie médicale
Mme Pascale SCHNEIDER HCN Pédiatrie
Mr Michel SCOTTE HCN Chirurgie digestive
Mme Fabienne TAMION HCN Thérapeutique
Mr Luc THIBERVILLE HCN Pneumologie
Mr Christian THUILLEZ (surnombre) HB Pharmacologie
Mr Hervé TILLY CB Hématologie et transfusion
M. Gilles TOURNEL HCN Médecine Légale
Mr Olivier TROST HCN Chirurgie Maxillo-Faciale
Mr Jean-Jacques TUECH HCN Chirurgie digestive
Mr Jean-Pierre VANNIER (surnombre) HCN Pédiatrie génétique
Mr Benoît VEBER HCN Anesthésiologie - Réanimation chirurgicale
Mr Pierre VERA CB Biophysique et traitement de l’image
Mr Eric VERIN HB Service Santé Réadaptation
Mr Eric VERSPYCK HCN Gynécologie obstétrique
Mr Olivier VITTECOQ HB Rhumatologie
MAITRES DE CONFERENCES DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mme Noëlle BARBIER-FREBOURG HCN Bactériologie – Virologie
Mme Carole BRASSE LAGNEL HCN Biochimie
Mme Valérie BRIDOUX HUYBRECHTS HCN Chirurgie Vasculaire
Mr Gérard BUCHONNET HCN Hématologie
Mme Mireille CASTANET HCN Pédiatrie
Mme Nathalie CHASTAN HCN Neurophysiologie
Mme Sophie CLAEYSSENS HCN Biochimie et biologie moléculaire
Mr Moïse COEFFIER HCN Nutrition
Mr Serge JACQUOT UFR Immunologie
Mr Joël LADNER HCN Epidémiologie, économie de la santé
Mr Jean-Baptiste LATOUCHE UFR Biologie cellulaire
Mr Thomas MOUREZ HCN Virologie
Mr Gaël NICOLAS HCN Génétique
Mme Muriel QUILLARD HCN Biochimie et biologie moléculaire
Mme Laëtitia ROLLIN HCN Médecine du Travail
Mr Mathieu SALAUN HCN Pneumologie
Mme Pascale SAUGIER-VEBER HCN Génétique
Mme Anne-Claire TOBENAS-DUJARDIN HCN Anatomie
Mr David WALLON HCN Neurologie
PROFESSEUR AGREGE OU CERTIFIE
Mr Thierry WABLE UFR Communication
II - PHARMACIE
PROFESSEURS
Mr Thierry BESSON Chimie Thérapeutique
Mr Roland CAPRON (PU-PH) Biophysique
Mr Jean COSTENTIN (Professeur émérite) Pharmacologie
Mme Isabelle DUBUS Biochimie
Mr Loïc FAVENNEC (PU-PH) Parasitologie
Mr Jean Pierre GOULLE (Professeur émérite) Toxicologie
Mr Michel GUERBET Toxicologie
Mme Isabelle LEROUX - NICOLLET Physiologie
Mme Christelle MONTEIL Toxicologie
Mme Martine PESTEL-CARON (PU-PH) Microbiologie
Mr Rémi VARIN (PU-PH) Pharmacie clinique
Mr Jean-Marie VAUGEOIS Pharmacologie
Mr Philippe VERITE Chimie analytique
MAITRES DE CONFERENCES
Mme Cécile BARBOT Chimie Générale et Minérale
Mr Jérémy BELLIEN (MCU-PH) Pharmacologie
Mr Frédéric BOUNOURE Pharmacie Galénique
Mr Abdeslam CHAGRAOUI Physiologie
Mme Camille CHARBONNIER (LE CLEZIO) Statistiques
Mme Elizabeth CHOSSON Botanique
Mme Marie Catherine CONCE-CHEMTOB Législation pharmaceutique et économie de la santé
Mme Cécile CORBIERE Biochimie
Mr Eric DITTMAR Biophysique
Mme Nathalie DOURMAP Pharmacologie
Mme Isabelle DUBUC Pharmacologie
Mme Dominique DUTERTE- BOUCHER Pharmacologie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr François ESTOUR Chimie Organique
Mr Gilles GARGALA (MCU-PH) Parasitologie
Mme Marie-Laure GROULT Botanique
Mr Hervé HUE Biophysique et mathématiques
Mme Laetitia LE GOFF Parasitologie – Immunologie
Mme Hong LU Biologie
M. Jérémie MARTINET (MCU-PH) Immunologie
Mme Marine MALLETER Toxicologie
Mme Sabine MENAGER Chimie organique
Mme Tiphaine ROGEZ-FLORENT Chimie analytique
Mr Mohamed SKIBA Pharmacie galénique
Mme Malika SKIBA Pharmacie galénique
Mme Christine THARASSE Chimie thérapeutique
Mr Frédéric ZIEGLER Biochimie
PROFESSEURS ASSOCIES
Mme Cécile GUERARD-DETUNCQ Pharmacie officinale
Mr Jean-François HOUIVET Pharmacie officinale
PROFESSEUR CERTIFIE
Mme Mathilde GUERIN Anglais
ATTACHES TEMPORAIRES D’ENSEIGNEMENT ET DE RECHERCHE
Mme Anne-Sophie CHAMPY Pharmacognosie
M. Jonathan HEDOUIN Chimie Organique
LISTE DES RESPONSABLES DES DISCIPLINES PHARMACEUTIQUES
Mme Cécile BARBOT Chimie Générale et minérale
Mr Thierry BESSON Chimie thérapeutique
Mr Roland CAPRON Biophysique
Mme Marie-Catherine CONCE-CHEMTOB Législation et économie de la santé
Mme Elisabeth CHOSSON Botanique
Mme Isabelle DUBUS Biochimie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr Loïc FAVENNEC Parasitologie
Mr Michel GUERBET Toxicologie
Mr François ESTOUR Chimie organique
Mme Isabelle LEROUX-NICOLLET Physiologie
Mme Martine PESTEL-CARON Microbiologie
Mr Mohamed SKIBA Pharmacie galénique
Mr Rémi VARIN Pharmacie clinique
Mr Philippe VERITE Chimie analytique
III – MEDECINE GENERALE
PROFESSEUR
Mr Jean-Loup HERMIL (PU-MG) UFR Médecine générale
MAITRE DE CONFERENCE
Mr Matthieu SCHUERS (MCU-MG) UFR Médecine générale
PROFESSEURS ASSOCIES A MI-TEMPS – MEDECINS GENERALISTE
Mr Emmanuel LEFEBVRE UFR Médecine Générale
Mme Elisabeth MAUVIARD UFR Médecine générale
Mme Marie Thérèse THUEUX UFR Médecine générale
MAITRE DE CONFERENCES ASSOCIE A MI-TEMPS – MEDECINS GENERALISTES
Mr Pascal BOULET UFR Médecine générale
Mr Emmanuel HAZARD UFR Médecine Générale
Mme Marianne LAINE UFR Médecine Générale
Mme Lucile PELLERIN UFR Médecine générale
Mme Yveline SEVRIN UFR Médecine générale
ENSEIGNANTS MONO-APPARTENANTS
PROFESSEURS
Mr Serguei FETISSOV (med) Physiologie (ADEN)
Mr Paul MULDER (phar) Sciences du Médicament
Mme Su RUAN (med) Génie Informatique
MAITRES DE CONFERENCES
Mr Sahil ADRIOUCH (med) Biochimie et biologie moléculaire (Unité Inserm 905) Mme Gaëlle BOUGEARD-DENOYELLE (med) Biochimie et biologie moléculaire (UMR 1079)
Mme Carine CLEREN (med) Neurosciences (Néovasc)
M. Sylvain FRAINEAU (med) Physiologie (Inserm U 1096)
Mme Pascaline GAILDRAT (med) Génétique moléculaire humaine (UMR 1079)
Mme Rachel LETELLIER (med) Physiologie
Mme Christine RONDANINO (med) Physiologie de la reproduction Mr Antoine OUVRARD-PASCAUD (med) Physiologie (Unité Inserm 1076)
Mr Frédéric PASQUET Sciences du langage, orthophonie
Mme Isabelle TOURNIER (med) Biochimie (UMR 1079)
CHEF DES SERVICES ADMINISTRATIFS : Mme Véronique DELAFONTAINE
HCN - Hôpital Charles Nicolle HB - Hôpital de BOIS GUILLAUME
CB - Centre Henri Becquerel CHS - Centre Hospitalier Spécialisé du Rouvray CRMPR - Centre Régional de Médecine Physique et de Réadaptation SJ – Saint Julien Rouen
REMERCIEMENTS
Madame le Professeur Soumeya Bekri, je vous remercie de me faire l’honneur de présider cette thèse. Je vous suis également reconnaissant pour vos enseignements de maladies métaboliques et pour la coordination du DES de biologie médicale. Je vous prie de trouver ici l’expression de ma profonde reconnaissance.
Madame le Professeur Martine Pestel-Caron, je vous remercie de faire partie du jury de cette thèse. Merci pour vos enseignements, votre bienveillance et votre confiance. Veuillez trouver ici l’expression de mon profond respect.
Madame le Docteur Sophie Boyer, je vous remercie d’avoir encadré ce travail, du choix du sujet à la relecture. Merci pour vos conseils avisés, vos enseignements et le partage de votre savoir. Veuillez trouver ici l’expression de ma gratitude la plus sincère.
Monsieur le Docteur Gérard Buchonnet, je vous remercie d’avoir accepté de faire partie du jury de cette thèse. Merci de m’accueillir de nouveau en hématologie. Veuillez trouver ici l’expression de mon profond respect.
Monsieur le Docteur François Guerin, je vous remercie d’avoir accepté de faire partie du jury de cette thèse. Merci pour votre disponibilité et votre expertise de la qualité. Veuillez trouver ici l’expression de ma respectueuse considération.
A Mesdames les Docteurs Frébourg et Skalli et Monsieur le Docteur Lemée, merci pour le partage de votre expérience et pour vos enseignements dispensés au cours de ces mois en bactériologie. Merci a Sandrine et Anaïs pour votre disponibilité et votre bonne humeur. Je vous souhaite le meilleur pour la suite.
Au personnel de l’IBC, merci pour toutes ces années d’internat. Merci en particulier aux techniciens de bactériologie pour ces trois semestres. Merci notamment à Patricia pour son aide dans ce travail.
Aux biologistes et techniciens du laboratoire de Dieppe, merci pour le semestre passé chez vous, riche en enseignements ; merci également à tous les autres biologistes que j’ai pu rencontrer au cours de l’internat.
Merci à Ana, Cédric, Céline, Elise, Justine, Valentin pour ces soirées microbiologie avec Ismaël, merci à Guillaume l’ancien externe, à Wassim, aux Marion, à Abdulaziz. Merci à mes co-internes de promotion : Aurélie et Aurélie, Ferdi, Mustapha.
Merci aux jeunes chefs d’hématologie pour leur présence : Elsa, Paul, Victor. Merci aussi à Stéphanie et Benoît.
Merci à mes co-internes du dernier semestre de bactériologie pour votre compréhension et coopération au cours de ces mois d’analyses. C’était plutôt pratique. Merci à DJ Fiston, Pierre DLVG et Tangal « spirochète » pour l’identité audiovisuelle de ce semestre et les rendez vous « team Café » intemporels. Merci à François et Pauline pour leur exemplarité et avant-gardisme dans le bon usage du SHA. Merci également à Albane, à Isabelle, à Louis. Merci à Nicolas, pour ces innombrables semestres d’externat passés ensemble, merci aux autres cliniciens hématologues ou infectiologues rencontrés à l’IBC (Juliette, Mathilde, Pierre). Merci à mes co-internes de DUCAI (Aurélie, Céline, Marion) et à tous nos jeunes co-internes : Anaïs, Charles, Ella, Emilie, Louise, Maria, Thomas, Tania, Louise, Vincent...
Merci à ma belle famille pour votre accueil et votre hospitalité, merci à mes parents pour votre présence, votre confiance et votre soutien sans faille depuis toutes ces années, merci à mes frères Quentin et Thibaud, à mes sœurs Aurélie et Clarence, merci à Hava et Nicolas. Merci à ma tendre épouse Melissa pour m’épauler au quotidien. Merci pour ta personnalité exceptionnelle. Chaque jour en ta compagnie est un bonheur.
SOMMAIRE
Introduction 7
1 Les coprocultures 8
2 Les prélèvements respiratoires 9
2.1 Prélèvements respiratoires non protégés 10
2.2 Prélèvements respiratoires protégés 11
3 Principaux pathogènes étudiés au sein des prélèvements 12
3.1 Pathogènes entériques 12
3.2 Pathogènes respiratoires 16
4 Conditions préanalytiques et numérations d’éléments 18
4.1 Numérations des éléments urinaires 18
4.2 Numérations des liquides de ponctions 18
4.3 Délais de prise en charge des liquides cérébro-spinaux 19
5 Objectifs de l’étude 20
Matériel et méthodes 21
1 Matériel 21
1.1 Selles 21
1.2 Prélèvements respiratoires 21
1.3 Urines sur tube boraté 22
1.4 Liquides de ponctions sur tube EDTA K2 22
2 Méthodes 22
2.1 Impact des délais sur les cultures de selles 22
2.2 Impact des délais sur les cultures de prélèvements respiratoires 23
2.3 Impact des délais sur les numérations d’éléments 25
2.4 Délais de prise en charge des liquides cérébro-spinaux 25
3 Analyses statistiques 26
Résultats 27
1 Impact des délais avant ensemencement sur les cultures de selles 27
2 Impact des délais sur les cultures de prélèvements respiratoires 29
2.1 Prélèvements respiratoires non protégés 33
2.2 Prélèvements respiratoires protégés 36
3 Impact des délais de recompte sur les numérations des éléments urinaires 37
3.1 Leucocytes 37
3.2 Hématies 41
4 Impact des délais de recompte sur les numérations de liquides de ponctions 43
4.1 Leucocytes 44
4.2 Hématies 45
5 Délais de prise en charge des liquides cérébro-spinaux 45
Discussion 48
Conclusion 55
LISTE DES FIGURES
Figure 1 : Légende des boites à moustaches. 26 Figure 2 : Répartition des différents pathogènes entériques dans les échantillons de selles étudiés (n = 87). 27 Figure 3 : Délais d’acheminement et de réensemencement des selles étudiées. 28 Figure 4 : Courbes de survie des souches étudiées lors des repiquages après différents délais de conservation (n = 87). 28 Figure 5 : Comparaison des délais d’acheminement et des délais avant réensemencement des germes issus des prélèvements respiratoires étudiés (n = 459). 30 Figure 6 : Stabilité des numérations bactériennes lors des réensemencement des prélèvements respiratoires étudiés (n = 459). 32 Figure 7 : Survie bactérienne après réensemencement des prélèvements respiratoires étudiés (n = 459). 33 Figure 8 : Impact des délais avant réensemencement sur la positivité des cultures des prélèvements respiratoires non protégés (n = 297). 35 Figure 9 : Variations de dilution (en Log10 UFC/mL) des numérations de germes par rapport aux numérations initiales des prélèvements protégés pour différents délais de réensemencement (n = 162). 36 Figure 10 : Impact du temps sur la détection des germes des prélèvements respiratoires protégés pour un seuil de détection de 102 UFC/mL (variations exprimées en Log10 UFC/mL, n = 162). 37
Figure 11 : Comparaison des délais initiaux et des délais avant recompte des numérations leucocytaires des urines prélevées sur tubes boratés BD. 38 Figure 12 : Variation de numération leucocytaire observée lors des recomptes après différents délais de conservation sur tubes boratés BD pour des numérations initiales ≤ 50 /mm3. 39
Figure 13 : Variation de numération leucocytaire observée lors des recomptes après différents délais de conservation sur tubes boratés BD pour des numérations initiales ≤ 20 /mm3. 39
Figure 14 : Numérations leucocytaires obtenues après recompte en fonction de la numération initiale : intérêt d’une zone grise (« Grayzone ») entre 10 et 12 leucocytes/mm3. 40
Figure 15 : Comparaison des délais initiaux et des délais avant recompte des numérations érythrocytaires des urines prélevées sur tubes boratés BD (n = 108). 41 Figure 16 : Variation de numération érythrocytaire observée lors des recomptes après différents délais de conservation sur tubes boratés BD pour des numérations initiales ≤ 50 /mm3. 42
Figure 17 : Variation de numération érythrocytaire observée lors des recomptes après différents délais de conservation sur tubes boratés BD pour des numérations initiales ≤ 20 /mm3. 42
Figure 18 : Part de chaque type de liquide de ponction dans la population étudiée (n = 53). 43 Figure 19 : Comparaison des délais initiaux et des délais avant recompte des numérations des liquides de ponctions prélevés sur tubes BD EDTA K2. 43 Figure 20 : Variations (exprimées en rapport) entre les numérations initiales des leucocytes et les numérations recomptées après conservation sur tube BD EDTA K2 des liquides de ponctions en fonction des délais de recompte et des types de liquides. 44 Figure 21 : Variations (exprimées en rapport) entre les numérations initiales des hématies et les numérations recomptées après conservation sur tube BD EDTA K2 des liquides de ponctions en fonction des délais de recompte et des types de liquides. 45 Figure 22 : Etapes composant la prise en charge urgente des LCS : rappel des définitions et vue globale des délais. 46
LISTE DES TABLEAUX
Tableau 1 : Critères de Bartlett, Murray et Washington. 10
Tableau 2 : Seuils de significativité des prélèvements respiratoires. 11
Tableau 3 : Interprétation des cultures des expectorations, aspirations bronchiques et aspirations pharyngées. 24
Tableau 4 : Interprétation des brosses et PBDP dilués au dixième. 24
Tableau 5 : Interprétation des brosses et PBDP dilués au centième. 24
Tableau 6 : Pathogènes, nombre et types de selles étudiées. 27
Tableau 7 : Nombre et type d’échantillons respiratoires étudiés en fonction du nombre d’espèces pathogènes isolées. 29
Tableau 8 : Répartition (nombre de souches) des différents germes retrouvés selon le type de prélèvement. 31
Tableau 9 : Variations de numération des germes des prélèvements respiratoires non protégés. 34
Tableau 10 : Significativité du seuil de 48 heures et 55 heures pour la détection et la numération des germes retrouvés dans les prélèvements respiratoires non protégés. 35
Tableau 11 : Effectif des recomptes de numérations leucocytaires d’urines boratées (sur tube BD) selon leur intervalle initial et le délai avant recompte. 38
Tableau 12 : Evolution des numérations leucocytaires des urines boratées (sur tube BD) comprises initialement entre 10 et 50 leucocytes/mm3, selon le délai avant recompte. 40
Tableau 13 : Effectif des recomptes de numérations érythrocytaires d’urines boratées (sur tube BD) selon leur intervalle initial et le délai avant recompte. 41
ABBREVIATIONS
AET : aspiration endo-trachéale
BPCO : bronchopneumopathie chronique obstructive CDC : center for disease control and prevention COFRAC : comité français d’accréditation
ECBC : examen cytobactériologique des crachats ECBU : examen cyto-bactériologique des urines EDTA : acide éthylène-diamine-tétraacétique ISO : international organization for standardization LCS : liquide cérébro-spinal
LBA : lavage broncho-alvéolaire
MALDI-TOF : matrix-assisted laser desorption/ionization time of flight NABM : nomenclature des actes de biologie médicale
PAT : proportion de tests acceptables
PBDP : prélèvement bronchique distal protégé PCR : polymerase chain reaction
SFBC : société française de biologie clinique SFM : société française de microbiologie SHU : syndrome hémolytique et urémique SIDA : syndrome de l’immunodéficience acquise SIL : système informatique de laboratoire
TAT : turnaround time
TIAC : toxi-infection alimentaire collective UFC : unité formant colonie
VIH : virus de l’immunodéficience humaine VNC : viable non cultivable
Introduction
La phase préanalytique, qui va du prélèvement de l’échantillon jusqu’à l’analyse de celui-ci est une étape cruciale en biologie médicale pour la qualité des résultats rendus. Avec l’accréditation des laboratoires et l’application de la norme ISO 15189, cette phase doit être maîtrisée au même titre que les autres pour éliminer des sources d’erreurs.
Les erreurs constatées en biologie médicale (en quantité bien inférieures à celles d’autres types de spécialités) concernent particulièrement la phase préanalytique (31 à 75 % des erreurs). Cette phase peut comporter des étapes échappant au contrôle du laboratoire, mais reste néanmoins sous la responsabilité du biologiste.55 Avec la restructuration des laboratoires de
biologie médicale, la diminution du nombre de plateaux techniques a augmenté la distance physique séparant le patient et son prélèvement du site d’analyse et, par conséquent, la durée de transport de l’échantillon.30 Ainsi, la gestion des conditions d’acheminement et de conservation des
échantillons avant analyse doit être maîtrisée.26 Par ailleurs, certains prélèvements peuvent être
reçus par des laboratoires en période de permanence de soins et n’être pris en charge qu’en jour ou horaire ouvré (par exemple : les coprocultures, les examens cyto-bactériologiques des crachats (ECBC) ou les examens cyto-bactériologiques des urines (ECBU)). Un délai excessif avant analyse peut donc avoir un impact sur les résultats qu’il est nécessaire d’évaluer.
La microbiologie est un domaine qui devient plus complexe avec les nouvelles méthodes de génomique et protéomique. Les conditions préanalytiques sont cependant toujours critiques comme la qualité du recueil, les conditions de transport et de stockage ainsi que le délai avant analyse. Le dialogue clinico-biologique reste essentiel car les besoins du laboratoire (urgences biologiques) et du clinicien (urgences médicales) se doivent d’être communiqués afin d’assurer la bonne prise en charge du prélèvement et du patient.6 L’ouvrage de référence principal en
microbiologie médicale est le Rémic,56 qui décrit en particulier les critères préanalytiques
d’acceptation des échantillons biologiques ainsi que leur conservation.
Définie comme la capacité d’un produit ou d’un service à satisfaire les besoins et attentes d’un client, l’analyse de la qualité s’applique aux aspects techniques (analytiques), préanalytiques mais également aux délais de rendu de résultats et de leur interprétation contextuelle (post-analytique). Les cliniciens désirent un service rapide, fiable et efficient à bas coût. Parmi ces caractéristiques, la vitesse est particulièrement importante36, notamment pour des prélèvements
critiques tels les liquides cérébro-spinaux (LCS).
Notre étude porte sur différents prélèvements et recherches de pathogènes spécifiques afin de définir les paramètres de la phase préanalytique susceptibles d’affecter le résultat final, notamment concernant les délais d’acheminement et les conditions de conservation des échantillons. Les examens concernés sont les cultures de selles, de prélèvements respiratoires protégés et non protégés, les numérations de liquides de ponctions et les numération d’urines.
1 Les coprocultures
La coproculture reste l’examen de référence pour le diagnostic étiologique des diarrhées infectieuses, deuxième cause de mortalité et de morbidité au niveau mondial. Le résultat d’une exploration bénéficie au patient mais aussi à la santé publique par l’impact collectif d’une coproculture positive.35, 37 Le diagnostic biologique en routine des gastroentérites bactériennes est
réalisé par la culture de selles avant toute introduction d’antibiothérapie,21 (à l’exception de la
recherche de Clostridium difficile).37 Ainsi, en 2015, plus de 500’000 examens microbiologiques de
matières fécales (code 5207 de la NABM) ont été réalisés en France.10
Les infections gastro-intestinales peuvent avoir des présentations variées7 et il n’y a pas
d’indication à des examens complémentaires si la diarrhée est non invasive ou en cas de gastro-entérite aiguë. En effet, majoritairement virale,56 toutes les diarrhées ne sont pas infectieuses,
toutes les diarrhées infectieuses ne sont pas bactériennes et toutes les diarrhées bactériennes ne sont pas dues à des bactéries spécifiques.23 La coproculture doit donc être envisagée après avoir
éliminé une cause non infectieuse de diarrhée à l’examen clinique. Elle est par ailleurs inutile en cas de diarrhée chronique, en dehors d’un contexte d’immunodépression.56
Quand il est indiqué, le prélèvement de choix est une selle diarrhéique (prenant la forme du pot) voire purulente, muqueuse et hémorragique.23 Une selle moulée ou recueillie sur un écouvillon
n’est pas optimale. Un échantillon unique présente une sensibilité suffisante chez l’enfant. En cas d’analyse de selles sur écouvillon chez cette population, le mode de recueil doit être satisfaisant : effectuer une insertion jusqu’à 2 à 3 cm au-delà du sphincter anal, puis procéder à une rotation de l’écouvillon. La présence visible de matières fécales doit être vérifiée, et un milieu de transport doit accompagner l’écouvillon37 afin d’éviter la dessiccation.27 Chez l’adulte, un second prélèvement
peut être discuté en proscrivant les écouvillons rectaux7, 21, 68 qui ont de plus l’inconvénient de ne
pas renseigner sur l’aspect macroscopique de la selle.37 Au total, 0,5 à 2 grammes de selles
doivent être récupérés en cas de selles solides. En cas de selles liquides, 5 mL devront être acheminés.37
Les recommandations préconisent une prise en charge immédiate avec un acheminement au laboratoire inférieur à 2h. Une conservation est possible à +4°C, sans dépasser 12 heures.23
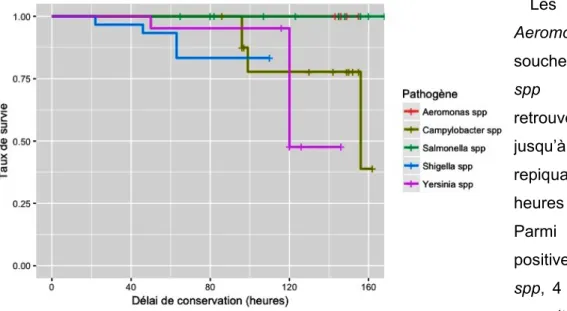
Au-delà (48 à 72 heures), une conservation dans un milieu de transport de type Cary-Blair est recommandée.21, 56 Néanmoins, la viabilité des Campylobacter spp et Yersinia spp dans les milieux
de transport n’a pas été validée.30 C’est tout particulièrement pour Campylobacter spp et Shigella
spp que le délai de prise en charge est critique.37 Les espèces du genre Yersinia spp pouvant se
multiplier à basse température, la conservation à +4°C pourrait à l’inverse constituer un moyen d’enrichissement pour cette espèce.4, 23 Les souches de Shigella spp ne supportent pas les délais
prolongés60 dans les selles en raison de l’acidification du prélèvement par la flore associée,19, 21, 59, 65
notamment par les bactéries anaérobies46 ce qui explique leur survie diminuée par rapport aux
aucune méthode d’enrichissement n’existe pour ce genre bactérien, à la différence des espèces du genre Salmonella spp (bouillon sélénite).4 De plus, leur croissance est meilleure sur les milieux
gélosés sélectifs non inhibiteurs (Hektoen, Drigalski, Mac Conkey) : le milieu SS est à déconseiller car il ne permet pas la croissance de certaines souches de Shigella spp.
Au même titre que les Salmonella spp, la recherche des Campylobacter spp par coproculture doit être systématique27 devant une diarrhée aiguë de plus de 48 heures, surtout chez
le jeune de moins de 5 ans.11
2 Les prélèvements respiratoires
Les infections respiratoires sont les infections les plus fréquentes et peuvent survenir à tout âge.23 Les agents les plus fréquemment incriminés sont les virus. Néanmoins, les causes
bactériennes ne pouvant être éliminées à l'examen clinique, un traitement peut être indiqué sans prélèvement bactériologique en ambulatoire.18, 50 En effet, les prélèvements respiratoires ne sont
indiqués que s’ils sont susceptibles de modifier la prise en charge du patient56 et malgré des
explorations approfondies, aucune étiologie n’est en effet retrouvée dans plus de 40 % des cas de pneumopathie aiguë communautaire.7, 50 Ainsi, le nombre d’examens microbiologiques des
sécrétions broncho-pulmonaires et des expectorations (code 5210 de la NABM) était de l’ordre de 95’000 actes en France en 2015.10 Chez le patient hospitalisé, les prélèvements non invasifs
seront réalisés pour les pneumopathies aigues, les prélèvements invasifs (code 5230 de la NABM, soit environ 30’000 actes en France en 201510) ayant une place en seconde intention pour les
patients de réanimation ou en première intention pour les patients immunodéprimés. En cas de suspicion de pneumopathie acquise par ventilation mécanique, les analyses bactériologiques quantitatives des prélèvements respiratoires ont un rôle diagnostic important et permettent de diminuer l’exposition aux antibiotiques par rapport à des stratégies diagnostiques cliniques.15
De grandes variabilités de performances peuvent être retrouvées pour un même type de prélèvements. Une répartition non uniforme des bactéries dans le prélèvement (dans les expectorations par exemple69) peut expliquer ces variations.
Quand ils sont indiqués, les prélèvements respiratoires devront être réalisés sans retard, avant toute antibiothérapie.2 Les recommandations préconisent une prise en charge préanalytique
rapide (transport et conservation avant ensemencement).23, 44, 53, 56 Une prise en charge dans les 2h
est en effet recommandée pour éviter la perte de viabilité de Streptococcus pneumoniae ou
Haemophilus influenzae et la prolifération d’autres germes (bacilles à Gram négatif). En effet, une
perte de viabilité des germes fragiles a été décrite au-delà de 4 heures (en liaison avec la présence d’enzymes lysosomales dans le prélèvement).7 Si le prélèvement ne peut être pris en
2.1 Prélèvements respiratoires non protégés
L’examen cytobactériologique des crachats (ECBC) présente l’avantage d’être non invasif et d’être facile de réalisation. Néanmoins, de grandes variabilités de performances sont observées et une contamination d’origine salivaire est retrouvée dans 50 % des cas.18 Afin d’éviter la
contamination par la flore oropharyngée, des conditions strictes de recueil doivent être observées : la prélèvement doit être fait après 1 à 2 heures de jeûne (idéalement le matin), après rinçage de la bouche au sérum physiologique (ou eau distillée) stérile et lors d’une toux productive profonde, aidée si besoin d’un kinésithérapeute.13
Avant ensemencement, un examen direct par lecture au microscope optique après coloration de Gram est réalisé pour éliminer les prélèvements les plus à risque de contamination salivaire, définis par les critères de Bartlett, Murray et Washington (cf Tableau 1). Ces critères ne s'appliquent cependant pas à la culture des légionelles et des mycobactéries pour lesquels la présence est nécessairement pathologique.18 La présence de bactéries à l’examen direct pourra
également être renseignée, bien que son utilité soit controversée.28, 39, 43, 45, 47, 48, 52, 57
Tableau 1 : Critères de Bartlett, Murray et Washington. Cellules/champs au grossissement x100
Indication à la culture Cellules épithéliales Leucocytes
> 25 < 10 Non > 25 10 à 25 Non > 25 > 25 Non 10 à 25 < 10 Non 10 à 25 10 à 25 Non 10 à 25 > 25 Oui < 10 < 10 Non < 10 10 à 25 Oui < 10 > 25 Oui
Le lavage broncho-alvéolaire (LBA) est un prélèvement invasif réalisé par fibroscopie d’une bronche sous segmentaire (de 3e ou 4e génération). Du sérum physiologique est injecté puis
ré-aspiré et analysé. La quantité de liquide récupérée (150 mL environ) permet d’étudier un vaste territoire pulmonaire. Une variante, le mini-LBA permet de documenter les patients instables en ne récupérant que 2 à 3 mL d’échantillon à l’aveugle.18
L’aspiration endo-trachéale (AET) est une technique alternative réalisable chez les patients intubés ou trachéotomisés pour lesquels les techniques invasives sont contre-indiquées.18 Le
risque de contamination par la flore commensale est également élevé et seuls les prélèvements de bonne qualité seront ensemencés.
2.2 Prélèvements respiratoires protégés
Le brossage bronchique (brosse) est un prélèvement invasif sous fibroscopie consistant à s’affranchir du risque de contamination salivaire par un système de double cathéter, la brosse n’étant exposée que dans les derniers centimètres. Un volume de 1 à 10 μL d’échantillon peut être récupéré et homogénéisé dans 1 mL de sérum physiologique.18
Le prélèvement bronchique distal protégé (PBDP) est une variante de la technique précédente. Réalisé à l’aveugle sans fibroscope, un volume de 1 mL de liquide stérile est injecté puis ré-aspiré. Plus simple et moins couteux, il présente des performances comparables avec le brossage bronchique avec moins d’effets indésirables.18
Les prélèvements respiratoires pouvant être sujets à des contaminations par la flore oropharyngée, des seuils de significativité ont été établis afin de distinguer les bactéries commensales des bactéries impliquées dans des processus infectieux. Les seuils de significativité des prélèvements respiratoires sont donnés par le Tableau 2.18, 23
Tableau 2 : Seuils de significativité des prélèvements respiratoires. Type de prélèvement Seuil de significativité (UFC/mL)
Expectoration ≥10⁷
LBA et AET ≥10⁴
Mini-LBA, PBDP, brosse ≥10³
AET ≥10⁵
Néanmoins, dans les prélèvements des voies respiratoires inférieures chez les patients intubés, ces seuils peuvent être pris en défaut. Une croissance inférieure au seuil de significativité peut indiquer une contamination ou colonisation, mais aussi une antibiothérapie préalable (dans les 72 heures,6 même si le germe présente des résistances à l’antibiotique utilisé7) ou une réelle
infection à la phase précoce.2, 7 Les prélèvements présentant une croissance à la limite du seuil de
positivité peuvent ainsi présenter des problèmes d’interprétation.15 En cas d’antibiothérapie
préalable ou de forte suspicion d’infection respiratoire, l’utilisation de seuils inférieurs peut être licite.2
A l’inverse, des faux positifs peuvent être retrouvés en cas de prélèvements hors contexte de suspicion de pneumopathie.7 En effet, l’incidence des colonisations est importante, surtout en
cas d’intubation endotrachéale. Le traitement antibiotique des colonisations est fortement déconseillé. En revanche, une culture négative en l’absence de modification d’antibiotique récente (dans les 72 heures) permet d’écarter l’infection respiratoire bactérienne (Legionella spp exceptée)2 et doit faire rechercher une autre cause de fièvre. Cependant, en cas de forte suspicion
clinique de pneumopathie, la négativité des culture doit faire évoquer un faux négatif et l'arrêt des antibiotiques expose le patient à une hausse de mortalité et morbidité.7
3 Principaux pathogènes étudiés au sein des prélèvements
3.1 Pathogènes entériques
Les bactéries du genre Salmonella spp sont des bacilles à Gram négatif aéro-anaérobies, souvent mobiles, appartenant à la famille des Enterobacteriaceae, pouvant coloniser le tractus intestinal des vertébrés.27 Certains sérotypes sont exclusivement humains (exemple : Salmonella
Typhi = Salmonella enterica subsp. enterica sérotype Typhi).37 Leur présentation clinique est large :
allant du portage asymptomatique à la fièvre typhoide létale.21 Les salmonelloses correspondent à
deux entités selon leur appartenance à un sérovar typhoïde ou non typhoïde. La première présentation (sérovars Typhi et Paratyphi : A, B ou C37) est celle d’une atteinte systémique avec
bactériémie définissant la fièvre typhoïde menaçant le pronostic vital et pouvant persister dans le système lymphatique mésentérique, la moelle osseuse et la vésicule biliaire avec des rechutes ultérieures chez 5 à 10 % des patients (après 2 à 3 semaines typiquement). La seconde présentation est celle d’une diarrhée fébrile avec douleurs abdominales, 12 à 72 heures après l’infection, spontanément résolutive en 4 à 7 jours. En cas d’immunodépression (SIDA) ou d’altération de la phagocytose (drépanocytose37), certaines souches peuvent néanmoins présenter
un passage systémique et atteindre d’autres organes. La coproculture peut rester longtemps positive (convalescence, porteur sain).27
Les formes les plus répandues dans les pays développés sont les gastro-entérites et les entérocolites survenant après intoxication alimentaire (TIAC). L’impact mondial sur la santé publique est important avec une incidence annuelle de 25 millions de cas, dont plus de 200’000 décès.
Les bactéries du genre Shigella spp sont des bacilles à Gram négatif aéro-anaérobies appartenant à la famille des Enterobacteriaceae49, immobiles, non encapsulés. Dotées d’un
pouvoir invasif caractéristique au niveau recto-colique, leur seul hôte naturel est Homo sapiens.27
Adaptées aux humains, les espèces du genre Shigella spp peuvent être rarement retrouvées chez le chien et le primate. Au total, 4 groupes sérologiques sont décrits49 : Shigella dysenteriae (groupe
A), Shigella flexneri (groupe B, touchant les pays en voie de développement), Shigella boydii (groupe C, retrouvée davantage en Inde), Shigella sonnei (groupe D, prédominant dans les pays développés). La similarité génétique et protéique des espèces du genre Shigella spp avec
Escherichia coli rend leur identification délicate et fait préférer les critères biochimiques.
Associée au péril fécal, l’infection de fait par ingestion d’aliments ou d’eau contaminée avec une recrudescence estivale. La mouche commune (Musca domestica) peut constituer un vecteur.37
Une transmission interhumaine est possible (relation sexuelle oro-anale) ainsi que lors d’accidents de laboratoire.37 La dose infectieuse est en effet très faible : 10 à 100 organismes sont suffisants
pour provoquer une infection.37, 49 Les Shigella spp peuvent survivre dans l’environnement et dans
Associées au bas niveau d’hygiène, à la malnutrition et au manque d’accès aux soins (favorisés par les guerres, les déplacements de population et les cataclysmes naturels9), les
épidémies de shigelloses sont responsables de fortes morbidité et mortalité chez la population pédiatrique des pays en voie de développement du tiers-monde. En effet, 165 millions de cas annuels sont estimés au niveau mondial dont plus d’un million d’évolution fatale. Les patients de moins de 5 ans représentent 60 % des cas de décès.49 Chez les populations affaiblies, malnutries
et massivement contaminées, la mortalité peut atteindre 10 à 30 %9 lors d’infections à S.
dysenteriae.
Les infections à Shigella spp entraînent des symptômes principalement digestifs21 (diarrhée
aqueuse fébrile, crampes abdominales douloureuses, myalgies avec de possibles céphalées et raideur de nuque37). La durée d’incubation est variable : de quelques heures à 4 jours et jusqu’à 8
jours pour S. dysenteriae.9, 49 La phase d’état est caractérisée par la survenue d’une diarrhée
glairo-sanglante en 2 à 3 jours avec altération de l’état général, résolutive le plu souvent en 5 à 7 jours. Il peut exister une bactériémie avec de possibles manifestations extra-intestinales : SHU (retrouvé dans 13 % des cas d’infection à S. dysenteriae37), arthrites réactionnelles (associées aux
infections à S. flexneri37), syndrome de Fiessinger-Leroy-Reiter49). Dans de rares cas, une atteinte
méningée, pulmonaire ou du tractus urinaire peuvent être présentes.37 Après un épisode non traité,
des Shigella spp peuvent être retrouvées dans les selles jusqu’à 3 mois, voire pendant plusieurs années en cas de dénutrition.9
Les bactéries du genre Yersinia spp sont des bacilles à Gram négatif aéro-anaérobies appartenant à la famille des Enterobacteriaceae21, présentant une croissance préférentielle entre
25 et 32°C. Une culture sélective est possible sur milieu CIN (cefsulodin-irgasan-novobiocin), comme les Aeromonas spp. Il s’agit de bactéries environnementales avec un réservoir large (sol, eau, égout, végétaux) pouvant également être retrouvée chez les animaux (porcins, bovins, caprins, ovins, rongeurs, félins, canins).23, 37
Parmi les 18 espèces inclues dans le genre Yersinia spp, 4 sont pathogènes pour l’homme56 : Yersinia pestis, Yersinia wautersii, Yersinia enterocolitica et Yersinia
pseudotuberculosis. Cette dernière espèce présente une proximité génétique importante avec Yersinia pestis21 qui partage 90 % de ses gènes.23
Les infections à Yersinia spp. constituent la troisième cause de diarrhées bactériennes en Europe, dépendantes d’un mécanisme toxinique et invasif.27 L’infection se fait par transmission
féco-orale suite à l’ingestion d’aliments contaminés, par contact avec des animaux domestiques porteurs de Yersinia spp ou par contact avec un sujet atteint ou convalescent d’une yersiniose.9
Ces transmissions sont facilitées par la capacité des bactéries du genre Yersinia spp à se multiplier à basse température.21 La survenue des cas est sporadique ou en faible nombre.
L’incidence annuelle des infections à Yersinia spp est comprise entre 2 et 16 cas pour 100’000 habitants. Ces infections sont probablement sous-estimées en raison de la recherche inconstante de ces bactéries dans les selles diarrhéiques.
L’espèce principale en cause dans les infections à Yersinia spp est Y. enterocolitica, avec une recrudescence saisonnière discutée.21, 37 Après une incubation de 4 à 7 jours, la présentation
clinique typique est celle d’une entérite aigüe fébrile, prédominant chez l’enfant de moins de 10 ans, éventuellement associée à une iléite terminale et une lymphadénite21 pouvant mimer une
appendicite. Les symptômes sont souvent modérés et spontanément résolutifs en 1 à 3 semaines. Les infections à Y. pseudotuberculosis, responsables de moins de 2 % des yersinioses, prédominent en saison froide et entraînent majoritairement une adénite mésentérique mimant une appendicite.21, 37 La population à risque est le sujet âgé de plus de 60 ans chez qui l’évolution peut
être péjorative avec des formes généralisées souvent mortelles (28 % à 100 % de décès pour les formes traitées et non traitées respectivement37). Les maladies inflammatoires chroniques de
l’intestin et les dysthyroïdies sont des facteurs de risques, de même que la surcharge en fer (hémochromatose, thalassémie ou traitement par deferoxamine).
Des séquelles immunologiques peuvent survenir à distance des yersinioses : érythème noueux dans 3 % des cas et arthrites réactionnelles dans 7 % des cas37 (de survenue dans les 3
semaines et plus fréquent chez l’immunodéprimé, une association avec le HLA-B27 a été décrite21, 37). Des syndromes de Fiessinger-Leroy-Reiter, cardites, glomérulonéphrites et thyroïdites ont été
décrits occasionnellement.4 Une persistance de Y. enterocolitica dans les selles peut être observée
plusieurs semaines, voire plusieurs mois, après la guérison.9, 23 A l’inverse, Y. pseudotuberculosis
n’est plus retrouvé dans les selles une fois les ganglions mésentériques envahis.
Les bactéries du genre Campylobacter spp sont des bacilles à Gram négatif microaérophiles (croissance idéale dans une atmosphère comprenant, entre autres, 5 % de dioxygène9), parfois thermotolérantes3, spiralées ou incurvées (du grec campylo : incurvé), mobiles
par un flagelle polaire.56 L’environnement aquatique constitue un réservoir38 ainsi que les animaux
domestiques : volailles, bovins, porcins, petits ruminants, animaux de compagnie (chats, chiens) et animaux sauvages (oiseaux, rongeurs). Les Campylobacter spp appartiennent à la classe des Epsilonproteobacteria regroupant 4 genres : Campylobacter spp, Arcobacter spp, Helicobacter spp et Wolinella spp. Parmi les 17 espèces du genre Campylobacter spp, les principales sont
Campylobacter jejuni, Campylobacter coli et Campylobacter fetus.23
Adaptées à la vie dans le tractus digestif de l’homme et des animaux3, 5 d’élevages et
domestiques37, les espèces du genre Campylobacter spp sont retrouvées chez les oiseaux et les
mammifères.23 Le poulet en particulier peut être considéré comme le principal réservoir naturel de
C. jejuni avec une concentration de 10 UFC par gramme de matières fécales au niveau du⁶ cloaque. Selon les études, 40 à 80 % des carcasses de poulet de grande distribution sont contaminées à Campylobacter spp (la viande étant inoculée lors de l’abattage de l’animal par dissémination à partir du tractus digestif).23, 37 Par ailleurs, l’emballage des aliments sous vide
favorise la microaérophilie et la croissance des Campylobacter spp.4
L’infection, zoonose de recrudescence estivale, se fait par ingestion de viande peu cuite ou par contamination croisée (consommation crus d’aliments souillés). Pouvant toucher tous les âges, les personnes à risque sont les nourrissons, les jeunes enfants3, 11 et les jeunes adultes.29 Il s’agit
de la première cause d’infection intestinale bactérienne dans les pays développés16, 23
(sous-estimée en raison d’une sous-déclaration27, 29, 37) mais la prévalence est également importante dans
les pays en voie de développement.11 Il existe une augmentation importante du nombre de cas
d’infections à Campylobacter spp, non explicable par l’amélioration des systèmes de détection. Lors de grandes épidémies (TIAC), l’eau et le lait cru furent les principales sources de contamination. Pour les cas sporadiques (plus fréquents37), un lien de causalité fort a été retrouvé
avec la consommation de viande de poulet pour C. jejuni3, 5, 11 et la viande de porc pour C. coli.29
Après une phase d’invasion de durée variable (probablement liée à la dose infectante9 : au
minimum 3 jours et pouvant aller jusqu’à 10 jours11, 23, 29, 37), la présentation clinique de l’infection à
Campylobacter spp est une entérite aiguë fébrile avec diarrhée, crampes abdominales et adénite
mésentérique.11 L’atteinte gastrique est rare. L’épisode est spontanément résolutif en 7 jours, mais
la bactérie peut persister plusieurs semaines dans les selles3, 9, 29, voire plusieurs mois.23 Dans
certains pays en voie de développement, près de 40 % des enfants de moins de 2 ans excrètent
Campylobacter jejuni dans leurs selles.9 Dans 5 à 25 % des cas, une rechute est observée.9, 23
L’espèce dominante en pathologie humaine est C. jejuni, représentant 80 % à 90 % des cas de campylobactérioses.3 Les infections à C. fetus (responsable de 4 % des cas de
campylobactérioses29) peuvent être bactériémiques avec des localisations secondaires et une
atteinte endovasculaire (endocardites ou anévrysmes de l’aorte), surtout en cas de pathologie sous-jacente (VIH, pathologie maligne ou hépatique37). Les infections à Campylobacter spp
(surtout C. jejuni) peuvent entraîner des syndromes post – infectieux immunologiques (par mimétisme entre les antigènes bactériens et certains composants des gaines de myéline)3 :
arthrite réactionnelle dans 2 à 4 % des cas (atteinte des genoux préférentielle37, pouvant survenir
dans les 3 à 40 jours après la diarrhée), érythème noueux, syndrome de Fiessinger-Leroy-Reiter9,
urticaire ou syndrome de Guillain-Barré dans 1 à 3 cas pour 1000 (pouvant survenir dans les 2 à 21 jours après la diarrhée37).3, 11 L’hospitalisation est requise dans 5 à 10 % des cas et la mortalité
est de 5 pour 10’000 cas.29
Sous l’influence d’une basse température, des formes viables non cultivables (VNC) de
Campylobacter spp ont été décrites3, 16, 19, 38, 42, 65, conservant leur pouvoir infectant5 mais non
retrouvables en culture. Néanmoins, la conservation à +4°C semble meilleure qu’à température ambiante.46, 64 Ne se multipliant pas dans les aliments (à la différence des salmonelles), il a été
montré dans des études agro-alimentaires que la quantité de C. jejuni dans les aliments décroissait avec le temps, quelque que soit la température, l’atmosphère et le pH.3 Néanmoins,
leur survie est possible dans l’eau et le lait pendant plusieurs semaines à des températures proches de +4°C.9, 23
Les bactéries du genre Aeromonas spp sont des bacilles à Gram négatif aéro-anaérobies mobiles, à oxydase positive. Une culture sélective est possible sur milieu CIN (cefsulodine-irgasan-novobiocine), comme les Yersinia spp.23 Plus de 26 espèces différentes d’Aeromonas spp ont été
veronii sp sobria.23, 27, 37 Les bactéries du genre Aeromonas spp sont ubiquitaires. Retrouvées en
surface des sites aquatiques souillés et stagnants, des pics de concentration estivaux sont visibles lors des hausses de températures. Les bactéries du genre Aeromonas spp peuvent persister plusieurs mois à années dans l’eau et le sol ainsi que dans des amibes. De nombreuses souches peuvent se multiplier et synthétiser leurs facteurs de virulence lors d’une réfrigération à +4°C.27
Les sources potentielles d’infections sont la consommation d’eau contaminée ou de viande de bœuf, de porc, de volaille, d’agneau ou de veau ainsi que des coquillages ou poissons infectés. Des eaux contaminées peuvent également infecter l’homme au niveau cutané par exposition de plaies ou brûlures ainsi qu’au niveau pulmonaire lors de noyades.23 La présentation clinique des
infections digestives à Aeromonas spp varie de la diarrhée aqueuse à sanglante. Très rarement, elle peut mimer une diarrhée aqueuse profonde semblable à celle du choléra. Des SHU sont également possibles. Des complications secondaires peuvent survenir, incluant colites ou MICI. En cas de comorbidités (chimiothérapies anticancéreuses27), une translocation bactérienne d’origine
digestive peut survenir avec une bactériémie d’évolution péjorative (32 % à 45 % de mortalité). D’autres agents peuvent être impliqués dans des diarrhées aigües bactériennes : Bacillus
cereus, Clostridium perfringens et Staphylococcus aureus. Ces pathogènes ne sont pas
recherchés en routine : les symptômes courts qu’ils entraînent ne donnent que rarement lieu à une consultation médicale.37
3.2 Pathogènes respiratoires
La flore oropharyngée est constituée de bactéries commensales pouvant être impliquées dans des infections respiratoires bactériennes : S. pneumoniae, H. influenzae, Moraxella
catarrhalis,1 certaines espèces du genre Corynebacterium et Staphylococcus ainsi que des
bactéries anaérobies.23 Les patients atteints de BPCO peuvent présenter une flore contenant des
entérobactéries, et des souches de Pseudomonas aeruginosa peuvent être retrouvées avec des résistances acquises par sélection au cours d’antibiothérapies. Lors du recueil d’expectorations, des conditions strictes doivent donc être observées pour minimiser le risque de contamination par la flore salivaire. A l’inverse, certaines bactéries d’origine orale ne doivent pas être prises en compte dans la recherche d’étiologie de processus infectieux : streptocoques oraux,
Staphylococcus non aureus, Neisseria spp, Haemophilus non influenzae.18
S. pneumoniae (pneumocoque) est un cocci à Gram positif, organisé en diplocoque,
lancéolé et encapsulé, essentiellement humain.4 Fragile, cette bactérie doit arriver rapidement au
laboratoire où sa culture nécessite des facteurs de croissance et une atmosphère enrichie en CO2.9, 23 De distribution mondiale, S. pneumoniae est responsable de multiples pathologies
humaines et représente une des principales causes de mortalité et de morbidité en infectiologie9, 31
avec une incidence annuelle en Europe de 800 infections/100’000 habitants dont 20 décès/100’000 habitants.4 Il s’agit en effet de la première cause de pneumonies communautaires
bactériologiquement documentées27 (50 % des cas4). Souvent isolé de flores commensales des
voies respiratoires de populations saines, la colonisation s’observe à un stade précoce au cours de la vie avec un taux de colonisation de 40 à 60 % chez l’enfant, qui diminue à 6 % chez l’adulte sans enfant.4, 9
H. influenzae est un bacille à Gram négatif de petite taille, immobile, aéro-anaérobie
facultatif. Exigente, sa croissance est favorisée par une atmosphère enrichie en CO2 après un
acheminement rapide23 sur gélose au sang (haemo : sang et philo : amour en grec), cuit de
préférence, et associé à des facteurs de croissance.59 Un passage des bactéries en forme VNC
est possible.42 Comme les autres espèces du genre Haemophilus spp (à l’exception
d’Haemophilus aegyptius et Haemophilus ducreyi),4 il fait partie de la flore normale des voies
aériennes supérieures et de la cavité buccale chez 50 à 80 % de la population, mais peut aussi être présent au niveau génital voire digestif.9, 27
M. catarrhalis est un cocco-bacille à Gram négatif23 exclusivement humain,27 normalement
présent dans le tractus respiratoire supérieur de 5 % de la population adulte et 66 à 100 % de la population pédiatrique.27 Il peut également être retrouvé dans des prélèvements d’origine génitale
ou conjonctivale. Fragile, son transport doit être rapide et sa culture est favorisée par une atmosphère enrichie en CO2.
S. aureus est un cocci à Gram positif, organisé en tétrades voire en amas, à coagulase
positive. Bactérie commensale de la peau et des muqueuses de l’homme dès la naissance, le portage chez l’adulte est fréquent en particulier au niveau nasopharyngé (20 à 40 % de la population) et vaginal (10 % de la population).9, 23 S. aureus est l’agent infectieux responsable de la
plus grande variété de pathologies chez l’homme,27 dont des infections pulmonaires (rares et
graves, pouvant compliquer la grippe4, 27), et son pouvoir pathogène est majoré par de nombreuses
toxines et enzymes.59 Résistant dans l’environnement, aucune précaution particulière lors du
transport n’est requise23 mais des formes VNC ont cependant été décrites.42
P. aeruginosa est un bacille à Gram négatif non fermentant, aérobie strict, mobile,
ubiquitaire. Présent à l’état naturel dans l’environnement (eaux douces et eaux de mer, sol, végétaux), il se multiplie dans les endroits humides et présente peu d’exigences nutritives mais des formes VNC ont été décrites.42 Pathogène opportuniste, il est fréquemment retrouvé dans le
tractus respiratoire des patients atteints de maladies pulmonaires chroniques (BPCO, mucoviscidose), ainsi qu’au niveau du tube digestif, de la gorge, du nez, de la peau et du tractus urinaire.27 Deux autres espèces peuvent être retrouvées dans des prélèvements d’origine
humaine : Pseudomonas fluorescens et Pseudomonas putida. Contaminants fréquents des prélèvements, leur croissance possible à +4°C favorise leur isolement.23
4 Conditions préanalytiques et numérations d’éléments
4.1 Numérations des éléments urinaires
Les ECBU sont les examens de microbiologie les plus réalisés (code 5201 de la NABM) avec plus de 9 millions d’actes en France en 2015, soit environ 2 % des actes de biologie médicale.10 Les conditions préanalytiques sont critiques. En effet, le délai avant l’analyse et la
présence de conservateur peuvent affecter la concentration urinaire en bactérie et en cellules (hématies et leucocytes). La numération bactérienne est importante pour conclure à une infection ou à une contamination par la flore périnéale. De même, la conservation des leucocytes et des hématies est essentielle afin de ne pas méconnaitre une leucocyturie et/ou hématurie significatives, définies par une concentration supérieure ou égale à 10 éléments/mm³ (ou 10’000/mL). La prise en charge d’urines sans conservateur doit être réalisée dans les 2 heures afin d’éviter la prolifération bactérienne et la dégradation des éléments. Au-delà, une réfrigération à +4°C permet de conserver les bactéries jusqu’à 24 heures mais n’assure pas la conservation des leucocytes.23 L’adjonction d’acide borique, agent bactériostatique, permet la conservation à
température ambiante des urines sans modification de la concentration bactérienne. Néanmoins, il semble raisonnable que chaque laboratoire effectue sa propre évaluation du risque de dégradation des leucocytes en fonction des récipients utilisés et du délai maximal entre le prélèvement et l’analyse.56 En effet, les résultats contradictoires sur les effets cytologiques des conservateurs
imposent la prudence au-delà de 8 heures de contact.30 Plus précisément, la stabilité des hématies
et des leucocytes est dépendant de l’osmolalité et du pH : un pH supérieur à 7,5 et une osmolalité inférieure à 300 mosm/kg peuvent entraîner une dégradation rapide des cellules urinaires.22, 34, 61
4.2 Numérations des liquides de ponctions
Normalement stériles, les liquides corporels contenus dans les séreuses (liquide pleural, liquides articulaires et liquide d’ascite) peuvent s’infecter et faire l’objet d'explorations microbiologiques. Avec les analyses du LCS (cf infra), ces analyses représentaient plus de 95’000 actes en France en 2015 (code 5231 de la NABM)10. Ce sont des urgences médicales et leur prise
en charge est immédiate après réception au laboratoire. Idéalement, leur analyse devrait être réalisée dans la demi-heure suivant le prélèvement33 et dans tous les cas avant 2 heures de
conservation à température ambiante.56 Néanmoins, les délais préanalytiques peuvent être
allongés en cas d’échantillons prélevés dans des établissements éloignés.
Parmi les échantillons envoyés au laboratoire pour explorations, l’utilisation de tubes BD vacutainer avec EDTA K2 est fréquente. Adaptés à la conservation du sang, la stabilité des numérations de liquides de ponctions sur tube EDTA K2 n’est cependant pas garantie par le