THESE
En vue de l’obtention du
DOCTORAT DE L’UNIVERSITE DE TOULOUSE
Délivré par :
L’UNIVERSITE TOULOUSE III– PAUL SABATIER
Discipline
:
Pharmacologie-Toxicologie Présentée et soutenue par
Solange Kiki-Mvouaka
Le 25 Septembre 2009
Titre
Rôle de la P-glycoprotéine dans le devenir des
lactones macrocycliques antiparasitaires chez
l’animal
Jury
Pr Gérard Campistron Professeur Faculté Pharmacie, Toulouse Président Pr Philipe Cardot Professeur à l’Université P et M Curie Rapporteur
Dr Sylvaine Lecoeur Chargée de Recherche INRA Rapporteur
Dr Michel Laurentie Directeur de Recherche AFSSA Rapporteur Pr Toussaint Bengone Ndong Maître de conférences ENS, Libreville Examinateur Dr Michel Alvinerie Ingénieur de Recherche INRA Examinateur Dr Anne Lespine Directrice de Recherche INRA Directrice de thèse
À
Lengoumbi –Foungui V, mon oncle Mbomba -Foungui MH, ma tante Ntounda Kiki M, ma tante
Merci !
Je tiens tout d’abord à remercier les membres du jury qui ont accepté de juger ce travail :
Professeur Campistron, je voudrais vous exprimer mes vifs remerciements, pour avoir accepté d’examiner et juger ce travail.
Professeur Philipe Cardot, Docteur Sylvaine Lecoeur, Docteur Michel Laurentie,
Vous avez pris de votre temps pour lire ce travail et être les rapporteurs de cette thèse. Je vous exprime ma reconnaissance et ma gratitude.
Avec une grande reconnaissance et gratitude, j’adresse mes remerciements à l’INRA qui m’a offert le cadre pour réaliser mes travaux de thèse.
Docteur Pierre Galtier, ancien directeur de l’unité UR66, Pharmacologie Toxicologie, Docteur Thierry Pineau, directeur du Département de Santé Animale,
Docteur Bernard Salles, directeur de l’unité UR66, Pharmacologie Toxicologie, Vous m’avez accueillie dans votre laboratoire et apporté conseils et encouragements. Docteur Michel Alvinerie, vous avez accepté de m’accueillir dans l’équipe de pharmacocinétique, vous avez guidé ce travail. Vos valeurs humanistes et votre disponibilité resteront marquées dans mon esprit. Je vous remercie de votre amitié. Docteur Anne Lespine, directeur de cette thèse, tu as accepté de diriger ce travail, tu m’a permis d’aller au bout de moi-même, merci, pour ton encadrement, ta rigueur et ta patience.
C’est grâce à chaque membre de l’équipe de pharmacocinétique que ce travail dont je suis porte parole a été réalisé.
Docteur Jacques Dupuy, c’est de manière didactique que tu as répondu aux questions que je posais ; j’aurai dû en poser un peu plus, merci,
Docteur Christiane Borin ma T.C.S, je te considère comme telle, merci,
Jean François Sutra, vous m’avez initié à l’HPLC, merci pour la pertinence de vos remarques,
Mes remerciements s’adressent aussi à tous les membres du laboratoire, et du site de Saint Martin du Touch qui par leur chaleur ont fait que la nostalgie ne m’habite :
Isabelle O, Nicolas L ; Olivier P ; Pascal M ; Laila M-L ; Hervé G, Afifa, Joëlle L ; Laurence K ; Sarah C ; Régine P ; Philipe P ; Marie José A ; Cathy G, Jean Pierre ; Soraya T; Arnaud P ; Frédéric L ; Jean Luc V, Mélanie ; Oudah, Gérard
Merci, encore un barbecue !!! À LBV peut être,
Bertrand, Amine, Alice, Simon, Graziela, Julie, Romain.
Je remercie également,
La direction de l’ENS de Libreville qui m’a donnée l’oppotunité d’effectuer ce travail hors du Gabon.
J’adresse mes vifs remerciements à Toussaint sans qui je n’aurais pu rencontrer le Docteur Alvinerie.
Pour votre soutien moral, Merci.
Charlotte, Justine, Huguette, Madé, Carle L et M, Marie Francine, Eric, Béatrice, Véronique Solange, Camille et toute la Famille.
SOMMAIRE
INTRODUCTION 9
ÉTAT DU SUJET 10
TRAVAUX ANTERIEURS
12
A.
LACTONES MACROCYCLIQUES ENDECTOCIDES (LMS) 13
1. ORIGINE DES AVERMECTINES 14
2. ORIGINE DES MILBEMYCINES 14
3. STRUCTURE ET PROPRIETES PHYSICOCHIMIQUES DES ENDECTOCIDES 15
3.1. Les avermectines 16
3.2. Les milbémycines 18
4. MODE D’ACTION DES LACTONES MACROCYCLIQUES ENDECTOCIDES 19
5. TOXICITE DES LACTONES MACROCYCLIQUES ENDECTOCIDES 20
6. LES LACTONES MACROCYCLIQUES ENDECTOCIDES ET L’ENVIRONNEMENT 22
6.1. Elimination des LMs 22
6.2. Faune sensible 23
6.3. Situation actuelle du problème 23
7. LES SPECIALITES THERAPEUTIQUES 24
7.1. Spécialités destinées à la thérapeutique humaine 24
7.2. Spécialités destinées à la thérapeutique vétérinaire 24
8. SPECTRE D’ACTIVITE DES LACTONES MACROCYCLIQUES ENDECTOCIDES 25
9. PROPRIETES PHARMACOCINETIQUES 28
9.1. Rappels sur les paramètres pharmacocinétiques 28
9.2. Pharmacocinétique des LMs 30
10. RELATION ENTRE LA PHARMACOCINETIQUE ET EFFICACITE DES ENDECTOCIDES 34
10.1. Influence du principe actif et de sa formulation 35
10.2. Influence de la voie d’administration 36
10.3. Différences entre espèces animales cibles 37
11. LA RESISTANCE DES PARASITES AUX ANTHELMINTHIQUES 38
11.1. Origine de la résistance 39
11.2. Mécanismes de la résistance 39
11.3. Détection de la chimiorésistance 40
11.4. Résistance génétique 41
2.6. Substrats de la P-gp 52
3. RESISTANCES PLEIOTROPIQUES ET PHENOTYPE MDR 53
3.1. Définition 53
3.2. Implication de la P-gp dans les phénomènes de résistance 54
C.
INTERACTIONS DES LMS AVEC LA P-GLYCOPROTEINE 56
1. METHODES D’EXPLORATION DES INTERACTIONS ENTRE LMS ET P-GP 57
1.1. Les sondes fluorescentes substrats 57
1.2. L’utilisation d’agents réversants de la P-gp 58
1.3. Les lignées cellulaires 58
1.4. Les vésicules inversées 60
1.5. Approches ex vivo ou in situ 61
1.6. Les souris déficientes en P-gp 62
2. ÉTUDES DES INTERACTIONS ENTRE LMS ET PGP 63
2.1. Transport direct des LMs par la P-gp 63
2.2. Inhibition de la fonction de transport de la P-gp par les LMs 64 2.3. Influence des LMs sur l’activité ATPasique de la P-gp 64
3. P-GP ET DEVENIR DES LMS DANS L’ORGANISME ANIMAL 67
3.1. Rôle de la P-gp dans le devenir des LMs in vivo 67
3.2. Rôle de la P-gp dans l’excrétion intestinale des LMs 69 3.3. Rôle de la P-gp dans la protection du cerveau contre l’accumulation des LMs 70 3.4. Corrélation des données in vitro et in vivo dans les études d’efflux de la P-gp 71 3.5. Rôle d’autres transporteurs MDR dans le transport LMs 72
4. P-GP ET DEVENIR DES LMS CHEZ LE PARASITE 73
4.1. Les P-gps chez Caenorhabditis elegans 73
4.2. Les P-gp des nématodes parasites 73
4.3. Implication de transporteurs MDR dans la résistance aux LMs 74 4.4. Autres facteurs impliqués dans la résistance aux LMs 75
TRAVAIL EXPERIMENTAL
77
CHAPITRE І 81
CHAPITRE ІІ 83
CHAPITRE Ш 85
DISCUSSION 87
CONCLUSION 91
Listes des figures et tableaux
Figure 1 : Origine des Lactones Macrocycliques
Figure 2 : Structure chimique des principales lactones macrocycliques
Figure 3 : Action de l’ivermectine sur l’acide amino butyrique (GABA) dans la synapse interneuronique d’un parasite
Figure 4 : Relation entre les concentrations plasmatiques et les concentrations au niveau des tissus cibles.
Figure 5 : Comparaison de la cinétique plasmatique de l’ivermectine administrée par voie sous-cutanée et par voie orale chez le mouton
Figure 6 : Topologie membranaire de la P-gp, des MRP et de la BCRP
Figure 7 : Fonction de la P-gp
Figure 8 : Cellules en monocouche Caco-2
Figure 9 : Dispositif expérimental d’études sur les cellules Caco-2
Figure 10 : Modèle d’intestin perfusé chez la souris
Tableau V : Constante de partage (AUC lait/AUC plasma) des lactones macrocycliques
Tableau VI : Exemple de rémanence d’activité des endectocides
Tableau VII : Transporteurs ABC, gènes et protéines
Tableau VIII : Localisation d’ABCB1 dans les différents tissus humains
Tableau IX : Variabilité interethnique du polymorphisme C3435T du gène MDR
Tableau X : Substrats de la P-gp
Tableau XI : Influence des LMs sur l'activité de transport dans les cellules.
Tableau XII : Affinité des LMs pour la P-gp des LMs dans les lignées cellulaires.
Tableau XIII : Influence des modérateurs MDR sur la pharmacocinétique des LMs in vivo et
in vitro
Abréviations
AAD : Amino-acetonitrile derivatives ABA : Abamectine
ABC: ATP-Binding Cassette ABCB1: P-glycoprotéine
ADME : Absorption, distribution, métabolisme, excrétion
ADN : Acide déxoxyribonucléique
AMM : Autorisation de mise sur le marché AP : Apical
AQ : Absorption quotient ARN : Acide ribonucléique ATP : Adénosine triphosphate AUC : Aire sous la courbe
BCRP : Breast Cancer Resistance Protein BDZ : Benzimidazoles
BHE : Barrière Hemato encéphalique BL : Basolatéral
Cmax : Concentration maximale CYP : Cytochrome P450
DL50 : Dose létale causant la mort de 50% de la population animale
DLN ou NBD: Nucleotide binding domains DOR : Doramectine
DTM ou TMD : Transmembrane domains EC50 : Concentration induisant 50% d'inhibition Emax : Effet maximal
EPR : Eprinomectine
GABA : Acide gamma amino butyrique
ITZ : Itrakonazole iv : Intraveineuse IVM : Ivermectine Ki : Constante d’affinité KO : Knock – out KTZ : Kétokonazole LMs : Lactones macrocycliques
Log P : Coefficient de partage Octanol/Eau MDR : Multi drug resistance
MOX : Moxidectine
MRP: Multidrug Resistance-associated Proteins MRT : Mean residence time
NBD : Nucleotide Binding domain NOEL : No effect observed level
OMS : Organisation mondiale de la santé Papp : Perméabilité apparente
P-gp : P-glycoprotéine Rho123 : Rhodamine 123 SC : Sous cutané
SEL : Selamectine SLC : Solute carrier
SNC : Système nerveux central SNP : Single nucleotide polymorphism SR : Slow Release
SXR : Steroid xenobiotic recepteur T1/2 : Temps de demi-vie
Tmax : Temps maximal
État du sujet
Les parasitoses représentent un problème de santé publique et économique majeur au niveau mondial et les pays en voie de développement ne sont pas épargnés. En matière d’élevage, les parasites sont un fléau à l’origine des lourdes pertes de productivité. Les pertes économiques sont liées au retard de croissance, au coût des médicaments et aux frais de main d’œuvre. En France, les problèmes de santé en élevage des ovins représentent 7 à 12 % des coûts en élevage conventionnel (Benoit et Laignel, 2002 ; Cabaret, 2004). Chez les ruminants, le parasitisme helminthique (nématodes, cestodes, trématodes) est un élément essentiel de la gestion du troupeau. Il en est de même en zone intertropicale où les pathologies gastro-intestinales des ruminants (Fabiyi, 1987) conjuguées aux aléas du climat sont dramatiques pour la gestion du troupeau. La prévalence de ces maladies est de 100% même dans la zone soudano-sahélienne plus aride (Vassiliades, 1984).
La chimiothérapie anthelminthique demeure la pierre angulaire de la lutte antiparasitaire tant en médecine vétérinaire qu’en médecine humaine. Les premiers antiparasitaires (arsénite et arséniates) avaient une action peu spécifique et étaient très toxiques pour l’hôte. Avec l’essor de la chimie de synthèse, des molécules plus spécifiques, plus efficaces et bien tolérées par l’animal apparaissent. Les organo-chlorés, commercialisés à partir des années 40, sont remplacés par les organo-phosphorés dans les années 70. Au cours de cette période apparaissent les benzimidazoles (BDZ) (Thiabendazoles, Albendazole, Oxfendazole), très éfficaces contre les nématodes, ainsi que les pyréthrinoïdes actifs contre les ectoparasites. Dans les années 80, la classe des lactones macrocycliques (LMs), douée d’une activité antiparasitaire endectocide à la fois active vis-à-vis des parasites externes et internes, est commercialisée. Dans les années 90, des molécules telles que le fipronil ou l’imidaclopride sont introduites sur le marché contre les ectoparasites exclusivement.
animaux de compagnie. Ces molécules représentent à l’heure actuelle 60% du chiffre d’affaire de tous les antiparasitaires utilisés chez les animaux de rente. Cependant, l’utilisation à grande échelle des LMs a conduit à l’apparition de résistances chez les nématodes. Cette problématique, associée aux contraintes législatives imposées pour l’usage des substances chimiques en élevage en particulier chez les espèces à vocation laitière, incite à rechercher des solutions nouvelles et durables.
Une nouvelle classe de composés (« amino-acetonitrile derivatives » ou AADs) efficace contre des souches de nématodes résistantes aux lactones macrocycliques (LMs) et aux benzimidazoles (BDZ) est en cours d’introduction sur le marché en 2009.
Mais, l’enjeu demeure encore dans l’optimisation de l’utilisation des molécules existantes principalement en recherchant une augmentation de leur efficacité. L’activité anthelminthique des LMs endectocides est liée à la présence effective du principe actif sur le site d’action en termes de concentration et de durée. Une connaissance des étapes qui conditionnent le devenir des LMs est dès lors indispensable ; d’où l’intérêt de l’outil pharmacocinétique dans cette recherche. Les LMs sont des substrats de la P-glycoprotéine (P-gp), protéine d’efflux de la famille des transporteurs « ATP-binding cassette » (ABC) qui représente une cible stratégique pour la modulation de la biodisponibilité et l’efficacité de ces médicaments.
Ce manuscrit comporte deux parties. La première partie, bibliographique, présente les LMs, puis les transporteurs ABC et fait le point sur les interactions connues entre les LMs et les transporteurs ABC. La seconde partie, expérimentale, présente les études réalisées. Ensuite, suit une discussion générale sur l’ensemble des résultats et une conclusion sur le rôle de la P-gp dans le devenir des LMs. En perspective, nos recherches proposeraient des stratégies rationnelles pour garantir l’efficacité à long terme des LMs.
A. Lactones macrocycliques
endectocides (LMs)
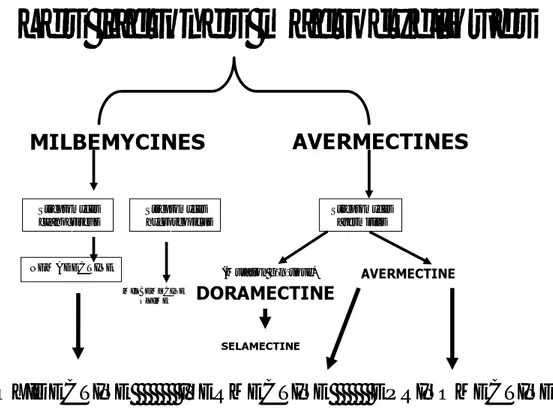
Les lactones macrocycliques endectocides sont des produits de fermentation d’actinomycètes du genre Streptomyces. Les espèces Streptomyces avermitilis, Streptotmyces
hygroscopicus et Streptomyces cyaneogrieus génèrent au cours de leur croissance de nombreux
composés qui se répartissent en deux familles : les avermectines et les milbémycines.
1.
Origine des avermectines
A partir de 1975, la recherche sur les antiparasitaires s’oriente vers des substances d’origine naturelle, radicalement différentes et novatrices conduisant à la découverte des endectocides (Burg et al., 1979). Un échantillon provenant du sol collecté à Kawana (Ito City, Japon) par des chercheurs de l’institut Kisatato montre une activité antiparasitaire remarquable dans un test in vivo sur des souris infestées par Nematospiroides dubius, un nématode résistant aux anthelminthiques classiques utilisés, c’est-à-dire les benzimidazoles (Egerton et al., 1980; Hotson, 1982).
Dans des proportions infimes, un agent actif est isolé. Son activité est très supérieure aux autres anthelminthiques connus à ce jour (Egerton et al., 1980). En effet, 1µg par gramme de nourriture distribuée, soit une ppm de la ration, permet de mettre en évidence le fort potentiel de cet agent.
De l’ensemble des propriétés acaricides, insecticides et nématodicides, découle le nom de cette nouvelle famille de composés AVERMECTINES (A : anti, Verm : ver, Ect : ectoparasite, IN : produit pharmaceutique).
L’innovation découle de la capacité de ce produit à traiter et à éliminer les endoparasites (nématodes) et ectoparasites (arthropodes) ; d’où le concept d’ENDECTOCIDES (figure : 1).
MILBEMYCINES
AVERMECTINES
Streptomyces hygroscopicus Streptomyces cyanogriseus NEMADECTINE Streptomyces avermitilis AVERMECTINE (Mutation génétique) MILBEMYCINE OXIME SELAMECTINE DORAMECTINELes lactones macrocycliques
MOXIDECTINE IVERMECTINE EPRINOMECTINE
Figure 1 : Principales Lactones Macrocycliques
3.
Structure et propriétés physicochimiques des endectocides
Les avermectines et les milbémycines présentent une même structure générale avec comme point commun un macrocycle à lactone. La différence structurale majeure des deux groupes vient du groupement saccharidique (substituant bisoleandrosyloxy) sur le carbone 13 des avermectines, les milbémycines en sont dépourvues et peuvent être ainsi considérées comme des avermectines déglycosylées (aglycones des avermectines).
Les endectocides sont des substances liposolubles et neutres. Leur solubilité dans l’eau est relativement faible. Cependant elles sont solubles dans de nombreux solvants (méthanol, chloroforme, etc…). Les LMs ont également un coefficient d’adsorption élevée, indiquant leur capacité de se lier au carbone organique, comme le confirme les mesures de degré de liaison entre
entre la phase aqueuse et la phase organique imiscible (Log P = concentration dans la phase octanol/concentration dans la phase aqueuse).
Une valeur élevée de LogP indique qu’un composé est hydrophobe et présente une faible solubilité dans l’eau. Cette valeur élevée pour les endectocides (IVM Log P = 4,8) confirme l’affinité de ces composés pour le tissu adipeux. Ce coefficient est contrebalancé par la grande masse moléculaire des LMs endectocides les empêchant de traverser les membranes biologiques. Leur limite de détection par HPLC se situe à 0,93 ng/g (Taylor et al., 1994).
Selamectin CH3 X OH O OH O O O O O R1 O O O O R2 H H H H H O O O O H OH H O H H N O Ivermectin B1a X = -CH2CH2- R1 = CH(CH3)CH2CH3 R2 = OH Abamectin B1a X = -CH=CH- R1 = CH(CH3)CH2CH3 R2 = OH Doramectin X = -CH=CH- R1 = cyclohexyl R2 = OH Eprinomectin B1a X = -CH=CH- R1 = CH(CH3)CH2CH3 R2 = NHCOCH3 H3C NOCH3 CH3v CH3 H3C H3C CH3 H3C CH3 CH3 OCH3 OCH3 H3C H3C CH3 H3C 13 25 13 13 25 25 23 22 1 54 Selamectin CH3 X OH O OH O O O O O R1 O O O O R2 H H H H H O O O O H OH H O H H N O Ivermectin B1a X = -CH2CH2- R1 = CH(CH3)CH2CH3 R2 = OH Abamectin B1a X = -CH=CH- R1 = CH(CH3)CH2CH3 R2 = OH Doramectin X = -CH=CH- R1 = cyclohexyl R2 = OH Eprinomectin B1a X = -CH=CH- R1 = CH(CH3)CH2CH3 R2 = NHCOCH3 H3C NOCH3 CH3v CH3 H3C H3C CH3 H3C CH3 CH3 OCH3 OCH3 H3C H3C CH3 H3C 13 25 13 13 25 25 23 22 1 54
diffèrent par la présence respective d’un groupement méthoxyl et hydroxyl sur le carbone C5. L’indice 1 et 2 permet de signaler la présence ou l’absence de la double liaison sur les carbones C 22 et C 23, enfin l’indice a et b permet d’indiquer la nature du substituant butyl ou isoproyl en position C 25. Les homologues a et b ont une activité identique, leur séparation est difficile et sans intérêt au cours de la fermentation à grande échelle si bien que certains auteurs simplifient la nomenclature à quatre types au lieu de huit A1, A2, B1, B2 (Shoop et al., 1995) (Figure 2).
L’ivermectine (IVM) (22-23 dihydro-avermectine B1) : C’est la première avermectine commercialisée (Chabala et al., 1980; Egerton et al., 1980). Elle est obtenue par hydrogénation sélective de la double liaison C 22-23 de l’avermectine B1. Il s’agit donc d’un intermédiaire entre B1 et B2. Au plan structural, son hydrogénation conduit à une conformation en chaise très proche de B. Au plan biologique, elle possède un excellent potentiel antiparasitaire (proche de B1), avec une sécurité d’emploi s’approchant de B2. Sa DL50 est estimée à 30 mg/kg chez la souris (Shoop et
al., 1995). Compte tenu de son ancienneté, elle possède le plus large spectre d’activité reconnu par les autorisations de mise sur le marché (Campbell, 1984, 1983).
L’abamectine (ABA) (avermectine B1) : C’est aussi un produit de fermentation de
Streptomyces avermitilis avec une production plus simple que celle de l’ivermectine. L’ABA ou
avermectine B1 diffère de l'IVM uniquement par la présence d'une double liaison en C22-23. La mesure de la toxicité aigue après administration orale donne une DL50 qui varie de 14 à 24 mg/kg chez les
souris mâles et femmelles (http://www.inchem.org/documents/jmpr/jmpmono/v94pr02.htm). L’ABA est plus active sur les nématodes que l’IVM mais un peu moins efficace sur quelques arthropodes, son utilisation en protection des cultures est en relation avec son activité acaricide et insecticide. Sa toxicité est plus importante que celle de l’IVM.
La doramectine (DOR) (25 cyclohexyl-avermectine B1) : Elle est produite par une souche mutante de Streptomyces avermitilis en présence de l’acide cyclohexane carboxylique. La seule différence structurale entre la doramectine et l’ABA, molécule représentative des avermectines, est le substituant du carbone C25 alors que l’ABA a un groupement éthyl (C2H5) ; la
DOR a un groupement cyclohexyl d’où elle tire son nom de 25-cyclohexylavermectine B1 en C13. La DOR a un disaccharide en C5, un groupement hydroxyl (OH) entre C22-C23, et une double liaison. Ces différences structurales font que la DOR est très lipophile (Moreno et al., 2008). Des études de toxicité aiguë ont été menées sur des rongeurs, chez la souris cette toxicité est comprable à celle de l’ivermectine (http://whqlibdoc.who.int/trs/WHO TRS 864 fre. pdf). Comme
L’éprinomectine (EPR) (4’-épiacétylamino-4désoxy-averectine B1) : Elle est obtenue par hémi-synthèse du produit issu de la fermentation de Streptomyces avermetilis. Structuralement, elle est très proche de l’IVM avec, comme différence majeure, l’ajout d’un groupement polaire epiacetyl amino (5NCOCH3) en C4 à l’extrémité du résidu saccharique. L’ajout de ce groupement polaire augmente, relativement aux autres LMs, l’hydrophilie de la molécule. Cette molécule a été sélectionnée parmi plus de 500 lactones macrocycliques en vue d’obtenir le spectre et la marge de sécurité les plus larges possibles, avec les concentrations les plus faibles dans le lait. Ainsi, seulement son emploi chez les vaches laitières en production pouvait être envisagé (Alvinerie et al., 1999b; Shoop et al., 1996a; Shoop et al., 1996b). Après administration par voie orale sa DL50
est de 70 mg/kg chez la souris et de 55 mg chez le rat. La toxicité à court terme est étudiée à 90 jours à la dose maximale de 20 mg/kg (http://whqlibdoc.who.int/trs/WHO_TRS_888_fre.pdf).
La sélamectine : La sélamectine est un composé semi-synthétique obtenu à partir de la doramectine, de poids moléculaire 770 kDa (Bishoop et al., 2000 ; Goudie et al., 1993). La sélamectine diffère de la doramectine par deux groupements et une liaison entre deux carbones en :
- C13, la doramectine a un disaccharide ; la sélamectine n’a plus qu’un monosaccharide, -C5, la doramectine a un groupement hydroxyle (OH) ; la sélamectine présente, elle, un groupement oxime (=N-OH),
- entre C22-C23, la doramectine a une double liaison ; la sélamectine n’a plus qu’une simple liaison.
La sélamectine est un antiparasitaire polyvalent développé pour le chien et le chat sous le nom déposé de Stronghold®. Cet endectocide dérivé de la doramectine, est le premier membre de la famille des avermectines présentant une bonne sécurité d’utilisation combinée à une efficacité à la fois sur les parasites internes et externes des animaux de compagnie. Aucune toxicité n’a été rapportée, que ce soit sur des femelles en gestation, en lactation ou des mâles reproducteurs. En cas de surdosage, même chez des chiens colleys sensibles à l’ivermectine, aucun trouble n’a été rapporté (Geyer et al 2009 ; Conder et Baker, 2002)
La moxidectine est obtenue par hémi - synthèse de la némadectine. La némadectine est issue de la fermentation de Streptomyces Cyanogriseus noncyanugenus. La moxidectine possède une meilleure activité contre les nématodes tissulaires et un spectre d’action nématicide sensiblement plus large que celui de l’ivermectine (Bisset et al., 1992). Au cours les études de toxicité aiguë la MOX administrée par voie orale chez la souris et le rat a donné des valeurs de DL50 qui varient de 50 à 100 mg/kg. Ajoutée à la nourriture pendant 28 jours, la MOX a provoqué la mort
des souris à la dose la plus élevée soit 32mg/kg (http://whqlibdoc.who.int/trs/WHO_TRS_864_fre.pdf).
4.
Mode d’action des lactones macrocycliques endectocides
Le mode d’action des endectocides n’a été connu que progressivement à cause de l’hétérogénéité des tests et des études réalisées (différents modèles animaux, protocoles et doses). Il est unique, lent, spécifique (Arena et al., 1995) et fait intervenir le système glutaminergique.
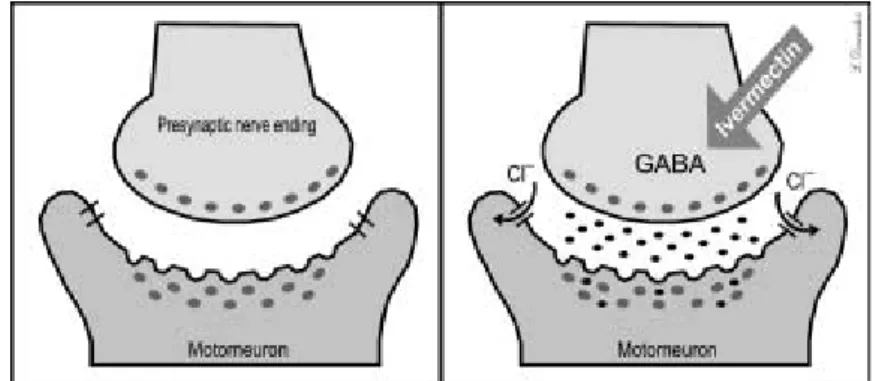
Action sur la transmission nerveuse : Les arthropodes, les nématodes et les invertébrés en général sont constitués d’un système neuro-inhibiteur qui fait intervenir différents types de récepteurs dont celui de l’Acide gamma amino butyrique (GABA). Les LMs agissent par effet GABA-mimétique (Pemberton et al., 2001; Turner, 1989). Les effets antiparasitaires connus sont : une paralysie des muscles pharyngiens et des muscles somatiques du parasite ou de l’insecte. En effet, les LMs agissent sur la transmission nerveuse en se fixant sur un récepteur au glutamate qui contrôlent les canaux chlores. Elles accroissent alors la perméabilité des muscles de la membrane des cellules nerveuses à proximité du récepteur GABA (Acide gamma amino butyrique) et du récepteur aux benzodiazépines dans le pharynx. Ce qui réduit le potentiel excitateur provoquant une hyperpolarisation de la membrane cellulaire. Cette hyperpolarisation bloque toute activité nerveuse et entraîne une paralysie flasque (Arena et al., 1995; Hejmadi et al., 2000; Lamb et al., 2003) (Figure3). Les neurones concernés se situent au niveau de la jonction interneuronale chez les nématodes et au niveau de la jonction neuro-musculaire chez les arthropodes.
L’action des endectocides se manifeste donc par une inhibition de l’activité électrique des cellules nerveuses des nématodes et celles des cellules musculaires des arthropodes ; d’où la
glutamate similaires à ceux des nématodes et arthropodes sur lesquels se fixent les macrolides endectocides (Courtney et al., 1985; Shoop et al., 1995).
Chez les mammifères, les récepteurs au glutamate ne sont retrouvés qu’au sein du système nerveux central (SNC), ce qui explique la toxicité de ces molécules. Leur accumulation et leur toxicité dans le SNC n’apparaît qu’après leur passage à travers de la barrière hémato-méningée (Li and Zhang, 1996 ; Schinkel et al., 1994; Schinkel et al., 1996).
Figure 3 : Action de l’ivermectine sur les recepteurs à l’acide -aminobutiyique (GABA) dans la synapse interneuronique d’un parasite (Dourmishev et al., 2005) : Ces recepteurs contrôlent l’ouverture des canaux qui permettent le passage des ions chlores.L’IVM augmente le relargage de GABA, augmente la liason du GABA au motoneurone et ouvre le canal chlore.
Action sur le cycle du parasite : Elle est reliée à la fois à l’action intrinsèque du médicament sur le parasite et à la présence des concentrations significatives en terme de niveau et de durée sur le site d’action. On note dans le cas de l’ivermectine une action relativement délétère sur les fonctions de reproduction du parasite. Une inhibition de la ponte chez les femelles adultes, des organes reproducteurs femelles, de la mue pour les stades nymphaux et une inhibition des récepteurs au glutamate des muscles et des ont été signalées chez Ascaris suum (Fellowes et al., 2000).
pas la possibilité d’une action systémique qui peut donner lieu à des effets indésirables généraux et à des intoxications.
Les modalités d’emploi doivent être rigoureuses pour les races dites anglaises (colleys, bobtail) qui sont beaucoup plus sensibles et peuvent développer des signes cliniques très sérieux, même à doses thérapeutiques ou infra-thérapeutiques.
Les formulations à base de sélamectine de milbémycine oxime ou de moxidectine enregistrées pour le chien et le chat sont inoffensives si la dose est respectée (Folia veterinaire 2009, Geyer et al 2009).
Chez le cheval et le chien infestés par respectivement des microfilaires d’Onchocerca ou de « ver cardiaque » (dirofilariose), des réactions d’hypersensibilité peuvent apparaître suite à la nécrose d’un grand nombre de parasites. Le traitement de bovins infestés par Hypoderma bovis peut engendrer de graves effets indésirables lorsque le parasite est à proximité du canal rachidien (paralysie) ou de l’œsophage (tympanisme). L’utilisation simultanée avec des benzodiazépines augmente la toxicité de chaque principe actif (Folia veterinaria, 2009).
Ces composés sont dangereux pour les poissons et les organismes aquatiques dont le milieu peut être contaminé par l’élimination de flacons usagés ou par les résidus issus d’animaux traités. Aucune malformation fœtale n’a été observée dans les études de reproduction menées chez différents animaux. Selon Campbell 1989, les études sur les animaux gestants ne montrent pas d’embryotoxicité, toutes les anomalies du développement et les malformations néonatales sont observées pour des doses proches des doses létales pour la mère. A l’exception de l’éprinomectine, ces substances sont excrétées en faibles concentrations dans le lait (Folia veterinaria 2008, 2009).
Chez les mammifères, deux mécanismes concourent à la faible toxicité et à la grande innocuité des endectocides. En effet, les cibles des endectocides chez les mammifères sont les canaux chlores gabaergiques, canaux moins sensibles à l’ivermectine que les canaux chlore dépendant du glutamate présent de manière diffuse chez les invertébrés (Schaeffer and Haines, 1989). Chez les mammifères, les cibles de la toxicité de l’IVM sont les recepteurs au GABA
(neurotransmetteur inhibiteur) localisés dans le SNC qui lui-même est protégé par la P-gp située sur le BHE. Cependant, l’ivermectine peut être toxique chez les animaux déficients en P-gp, par une accumulation anormale de l’ivermectine au niveau du cerveau (Schinkel et al., 1994; Schinkel et al., 1996 ; Roulet et al., 2003). Un dépistage précoce des animaux sensibles à l’ivermectine par un test génétique peut permettre d’éviter les phénomènes de toxicité.
niveau des hormones reproductives comme l’hormone lutéinisante (Lacau-Mengido et al., 2000) mais aussi le facteur de croissance insulinoïde (Kappeler et al., 2006). Dans une étude sur le comportement sexuel Rodrigues-Alves et al. (2008) montrent que la moxidectine module sur le taux de GABA par une action sur le système hypothalamo – GABA chez les rats mâles.
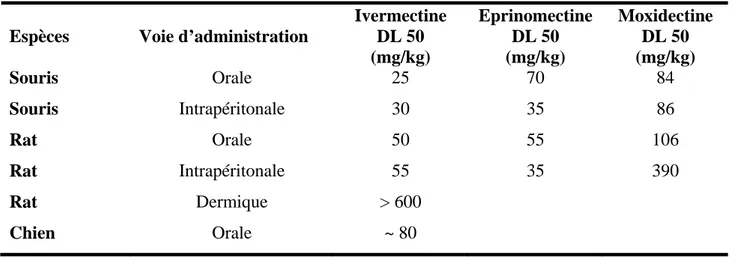
Tableau I : Toxicité comparée de trois LMs endectocides (WHO Food Additives Series1992, 1996, 1998)
Espèces Voie d’administration
Ivermectine DL 50 (mg/kg) Eprinomectine DL 50 (mg/kg) Moxidectine DL 50 (mg/kg) Souris Orale 25 70 84 Souris Intrapéritonale 30 35 86 Rat Orale 50 55 106 Rat Intrapéritonale 55 35 390 Rat Dermique > 600 Chien Orale ~ 80
6.
Les Lactones macrocycliques endectocides et
l’environnement
Le problème de l’impact des LMs sur l’environnement prend son origine à deux niveaux : - l’élimination importante du principe parental inchangé,
- l’existence d’une faune sensible : insectes bousiers.
6.1. Elimination des LMs
Les travaux sur ce sujet (Alvinerie et al., 1999c) ont démontré l’importance de l’élimination fécale de l’ivermectine administrée sous forme de bolus intra ruminal à libération lente (Ivomec
6.2. Faune sensible
Il existe une faune d’insectes bousiers (coléoptères, diptères) essentielle pour la transformation des bouses de vaches ; ce qui permet d’éviter ainsi la mortification et l’envahissement des prairies par les excréments. L’évaluation de l’impact écotoxicologique de matières fécales provenant de bovins traités par un bolus intra ruminal (Ivomec SR Bolus®) a fait l’objet de mesures directes et indirectes des effets indésirables sur la faune coprophage. Les insectes coprophages constituent en effet l’un des groupes-clés impliqués dans la dégradation des déjections animales en pâturage. L’EPR et l’IVM sont les LMs qui ont été testées sur les insectes coprophages. L’expérience est conduite sur Neomyia cornicina (Diptera), une mouche dont la larve se développe dans les déjections avec l’EPR. Par contre, les expérimentations sont menées avec l’ivermectine sur le coprophage Aphodius constants, une des espèces de référence internationale pour les études de ce type. La mortalité des larves a été totale de 105 à 128 jours après le traitement. Suite à une administration d’Ivomec SR Bolus®, 135 à 143 jours après, les bouses contenaient toujours de l’ivermectine et mettaient beaucoup plus de temps à disparaître que les bouses des animaux non traités. La DL50 est le paramètre qui a permi de mesurer la disparition
de 50% de la matière sèche dans les bouses sous l’action de Coléoptères coprophages tel qu’Aphodius constans. En région méditerranéenne, l’élimination de déjections animales dure 11.5 mois dans le cas des séries bolus alors que dans les séries témoin, la DL50 est de 4,5 mois (Lumaret
et al., 1993).
6.3. Situation actuelle du problème
Le bolus intra ruminal à libération prolongée présentait le plus grand risque compte tenu de la dose massive utilisée (1700 mg). Il a fait l’objet d’une évaluation au laboratoire de pharmacologie de L’INRA de Toulouse. A la suite des travaux réalisés par le programme PNETOX, la commission d’AMM vétérinaire a proposé le retrait de la commercialisation en France du bolus intra ruminal (Ivomec SR Bolus®) (Alvinerie et al., 1999c). Les formulations (sous cutanées, « pour on » ou orale) ont satisfait aux exigences réglémentaires relatives à la partie du dossier AMM qui concerne la mesure de l’impact sur l’environnement.
7.
Les spécialités thérapeutiques
Les spécialités pharmaceutiques sont pour la plupart à destination animale. Cependant, il existe un usage grandissant en thérapeutique humaine.
7.1. Spécialités destinées à la thérapeutique humaine
Associant morbidité et mortalité, les répercussions des infestations par les helminthes représentent un fléau majeur au niveau de la santé humaine. Les infestations par Onchocerca
volvulus conduisent à l’apparition de graves séquelles : cécité, éléphantiasis… Afin de réduire
l’impact de ces parasitoses, l’OMS (1980) a mis en place des vastes programmes d’éradication grâce à des formulations galéniques bien spécifiques (http://www.who/topics/onchocerciasis/fr). En médecine humaine, l’ivermectine a reçu l’AMM sous le nom de Mectizan® dans l’indication d’onchocercose à O.volvulus (Boussinesq, 2005) dans le cadre des programmes internationaux. En 1997, dans le cadre des traitements individuels, une nouvelle présentation a été commercialisée sous la dénomination Stromectol® dans le traitement de la strongyloïdose (anguillulose) gastro-intestinale (Guzzo et al., 2002; Marigny et al., 2001). La découverte des pouvoirs scabicides de l’ivermectine chez l’homme date d’un peu plus de 10 ans suite à l’observation de son action sur la gale humaine lors des traitements pour onchocercose. Dans cette dernière indication, l’ivermectine a obtenu une AMM pour le traitement de la gale (Guzzo et al., 2002; Marigny et al., 2001).
7.2. Spécialités destinées à la thérapeutique vétérinaire
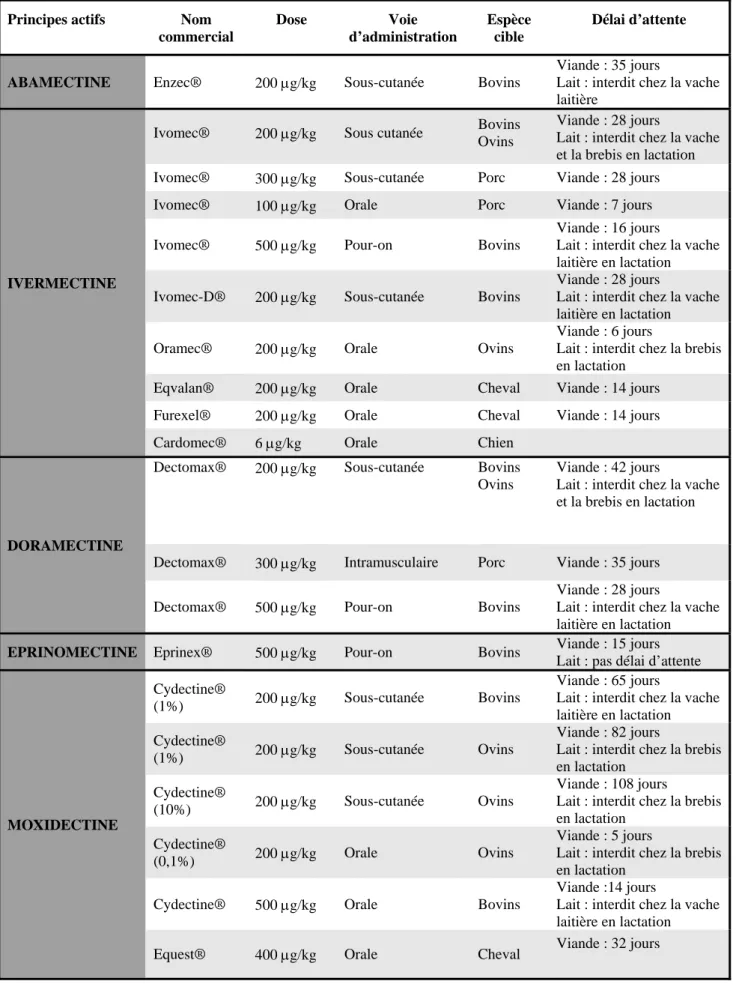
En France, l’usage vétérinaire des LMs concernent six molécules : l’ivermectine, l’abamectine, la doramectine, la moxidectine, l’éprinomectine et la sélamectine (tableau II). Ces LMs ont pour indications : le traitement des endoparasitoses telles les strongyloses intestinales et pulmonaires, les ascaridioses, les oxyuroses et le traitement des insectes comme le varron, les
d’administration. Ainsi, la posologie des endectocides dans une forme injectable et une formulation pour-on est de 0,2 mg/kg et 0,5 mg/kg respectivement (pour compenser la faible biodisponibilité) chez les herbivores.
8.
Spectre d’activité des lactones macrocycliques endectocides
Les lactones macrocycliques présentent une grande efficacité à l’égard de nombreux parasites internes et externes des animaux domestiques et leur activité s’exerce à de nombreux stades parasitaires. Elle comprend une action anthelminthique et une action insecticide et acaricide.
Action sur les nématodes digestifs et respiratoires : Les endectocides sont actifs sur la majorité des nématodes parasites à localisation digestive et respiratoire. Ils sont particulièrement indiqués contre les strongles digestifs (Haemonchus, Ostertagia, Teladorsagia, Trichostrongylus,
Tableau II : Principales lactones macrocycliques antiparasitaires utilisées en médecine vétérinaire.
Principes actifs Nom commercial Dose Voie d’administration Espèce cible Délai d’attente
ABAMECTINE Enzec® 200 g/kg Sous-cutanée Bovins
Viande : 35 jours
Lait : interdit chez la vache laitière
IVERMECTINE
Ivomec® 200 g/kg Sous cutanée Bovins Ovins
Viande : 28 jours
Lait : interdit chez la vache et la brebis en lactation Ivomec® 300 g/kg Sous-cutanée Porc Viande : 28 jours Ivomec® 100 g/kg Orale Porc Viande : 7 jours
Ivomec® 500 g/kg Pour-on Bovins
Viande : 16 jours
Lait : interdit chez la vache laitière en lactation Ivomec-D® 200 g/kg Sous-cutanée Bovins
Viande : 28 jours
Lait : interdit chez la vache laitière en lactation
Oramec® 200 g/kg Orale Ovins
Viande : 6 jours
Lait : interdit chez la brebis en lactation
Eqvalan® 200 g/kg Orale Cheval Viande : 14 jours Furexel® 200 g/kg Orale Cheval Viande : 14 jours Cardomec® 6 g/kg Orale Chien
DORAMECTINE
Dectomax® 200 g/kg Sous-cutanée Bovins Ovins
Viande : 42 jours
Lait : interdit chez la vache et la brebis en lactation
Dectomax® 300 g/kg Intramusculaire Porc Viande : 35 jours
Dectomax® 500 g/kg Pour-on Bovins
Viande : 28 jours
Lait : interdit chez la vache laitière en lactation EPRINOMECTINE Eprinex® 500 g/kg Pour-on Bovins Viande : 15 jours
Lait : pas délai d’attente Cydectine®
(1%) 200 g/kg Sous-cutanée Bovins
Viande : 65 jours
Lait : interdit chez la vache laitière en lactation Cydectine®
(1%) 200 g/kg Sous-cutanée Ovins
Viande : 82 jours
Lait : interdit chez la brebis en lactation
Cydectine®
(10%) 200 g/kg Sous-cutanée Ovins
Viande : 108 jours
(Dictyocaulus, Protostrongylus, Muellerius), les anguillules (Strongyloides) et les trichures chez les ruminants. Parmi ces nématodes, certains constituent des espèces limitantes car naturellement moins sensibles que d’autres. Il s’agit des Cooperia spp. et de Nematodirus spp (Bisset et al., 1992; Werner et Rajan, 1992; William et al., 1997). Les endectocides ont une action adulticide, larvicide et, dans certains cas, sont actifs sur les larves de strongles entrant en hypobiose, notamment celles du genre Teladorsagia. Il existe des niveaux de sensibilité différents selon la nature du parasite.
Action des endectocides sur les parasites externes : Les macrolides endectocides sont utilisés dans le traitement des ectoparasitoses des ruminants. Les formulations injectables sont actives sur les poux piqueurs (Haematopinus, Linognathus et Solenopotes), les mélanophages (Melaphagus ovinus) et les agents de gales du genre Sarcoptes ou Psoroptes (Heinze-Mutz et al., 1993; Seaton et al., 1989; Shoop et al., 1996a; Shoop et al., 1996b). Les applications dermiques «pour-on», avec une distribution à la fois systémique et superficielle, ont un spectre d’activité élargi aux poux broyeurs (Bovicola syn. Damalinia) et aux agents de gales du genre Chorioptes. Une seule administration est généralement suffisante chez les bovins pour contrôler une phtiriose ou une gale. Les formulations orales sont insuffisamment actives sur les parasites externes et ne sont employées que pour une vermifugation des animaux.
Action de l’éprinomectine : L’action de l’éprinomectine chez l’hôte (bovin, caprins, ovin, vache laitière) est combinée aux caractéristiques suivantes :
- très grande efficacité, sécurité d’utilisation,
- réduction rapide de l’excrétion d’œufs (le bilan cumulé des comptages d’œufs permet d’estimer l’effet des traitements sur la contamination des pâtures),
- durée d’action, insensibilité aux intempéries,
- zéro délai d’attente pour le lait (utilisation chez la vache et la chèvre laitière à la dose de 0.5 mg/kg et 1mg/kg repectivement).
Le potentiel de l’EPR est établi à partir d’EPRINEX « pour-on » (Tableau 3) sur les parasites majeurs externes et internes des bovins, tout particulièrement les adultes et les immatures de Nematodirus helvetianus, ainsi que sur les différentes espèces de Cooperia adultes et immatures, « parasite dose limitante » pour les autres lactones macrocycliques à pouvoir endectocide.
Tableau III : Spectre d’activité d’Eprinex « pour on » 500 µg/kg. Action sur les parasites majeurs externes
et internes des bovins, tout particulièrement sur les adultes et les immatures de Nematodirus helvetianus, ainsi que sur les différentes espèces de Cooperia adultes et immatures. Les observations ont été faites pendant deux ans (Forbes et al, 2004)
Parasites internes
Strongles gastro-intestinaux Adultes Larves L4
Ostertagia ostartagi > 99 % > 99 %
O. ostertagi (larves L4 en hypobiose) > 99 %
Ostertagia lyrata > 99 % Non testé
Cooperia oncophora > 99 % > 99 % Cooperia pectinata > 99 % > 99 % Cooperia punctata > 99 % > 99 % Cooperia sumabada > 99 % > 99 % Nematodirus helvetianus > 99 % > 99 % Haemonchus placei > 99 % > 99 % Trichostrongylus colubriformis > 99 % > 99 % Oesophagostomum radiatum > 99 % > 99 %
Trichuris sp > 97 % Non testé
Bunostomum phlebotomum > 99 % > 99 %
Strongles pulmonaires
Dystyocaulus viviparus > 99 % > 99 %
9.
Propriétés pharmacocinétiques
Les propriétés physico-chimiques (polarité, lipophilie….) déterminent les caractéristiques pharmacocinétiques d’un médicament.
- le Tmax est le temps nécessaire pour atteindre la concentration plasmatique maximale. - l’aire sous la courbe (AUC), exprime le niveau d’exposition de l’organisme au médicament et correspond à la surface sous-tendue par la courbe des concentrations plasmatiques en fonction du temps.
- le temps de demi-vie (T1/2), est le temps nécessaire pour que les concentrations
plasmatiques soient divisées par deux lorsque l’équilibre de pseudo distribution est atteint. Il décrit dans sa globalité :
le processus d’élimination, ce temps se calcule sur la phase terminale de la courbe des concentrations plasmatiques.
la distribution d’un médicament correspond à sa répartition dans les tissus de l’organisme à partir du point d’administration grâce à la circulation sanguine et lymphatique. Le volume de distribution est défini comme le volume fictif en litre par kilogramme qu’occuperait le médicament s’il se partageait de façon homogène dans le sang et les tissus. Ce paramètre permet de bien apprécier la répartition dans les différents organes.
- la biodisponibilité, mesure la fraction ou pourcentage du médicament qui après résorption atteint la circulation générale.
La biodisponibilité absolue, correspondant au rapport de la quantité absorbée par une voie d’administration donnée à celle obtenue par voie iv (égale à 100%, par définition). La biodisponibilité relative mesure les quantités relatives du médicament lorsque celui-ci est administré sous deux ou plusieurs formes pharmaceutiques ou par des voies d’administration différentes autres que la voie iv.
- le temps moyen de résidence (MRT) se définit comme étant le temps passé en moyenne par une molécule de médicament dans l’organisme. Contrairement au temps de demi-vie, le MRT est un paramètre pertinent qui prend en compte la totalité des processus de disposition (absorption, distribution et élimination).
- la clairance mesure la capacité d’un organisme ou d’un organe à éliminer un médicament. Pour un organe donné, c’est la fraction du débit sanguin qui sera totalement débarrassée du médicament lors de la traversée de l’organe. Il s’agit d’un paramètre majeur en pharmacocinétique et son étude doit faire suite à une administration intraveineuse.
9.2. Pharmacocinétique des LMs
La pharmacocinétique des LMs est conditionnée par leur caractère physico–chimique tels que la polarité et la lipophilie. Les membres de cette famille d’antiparasitaires sont pratiquement insolubles dans l’eau (6-9 g/l) (Hennessy et Alvinerie, 2002), cette propriété leur confère une bonne absorption, une forte distribution et une longue rémanence dans l’organisme.
Ivermectine (IVM) : L’ivermectine se caractérise par une grande variabilité de comportement pharmacocinétique (Tableau IV) entre les espèces et entre les individus d’une même espèce (Atta et Abo-Shihada, 2000 ; Bengone Ndong et al., 2005; Prichard, 1985; Toutain et al., 1997; Wilkinson et al., 1985).
L’absorption, exprimée en pourcentage du médicament administré qui atteint le compartiment plasmatique, est de 50-60% chez l’homme, de 41% chez le porc, et de l’ordre de 50% chez le mouton par voie orale et du même ordre par voie sous–cutanée (Fink, 1989). L’ivermectine après son absorption passe dans la circulation sanguine où elle se fixe fortement aux lipoprotéines (Bassissi et al., 2004). La métabolisation et l’excrétion sont les deux mécanismes physiologiques qui déterminent l’élimination d’un médicament. L’ivermectine a une demi–vie très longue (2 à 3 jours) chez de nombreux mammifères, chez l’homme, elle est de 28 h (Guzzo et al., 2002; Marigny et al., 2001). Après une administration orale de 300 µg/kg chez les rats on retrouve dans les selles jusqu’à 58 % de la dose administrée sous forme native après un jour et jusqu’à 90 % au bout de 5 jours (Alvinerie et al., 1999c; Halley, 1989). Cette forte excrétion fécale suivant une administration orale est due à trois phénomènes : la persistance de la partie non absorbée dans le bol alimentaire, la sécrétion par la bile et surtout une sécrétion intestinale active et dans une faible mesure la sécrétion dans le lait chez les vaches en production (1 à 2 %). Sur l’intestin perfusé de rat (Laffont et al., 2002) l’utilisation du vérapamil, un inhibiteur de la P-gp inhibe l’excrétion intestinale de l’ivermectine au niveau du Jéjunum. L’utilisation des inhibiteurs de la P-gp in vitro et in vivo sur le mouton confirme cette forte excrétion intestinale de l’ivermectine (Ballent et al., 2006).
voies d’élimination, par sécrétion biliaire et par estérification avec des acides gras au niveau du tissu adipeux. Toutefois, on note que la façon dont l’ivermectine est métabolisée par les vertébrés diffère selon le mode d’administration, certaines formulations libérant le médicament plus lentement que d’autres (Hennessy et Alvinerie, 2002).
La forte lipophilie de l’ivermectine conduit à un fort stockage tissulaire et un volume de distribution supérieur au volume sanguin. Ce stockage de l’ivermectine se localise dans les tissus riches en lipides (cerveau, tissus adipeux, etc…) et principalement sous forme native. Cependant le foie et le tissu adipeux sont les deux organes qui présentent de fortes concentrations en ivermectine (Campbell, 1983 ; Fisher et Mrozik, 1992). Malgré sa forte vascularisation et sa forte composition lipidique, de tous les organes évalués seul le cerveau présente un taux infime d’ivermectine (Schinkel et al., 1994).
Tableau IV : Quelques paramètres pharmacocinétiques de l’ivermectine dans le plasma de différentes
espèces animales Espèces Dose (g/kg) Voie d’administration Cmax (ng/ml) Tmax (h) AUC (ng/h/ml) MRT (d) VDss (L/kg) Références
Buffle 500 Sous-cutanée 28,5 58,8 98,8 80,5 Anastasio et al. 2002 Bœuf 500 Pour-on 8,83 1,3 30,63 3,38 Bengone Ndong et al. 2007 Mouton 200 Intraveineuse - - 8990 - 5,3 Prichard et al. 1985 Mouton 200 Sous-cutanée 16,3 62,4 6744 5,88 Atta et Abo-shehada 2000 Chèvre 200 Sous-cutanée 6,12 68,4 1344 7,85 Alvinerie et al. 1993 Chèvre 200 Orale 10,5 28,9 831 2,59 Escudero et al. 1997 Chèvre 500 Pour-on 4 48 317 - Scott et al. 1990 Porc 300 Intraveineuse - - 2040 2 7,9 Friis ey Bjorn 1990 Porc 300 Sous-cutanée 39,6 22,6 31,68 5,78 Lifschitz et al 1999 Vache 200 Sous-cutanée 31 ,7 95,5 8664 9 Toutain et al. 1997 Vache 200 Intraveineuse - - 6096 3,18 2,2 Wilkinson et al. 1985 Vache 500 Pour-on 12,2 81,6 2916 8,4 Gayard et al. 1999 Ane 200 Orale 23,6 19,2 2863 6,5 Gokbulut et al. 2005 Dromadaire 200 Sous-cutanée 3,24 144 1591 21,5 Oukessou et al. 1996 Chien 250 Orale 132,6 - - - 5,35 Al’Azzam et al. 2007 Veau 200 Sous-cutanée 34,5 1,75 134,3 3,81 Alvarez et al. 2008
Le profil de répartition tissulaire est inchangé en fonction de la voie d’administration (sous cutanée, intra ruminale et orale) chez de nombreuses espèces. On note toutefois qu’en
présente des valeurs plus faibles 75,2 ± 15,5 ng/j/ml contre 134,3 ± 15,7 ng/j/ml dans les lots infestés comparativement aux lots témoins (Perez et al., 2007).
Tableau V : Constante de partage (AUC lait/AUC plasma) des lactones macrocycliques
Espèces Ivermectine Eprinomectine Moxidectine Doramectine
Vache 1 0,1 2,5 1
Chèvre 1 0,1 7,5 1
Mouton 1,67 0,6 10 2,86
Eprinomectine (EPR) : Son autorisation de mise sur le marché (AMM) date d’août 1997 en France et ne concerne que l’espèce bovine avec une administration topique. Des travaux ont montré que l’éprinomectine a un comportement pharmacocinétique distinct des autres LMs. Après administration topique à la dose de 500 μg/kg avec un excipient à base d’huiles d’origine naturelle, le pic plasmatique est quatre fois plus élevé que celui de l’ivermectine et sa demi-vie plus faible. Le temps de résidence moyen est de l’ordre de 4 jours contre 8 jours pour l’ivermectine. Sa constante de partage lait/plasma (AUC lait/AUC Plasma) est 10 fois plus faible que celle de l’ivermectine (Tableau V). Elle se présente sous la forme pour-on et les différentes études en cours chez la chèvre montrent que son emploi nécessite une dose 1,5 à 2 fois supérieure à la dose bovine (soit 0,75 à 1 mg/kg), (Alvinerie et al., 1999b; Chartier et al., 1999). L’éprinomectine pour-on chez le buffle (Bubalus bubalis) donne une AUC 20 fois plus basse que chez la vache laitière. L’excrétion dans le lait est faible ; le rapport AUC lait/AUC plasma (0,76 ± 0,16) permet de suggérer une utilisation chez la femelle buffle en lactation (Dupuy et al., 2008). L’évaluation de
2002). Son efficacité contre les acariens Chorioptes bovis, Otodectes cynotis, Sarcoptes bovis est démontrée (Barth et al., 1997).
Doramectine (DOR) : La pharmacocinétique est établie par comparaison avec la DHAVM (dihydroavermectine B1a) chez la génisse (Bishop et al., 2000). La doramectine a un temps de demi-vie plasmatique (89 h) presque deux fois supérieur à celui de la DHAVM (47 h) ; ce qui suppose une élimination plus lente. Chez le veau, la pharmacocinétique de la doramectine a été comparée à celle de l’ivermectine (Gayrard et al., 1999; Toutain et al., 1997). La doramectine atteint la même concentration plasmatique maximale que l’ivermectine, que ce soit suite à une administration sous-cutanée, ou « pour on », mais plus lentement (voie sous-cutanée : 5,4 jours pour la doramectine, contre 4jours pour l’ivermectine en application «pour on» : 4,3 jours pour la doramectine, contre 3,4 jours pour l’ivermectine). Cela suppose que l’absorption est plus lente pour la doramectine.
Moxidectine (MOX) : L’absorption de la moxidectine serait de 20 % chez les ovins avec une solution orale et de l’ordre de 40% avec un gel chez les chevaux (Lanusse et al., 1997; Perez et al., 1999). Chez la femelle buffle, cette biodisponibilité est semblable à celle de la vache laitière (Dupuy et al., 2008). Il semble donc que malgré sa grande lipophilie, la moxidectine soit moins bien absorbée par voie orale que l’ivermectine. Par contre, on note que son volume de distribution est trois fois plus élevé que celui de l’ivermectine. Cet accroissement semble provenir de la forte répartition tissulaire. Le volume de distribution est lié à la physiologie. En effet, le tissu adipeux serait un déterminant majeur qui contrôle la demi-vie de la moxidectine. Elle présente une forte rémanence dans l’organisme, en rapport direct avec son fort tropisme pour le tissu adipeux. Chez le zébu Gobra, on note que l’aire sous la courbe (AUC) est plus élevée pour la doramectine (475 ng/jour/ml) par rapport à la moxidectine (198 ng/jour/ml), alors que le MRT est plus long pour la moxidectine (13,4 jours) par rapport à la doramectine (9,4 jours) (Bengone-Ndong et al., 2008). Le temps de demi-vie de la moxidectine est de 2 à 5 fois plus élevé que celui de l’ivermectine ou de l’éprinomectine. Il est de huit jours pour la moxidectine après une administration topique alors qu’il est de deux jours pour l’éprinomectine et de cinq jours pour l’ivermectine. Après administration, l’excrétion de la molécule est majoritairement fécale (Alvinerie et al., 1999b; Alvinerie et al., 1999c). La voie d’élimination par le lait est beaucoup plus forte que pour les deux avermectines étudiées ; son coefficient de partition dans le lait K (AUC lait/AUC plasma) est très élevé, il est de l’ordre de 4 alors que celui de l’ivermectine est inférieur à 1 et que celui de
consiste principalement en une oxydation en R5 (Dupuy et al., 2003; Lifschitz et al., 2002) . Comparativement aux autres molécules, la moxidectine présente la plus forte répartition tissulaire alors que l’éprinomectine présente la plus faible. Cette répartition varie aussi bien quantitativement que qualitativement. Les fortes concentrations tissulaires se trouvent majoritairement dans le tissu adipeux alors que le tissu hépatique présente des quantités beaucoup plus faibles et inférieures à d’autres organes (Zulalian., 1994). La concentration cérébrale en moxidectine est plus élevée que celle de l’ivermectine malgré une dose administrée 1,5 fois plus faible. Après une administration orale et sous forme de principe parental, plus de 58% de la moxidectine et 51% de la doramectine de la dose totale administrée sont excrétées dans les fèces (Alvinerie et al., 1999c). Selon Lanusse et al (1997), 5% de la dose administrée est retrouvée dans le lait chez la vache en lactation, cette fraction passe à 22% chez la chèvre en lactation (Carceles et al., 2001).
10.
Relation entre la pharmacocinétique et efficacité des
endectocides
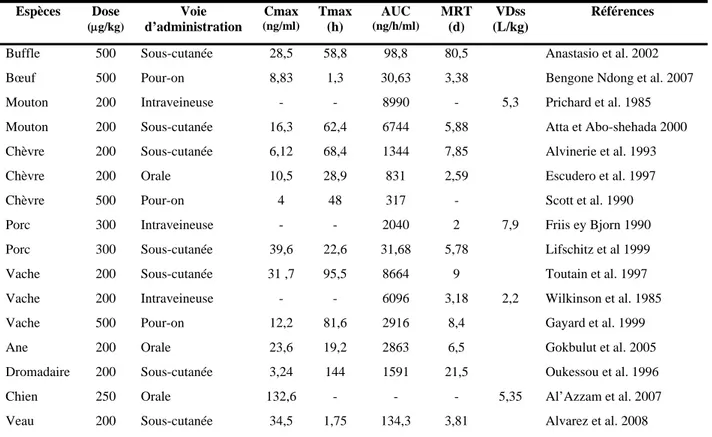
De nombreux travaux démontrent l’étroite corrélation entre les concentrations plasmatiques et les concentrations observées au niveau des sites d’action tels que la peau ou le mucus abomasal (Lifschitz et al., 1999). En effet, non seulement les profils d’évolution sont parallèles, mais, de plus, les concentrations dans les tissus cibles sont supérieures à celles observées dans le plasma.
A titre d’exemple, chez les bovins après administration sous-cutanée de moxidectine à la dose thérapeutique de 0,2 mg/kg, les valeurs des AUC sont respectivement de 159 ng/j/ml et 371 ng/j/ml pour le plasma et le mucus abomasal, ce qui traduit un taux d’exposition deux fois supérieur pour le mucus (figure 4). Par contre, le temps moyen de résidence (MRT) présente une valeur identique dans les deux compartiments (8,60 et 8,90 jours), ce qui reflète une disposition cinétique parallèle. Des résultats similaires ont été obtenus pour la doramectine et l’ivermectine (Lifschitz et al., 2000).
0,1 1 10 100 0 10 20 30 40 50 60 Durée (jours) C onc ent ra ti on ( ng/ m l ; ng/ g) P la s m a M uc us a bo m a s a l P e a u
Figure 4 : Relation entre les concentrations plasmatiques et les concentrations au niveau des tissus cibles après administration sous-cutanée de moxidectine à la dose de 0,2 mg/kg chez les bovins (Lifschitz et al., 1999).
10.1. Influence du principe actif et de sa formulation
Une comparaison du profil pharmacocinétique des trois endectocides (ivermectine, doramectine, moxidectine) administrés par voie sous-cutanée, dans le cadre d’une étude standardisée a révélé un profil similaire pour l’ivermectine et la doramectine tandis que la moxidectine se caractérisait par un processus d’absorption plus rapide et une rémanence plus longue (Lanusse et al., 1997). Cette différence est la résultante d’une formulation différente (aqueuse) pour la moxidectine et d’un stockage plus intense au niveau graisseux.
Cet effet de la formulation sur le processus d’absorption a été longuement documenté tant pour l’ivermectine (Lo et al., 1985) que pour la doramectine (Wicks et al., 1993). Cela a justifié le choix d’une formulation huileuse par Pfizer (doramectine) et Merck (ivermectine) tandis que Fort-Dodge (moxidectine), en raison du caractère lipophile plus marqué de la moxidectine retenait un excipient aqueux afin de ne pas majorer l’importante rémanence résultant du stockage au niveau de la graisse.
10.2. Influence de la voie d’administration
La voie d’administration est un déterminant majeur à prendre en compte dans la recherche d’une efficacité optimale des endectocides (Lespine et al., 2005). Dans le cas de l’ivermectine, une comparaison des différentes voies d’administration chez les bovins permet d’illustrer l’importance du mode de traitement (Figure 5). Les niveaux d’exposition engendrés par les différents types de traitement sont directement liés à la quantité d’ivermectine utilisée, mais ne sont pas proportionnels. En effet, la mise en jeu du principe actif 2,5 fois supérieure dans le cas du « pour on », n’engendre pas une exposition supérieure (mais inférieure) à celle générée par une administration par voie sous-cutanée (Alvinerie et al., 1998). Par ailleurs, l’usage de la voie « pour on » génère plusieurs biais inhérents à ce type d’application :
- l’absorption percutanée est faible (biodisponibilité de 19 ± 5 %) (Laffont et al., 2001). - le léchage des animaux eux-mêmes ou entre eux engendre une absorption du principe actif par voie orale qui augmente largement la biodisponibilité de la formulation (biodisponibilité 33 ±18 %), mais est aussi à l’origine d’une très grande variabilité (Laffont et al., 2001).
Dès lors, on peut considérer que la voie «pour on» n’est pas une voie aussi performante qu’une administration sous-cutanée en terme de retour sur la dose mise en jeu. Elle présente le risque d’engendrer des niveaux de concentration sub-thérapeutiques chez de nombreux animaux traités (Gayrard et al., 1999) et des résidus inattendus chez des animaux non traités.
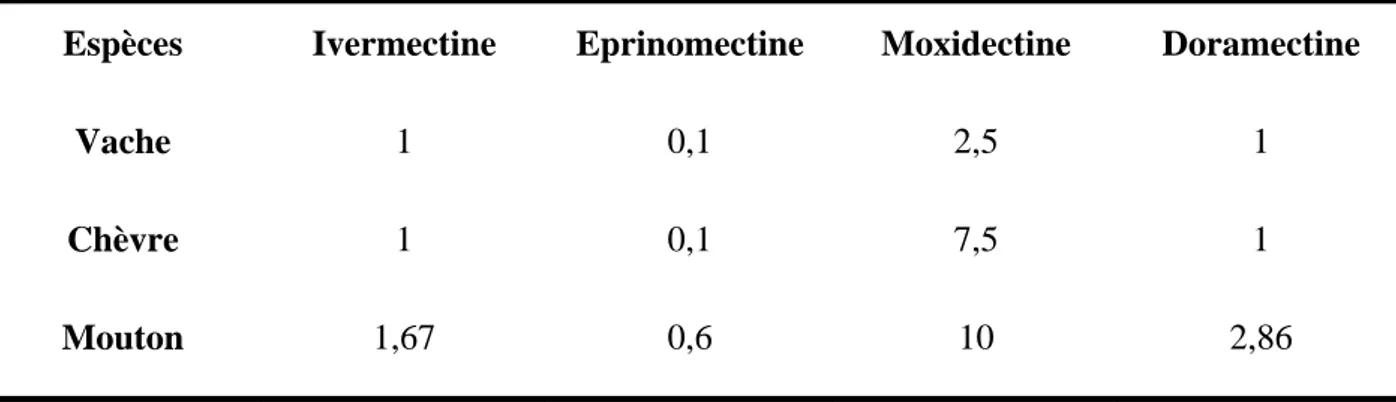
Dans le cas de la moxidectine, une comparaison des voies d’administration sous-cutanée et orale chez le mouton démontre une équivalence en terme d’exposition révélée par la similitude des AUC (98,89 34,98 ng/j/ml pour la voie orale et 112,3 46,50 ng/j/ml pour la voie sous-cutanée) (Alvinerie et al., 1998).
Néanmoins, pendant la période de 5 à 33 jours après l’administration, la voie sous-cutanée permet le maintien d’une concentration plasmatique de moxidectine double de celle obtenue par la voie orale (figure 5). Cette différence de rémanence est bien corrélée par les observations des parasitologues qui décrivent une persistance d’activité plus longue pour la voie sous-cutanée (Dorchies et al., 1996; Kerboeuf et al., 1995).
Figure 5 : Comparaison de la cinétique plasmatique de l’ivermectine administrée par voie sous-cutanée et par voie orale chez le mouton : Pendant la période de 5 à 35 jours, la voie sous-cutanée permet le maintien d’une concentration double de celle obtenue par la voie orale (Alvinerie et al., 1998).
10.3. Différences entre espèces animales cibles
Des études comparées des niveaux d’exposition et de rémanence (Tableau VI) ont été réalisées chez de nombreuses espèces (vache, mouton, chèvre, cheval) ; elles démontrent la grande variabilité de ces paramètres chez les différentes espèces (Alvinerie et al., 1996; Lanusse et al., 1997).
A titre d’exemple, l’exposition à la doramectine générée par une administration sous-cutanée (0,2 mg/kg) est respectivement 3 et 6 fois inférieure chez le mouton et la chèvre par rapport à celle obtenue chez la vache. Des variations similaires sont décrites pour l’ensemble des lactones macrocycliques et interrogent sur la pertinence de la transposition de la dose sélectionnée chez la vache aux autres espèces. Des travaux plus récents sur l’usage de l’éprinomectine chez la chèvre ont démontré l’efficacité sub-optimale de la formulation « pour on » à la dose de 0,5 mg/kg, tandis qu’une dose double (1mg/kg) satisfait tant aux exigences d’efficacité qu’à celles de la sécurité de la production laitière (Dupuy et al., 2001a; Silvestre A., 2007). L’ensemble de ces éléments devrait conduire à déposer un dossier d’enregistrement pour l’usage de l’éprinomectine chez la chèvre avec une dose spécifique à cette espèce. L’exposition dramatiquement faible
Voie sous-cutanée 2 4 6 8 5 10 35 Durée (jours) Voie orale C once n trat io n (n g/ ml )
cette espèce. Cet exemple illustre parfaitement tout le danger des concentrations sub-thérapeutiques.
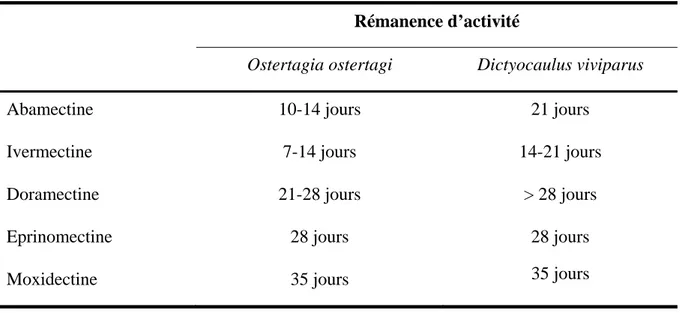
Tableau VI : Exemple de rémanence d’activité des endectocides par voie sous-cutanée à 0, 2 mg/ kg
chez le bovin (Beugnet, 1997).
Rémanence d’activité
Ostertagia ostertagi Dictyocaulus viviparus
Abamectine 10-14 jours 21 jours
Ivermectine 7-14 jours 14-21 jours
Doramectine 21-28 jours > 28 jours
Eprinomectine 28 jours 28 jours
Moxidectine 35 jours 35 jours
11.
La résistance des parasites aux anthelminthiques
La définition de la chimiorésistance, énoncée par l’OMS (1976), est la suivante : « une population chimiorésistante est une population de parasites ayant génétiquement acquis la capacité de résister à des concentrations d’antiparasitaires habituellement létales pour des individus de cette espèce » (Beugnet, 2006). Elle correspond à l’augmentation de la fréquence des individus d’une population d’helminthes qui tolèrent des doses d’un produit antiparasitaire supérieures à celles tolérées par des individus normaux ; cette tolérance étant en outre transmissible héréditairement. Il s’agit, en effet, d’un phénomène dont les fondements sont biologiques, évolutifs et qui résulte
sensibilité innée qui concerne l’ensemble de la population et qui existe indépendamment de toute exposition préalable au produit anthelminthique.
11.1. Origine de la résistance
Du fait d’une climatologie favorable à la prolifération des parasites et à l’utilisation fréquente des benzimidazoles, le phénomène de résistance aux produits antiparasitaires est apparu dans les pays tropicaux (Amérique du Sud, Afrique, Australie, Nouvelle Zélande) qui subissent de très lourdes pertes économiques par suite d’une mortalité accrue des animaux (Beugnet 2006). En Europe et en Amérique du Nord, les mêmes observations ont commencé dans les années 90 (Chartier et al. 2001; Silvestre et al. 2002, Wolstenholme et al. 2004). Des enquêtes ont montré que la prévalence des élevages ovins et caprins confrontés au phénomène de résistance aux antiparasitaires est de l’ordre de 80% en France (Hoste et al., 1999). Pour des raisons chronologiques liées à la mise sur le marché des antiparasitaires, les résistances des strongles sont d’abord apparues vis-à-vis des benzimidazoles. Elles sont maintenant décrites pour toutes les familles d’anthelminthiques : benzimidazoles, lévamisole, pyrantel, macrolides antiparasitaires, closantel, oxyclozanide.
Les parasites qui présentent une chimiorésistance aux anthelminthiques sont en général les plus pathogènes : H. contortus, Teladorsagia circumcincta, Trichostrongylus colubriformis,
Oesophagostomum columbianum, Nematodirus.
On constate donc que l’utilisation d’anthelminthique, si elle est indispensable, peut s’avérer limitante par des applications non adaptées conduisant à l’émergence de parasites résistants. S’agissant des LMs, leur attractivité est due à un large spectre d’action endo et ectoparasite, une grande rémanence d’efficacité ainsi qu’une faible toxicité. L’efficacité est liée à la présence des LMs dans l’organisme hôte à des concentrations significatives en termes de niveau et de durée sur le site d’action. Une des approches pour améliorer l’efficacité antiparasitaire consiste à augmenter la biodisponibilité des LMs au sein des cellules du parasite chez l’animal hôte.
11.2. Mécanismes de la résistance
transport membranaire des xénobiotiques, qui limite l’accès des ces molécules à la cellule et favorise leur élimination.
Les mécanismes biochimiques de la chimiorésistance sont en relation avec le mode d’action principal (à l’échelle moléculaire) de l’anthelminthique sur une cible donnée de l’helminthe. Le médicament remplace, par mimétisme structurel, une molécule organique sur le site ou le récepteur cible de son action, ce qui empêche le déroulement de la réaction normale et aboutit à des perturbations du métabolisme. Lors de chimiorésistance, on peut constater des modifications quantitatives et qualitatives des récepteurs aux antiparasitaires. Par exemple : la mutation de la béta-tubuline (voir 4.4 page75) chez les nématodes résistants aux benzimidazoles (Beugnet, 2006).
11.3. Détection de la chimiorésistance
L’apparition d’un phénomène de chimiorésistance aux produits anthelminthiques est suspectée quand un éleveur constate la diminution de l’efficacité thérapeutique du produit utilisé ou, plus souvent, du rendement attendu des animaux traités, au cours d’enquêtes épidémiologiques (Chartier et al., 2001; Hoste et al., 2002). Il est cependant nécessaire de confirmer le phénomène, car de nombreuses autres causes peuvent être à l’origine des déficiences constatées. Des examens parasitologiques ainsi que des tests de laboratoire ont été mis au point pour la détection et la quantification éventuelle de la chimiorésistance aux produits anthelminthiques (Silvestre et Humbert, 2000 ; Silvestre et al., 2000). Malgré leurs limites, ces tests représentent un outil indispensable pour confirmer et suivre l’évolution du phénomène. Il existe 3 types de tests de détection de la chimiorésistance aux produits anthelminthiques :
Les tests parasitologiques : détection directe de la chimiorésistance sur les stades endogènes de la population parasite qui peut s’effectuer de 2 manières : par coproscopie ou alors par bilan parasitaire (Cabaret et al., 1980; Cabaret et Morales, 1983; Kerboeuf, 1978).
Les tests biologiques : il s’agit de détection indirecte sur les stades libres après obtention des œufs qui peut s’effectuer de 4 manières par : test d’éclosion des œufs (Chartier et al., 2002),