HAL Id: dumas-01844544
https://dumas.ccsd.cnrs.fr/dumas-01844544
Submitted on 19 Jul 2018
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
État des lieux de la prise en charge de la dermatite
atopique en médecine générale dans le Calvados
Philippe Turbatte
To cite this version:
Philippe Turbatte. État des lieux de la prise en charge de la dermatite atopique en médecine générale dans le Calvados. Dermatologie. 2018. �dumas-01844544�
UNIVERSITÉ de CAEN - NORMANDIE ---
FACULTÉ de MÉDECINE
Année 2018
THÈSE POUR L’OBTENTION
DU GRADE DE DOCTEUR EN MÉDECINE
Présentée et soutenue publiquement le 4 avril 2018
Par
M. Philippe TURBATTE Né le 14 janvier 1984 à Caen (14)
ETAT DES LIEUX DE LA PRISE EN CHARGE DE LA DERMATITE ATOPIQUE
EN MEDECINE GENERALE DANS LE CALVADOS
Président : Madame le Professeur DOMPMARTIN-BLANCHÈRE Anne
Membres : Madame le Docteur ACHER Aurélie, directrice de thèse
Monsieur le Docteur LE BAS François
UNI V ER SI T É D E CA EN · NOR MA ND I E
U FR DE S A N TE – FA CU L TE DE ME DE CI N E
Année Universitaire 2017 / 2018
Doyen
Professeur Emmanuel TOUZÉ Assesseurs
Professeur Paul MILLIEZ (pédagogie) Professeur Guy LAUNOY (recherche)
Professeur Sonia DOLLFUS & Professeur Evelyne EMERY (3ème cycle)
Directrice administrative Madame Sarah CHEMTOB
PROFESSEURS DES UNIVERSITÉS - PRATICIENS HOSPITALIERS
M. AOUBA Achille Médecine interne
M. AGOSTINI Denis Biophysique et médecine nucléaire
M. AIDE Nicolas Biophysique et médecine nucléaire
M. ALLOUCHE Stéphane Biochimie et biologie moléculaire
M. ALVES Arnaud Chirurgie digestive
M. BABIN Emmanuel Oto-Rhino-Laryngologie
M. BÉNATEAU Hervé Chirurgie maxillo-faciale et stomatologie
M. BENOIST Guillaume Gynécologie - Obstétrique
M. BERGER Ludovic Chirurgie vasculaire
M. BERGOT Emmanuel Pneumologie
M. BIBEAU Frédéric Anatomie et cytologie pathologique
Mme BRAZO Perrine Psychiatrie d’adultes
M. BROUARD Jacques Pédiatrie
M. BUSTANY Pierre Pharmacologie
Mme CHAPON Françoise Histologie, Embryologie
Mme CLIN-GODARD Bénédicte Médecine et santé au travail
M. COQUEREL Antoine Pharmacologie
M. DAO Manh Thông Hépatologie-Gastro-Entérologie
M. DAMAJ Ghandi Laurent Hématologie
M. DEFER Gilles Neurologie
M. DELAMILLIEURE Pascal Psychiatrie d’adultes
M. DENISE Pierre Physiologie
M. DERLON Jean-Michel Éméritat jusqu’au 31/08/2018 Neurochirurgie
Mme DOLLFUS Sonia Psychiatrie d'adultes
M. DREYFUS Michel Gynécologie - Obstétrique
M. DU CHEYRON Damien Réanimation médicale
M. DUHAMEL Jean-François Éméritat jusqu’au 31/08/2018 Pédiatrie
M. ESMAIL-BEYGUI Farzin Cardiologie
Mme FAUVET Raffaèle Gynécologie – Obstétrique
M. FISCHER Marc-Olivier Anesthésiologie et réanimation
M. GÉRARD Jean-Louis Anesthésiologie et réanimation
M. GUILLOIS Bernard Pédiatrie
Mme GUITTET-BAUD Lydia Épidémiologie, économie de la santé et prévention
M. HABRAND Jean-Louis Cancérologie option Radiothérapie
M. HAMON Martial Cardiologie
Mme HAMON Michèle Radiologie et imagerie médicale
M. HANOUZ Jean-Luc Anesthésiologie et réanimation
M. HÉRON Jean-François Éméritat jusqu’au 31/08/2018 Cancérologie
M. HULET Christophe Chirurgie orthopédique et traumatologique
M. HURAULT de LIGNY Bruno Éméritat jusqu’au 31/01/2020 Néphrologie
M. ICARD Philippe Chirurgie thoracique et cardio-vasculaire
M. JOIN-LAMBERT Olivier Bactériologie - Virologie
Mme JOLY-LOBBEDEZ Florence Cancérologie
Mme KOTTLER Marie-Laure Biochimie et biologie moléculaire
M. LAUNOY Guy Épidémiologie, économie de la santé et prévention
M. LE COUTOUR Xavier Épidémiologie, économie de la santé et prévention
Mme LE MAUFF Brigitte Immunologie
M. LEPORRIER Michel Éméritat jusqu’au 31/08/2020 Hématologie
M. LEROY François Rééducation fonctionnelle
M. LOBBEDEZ Thierry Néphrologie
M. MANRIQUE Alain Biophysique et médecine nucléaire
M. MARCÉLLI Christian Rhumatologie
M. MARTINAUD Olivier Neurologie
M. MAUREL Jean Chirurgie générale
M. MILLIEZ Paul Cardiologie
M. MOREAU Sylvain Anatomie/Oto-Rhino-Laryngologie
M. MOUTEL Grégoire Médecine légale et droit de la santé
M. NORMAND Hervé Physiologie
M. PARIENTI Jean-Jacques Biostatistiques, info. médicale et tech. de communication
M. PELAGE Jean-Pierre Radiologie et imagerie médicale
Mme PIQUET Marie-Astrid Nutrition
M. RAVASSE Philippe Chirurgie infantile
M. REZNIK Yves Endocrinologie
M. ROUPIE Eric Thérapeutique
Mme THARIAT Juliette Radiothérapie
M. TILLOU Xavier Urologie
M. TOUZÉ Emmanuel Neurologie
M. TROUSSARD Xavier Hématologie
Mme VABRET Astrid Bactériologie - Virologie
M. VERDON Renaud Maladies infectieuses
M. VIADER Fausto Neurologie
M. VIVIEN Denis Biologie cellulaire
Mme ZALCMAN Emmanuèle Anatomie et cytologie pathologique
PROFESSEUR DES UNIVERSITÉS
M. LUET Jacques Éméritat jusqu’au 31/08/2018 Médecine générale
PROFESSEUR ASSOCIÉ DES UNIVERSITÉS A TEMPS PLEIN
M. VABRET François Addictologie
PROFESSEURS ASSOCIÉS DES UNIVERSITÉS A MI-TEMPS
M. de la SAYETTE Vincent Neurologie
Mme DOMPMARTIN-BLANCHÈRE Anne Dermatologie
Mme LESCURE Pascale Gériatrie et biologie du vieillissement
M. SABATIER Rémi Cardiologie
PRCE
Année Universitaire 2017 / 2018
Doyen
Professeur Emmanuel TOUZÉ Assesseurs
Professeur Paul MILLIEZ (pédagogie) Professeur Guy LAUNOY (recherche)
Professeur Sonia DOLLFUS & Professeur Evelyne EMERY (3ème cycle)
Directrice administrative Madame Sarah CHEMTOB
MAITRES DE CONFERENCES DES UNIVERSITÉS - PRATICIENS HOSPITALIERS
M. ALEXANDRE Joachim Pharmacologie clinique
Mme BENHAÏM Annie Biologie cellulaire
M. BESNARD Stéphane Physiologie
Mme BONHOMME Julie Parasitologie et mycologie
M. BOUVIER Nicolas Néphrologie
M. COULBAULT Laurent Biochimie et Biologie moléculaire
M. CREVEUIL Christian Biostatistiques, info. médicale et tech. de communication
Mme DEBRUYNE Danièle Éméritat jusqu’au 31/08/2019 Pharmacologie fondamentale
Mme DERLON-BOREL Annie Éméritat jusqu’au 31/08/2020 Hématologie
Mme DINA Julia Bactériologie - Virologie
Mme DUPONT Claire Pédiatrie
M. ÉTARD Olivier Physiologie
M. GABEREL Thomas Neurochirurgie
M. GRUCHY Nicolas Génétique
M. GUÉNOLÉ Fabian sera en MAD à Nice jusqu’au 31/08/18 Pédopsychiatrie
M. HITIER Martin Anatomie - ORL Chirurgie Cervico-faciale
M. LANDEMORE Gérard sera en retraite à partir du 01/01/18 Histologie, embryologie, cytogénétique
M. LEGALLOIS Damien Cardiologie
Mme LELONG-BOULOUARD Véronique Pharmacologie fondamentale
Mme LEPORRIER Nathalie Éméritat jusqu’au 31/10/2017 Génétique
Mme LEVALLET Guénaëlle Cytologie et Histologie
M. LUBRANO Jean Chirurgie générale
M. MITTRE Hervé Biologie cellulaire
M. REPESSÉ Yohann Hématologie
M. SESBOÜÉ Bruno Physiologie
M. TOUTIRAIS Olivier Immunologie
UNI V ER SI T É D E CA EN · NOR MA ND I E
MAITRES DE CONFERENCES ASSOCIÉS DES UNIVERSITÉS A MI-TEMPS
Mme ABBATE-LERAY Pascale Médecine générale
M. COUETTE Pierre-André Médecine générale
M. GRUJARD Philippe Médecine générale
M. LE BAS François Médecine générale
M. SAINMONT Nicolas Médecine générale
REMERCIEMENTS
A Madame le Pr Dompmartin-Blanchère, pour m’avoir fait l’honneur d’accepter la présidence de ce jury. Je vous remercie pour l’attention que vous avez portée à mon travail et vos bons conseils.
A Madame le Dr Acher, pour avoir accepté de prendre la direction de cette thèse. Je vous remercie de votre disponibilité. Veuillez trouver ici le témoignage de mon respect le plus profond et de ma reconnaissance.
A Monsieur le Dr Le Bas, pour avoir accepté de juger cette thèse. Pour votre investissement dans la formation des internes de médecine générale. Veuillez trouver ici l’expression de mon respect.
A Monsieur le Dr Grujard, pour avoir accepté de juger cette thèse. Pour votre soutien et votre investissement dans la formation des internes de médecine générale. Veuillez trouver ici l’expression de mon respect et de ma reconnaissance.
A Monsieur le Dr Creveuil, pour votre aide à l’élaboration des statistiques de cette thèse et vos conseils.
A mes Maîtres de stage, à tous les médecins et aux équipes paramédicales rencontrés au cours de mes études et stages, pour avoir participé à ma formation et motivé mon engagement.
ABREVIATIONS
AMM : Autorisation de Mise sur le Marché CIL : Correspondant Informatique et Libertés
CNIL : Commission Nationale de l’Informatique et des Libertés CNOM : Conseil National de l’Ordre des Médecins
DA : Dermatite Atopique
DC : Dermocorticoïde
DRCI : Délégation Recherche Clinique et Innovation
DUMG : Département Universitaire de Médecine Générale
FLG : Filaggrine
FNH : Facteur Naturel d’Hydratation
IFN-g : Interféron gamma
IgE : Immunoglobuline de type E
IL : Interleukine
LT : Lymphocytes T
PAM : Peptides Antimicrobiens
PAMPs : Motif moléculaire associé aux pathogènes (Pathogen Associated Molecular
Pattern
PIE : Pertes Insensibles en Eau
PRRs : Récepteurs de reconnaissance de motifs moléculaires (Pathogene Recognition
Receptors)
SFD : Société Française de Dermatologie
TNFa : Tumor Necrosis Factor a
UBRC : Unité de Biostatistique et Recherche Clinique
INDEX DES FIGURES
Figure 1 : Représentation schématique de la peau. ...5
Figure 2 : Représentation schématique de l’épiderme. ...7
Figure 3 : Métabolisme de la filaggrine. ...10
Figure 4 : Le rôle central de la filaggrine. ...10
Figure 5 : La différenciation des lymphocytes T naïfs en lymphocytes T auxiliaires dits helper et profils respectifs de sécrétion de cytokines ...14
Figure 6 : Immunité adaptative dans la DA ...16
Figure 7 : Dermatite atopique du nourrisson. ...21
Figure 8 : Dermatite atopique de l’enfant. ...21
Figure 9 : Topographie des lésions de DA chez le nourrisson, l’enfant et l’adulte. ...22
Figure 10 : Eczéma herpeticum (syndrome de Kaposi-Juliusberg) ...26
Figure 11 : Diagramme de flux des données recueillies. ...37
Figure 12 : Répartition des âges des médecins de l’échantillon et de la population. ...38
Figure 13 : Secteurs d’activité des médecins de l’échantillon ...39
Figure 14 : Répartition des classes de DC utilisés dans la poussée de DA en fonction de l’âge et de la région à traiter. ...42
INDEX DES TABLEAUX
Tableau 1 : Critères diagnostiques de Hanifin et Rajka (1980)...23
Tableau 2 : Critères diagnostiques de la United Kingdom Working Party (1994) ...24
Tableau 3 : Répartition du nombre d’applications quotidiennes de DC. ...41
Tableau 4 : Durée de traitement de la phase d’attaque de la poussée de DA...41
Tableau 5 : Quantité de DC prescrite selon le nombre de tubes...42
Tableau 6 : Mesures d’éducation thérapeutique pratiquées au sein de l’échantillon. ...43
Tableau 7 : Craintes des effets indésirables chez les médecins généralistes ne prescrivant pas de DC en première intention en cas de poussée de DA. ...44
Tableau 8 : Craintes des effets indésirables chez les médecins généralistes prescrivant un DC en première intention en cas de poussée de DA. ...45
Table des matières
INTRODUCTION ...1
PREMIERE PARTIE : RAPPELS GENERAUX SUR LA DERMATITE ATOPIQUE ...4
1. Définitions ... 5
2. Rappels concernant la peau ... 5
3. Physiopathologie ... 8
a. La dysfonction de la barrière épidermique ... 9
i. La filaggrine ... 9
ii. Facteurs génétiques ... 11
iii. Conséquences sur la barrière épidermique ... 12
b. Anomalies immunitaires ... 12
i. Rappel sur l’immunité innée et adaptative ... 12
ii. Immunité et dermatite atopique ... 14
c. Microbiote ... 16
4. Épidémiologie ... 17
a. Histoire naturelle ... 17
b. Prévalence ... 17
5. Diagnostic positif ... 18
a. Chez le nourrisson (jusqu’à 2 ans) ... 20
b. Chez l’enfant (après 2 ans) ... 20
c. Chez l’adolescent et l’adulte ... 20
6. Diagnostic différentiel ... 24
a. Chez le nourrisson ... 24
b. Chez l’enfant, l’adolescent et l’adulte... 24
7. Explorations complémentaires ... 24
8. Complications ... 25
a. Surinfections cutanées ... 25
i. Bactériennes ... 25
ii. Virales ... 26
b. Dermatite de contact (eczéma de contact) ... 26
c. Retard de croissance ... 27
d. Complications ophtalmologiques ... 27
9. Traitement ... 27
a. Information et éducation thérapeutique ... 27
b. Réalisation pratique du traitement pour le médecin généraliste ... 28
i. Traitement de la poussée ... 28 1. Dermocorticoïdes ... 28 a. Choix ... 28 b. Prescription ... 29 c. Effets indésirables ... 29 2. Autres ... 29
ii. Traitement d’entretien : les émollients ... 30
c. Les thérapeutiques du dermatologue ... 30
ii. Photothérapie ... 30
iii. Traitements systémiques... 30
iv. Thérapeutiques à venir... 31
DEUXIEME PARTIE : MATERIEL ET METHODE ...32
1. Type d’étude... 33
2. Population étudiée ... 33
3. Questionnaire ... 34
4. Éthique ... 35
5. Analyse statistique des données ... 35
TROISIEME PARTIE : RESULTATS ...36
1. Recueil des données ... 37
2. Caractéristiques socio-démographiques ... 37
a. Données du Conseil national de l’Ordre des Médecins (CNOM) ... 37
b. Âge et sexe ... 38
c. Modalités d’exercice ... 38
3. Concernant la dermatite atopique ... 39
a. Prescription de dermocorticoïdes ... 39
b. Modalités de prescription des DC ... 40
c. Éducation thérapeutique ... 43
d. Traitements adjuvants ... 43
i. Émollients ... 43
ii. Autres thérapeutiques et modalités de prise en charge ... 43
e. Craintes et freins à l’utilisation des dermocorticoïdes ... 44
i. Médecins ne prescrivant pas de DC en première intention en cas de poussée de DA... 44
ii. Médecins prescrivant des DC en première intention en cas de poussée de DA ... 45
iii. Totalité de l’échantillon ... 45
QUATRIEME PARTIE : DISCUSSION ...47
1. Forces et faiblesses de l’étude. ... 48
a. Le questionnaire ... 48
b. L’échantillon ... 48
2. Synthèse des principaux résultats et confrontation aux données de la littérature... 49
a. Démographie de l’échantillon et modalités d’exercice ... 49
b. Prescription de dermocorticoïdes ... 49
c. Modalités de prescription des DC en première intention ... 51
d. Mesures adjuvantes ... 52
i. Éducation thérapeutique ... 52
ii. Émollients ... 53
CONCLUSION ...54
ANNEXES ...63
Annexe 1 : Le SCORAD ... 63
Annexe 2 : Le PO-SCORAD ... 64
Annexe 3 : Classification internationale des dermocorticoïdes ... 65
Annexe 4 : Questionnaire ... 66
La dermatite atopique (DA), ou eczéma atopique, est une dermatose chronique touchant principalement l’enfant. Elle cède progressivement avant l’adolescence, bien qu’il existe des formes persévérantes chez l’adulte. (1)
Elle entre dans le cadre de l’atopie, dont elle est une des manifestations cliniques, au même titre que l’asthme et la rhinite allergique entre autres.
Cette pathologie évolue par phases de poussées inflammatoires aiguës, entrecoupées de phases de rémission.
Le traitement de la DA va donc consister en la prise en charge à la fois des poussées, mais également des phases de rémission ; le traitement d’entretien permettant de prévenir les récurrences.
Organisée en 2004, la conférence de consensus de la Société Française de Dermatologie (SFD) relative à la prise en charge de la DA de l’enfant a regroupé des dermatologues, pédiatres, allergologues, ainsi que des médecins généralistes. A l’issue de cette conférence, les dermocorticoïdes (DC) ont été reconnus comme étant la pierre angulaire du traitement de première intention de la poussée inflammatoire. (2)
Une enquête nationale d’intentions de pratique, réalisée en 2004 afin de préparer cette conférence, montrait que seuls 28 % des médecins généralistes prescrivaient un DC en première intention pour traiter la poussée inflammatoire de DA. (3)
De même, une étude américaine de grande échelle montrait que 52 % des médecins, toutes spécialités confondues, prescrivaient des DC dans la DA. Il a également été mis en évidence que les médecins généralistes en prescrivaient également moins que les dermatologues. (4)
L’objectif principal de cette étude est de déterminer si, 13 ans après la publication des recommandations de la conférence de consensus, les DC font bien partie de la thérapeutique de première intention dans la dermatite atopique chez les médecins généralistes du Calvados, et d’en décrire les modalités de prescription.
Les objectifs secondaires ont pour objet l’étude des modalités adjuvantes de traitement utilisées et de déterminer les éventuels obstacles à la prescription des DC.
Une première partie présentera un rappel général de la dermatite atopique, comprenant la physiopathologie, l’épidémiologie, les éléments diagnostics et le traitement de
la DA. La suite de notre travail présentera l’étude avec, dans l’ordre, le matériel et méthode utilisés, puis les résultats obtenus et, enfin, une dernière partie de discussion des résultats.
Première partie : Rappels
généraux sur la dermatite
1. Définitions
La dermatite atopique (DA), ou eczéma atopique, est une dermatose inflammatoire chronique, survenant sur un terrain atopique. L’évolution naturelle se fait de façon paroxystique par épisodes de poussées aiguës, entrecoupées de périodes de rémission.
L’atopie est une prédisposition, personnelle et/ou familiale d’origine génétique, du système immunitaire, à produire des anticorps de type IgE lors de l’exposition à des allergènes de l’environnement. Elle a pour traduction clinique plusieurs pathologies comme la dermatite atopique, l’asthme, la rhinite et la conjonctivite allergique, ainsi que les allergies alimentaires. Toutes ces manifestations de l’atopie peuvent être associées. (2)
2. Rappels concernant la peau
La peau se compose de trois couches principales : l’épiderme, le derme et l’hypoderme.
Figure 1 : Représentation schématique de la peau.
Démarchez M. L’épiderme et la différenciation des kératinocytes [Internet]. Biologie de la peau. 2015 [cité 28 janv 2018]. Disponible sur:
L’épiderme, couche superficielle de la peau et directement en contact avec l’environnement extérieur, est un épithélium pluristratifié, kératinisé, squameux, non vascularisé.
Il est composé de quatre types cellulaires principaux : (6)
- Les kératinocytes qui synthétisent la kératine. Leur cycle de vie dure 28 jours, migrant de la profondeur (couche basale) vers la surface de l’épiderme (couche cornée) où ils se transforment en cornéocytes ;
- Les mélanocytes qui synthétisent la mélanine au sein des mélanosomes, eux-mêmes transférés aux kératinocytes environnants. Les mélanocytes sont essentiellement retrouvés dans la couche basale ;
- Les cellules de Langerhans, cellules dendritiques capables de phagocytose, sont également des cellules présentatrices d’antigènes aux lymphocytes ;
- Les cellules de Merkel, situées dans la couche basale, sont les mécanorécepteurs responsables de la sensibilité tactile fine.
La division de l’épiderme est basée sur la morphologie des kératinocytes migrant vers la surface.
On distingue cinq couches dans l’épiderme, de la plus profonde à la plus superficielle : - Le stratum germinativum, ou couche basale, où prolifèrent les cellules souches
épidermiques qui se différencient en kératinocytes ;
- Le stratum spinosum, ou couche spineuse, où les kératinocytes sont hérissés de desmosomes les liant entre eux ;
- Le stratum granulosum, ou couche granuleuse, où les cellules contiennent des grains de kératohyaline qui regroupent la loricrine et la profilaggrine entre autres ;
- Le stratum lucidum, ou couche claire, uniquement présente dans les épidermes épais ; - Le stratum corneum, ou couche cornée, composée de grandes cellules, les cornéocytes, qui sont voués à desquamer. Les cornéocytes sont reliés entre eux par plusieurs éléments afin de réaliser la barrière cutanée : lipides intercornéocytaires, jonctions serrées et cornéodesmosomes.
Figure 2 : Représentation schématique de l’épiderme.
Démarchez M. L’épiderme et la différenciation des kératinocytes [Internet]. Biologie de la peau. 2015 [cité 28 janv 2018]. Disponible sur:
https://biologiedelapeau.fr/spip.php?article10. (5)
La peau est un organe dont la principale fonction est d’établir une barrière entre l’organisme et l’environnement extérieur afin de maintenir l’homéostasie.
Elle a un rôle de barrière multifonctionnelle. (7)
- Barrière hydrique, en limitant la diffusion de l’eau hors de l’organisme ou pertes insensibles en eau (PIE) grâce à la filaggrine ;
- Barrière physique, grâce à l’empilement des cornéocytes reliés entre eux par les cornéodesmosomes de la couche cornée ;
- Barrière photo-protectrice vis-à-vis des rayonnements ultra-violets grâce à la mélanine et de l’acide urocanique ;
- Barrière antimicrobienne grâce aux cellules de Langerhans et aux kératinocytes, capables de produire des peptides antimicrobiens. Ces deux types cellulaires sont producteurs de cytokines.
La peau agit également sur l’excrétion des déchets, la régulation de la température corporelle, la sensibilité tactile et la production de vitamine D. (8)
3. Physiopathologie
Il existe plusieurs formes physiopathologiques de DA, même si leur présentation clinique est considérée comme identique.
Nous distinguerons :
- La DA extrinsèque, la mieux connue sur le plan physiopathologique et la plus fréquente car elle représente environ 80 % des cas de DA. (9) C’est celle que nous traiterons dans ce travail. Elle correspond à une immunisation vis-à-vis des allergènes de l’environnement avec production de lymphocytes T Helper de type 2 (TH2) et d’IgE spécifiques. (10)
- La DA intrinsèque, correspondant à une DA sans aucun terrain atopique associé, est moins bien connue sur le plan physiopathologique. Il est cependant bien établi que la DA intrinsèque requière également la mise en jeu des lymphocytes TH2, sans qu’il soit toutefois possible de retrouver une élévation des IgE totaux ou des IgE spécifiques. (11) Plusieurs hypothèses pathogéniques sont évoquées :
§ DA par hypersensibilité retardée à des allergènes non mis en évidence par les patch tests aux allergènes. (12)
§ DA auto-immune, avec une immunisation vis-à-vis d’auto-antigènes épidermiques.
§ DA auto-inflammatoire en lien avec l’immunité innée. (13)
Quelle que soit la forme de DA, deux anomalies s’associent dans la pathogénèse de cette maladie : de la dysfonction de la barrière épidermique et celle du système immunitaire. A l’heure actuelle, l’origine physiopathologique de la DA n’a pas été établie précisément car ces deux processus sont potentiellement imbriqués. Deux théories s’opposent ainsi : la théorie
outside in fait l’hypothèse d’un défaut primaire de la barrière cutanée, entraînant une perte
d’eau trans-épidermique, d’où la xérose et une pénétration accrue des allergènes et irritants et favorisant une réponse immunitaire de type Th2. La théorie inside out, quant à elle, affirme que le principal dysfonctionnement est avant tout immunitaire, lui-même générateur d’anomalies épidermiques.
a. La dysfonction de la barrière épidermique
i. La filaggrine
La filaggrine (filament aggregating protein - FLG) est une protéine issue de la phosphorylation de la profilaggrine, elle-même stockée sous la forme de grains de kératohyaline dans les kératinocytes de la couche granuleuse.
Cette protéine a pour rôle d’agréger les filaments de kératine au sein des kératinocytes afin de former la matrice fibreuse, lors de leur migration vers la couche cornée.
Tout au long de la différenciation des kératinocytes en cornéocytes, la filaggrine va être dégradée, par l’action de protéases, en acides aminés libres : acide pyrrolidone carboxylique (PCA) et acide urocanique (UCA).
Ces acides aminés libres participent à hauteur de 50 % à l’élaboration du facteur naturel d’hydratation (FNH).
Le FNH est un complexe très hygroscopique qui permet le maintien de l’hydratation de la couche cornée. Il représente à lui seul environ 30 % de la masse sèche du stratum corneum. La présence de ces acides aminés permet également le maintien d’un pH acide dans la couche cornée, favorable au développement de la flore commensale et donnant lieu à un effet antimicrobien, notamment sur le Staphylococcus aureus.
L’UCA a par ailleurs des propriétés d’absorption des rayonnements UV-B.
La FLG a donc un rôle central au sein de l’épiderme, de la structuration de la matrice intracellulaire des cornéocytes au maintien de l’hydratation, en passant par son effet antimicrobien via les acides aminés issus de sa dégradation.
Par conséquent, une perte de fonction de cette protéine liée à une mutation génétique entraînera une limitation de son activité et donc un déséquilibre de la barrière épidermique.
Figure 3 : Métabolisme de la filaggrine.
Démarchez M. L’épiderme et la différenciation des kératinocytes [Internet]. Biologie de la peau. 2015 [cité 28 janv 2018]. Disponible sur:
https://biologiedelapeau.fr/spip.php?article10. (5)
Figure 4 : Le rôle central de la filaggrine.
D’après Brown SJ, McLean WHI. One remarkable molecule: Filaggrin. J Invest Dermatol. 2012;132(3 Pt 2):751-62. (14)
ii. Facteurs génétiques
Entre 50 et 70 % des patients atteints de DA ont un parent au premier degré atteint d’une pathologie entrant dans le cadre de l’atopie. (15)
De même, une étude sur des jumeaux a démontré que 82 % du risque de développer une DA est déterminé par les facteurs génétiques et seulement 18 % du risque par les facteurs environnementaux. Une seconde étude sur des jumeaux a déterminé qu’un jumeau monozygote d’un individu présentant une DA a un risque sept fois supérieur de développer une DA que dans la population normale et un risque trois fois supérieur pour les jumeaux dizygotes. (16) Ces chiffres permettent d’émettre l’hypothèse d’une composante génétique de la DA.
Deux groupes majeurs de gènes impliqués dans la DA ont été identifiés : des gènes codant pour des protéines participant à la structure de l’épiderme (dont la filaggrine) et des gènes liés à l’immunité innée et adaptative que nous aborderons plus loin.
Depuis 2006, plusieurs études ont permis de mettre en évidence de nombreuses mutations type « perte de fonction » ou « non-sens » de la filaggrine. (17)(18).
Ces mutations aboutissent à la diminution ou l’abolition de production de la protéine active, sur le plan quantitatif et/ou qualitatif.
Ceci étant, selon les études, seuls 15 à 50 % des patients atteints de DA présentent une mutation hétérozygote du gène de la filaggrine.(19) Les mutations homozygotes sont responsables de l’ichtyose vulgaire. Cependant, la présence d’une mutation hétérozygote multiple par trois le risque d’apparition d’une DA. (17)
Il est donc très probable que des phénomènes épigénétiques altèrent la transcription du gène de la filaggrine pour aboutir à un défaut de la barrière épidermique chez les patients ne présentant pas de mutation, mais atteints de DA. (20)
La mutation du gène de la filaggrine est donc un facteur nécessaire mais non suffisant pour développer la maladie.
En 2009, une revue de la littérature avait retrouvé 111 études rapportant 81 gènes probablement impliqués dans la DA. Enfin, pour 46 d’entre eux, une association directe avec la DA a été prouvée. (21)
iii. Conséquences sur la barrière épidermique
La première conséquence de la perte de fonction de la filaggrine a lieu au niveau de la couche cornée. L’adhésion des filaments intermédiaires de la kératine sera limitée, perturbant ainsi la constitution de la matrice intracellulaire. Cette dernière étant moins stable, il en résulte une augmentation de la perméabilité de la couche cornée, prédisposant à la pénétration d’agents irritants et d’allergènes. (22)
La seconde conséquence est la diminution du taux d’acides aminés libres UCA et PCA, mais aussi des protéases responsables de leur formation. (23)
Ainsi, il en résultera une diminution du FNH, induisant elle-même une hausse des PIE et une baisse de l’hydratation cutanée des couches profondes de l’épiderme.
Cependant, même avec une diminution des taux d’UCA et de PCA, il n’y aura pas de modification du pH épidermique comme nous aurions pu le supposer, en raison de phénomènes compensatoires impliquant les lipides cutanés. (24)
Indirectement, le grattage, secondaire au prurit, participe également à la pénétration des molécules en contact direct avec la peau en modifiant physiquement la cohésion des kératinocytes.
Tous ces éléments participent donc à la fragilisation de la barrière épidermique face aux antigènes de l’environnement et constituent un premier pas vers la DA.
b. Anomalies immunitaires
i. Rappel sur l’immunité innée et adaptative
La réponse immunitaire se déclenche parce que le système immunitaire reçoit des signaux de « danger » et que certaines cellules sont capables de reconnaître des motifs moléculaires associés aux pathogènes (PAMPs), tandis que d’autres reconnaissent spécifiquement des antigènes du non-soi. Pour ce faire, l’organisme dispose de deux types d’immunité : l’innée et l’adaptative.
L’immunité innée correspond à une réponse d’action immédiate, non spécifique de l’agent pathogène, reposant sur une distinction globale du soi et du non-soi au travers de
récepteurs, les récepteurs de reconnaissance de motifs moléculaires (PRRs), capables de reconnaître les PAMPs.
L’immunité adaptative est spécifique de l’antigène, car les lymphocytes, cellules-clés de cette immunité, portent un seul type de récepteur capable de reconnaître un déterminant antigénique.
L’immunité innée sert de première ligne de défense contre l’invasion des agents pathogènes en agissant rapidement, de manière non spécifique, avant la mise en œuvre de l’immunité adaptative, plus spécifique et durable.
Les acteurs de l’immunité innée sont :
- Les cellules de l’inflammation vasculaire qui produisent les signes classiques de l’inflammation (rougeur, chaleur, tuméfaction locale). Dans le sang, ce sont les polynucléaires basophiles, dans les tissus, ce sont les mastocytes.
- Les cellules capables de phagocytose : les polynucléaires neutrophiles, les monocytes qui, en traversant la paroi vasculaire, évoluent en macrophages et les cellules dendritiques.
- Les cellules tueuses qui regroupe les macrophages, les polynucléaires éosinophiles et les cellules Natural Killer (NK).
Les acteurs de l’immunité adaptative sont avant tout les lymphocytes T et B.
Le précurseur natif des LT, le LT CD4+ naïf, est activé par une cellule présentatrice d’antigène (cellule dendritique par exemple), avant d’évoluer en LTh0 et de proliférer en plusieurs lignées distinctes en fonction des cytokines environnantes. Les deux lignées qui vont surtout nous intéresser dans le cadre de l’atopie, sont les voies Th1 et Th2.
Sous l’action d’IL-4, les LTh0 évoluent en LTh2 et sous l’action d’IL-12, en LTh1.
La voie des LTh1 ou voie Th1, réponse immunitaire à médiation cellulaire, va permettre la sécrétion d’IL-2 et d’IFN-g qui activent les macrophages et les polynucléaires neutrophiles, ainsi que les LT cytotoxiques. L’IFN-g inhibe la voie Th2.
La voie des LTh2 ou voie Th2, réponse immunitaire à médiation humorale, va induire la production d’IL-4, d’IL-5 et d’IL-13 qui va permettre la coopération des LT et des lymphocytes B qui synthétisent les IgE, ainsi que le recrutement des polynucléaires éosinophiles et
basophiles. L’IL-4 inhibe la voie Th1 et, on le sait depuis peu, une autre voie de différenciation des LT, la voie Th17. (8) L’IL-4 et l’IL-13 inhibent aussi l’expression de protéines de la barrière cutanée (FLG, loricrine, involucrine), ainsi que des PAM. (25)(26)
Figure 5 : La différenciation des lymphocytes T naïfs en lymphocytes T auxiliaires dits helper et profils respectifs de sécrétion de cytokines
D’après Boschetti G, et al. Réponses immunitaires au cours des MICI : implication de l’axe IL-23/Th17. Hépato-Gastro Oncol Dig. 2012;19(6):446-54. (27)
La DA présente des caractéristiques immunologiques à la fois d’hypersensibilité immédiate de type I (médiée par les IgE), et d’hypersensibilité retardée de type IV médiée par les lymphocytes T.
L’hypersensibilité de type I résulte d’une réponse excessive de la voie Th2, tandis que l’hypersensibilité de type IV résulte, elle, d’une réponse excessive de la voie Th1.
ii. Immunité et dermatite atopique
Concernant l’immunité innée :
Dans le tissu épidermique, les kératinocytes sont les principales cellules porteuses de PRRs dont font partie les Toll-Like Receptors (TLR), mais les cellules de Langerhans, les
mastocytes et les macrophages en sont également porteurs. Une diminution de l’expression de TLR2 a été démontrée dans les kératinocytes et les monocytes de patients atopiques et deux mutations TLR2 ont été identifiées dans la DA. (28)(29) Par ailleurs, il a été démontré que la voie de signalisation de TLR2 permet d’augmenter la production de PAM. (30)
Concernant l’immunité adaptative :
Les cytokines de la voie Th2 (IL-4, IL-5 et IL-13) sont essentielles dans la réponse immunitaire anti-infectieuse et dans la physiopathologie de la DA où elles sont surexprimées. Elles vont également auto-amplifier la différenciation des LT vers la voie Th2 par rétrocontrôle positif.
L’IL-4 et l’IL-13 sont également responsables d’une stimulation de l’inflammation en favorisant la migration tissulaire des polynucléaires éosinophiles, des lymphocytes T et B. Ces derniers vont sécréter d’autant plus d’IgE qui vont se fixer sur les récepteurs des mastocytes et des polynucléaires basophiles. Ceux-ci, lorsqu’ils sont en contact avec un allergène vont donc dégranuler.
L’IL-4 et l’IL-13 conduisent à une diminution de l’expression de la FLG dans les kératinocytes, mais aussi d’autres protéines de la barrière, à savoir la loricrine et l’involucrine, ceci augmentant la perméabilité de l’épiderme aux allergènes et agents pathogènes. (31)
D’autres voies de différenciation des LT sont également incriminées dans la pathogénèse de la DA. Dans les lésions aiguës, il existe une surexpression de la voie Th2, mais aussi de la voie Th17 et Th22. Toutes deux s’atténuent dans les lésions chroniques. (32)
L’implication de Th1 associée à la production d’IFN-g tend à être plus notable dans les lésions de DA chronique.
Figure 6 : Immunité adaptative dans la DA
D’après Gittler JK, et al. Progressive activation of Th2/Th22 cytokines and selective epidermal proteins characterizes acute and chronic atopic dermatitis. J Allergy Clin Immunol.
2012;130(6):1344-54. (33)
c. Microbiote
Le tissu cutané varie grandement selon les localisations topographiques, et chaque région cutanée possède son propre ensemble de microorganismes commensaux. La bactérie la plus représentée au sein du microbiote cutané aérobie est Staphylococcus epidermidis (S.
epidermidis) (> 90 %). Cette dernière, tout comme les kératinocytes, est productrice de
peptides antimicrobiens (AMP) qui possèdent une activité bactéricide, notamment contre
Chez 90 % des patients atteints de DA, il existe une colonisation par S. aureus, alors que seuls 5 % de la population générale sont colonisés, 60 % ne le sont que de façon intermittente et 20 % n’en sont pas porteurs. (35)(36)(37)
La colonisation cutanée par S. aureus amplifie l’inflammation cutanée, aggravant les symptômes de DA. (38)
Ce phénomène est lié, d’une part, à la libération par S. aureus d’une exotoxine qui active la prolifération des LT, la production d’IL-31 et d’IL-22, et d’autre part à la production d’une protéase à sérine, connue pour dégrader la barrière épidermique. (39)(40)
4. Épidémiologie
a. Histoire naturelle
L’épidémiologie de la DA a beaucoup évolué au cours des dernières décennies. Il était classiquement admis qu’il s’agissait principalement d’une maladie de l’enfant. Elle commence communément dans les premiers mois de vie, généralement à partir de l’âge de trois mois. Il était reconnu que la guérison est obtenue vers l’âge de deux ans dans 50 % des cas. (2) On considère qu’elle va nettement s’améliorer après l’adolescence dans 70 % des cas. (41)(42)
Or, plusieurs études, réalisées au cours des années 2000, ont mis en évidence l’existence de formes persistantes de DA chez l’adulte. (43)
Les résultats de ces études montrent que les formes persistantes à l’âge adulte sont plus souvent le fait de formes sévères. De plus, elles mettent en évidence que l’âge de début de la maladie influencerait le risque de sa persistance au-delà de la petite enfance. Les enfants ayant développé la maladie avant deux ans auraient un risque moins important de persistance à l’âge adulte. (44)
Malheureusement, des données provenant d’autres études semblent contradictoires et les facteurs prédictifs de la persistance ne sont pour le moment pas établis.(41)
b. Prévalence
Du fait de l’absence de test objectif ou de marqueur biologique permettant un diagnostic précis de la DA, il est difficile d’établir l’épidémiologie de cette pathologie. De plus,
de nombreux termes faisant référence à la DA sont utilisés par les auteurs (« eczéma atopique », « eczéma », « eczéma infantile »), le développement de questionnaires fiables et reproductibles est limité pour les études épidémiologiques, ce qui impacte logiquement la comparaison des résultats. (45)
Selon les études et méthode d’évaluation de la DA, les données récentes de prévalence chez l’enfant aux États-Unis varient entre 6 et 12,98 %. Il était également noté qu’elle avait une tendance à la hausse entre 1997 et 2010, passant de 8 à 12 %. (46)
Cette augmentation de la prévalence est confirmée par une revue systématique, concernant les taux de DA et leur évolution entre 1990 et 2010, en Afrique, en Asie de l’Est et en Europe occidentale. (47)
L’Étude Internationale de l’Asthme et des Allergies de l’Enfant (International Study of
Asthma and Allergies in Childhood – ISAAC) a permis de mesurer les prévalences de la DA dans
de nombreux pays sur de très grands groupes de patients en utilisant les mêmes critères diagnostiques. Elle rapporte de nombreuses variations géographiques : de 0,9 % en Inde jusqu’à 22,5 % en Équateur, pour les enfants de six à sept ans et de 0,2 % en Chine jusqu’à 24,5 % en Colombie, pour les enfants de treize à quatorze ans. (48)
Chez l’adulte, avant les années 2000, la prévalence de la DA était estimée entre 2 % et 6,9 % selon les études. Les données américaines de la National Health Interview Survey (NHIS), retrouvaient une prévalence de la DA à l’âge adulte de 10,2 % en 2010 et 7,2 % en 2012. (49)(50)
Très récemment, une méta-analyse a mis en évidence l’absence de décroissance de la prévalence entre l’enfance et le début de l’âge adulte. (51)
5. Diagnostic positif
Le diagnostic de dermatite atopique est avant tout clinique.
Il est nécessaire de rechercher, par l’interrogatoire, des arguments en faveur d’un terrain atopique. A savoir : l’existence d’une rhinite allergique, d’un asthme, d’une conjonctivite allergique ou d’une allergie alimentaire, chez le patient, mais aussi dans l’entourage.
L’eczéma est la lésion cutanée élémentaire. Il s’agit de lésions érythémateuses et vésiculeuses, prurigineuses, à bordure émiettée.
Les lésions évoluent en quatre phases :
- Phase érythémateuse : présence de xérose débutante puis apparition d’un érythème inflammatoire à contours émiettés, recouvert de micro-papules ;
- Phase vésiculeuse où les papules évoluent en vésicules ; - Phase suintante, liée à la rupture des vésicules ;
- Phase croûteuse, intervenant après l’assèchement des lésions, plus ou moins accompagnée d’œdème.
La topographie et l’aspect des lésions sont variables selon l’âge. Nous décrirons ces modifications plus loin dans ce chapitre.
Le prurit est le signe clinique constant de la DA, quel que soit l’âge. Celui-ci est parfois difficile à mettre en évidence, notamment chez le nourrisson.
Des critères diagnostiques ont été proposés par Hanifin et Rajka en 1979 (tableau 1), puis simplifiés et validés en 1994 par le United Kingdom Working Party (tableau 2). (2)
Afin de faciliter l’évaluation de la gravité de la poussée de DA par les médecins, un score clinique nommé SCORAD (SCORing of Atopic Dermatitis) a été mis au point par un groupe d’experts, le European task force on atopic dermatitis en 1993. (52). Ce score est détaillé en annexe 1.
Un score d’auto-évaluation, le PO-SCORAD, a été établi en 2011 par le même groupe d’experts. Son objectif était de permettre au patient et son entourage d’évaluer l’évolution de leur DA. (53) Ce score est détaillé en annexe 2. (54)
Un second score d’évaluation, l’EASI (Eczema Area and Severity Index) est également utilisé.
a. Chez le nourrisson (jusqu’à 2 ans)
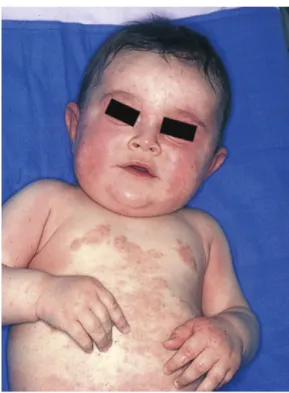
L’atteinte est symétrique, prédominant sur les zones convexes du visage et des membres, le tronc, parfois également au niveau des plis, mais épargnant le siège (voir figure 7).
La xérose est parfois déjà associée.
Le prurit du nourrisson peut être difficile à reconnaître et prendre la forme d’une agitation ou de troubles du sommeil.
b. Chez l’enfant (après 2 ans)
Les lésions prédominent surtout au niveau des plis de flexion : cou, plis rétro-auriculaires, coudes, creux poplités, mais aussi aux mains et poignets, aux chevilles et mamelons (voir figure 8).
La xérose est plus nette que chez le nourrisson.
Les poussées aiguës vésiculeuses deviennent plus rares et moins intenses. L’épaississement de la peau, ou lichénification, est plus présent, en raison du caractère chronique du prurit.
c. Chez l’adolescent et l’adulte
Le prurit peut être permanent.
La lichénification et la xérose sont particulièrement présentes.
Figure 7 : Dermatite atopique du nourrisson.
D’après CEDEF. Item 183 – UE 7 Hypersensibilités et allergies cutanéo-muqueuses chez l’enfant et l’adulte. Ann Dermatol Vénéréologie. 1 juin 2015;142(Suppl 2):S145-66. (15)
Figure 8 : Dermatite atopique de l’enfant.
D’après 56. Wallach D, Farhi D. Guide pratique de dermatologie. 3e éd. Elsevier, Masson. Issy- les-Moulineaux; 2007. (Médiguides). (55)
Figure 9 : Topographie des lésions de DA chez le nourrisson, l’enfant et l’adulte.
D’après Lamirand M, Vuitton DA. La dermatite atopique : savoirs et expérience. Arnette. Rueil-Malmaison; 2006. (56)
Tableau 1 : Critères diagnostiques de Hanifin et Rajka (1980)
Critères majeurs (au moins 3) :
- Prurit
- Aspect et localisation typiques : • Lichénification des plis (adultes)
• Atteinte du visage et des faces d’extension des membres (nourrissons et enfants)
- Dermatite chronique
- Antécédents personnels ou familiaux d’atopie (asthme, rhinite allergique, dermatite atopique)
Critères mineurs (au moins 3) :
- Xérose
- Ichtyose / hyperlinéarité des paumes / kératose pilaire
- Positivité des tests cutanés d’hypersensibilité immédiate (type I) - Élévation des IgE sériques
- Début précoce
- Tendance aux infections cutanées (staphylocoque, herpès) / Déficit de l’immunité cellulaire
- Tendance aux dermites non spécifiques des mains et des pieds - Eczéma des mamelons
- Chéilite
- Conjonctivite récidivante
- Pli sous orbitaire de Dennie-Morgan - Kératocône
- Cataracte antérieure sous-capsulaire - Pigmentation orbitaire
- Pâleur du visage / érythème du visage - Pityriasis alba
- Plis cervicaux antérieurs - Prurit à la sueur
- Intolérance à la laine et aux solvants des lipides - Accentuation périfolliculaire
- Intolérance alimentaire
- Évolution influencée par des facteurs environnementaux et émotionnels - Dermographisme blanc / blanchiment retardé
Tableau 2 : Critères diagnostiques de la United Kingdom Working Party (1994)
Critère obligatoire :
Dermatose prurigineuse ou parents rapportant que l’enfant se gratte ou se frotte
Associé à trois ou plus des critères suivants :
- Antécédents personnels de dermatite des plis de flexion (plis des coudes, creux poplités, face antérieure des chevilles, cou) et/ou des joues chez les enfants de moins de 10 ans.
- Antécédents personnels d’asthme ou de rhinite allergique (ou antécédent de maladie atopique chez un parent au premier degré chez l’enfant de moins de 4 ans).
- Antécédents de peau sèche généralisée au cours de la dernière année.
- Eczéma des grands plis visible ou eczéma des joues, du front, et des convexités des membres chez l’enfant au-dessous de 4 ans.
- Début des signes cutanés avant l’âge de 2 ans (critère utilisable chez les plus de 4 ans uniquement).
(58)
6. Diagnostic différentiel a. Chez le nourrisson
Les diagnostics différentiels chez le nourrisson font référence aux autres dermatoses de type eczématiforme, à savoir la dermatite séborrhéique dont les lésions sont érythémato-squameuses mais non prurigineuses, ainsi que la gale.
b. Chez l’enfant, l’adolescent et l’adulte
Les pathologies à éliminer dans cette population sont essentiellement la dermatite ou eczéma de contact dont les lésions sont vésiculeuses, de topographie typique, la gale et le psoriasis.
7. Explorations complémentaires
Le diagnostic positif de la DA est avant tout clinique, aucun examen complémentaire n’est nécessaire pour le confirmer.
Cependant, un bilan allergologique peut être demandé dans les indications limitées suivantes :
- Suspicion d’allergie alimentaire associée :
o En cas de dermatite atopique grave et/ou de résistance à un traitement bien conduit ;
o En cas de stagnation ou de cassure des courbes staturo-pondérales ;
o En cas de signes évocateurs d’une allergie alimentaire après ingestion ou contact avec un aliment.
Dans ce cas, les explorations allergologiques comprendront des
prick-tests cutanés, des dosages des IgE sériques spécifiques (Phadiatopâ et Trophatopâ), d’éventuels tests de provocation orale et des tests épicutanés sous la forme de patch-tests aux allergènes.
- Suspicion d’allergie respiratoire associée :
o En cas d’asthme, de rhinite ou de rhinoconjonctivite associés.
Les explorations se feront à l’aide de prick-tests et de dosages des IgE sériques spécifiques.
- Suspicion d’eczéma de contact
o En cas d’eczéma de zones inhabituelles dans la DA, ou de DA ne répondant pas au traitement.
Dans ce cas, les explorations se feront à l’aide de tests épicutanés. (15)
8. Complications
a. Surinfections cutanées
i. Bactériennes
Comme nous l’avons décrit dans la physiopathologie, les modifications du microbiome cutané chez les patients atteints de DA induisent progressivement une colonisation de la peau par Staphylococcus aureus (S. aureus).
La surinfection cutanée prend donc la forme d’un impétigo avec présence de lésions pustuleuses et croûteuses sur les lésions d’eczéma.
Celle-ci est majoritairement due à S. aureus, mais les différents streptocoques peuvent également être impliqués. (59)
ii. Virales
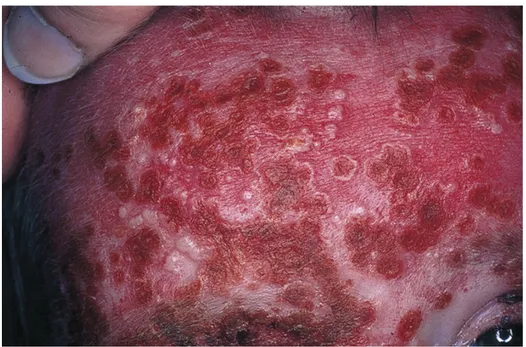
La surinfection des lésions par l’Herpès Virus de type 1 (HSV1) est responsable de l’eczéma herpeticum dont les formes graves sont appelées syndrome de Kaposi-Juliusberg.
L’examen clinique met en avant une fièvre associée à une altération de l’état général dans un contexte d’éruption de vésiculo-pustules ombiliquées (déprimées en leur centre).
La prise en charge doit être hospitalière afin de débuter un traitement antiviral et de surveiller l’évolution des lésions. Le risque est dominé par l’atteinte viscérale, notamment oculaire, pulmonaire ou neurologique.
Ainsi, il est nécessaire de rechercher la notion d’un portage d’herpès dans l’entourage afin de prévenir le patient ou ses parents du risque de surinfection par HSV1.
Figure 10 : Eczéma herpeticum (syndrome de Kaposi-Juliusberg)
D’après CEDEF. Item 183 – UE 7 Hypersensibilités et allergies cutanéo-muqueuses chez l’enfant et l’adulte. Ann Dermatol Vénéréologie. 2015;142(Suppl 2):S145-66. (15)
b. Dermatite de contact (eczéma de contact)
La prévalence de l’eczéma de contact est importante chez les sujets atteint de DA en raison d’une pénétration plus aisée des allergènes liée à la fragilité de la peau.
Ce diagnostic doit être évoqué devant l’absence de réponse au traitement ou dans les cas de localisation inhabituelle des lésions.
c. Retard de croissance
Un retard de croissance peut être associé à une DA sévère.
d. Complications ophtalmologiques
De rares complications ophtalmologiques existent dans les formes sévères de DA. Il s’agit de la kérato-conjonctivite, du kératocône et de la cataracte. (2)
9. Traitement
a. Information et éducation thérapeutique
Du fait de l’absence de traitement curatif de la DA, le traitement est symptomatique. Il va consister à réduire l’inflammation au cours des poussées à l’aide d’anti-inflammatoires locaux et à limiter les récidives grâce aux mesures hygiéniques.
L’adhésion du patient et de son entourage au projet thérapeutique est nécessaire, et doit passer par l’éducation et l’écoute.
Une bonne compréhension de la pathologie est essentielle, car nombreuses sont les idées reçues, notamment concernant l’aspect allergique de la DA.
Concernant les règles hygiéniques, les conseils à donner sont : - Habillement : limiter les textiles irritants, privilégier coton et lin ; - Limiter l’exposition au tabac (60) ;
- Pour la nuit : température fraîche dans la chambre, ne pas trop se couvrir ; - Augmenter les applications d’émollients par temps froid et sec ;
- Vacciner normalement ;
- Bain court quotidien ou douche, à l’eau tiède, avec un syndet (détergent synthétique), sans savon. (15)
De même, l’information sur les traitements est inévitable, d’autant plus avec les DC, compte tenu des idées reçues importantes et de la corticophobie des patients. (61)
Il existe en France plusieurs centres d’éducation thérapeutique, sous la dénomination « École de l’atopie », notamment à Nantes, Paris, Lille, Toulouse, Bordeaux, Angers, Tours, Lyon, Marseille.
Une étude menée par l’École de l’atopie de Lille a mis une évidence une franche amélioration du SCORAD après leur programme d’éducation thérapeutique. (62)
b. Réalisation pratique du traitement pour le médecin généraliste
i. Traitement de la poussée
1. Dermocorticoïdes
Les dermocorticoïdes sont le traitement de référence des poussées de DA. (2)
Les différents dermocorticoïdes sont répartis en quatre classes, en fonction de leur activité vasoconstrictrice, déterminée par le test de McKenzie (annexe 3). Nous utiliserons ici la classification internationale recommandée.
L’activité anti-inflammatoire des DC se traduit par plusieurs mécanismes :
- La vasoconstriction au niveau du derme avec diminution de la perméabilité capillaire ; - Diminution de la margination et de la diapédèse des leucocytes ;
- Diminution des phénomènes de phagocytose et de la libération des enzymes lysosomales ;
- Diminution de la sécrétion des cytokines. (63)
a. Choix
Le choix du DC sera fonction de plusieurs critères, à savoir l’âge du patient, la sévérité de la poussée, du site à traiter, ainsi que de son étendue. (2)
La classe 4, ou DC d’activité très forte, est contre-indiquée chez le nourrisson et le jeune enfant. Elle est contre-indiquée sur le visage, les plis et le siège quel que soit l’âge.
La classe 3, ou DC d’activité forte, est à privilégier pour le corps.
La classe 2, ou DC d’activité modérée, peut être utilisée sur le visage, les paupières, les plis et les zones génitales, y compris chez le nourrisson.
b. Prescription
La quantité de DC à appliquer doit être clairement expliquée au patient. Celle-ci doit être suffisante pour bien couvrir les lésions inflammatoires.
A titre indicatif, il existe la règle dite « de la phalangette » : la quantité de DC déposée sur la troisième phalange de l’index correspond à environ 0,5 gramme de produit et permet de couvrir une surface équivalente à deux paumes de la main.
Les crèmes sont préférées sur les lésions suintantes et les plis, les pommades sur les lésions sèches ou lichénifiées.
Une seule application quotidienne est suffisante, jusqu’à l’amélioration franche des lésions, obtenue généralement entre une et deux semaines (rémission).
Le DC peut être ensuite arrêté jusqu’à la récidive suivante, sans nécessiter de phase de décroissance des doses. Celle-ci reste possible, mais elle complique l’observance. En effet, il n’existe pas de phénomène de rebond prouvé, et l’épuisement de l’efficacité des DC ou tachyphylaxie ne semble pas réellement exister. (64)
Dans les formes modérées à sévères de DA, un traitement d’entretien par deux applications hebdomadaires de DC peut être nécessaire. (65)
La reprise du traitement sera nécessaire dès l’apparition d’une nouvelle poussée aiguë.
c. Effets indésirables
Les effets indésirables potentiels systémiques théoriques sont liés à la freination de l’axe hypothalamo-hypophysaire. Il faut noter qu’ils sont exceptionnels.
Les effets indésirables potentiels locaux, redoutés, sont eux aussi rarement observés. Ils regroupent plusieurs manifestations :
- Atrophie cutanée
- Dermatite rosacéiforme du visage
- Cataracte et glaucome induits, très rares.
2. Autres
Les antihistaminiques (anti-H1) n’ont pas d’AMM dans la DA et leur rôle adjuvant est mineur pour le traitement du prurit. Leur effet sédatif, pour ceux de première génération, est le seul bénéfice envisageable, notamment parce qu’il limite les réveils nocturnes.
De même, l’utilisation des antiseptiques et antibiotiques locaux n’a d’intérêt qu’en cas d’impétiginisation.
ii. Traitement d’entretien : les émollients
Leur rôle est de restaurer la fonction barrière cutanée et de lutter contre la xérose. Ils doivent être utilisés de façon quotidienne.
L’application des émollients ne doit pas être faite sur les lésions inflammatoires car il existe un risque de réactions d’intolérance. Leur application doit se faire sur l’ensemble de la peau en évitant les zones d’eczéma si elles sont douloureuses.
c. Les thérapeutiques du dermatologue
i. Inhibiteurs de la calcineurine topiques (immunomodulateurs
topiques)
Il existe deux molécules dans cette classe, à savoir le tacrolimus et le pimécrolimus. En inhibant la calcineurine, la prolifération des lignées de LT est également inhibée, ainsi que la production de nombres cytokines inflammatoires dont les interleukines IL-2, IL-3, IL-4, IL-12, le TNFa et l’IFN-g. (66)
Seul le tacrolimus topique (PROTOPIC) a reçu l’AMM en France. Le tacrolimus 0,03 % est utilisé chez l’enfant de deux à quinze ans et le tacrolimus 0,1 % à partir de seize ans. Le tacrolimus n’est pas remboursé chez l’enfant de moins de seize ans.
ii. Photothérapie
Les photothérapies utilisables sont la photothérapie UVB à spectre étroit et la photothérapie UVA1. La photothérapie à UVA est réservée aux adultes et enfants de plus de douze ans, en cas d’échec de la photothérapie à UVB en raison du risque carcinogène.
iii. Traitements systémiques
Plusieurs traitements systémiques sont déjà utilisés dans la DA. Il s’agit pour la plupart d’immunosuppresseurs.
On retrouve notamment le méthotrexate (MTX), régulièrement utilisé dans les DA de l’adulte bien qu’il n’ait pas d’AMM dans cette indication. Plusieurs études ont confirmé son efficacité. (67)(68)
La ciclosporine dispose en France de l’AMM dans le traitement de la DA. Son efficacité a également été démontrée à plusieurs reprises et une récente étude a mis en évidence une supériorité de la ciclosporine face au MTX. (69)
On retrouve également le mycophénolate mofetil et le mycophénolate sodique et l’azathioprine qui n’ont pas d’AMM en France.
Les corticoïdes systémiques n’ont, eux, pas leur place dans le traitement de la DA du fait de leurs effets secondaires conséquents à long terme.
iv. Thérapeutiques à venir
Avec l’avancée dans la compréhension de la physiopathologie, il est envisageable de voir apparaître des progrès considérables pour la DA de l’adulte résistante aux traitements conventionnels, comme ceux connus récemment dans le traitement du psoriasis.
Tous ces produits sont en cours d’études de phase 2 ou 3. On retrouve ainsi :
- Les inhibiteurs de la phosphodiestérase 4 topiques et systémiques ; - Les inhibiteurs de JAK ;
Deuxième partie : Matériel et
méthode
1. Type d’étude
Il s’agit d’une étude descriptive, observationnelle, de type transversal, qui au travers d’un questionnaire, réalise une enquête de pratiques auprès des médecins généralistes du Calvados, sur leur prise en charge de la dermatite atopique.
2. Population étudiée
L’Union Régionale des Médecins Libéraux (URML) de Normandie nous a fourni une liste des médecins généralistes thésés et installés dans le département du Calvados. La dernière mise à jour de cette liste n’était pas connue.
Nous avons vérifié les adresses postales, les numéros de téléphone, ainsi que les éventuelles spécialités pratiquées par les médecins présents sur cette liste, au moyen des sites Internet des Pages Jaunes et du Conseil National de l’Ordre des Médecins.
L’objectif de cette démarche était d’identifier et de supprimer de cette liste les cas suivants :
- Les médecins n’exerçant plus à l’adresse indiquée (cabinet fermé, départs en retraite), en raison d’un risque d’absence de retour du questionnaire ;
- Les médecins pratiquant une médecine alternative pouvant s’éloigner des pratiques de la médecine allopathique (homéopathie et acupuncture) ;
- Les médecins généralistes ayant un diplôme complémentaire et ne pratiquant potentiellement plus la médecine générale, à savoir :
o Les médecins vasculaires ; o Les médecins de la douleur.
Parmi les médecins urgentistes des services d’urgences privées du Calvados présents dans cette liste, seuls ceux du Centre Hospitalier Saint Martin étaient répertoriés, ainsi que seuls deux urgentistes de la Polyclinique du Parc. Par conséquent, ils n’ont pas été retenus pour l’envoi du questionnaire.
Les praticiens faisant partie de l’association SOS Médecins ont été conservés dans la liste de diffusion au motif que la médecine générale représente une partie non négligeable de leur activité quotidienne.
Au total, 654 médecins généralistes libéraux ont été identifiés dans le Calvados au sein de la liste fournie par l’URML.
81 médecins ont été exclus de la population d’étude.
La population d’étude regroupait donc 571 médecins généralistes installés dans le Calvados et référencés par l’URML.
Un échantillon aléatoire de 200 médecins généralistes a été établi par tirage au sort à l’aide du logiciel Microsoft Excel version 16.9.
3. Questionnaire
Une première version du questionnaire a été réalisée après une évaluation de la littérature existante sur la prise en charge de la dermatite atopique, plus particulièrement en médecine générale.
Celle-ci a été validée par la directrice de thèse avant d’être testée auprès de quatre médecins généralistes libéraux, issus d’un même cabinet de groupe, lors d’entretiens individuels.
Les remarques formulées au cours de ces entretiens ont été prises en compte afin d’établir une version définitive du document (questionnaire en annexe 4).
Il comportait un tronc commun de neuf questions suivies de deux bras selon la réponse à la question numéro 9. Le premier bras, si les médecins interrogés répondaient « Oui » à la question numéro 9, comportait dix questions supplémentaires. Le second bras, si les médecins interrogés répondaient « Non » à la question numéro 9, comportait trois questions supplémentaires.
Ce questionnaire a ensuite été approuvé par un médecin de l’Unité de Biostatistique et Recherche Clinique (UBRC) du Centre Hospitalier Universitaire (CHU) de Caen au cours d’une consultation méthodologique afin de valider la pertinence statistique des questions.
Le questionnaire a ensuite été envoyé le 10 janvier 2018, accompagné d’une lettre d’introduction, ainsi que d’une enveloppe de retour préaffranchie. Il était demandé aux participants de renvoyer leur questionnaire sous 14 jours.
4. Éthique
Une attestation de traitement anonyme a été établie par le Correspondant Informatique et Libertés (CIL) de l’Université de Caen Normandie en date du 31 janvier 2018. (Annexe 5)
L’auteur de l’étude ne déclare aucun conflit d’intérêt.
5. Analyse statistique des données
Les données ont été recueillies dans une feuille de calcul Excel établie selon un protocole réalisé avec le médecin de l’UBRC.
Les données qualitatives ont été résumées par des effectifs et pourcentages, l'année d'installation par sa médiane et ses quartiles. Les comparaisons de pourcentages ont été faites par des tests de khi² de Pearson ou des tests exacts de Fisher, selon les effectifs. Le seuil de significativité statistique a été défini à p < 0,05. L'analyse a été réalisée à l'Unité de Biostatistique et Recherche Clinique du CHU de Caen sous le logiciel IBM SPSSÒ, version 22.
1. Recueil des données
Les données ont été recueillies entre le 16 janvier et le 3 février 2018, soit sur une période de 19 jours. Au total, 91 enveloppes ont été reçues.
Un seul questionnaire n’a pu être traité en raison de réponses incomplètes. Nous avons obtenu un taux de participation de 45 %, sans relance.
Figure 11 : Diagramme de flux des données recueillies.
2. Caractéristiques socio-démographiques
a. Données du Conseil national de l’Ordre des Médecins (CNOM)
Selon le Service Étude Recherche et Statistique du CNOM, au premier janvier 2017, il était recensé dans le Calvados :1
- 533 médecins généralistes libéraux en exercice ;
- 37 % de femmes exerçant la médecine générale en exercice libéral ; - Répartition des âges :
§ Moins de 30 ans : 3 (1 %) ; § De 30 à 40 ans : 112 (21 %) ; § De 40 à 50 ans : 105 (20 %) ; § De 50 à 60 ans : 188 (35 %) ; § Plus de 60 ans : 125 (23 %).
1 Service Étude Recherche et Statistique du Conseil National de l’Ordre des Médecins. La démographie médicale