Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Laboratoire Signalisation et transports ioniques membranaires - STIM (Poitiers) (Diplôme National - Arrêté du 25 mai 2016)
École doctorale : Biologie-santé - Bio-santé (Limoges)
Secteur de recherche : Aspects moléculaire et cellulaire de la biologie
Présentée par : Oualid Ayad
Caractérisation fonctionnelle des cellules souches cardiaques humaines dans un but thérapeutique
Directeur(s) de Thèse : Patrick Bois, Aurélien Chatelier Soutenue le 12 décembre 2017 devant le jury
Jury :
Président Valérie Coronas Professeur des Universités, Université de Poitiers
Rapporteur Emmanuel Deval Chargé de recherche CNRS, Université de Nice-Sophia Antipolis Rapporteur Christophe Vandier Professeur des Universités, Université de Tours
Membre Patrick Bois Professeur des Universités, Université de Poitiers Membre Aurélien Chatelier Maître de conférences, Université de Poitiers
Membre Anne Aries Chercheur, Institut de recherche en hématologie et transplantion, Mulhouse
Pour citer cette thèse :
Oualid Ayad. Caractérisation fonctionnelle des cellules souches cardiaques humaines dans un but thérapeutique [En ligne]. Thèse Aspects moléculaire et cellulaire de la biologie. Poitiers : Université de Poitiers, 2017. Disponible sur Internet <http://theses.univ-poitiers.fr>
THESE
Pou l’o te tio du G ade de DOCTEUR DE L’UNIVER“ITE DE POITIER“ (Faculté des Sciences Fondamentales et Appliquées)
(Diplôme National - Arrêté du 25 mai 2016)
Ecole Doctorale : Biologie-santé
Secteur de Recherche : Aspects moléculaire et cellulaire de la biologie
Présentée par : Oualid AYAD
************************
Caractérisation fonctionnelle des cellules souches cardiaques humaines dans un but thérapeutique
************************
Directeurs de Thèse : Pr. Patrick Bois & Dr. Aurélien Chatelier
************************
Soutenue le 12 décembre 2017
De a t la Co issio d’E a e ************************
JURY
C. VANDIER Professeur, Université de Tours Rapporteur
E. DEVAL CR CNRS, IPMC, Nice Rapporteur
A. ARIES Chercheur, IRHT, Mulhouse Examinateur V. CORONAS Professeur, Université de Poitiers Examinateur A. CHATELIER MCU, Université de Poitiers Examinateur P. BOIS Professeur, Université de Poitiers Examinateur
Sommaire
1
SOMMAIRE
TABLE DES ILLUSTRATIONS ... 8
ABREVIATIONS ... 12
INTRODUCTION ... 16
Chapitre I : Cellules souches et régénération tissulaire ... 16
1 Historique ... 16
2 Propriétés des cellules souches ... 17
2.1 L’auto-renouvellement ... 17
2.2 Pouvoir de différenciation en plusieurs lignages cellulaires ... 18
3 Types et potentiels de différenciation des cellules souches humaines : ... 19
3.1 Les cellules souches embryonnaires (CSEs) : ... 20
3.1.1 Les cellules souches totipotentes : ... 20
3.1.2 Les cellules souches pluripotentes : ... 21
3.2 Les cellules souches adultes: ... 21
3.2.1 Les cellules souches hématopoïétiques (CSHs) ... 22
3.2.2 Les cellules souches mésenchymateuses (CSMs) ... 24
3.2.3 Les cellules souches du tissu adipeux ... 27
3.2.4 Les cellules progénitrices endothéliales ... 27
3.2.5 Les ellules sou hes de l’ pith liu i testi al : ... 29
3.2.6 Les ellules sou hes de l’ pide e ... 31
3.2.7 Les ellules sou hes de l’ pith liu pul o ai e ... 32
3.2.8 Les cellules souches de la cornée et de la rétine ... 33
3.2.9 Les cellules souches/progénitrices hépatiques ... 35
3.2.10 Les cellules souches neurales (CSNs) du système nerveux central ... 36
3.2.11 Les cellules souches musculaires squelettiques ... 39
3.2.12 Les cellules souches cardiaques ... 41
Chapitre II : Cellules souches et progéniteurs cardiaques ... 43
1 Nature des cellules souches cardiaques ... 43
2 Types des cellules souches cardiaques... 45
2.1 Les CSCs c-kit positives (CSC c-kit+) ... 45
2.2 Les CSCs Sca1 positives (CSC Sca1+) ... 48
2.3 Les CSCs Isl-1 positives (CSCs Isl-1+)... 50
2
2.5 Les cellules dérivées des cardiosphères (CDCs) ... 53
2.6 Les CSCs W8B2 positives (CSC W8B2+) ... 54
3 Modulateurs de la différenciation in vitro des CSCs adultes en cardiomyocytes ... 56
3.1 La 5-azacytidine ... 57
3.2 Le TGF-b: ... 58
3.3 L’a ide as o i ue : ... 59
3.4 L’a ide ti oï ue : ... 60
3.5 La dexaméthasone :... 61
3.6 L’o to i e: ... 61
Chapitre III : Physiologie des cellules souches /progéniteurs cardiaques ... 62
1 Le calcium : ... 62
1.1 Le calcium dans les cellules souches: ... 62
1.1.1 L’a ti it al i ue spo ta e da s les ellules sou hes: ... 63
1.1.2 Canaux VGCC et signalisation calciques ... 64
1.1.3 Les stocks calciques intracellulaires dans les cellules souches: ... 67
1.2 Le calcium dans les cellules souches/progéniteurs cardiaques: ... 67
2 Les canaux ioniques : ... 70
2.1 Les canaux ioniques dans les CSEs: ... 70
2.2 Les canaux ioniques dans les CSMs: ... 71
2.3 Les canaux ioniques dans les cellules souches/progéniteurs neurales: ... 72
2.4 Les canaux ioniques dans les CSCs: ... 73
3 Rôles des canaux ioniques dans la régulation de la prolifération et/ou la différenciation des cellules souches: ... 73
3.1 Prolifération ... 73
3.2 Différenciation : ... 75
POSITION DU PROBLEME ... 76
MATERIELS ET METHODES ... 78
I- Isolement et purification des CSCs W8B2+à pa ti d’ ha tillo s hu ai s d’o eillettes d oites 78 1 Isolement des CSCs W8B2+ avec la méthode des explants ... 78
2 Purification des CSCs W8B2+ ... 79
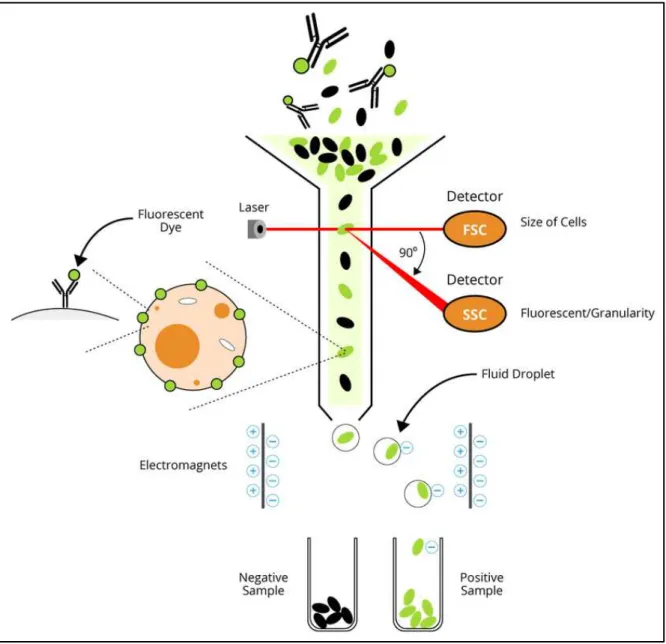
2.1 Enrichissement en CSCs W8B2+ par le système du tri cellulaire magnétique positif: ... 79
2.1.1 Principe : ... 79
2.1.2 Protocole expérimental : ... 81
2.2 Purification des CSCs W8B2+ par le système de tri cellulaire par cytométrie en flux: ... 82
2.2.1 Principe: ... 82
Sommaire
3
II- Immunophénotypage des CSCs W8B2+ ... 87
III- Conditions de culture et entretien des CSCs W8B2+ ... 88
IV- Congélation/décongélation des CSCs W8B2+ ... 89
V- Test de formation de colonies (CFU-Fs). ... 89
1 Principe : ... 89
2 Protocole expérimental: ... 89
VI- Test de prolifération par comptage cellulaire ... 90
1 Principe : ... 90
2 Protocole expérimental: ... 90
VII- Test de blessure (wound healing assay) ... 90
1 Principe : ... 90
2 Protocole expérimental : ... 91
VIII- Test de viabilité cellulaire ... 91
1 Principe : ... 91
2 Protocole expérimental: ... 92
IX- A al se du le ellulai e a e l’iodu e de p opidiu ... 92
1 Principe : ... 92
2 Protocole expérimental : ... 92
X- Immunocytochimie indirecte ... 93
1 Principe : ... 93
2 Protocole expérimental : ... 93
XI- Différenciation cardiaque in vitro des CSCs W8B2+... 94
1 Principe : ... 94
2 Protocole expérimental : ... 94
XII- Imagerie calcique ... 95
1 Principe : ... 95
2 Protocol expérimental : ... 96
XIII- RT-PCR « Reverse Transcription-Polymerase Chain Reaction » ... 98
1 Principe : ... 98
2 Protocole expérimental : ... 98
2.1 Extraction des ARNs totaux ... 99
2.1.1 Extraction des ARNs totaux à partir des CSCs W8B2+ adhérentes en culture : ... 99
2.1.2 Extraction des ARNs totaux à partir des EODHs : ... 99
2.2 Rétro-transcription ou RT (Reverse Transcription): ... 100
2.3 Amplification par PCR (Polymerase Chain Reaction) ... 100 XIV- RT-qPCR « Reverse Transcription- quantitative Polymerase Chain Reaction » en SybrGreen 101
4
1 Principe : ... 101
2 Protocole expérimental : ... 101
2.1 qPCR avec la technologie SybrGreen ... 102
2.2 RT-qPCR à haut rendement ou TLDA (TaqMan Low Density Custom Array) ... 102
2.2.1 Principe: ... 102
2.2.2 Extraction des ARNs totaux ... 102
2.2.3 Transcription inverse ou RT (Reverse Transcription): ... 103
2.2.4 qPCR avec la technologie TaqMan ... 103
XV- Western blot ... 106
1 Principe: ... 106
2 Protocole expérimental: ... 107
XVI- Patch clamp ... 108
1 Principe : ... 108
2 Protocole expérimental : ... 108
XVII- Tests statistiques ... 109
RESULTATS ... 110
Chapitre I : Isolement et caractérisation des CSCs W8B2+ ... 110
I- Isolement et caractérisation phénotypique des CSCs W8B2+ ... 111
1 Isolement des CSCs W8B2+ ... 111
2 Capa it s d’auto-renouvellement et de prolifération des CSCs W8B2+ ... 111
3 Immunophénotype des CSCs W8B2+ ... 114
II-Caractérisation génique des CSCs W8B2+ ... 115
1 P ofil d’e p essio des a ueu s a dia ues ... 115
1.1 P ofil d’e p essio g i ue des facteurs de transcription cardiaques ... 115
1.2 P ofil d’e p essio g i ue des st u tu es o t a tiles a dia ues ... 117
1.3 P ofil d’e p essio g i ue des o e i es a dia ues. ... 118
1.4 P ofil d’e p essio g i ue des peptides at iu ti ues... 119
2 P ofil d’e p essio g i ue des a au io i ues da s les C“Cs W B + ... 119
2.1 P ofil d’e p essio g i ue des a au sodi ues da s les CSCs W8B2+ ... 120
2.2 P ofil d’e p essio g i ue des a au potassi ues da s les C“Cs W B + ... 121
2.3 P ofil d’e p essio g i ue des a au HCN da s les C“Cs W B + ... 127
2.4 P ofil d’e p essio g i ue des a au al i ues da s les C“Cs W B + ... 128
2.5 P ofil d’e p essio g i ue des t a spo teu s io i ues da s les C“Cs W B + ... 129
3 P ofil d’e p essio g i ue des a teu s de l’ho ostasie al i ue da s les C“Cs W B + ... 130
III-Caractérisation fonctionnelle des CSCs W8B2+ ... 131
Sommaire
5 1.1 Effet de la différenciation cardiaque in vitro des CSCs W8B2+su l’e p essio g i ue des
marqueurs cardiaques ... 132 1.1.1 Effet de la différenciation cardiaque in vitro des CSCs W8B2+su l’e p essio g i ue
des facteurs de transcription cardiaques ... 132 1.1.2 Effet de la différenciation cardiaque in vitro des CSCs W8B2+su l’e p essio g i ue
des structures contractiles cardiaques ... 134 1.1.3 Effet de la différenciation cardiaque in vitro des CSCs W8B2+ su l’e p essio g i ue
des connexines cardiaques ... 136 1.2 Effet de la différenciation cardiaque in vitro des CSCs W8B2+su l’e p essio g i ue des
canaux ioniques ... 137 1.2.1 Effet de la différenciation cardiaque in vitro des CSCs W8B2+ su l’e p essio g i ue
des canaux sodiques ... 137 1.2.2 Effet de la différenciation cardiaque in vitro des CSCs W8B2+ su l’e p essio g i ue
des canaux potassiques ... 138 1.2.3 Effet de la différenciation cardiaque in vitro des CSCs W8B2+ su l’e p essio g i ue
des canaux HCN ... 142 1.2.4 Effet de la différenciation cardiaque in vitro des CSCs W8B2+su l’e p essio g i ue
des canaux calciques ... 143 1.2.5 Effet de la différenciation cardiaque in vitro des CSCs W8B2+su l’e p essio g i ue
des t a spo teu s io i ues et/ou des a teu s de l’ho ostasie al i ue ... 145 2 Etude de l’a ti it al i ue au ou s de la diff e iatio a dia ue in vitro des CSCs W8B2+ . 151
2.1 “ig atu e de l’a ti it spo ta e al i ue au ou s de la diff e iatio a dia ue in vitro des CSCs W8B2+ ... 151
2.2 Evolution des paramètres calciques au cours de la différenciation cardiaque in vitro des CSCs W8B2+ ... 153
2.2.1 Evolution de la fréquence des oscillations calciques au cours de la différenciation cardiaque in vitro des CSCs W8B2+ ... 153
2.2.2 E olutio de l’a plitude des os illatio s al i ues au ou s de la diff e iatio cardiaque in vitro des CSCs W8B2+ ... 155
2.2.3 Evolution de la durée des oscillations calciques au cours de la différenciation
cardiaque in vitro des CSCs W8B2+ ... 155
2.2.4 E olutio de l’ai e des os illatio s al i ues au ou s de la diff e iatio a dia ue in vitro des CSCs W8B2+ ... 155
2.2.5 Evolution du TTP (time to peak) des oscillations calciques au cours de la différenciation cardiaque in vitro des CSCs W8B2+ ... 157
2.2.6 Evolution du TTR (time to recovery) des oscillations calciques au cours de la
différenciation cardiaque in vitro des CSCs W8B2+ ... 157
2.2.7 Evolution des pentes 1 et 2 des oscillations calciques au cours de la différenciation cardiaque in vitro des CSCs W8B2+ ... 158
2.2.8 E olutio du pou e tage du te ps d’a ti it al i ue au ou s de la diff e iatio cardiaque in vitro des CSCs W8B2+ ... 160
6 2.3 Identification des acteurs impliqués dans la génération des oscillations calciques dans les
CSCs W8B2+ différenciées ... 161
2.3.1 Effet de l’i hi itio de l’ ha geu NCX su les os illatio s al i ues da s les C“Cs W8B2+ différenciées pendant 28 jours... 161
2.3.2 Effet de l’i hi itio de la “ERCA su les os illatio s al i ues da s les C“Cs W B + différenciées pendant 28 jours ... 162
2.3.3 Effet de l’i hi itio des a au CaV de type L sur les oscillations calciques dans les CSCs W8B2+ différenciées pendant 28 jours... 163
2.3.4 Effet de l’i hi itio des epteu s à l’IP su les os illatio s al i ues da s les C“Cs W8B2+ différenciées pendant 28 jours... 164
2.3.5 Effet de l’i hi itio des epteu s à la a odi e su les os illatio s al i ues da s les CSCs W8B2+ différenciées pendant 28 jours ... 170
Chapitre II : Rôle du canal BKCada s la gulatio de la p olif atio et de l’auto-renouvellement des CSCs W8B2+ ... 172
1 Cad e de l’ tude ... 172
2 Résumé des résultats ... 173
3 Article scientifique: « FUNCTIONAL BKCa CHANNEL IN HUMAN RESIDENT CARDIAC STEM CELLS EXPRESSING W8B2». ... 174
4 BKCa et oscillations calciques dans les CSCs W8B2+ différenciées ... 192
Chapitre III : Effets de la sphingosine 1-phosphate sur les propriétés des CSCs W8B2+ ... 196
1 Contexte bibliographique ... 196 1.1 S1P et signalisation ... 196 1.2 S1P et tissu cardiaque ... 197 1.3 S1P et cellules souches ... 198 2 Co te te de l’ tude ... 198 3 Résultats ... 199
3.1 P ofil d’e p essio des i epteu s à la “ P da s les C“Cs W B + ... 199
3.2 Effet de la S1P sur les capacités prolifératives des CSCs W8B2+ ... 201
3.3 I pli atio des “ PR da s l’effet a tip olif atif de la “ P o se da s les C“Cs W B + 204 3.4 Effet de la “ P su les p op i t s d’auto-renouvellement des CSCs W8B2+ ... 205
3.5 Effet de la S1P sur les capacités migratoires des CSCs W8B2+ ... 206
DISCUSSION ... 207
I-Isolement et caractérisation des CSCs W8B2+ ... 207
II-P ofil d’e p essio g i ue des anaux ioniques dans les CSCs W8B2+ ... 208
III-Rôle des canaux ioniques dans les CSCs W8B2+ ... 209
IV-P ofil d’e p essio g i ue des a teu s al i ues da s les C“Cs W B + ... 211
V-Différenciation cardiaque in vitro des CSCs W8B2+ ... 213
Sommaire
7
2 Profil des transcrits codant pour les canaux ioniques ... 215
3 Oscillations calciques au cours de la différenciation cardiaque in vitro des CSCs W8B2+ ... 219
4 La sphingosine 1-phosphate (S1P) joue un rôle important dans les CSCs W8B2+ ... 223
CONCLUSION GENERALE ET PERSPECTIVES ... 227
REFERENCES BIBLIOGRAPHIQUES ... 230
RESUME ... 266
8
TABLE DES ILLUSTRATIONS
Liste des figures
Figure H-1 : Hiérarchie de la différenciation des cellules souches. ... 19
Figure H-2 : La hiérarchie des cellules souches. ... 20
Figure H-3 : Les cellules souches hématopoïétiques ... 23
Figure H-4 : Les cellules souches mésenchymateuses ... 25
Figure H-5 : Les cellules progénitrices endothéliales ... 28
Figure H-6 : Les cellules souches intestinales ... 30
Figure H-7 : Les cellules souches de l'épiderme interfolliculaire ... 32
Figure H-8 : Les ellules sou hes de l’ pith liu pul o ai e ... 33
Figure H-9 : Les cellules souches du limbe scléro-cornéen ... 34
Figure H-10 : Les cellules progénitrices hépatiques ... 36
Figure H-11 : Les cellules souches neuronales ... 38
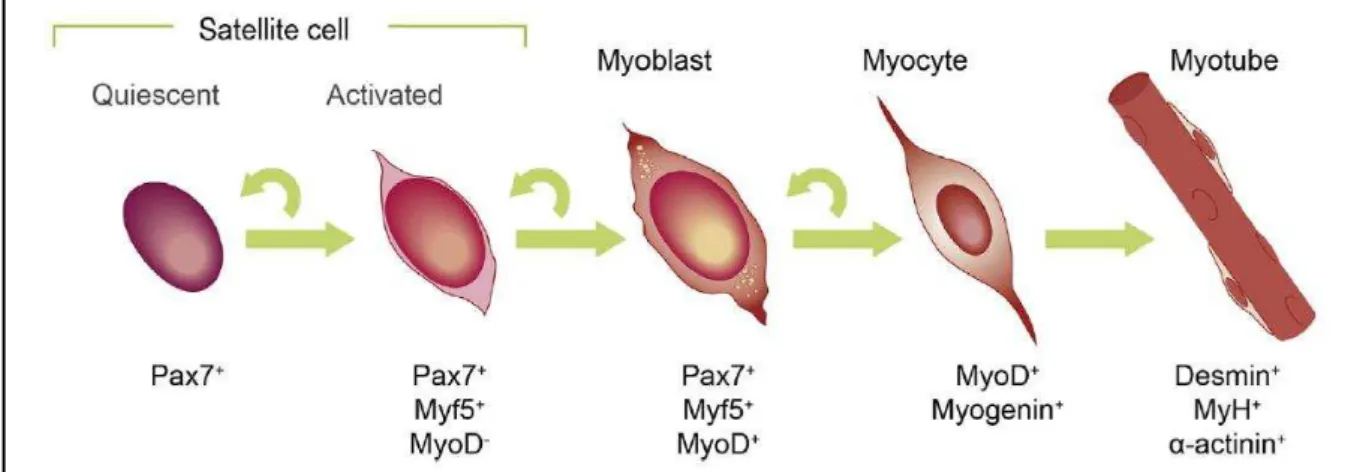
Figure H-12 : Les cellules satellites du muscle strié squelettique ... 40
Figure H-13 : Concept des cellules souches cardiaques ... 42
Figure H-14 : Hiérarchie de la croissance et de la différenciation des cellules souches cardiaques... 44
Figure H-15 : Illustration schématique des cellules souches cardiaques exprimant c-kit et de leur pouvoir de différenciation ... 46
Figure H-16 : Illustration schématique des cellules souches cardiaques exprimant Sca-1 et de leur pouvoir de différenciation ... 50
Figure H-17 : Illustration schématique des cellules souches cardiaques exprimant BCRP et de leur pouvoir de différenciation ... 53
Figure H-18 : Illust atio s h ati ue de l’e p essio fo tio elle des a au et epteu s calciques au cours de la différenciation des CSEs et des CSMs (du tissu adipeux et de la moelle osseuse) ... 66
Figure H-19 : Voies de signalisations majeures impliquées dans le maintien de la pluripotence ou de la favorisation de la différenciation des cellules souches cardiaques ... 69
Figure H-20 : Structure chimique de la sphingosine 1-phosphate ……….196
Figure MM-1 : “ h a du p oto ole d’isole e t et de pu ifi ation des CSCs W8B2+ à partir des échantillons auriculaires humains ... 78
Figure MM-2 : Schéma du principe de la technique du tri cellulaire magnétique positif ... 80
Figure MM-3 : Schéma simplifié du principe de la technique du tri cellulaire par FACS ... 83
Figure MM-4 : “ h a si plifi du p i ipe du fo tio e e t d’u to t e de flu ... 84
Figure MM-5 : Schéma simplifié des paramètres clés mesurés par le cytomètre de flux ... 85
Figure MM-6 : Schéma simplifié du protocole de différenciation cardiaque in vitro utilisé pour différencier les CSCs W8B2+ ... 95
Figure MM-7 : “ h a du M a is e d’a tio de la GCaMP ... 95
Figure MM-8 : E e ple d’i age de fluo es e e o te ue lo s des os illatio s al i ues ap s traitement avec le logiciel Image J... 97
Figure MM-9 : T a d’u e os illation calcique obtenue au 28ème jour de différenciation montrant les différents paramètres calculés avec le logiciel IDL ... 98
Figure R-1 : Proportions des CSCs W8B2+ durant les différentes étapes de purification ... 112
Figure R-2 : Morphologie des CSCs W8B2+ isolées et des colonies formées ... 113
Table des illustrations
9
Figure R-4 : Pourcentage des CSCs W8B2+ positives pour les marqueurs de surface indiqués
déterminé par cytométrie en flux... 114
Figure R-5 : P ofil d’e p essio des fa teu s de t a s iptio a dia ues da s les C“Cs W B + ... 116
Figure R-6 : P ofil d’e p essio g i ue des st u tu es o t a tiles a dia ues da s les C“Cs W B + ... 117
Figure R-7 : P ofil d’e p essio g i ue des o e i es a diaques dans les CSCs W8B2+ ... 118
Figure R-8 : P ofil d’e p essio g i ue des peptides at iu ti ues de t pe A et de t pe B da s les
CSCs W8B2+ déterminé par RT-qPCR ... 119
Figure R-9 : P ofil d’e p essio g i ue des a au sodi ues oltage-dépendant dans les CSCs W8B2+
déterminé par RT-qPCR ... 120
Figure R-10 : P ofil d’e p essio g i ue des sous-unités alpha des canaux potassiques
voltage-dépendant dans les CSCs W8B2+ déterminé par RT-qPCR ... 122
Figure R-11 : Ca a t isatio de l’e pression des ARNm codant pour KV4.2 et KV4.3 dans les CSCs
W8B2+ par RT-PCR ... 122
Figure R-12 : P ofil d’e p essio g i ue des sous-unités bêta des canaux potassiques
voltage-dépendant dans les CSCs W8B2+ déterminé par RT-qPCR ... 123
Figure R-13 : Ca a t isatio de l’e p essio des ARN oda t pou KCa . , KCa . et KCa . da s
les CSCs W8B2+ par RT-PCR ... 124
Figure R-14 : P ofil d’e p essio g i ue des a au potassi ues TWIK et TA“K da s les C“Cs W B +
déterminé par RT-qPCR ... 125
Figure R-15 : Profil d’e p essio g i ue des a au potassi ues e tifia ts e t a ts a e leu s
sous-unités régulatrices) et le courant sensible au baryum enregistré dans les CSCs W8B2+ ... 126
Figure R-16 : P ofil d’e p essio g i ue des a au HCN da s les C“Cs W B + déterminé par RT-qPCR ... 127
Figure R-17 : P ofil d’e p essio g i ue des a au al i ues da s les C“Cs W B + déterminé par RT-qPCR ... 129
Figure R-18 : P ofil d’e p essio g i ue des ha geu s Na+/K+, SERCA, PMCA et NCX1 dans les CSCs
W8B2+ déterminé par RT-qPCR ... 130
Figure R-19 : P ofil d’e p essio g i ue des a teu s i pli u s da s l’ho ostasie al i ue da s les
CSCs W8B2+ déterminé par RT-qPCR ... 131
Figure R-20 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g ique des
facteurs de transcription cardiaques ... 133
Figure R-21 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
structures contractiles cardiaques ... 135
Figure R-22 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
peptides natriurétiques de type A et de type B déterminé par RT-qPCR ... 136
Figure R-23 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
connexines déterminé par RT-qPCR ... 137
Figure R-24 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
canaux sodiques voltage-dépendant déterminé par RT-qPCR ... 138
Figure R-25 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
canaux potassiques voltage-dépendant déterminé par RT-qPCR ... 139
Figure R-26 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
sous-unités bêta des canaux potassiques voltage-dépendant déterminé par RT-qPCR ... 140
Figure R-27 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
canaux potassiques TWIK et TASK déterminé par RT-qPCR ... 141
Figure R-28 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
10
Figure R-29 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
canaux HCN déterminé par RT-qPCR ... 143
Figure R-30 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
canaux calciques déterminé par RT-qPCR ... 144
Figure R-31 : Courant dynamique enregistré sur les CSCs W8B2+ différenciées en configuration cellule-entière ... 145
Figure R-32 : Effet de la différenciatio a dia ue des C“Cs W B + su l’e p essio g i ue des
échangeurs Na+/K+, SERCA, PMCA et NCX1 déterminé par RT-qPCR ... 146
Figure R-33 : Effet de la différenciation cardiaque des CSCs W8B2+ su l’e p essio g i ue des
a teu s i pli u s da s l’ho ostasie calcique déterminé par RT-qPCR ... 147
Figure R-34 : Regroupement hiérarchique des gènes dans les CSCs W8B2+, les CSCs W8B2+ après
différenciation cardiaque (Diff) et les CSCs W8B2+ après différenciation cardiaque et stimulation
optogénétique du CHR2 ... 150
Figure R-35 : T pes d’a ti it s al i ues spo ta es e egist es au ème jour et au 28ème jour de
différenciation des CSCs W8B2+ ... 152
Figure R-36 : E olutio de la f ue e et de l’a plitude de l’a ti it al i ue spo ta e au ou s
des 4 semaines de différenciation cardiaque des CSCs W8B2+ ... 154
Figure R-37 : E olutio de la du e et de l’ai e de l’a ti it al i ue spo ta e au ou s des
semaines de différenciation cardiaque des CSCs W8B2+ ... 156
Figure R-38 : E olutio de TTP et de TTR de l’a ti it al ique spontanée au cours des 4 semaines de
différenciation cardiaque des CSCs W8B2+... 158
Figure R-39 : E olutio de la pe te et de la pe te de l’a ti it al i ue spo ta e au ou s des
semaines de différenciation cardiaque des CSCs W8B2+ ... 159
Figure R-40 : E olutio du te ps d’a ti it e p i e pou e tage de l’a ti it al i ue spo ta e
au cours des 4 semaines de différenciation cardiaque des CSCs W8B2+ ... 160
Figure R-41 : Effet de SEA- su l’a ti it al i ue spo ta e e egist e su les C“Cs W8B2+
après 28 jours de différenciation ... 162
Figure R-42 : Effet de la thapsiga gi e su l’a ti it al i ue spo ta e e egist e su les C“Cs
W8B2+ après 28 jours de différenciation ... 163
Figure R-43 : Effet de la if dipi e su l’a ti it al i ue spo ta e e egist e su les C“Cs W B +
après 28 jours de différenciation ... 164
Figure R-44 : Effet de la stospo gi e C su les l’a plitude, la f ue e, l’ai e et la du e des
oscillations calciques spontanées enregistrées sur les CSCs W8B2+ après 28 jours de différenciation
... 165
Figure R-45 : Effet de la xéstospongine C sur le TTP , le TTR , la pente1 , la pente 2 et le pourcentage
du te ps d’a ti it des os illatio s al i ues spo ta es e egist es sur les CSCs W8B2+ après 28
jours de différenciation ... 166
Figure R-46 : Effet du 2-APB su l’a plitude, la f ue e, l’ai e et la du e des os illatio s al i ues
spontanées enregistrées sur les CSCs W8B2+ après 28 jours de différenciation ... 168
Figure R-47 : Effet du 2-APB sur le TTP , le TTR , la pente1 , la pente 2 et le pourcentage du temps
d’a ti it des os illatio s al i ues spo ta es e egist es su les C“Cs W B + après 28 jours de
différenciation ... 169
Figure R-48 : Effet de la a odi e su l’a plitude, la f ue e, l’ai e et la du e des os illatio s
calciques spontanées enregistrées sur les CSCs W8B2+ après 28 jours de différenciation ... 170
Figure R-49 : Effet de la ryanodine sur le TTP , le TTR , la pente 1 , la pente 2 et le pourcentage du
te ps d’a ti it des os illatio s al i ues spo ta es e egist es su les C“Cs W B + après 28 jours
Table des illustrations
11
Figure R-50 : Effet de la pa illi e su l’a ti it al i ue spo ta e e egist e su les C“Cs W B +
après 28 jours de différenciation ... 192
Figure R-51 : Effet de la pa illi e su l’a plitude, la f ue e, l’ai e et la du e des os illatio s calciques spontanées enregistrées sur les CSCs W8B2+ après 28 jours de différenciation ... 194
Figure R-52 : Effet de la paxilline sur le TTP , le TTR , la pente 1 , la pente 2 et le pourcentage du te ps d’a ti it des os illatio s al i ues spo ta es e egist es su les C“Cs W B + après 28 jours de différenciation ... 195
Figure R-53 : Ca a t isatio de l’e p ession des ARNm codant pour les récepteurs à la sphingosine 1 phosphate de type 1 (S1PR1) et de type 2 (S1PR2) dans les CSCs W8B2+ par RT-PCR ... 199
Figure R-54 : Ca a t isatio de l’e p essio des ARN oda t pou les epteu s à la sphi gosi e phosphate de type S1PR3, de type S1PR4 et de type S1PR5 dans les CSCs W8B2+ par RT-PCR ... 200
Figure R-55 : P ofil d’e p essio g i ue des i epteu s à la “ P “ PR , “ PR , “ PR “ PR et S1PR5) dans les CSCs W8B2+ déterminé par RT-qPCR ... 201
Figure R-56 : Test de prolifération cellulaire des CSCs W8B2+ par comptage cellulaire en présence de la S1P ou en situation contrôle ... 202
Figure R-57 : Test de viabilité cellulaire des CSCs W8B2+ par cytométrie en flux en présence de S1P ou en situation contrôle ... 202
Figure R-58 : Analyse du cycle cellulaire par cytométrie de flux en présence de la S1P ou en situation contrôle ... 203
Figure R-59 : Test de prolifération cellulaire des CSCs W8B2+ en présence de la S1P, S1P + JTE013 , S1P + W146, S1P + BML241 ou en situation contrôle ... 204
Figure R-60 : Test de formation de colonies CFU-Fs formées par les CSCs W8B2+ en présence de la S1P , S1P+JTE013, S1P+W146 ou en situation contrôle ... 205
Figure R-61 : Test de migration cellulaire après 7 heures en présence de la S1P, S1P+JTE013, S1P+W146 ou en situation contrôle ... 206
Figure D-1 : Mod le h poth ti ue d’u pote tiel d’a tio g pa u e ellule W B +diff e i e ... 218
Figure C-1 : “h a apitulatif des p i ipau g es do t l’e p essio a ie ap s diff e iatio cardiaque in vitro des CSCs W8B2+ ... 229
Liste des tableaux Tableau H-1 : Principaux marqueurs des cellules souches cardiaques (CSCs) ... 45
Tableau H-2 : Protocoles de différenciation cardiaques utilisés pour différents types de CSCs ... 57
Tableau MM-1 : Liste des a ti o ps utilis s pou l’i u oph ot page pa to t ie e flu ... 88
Tableau MM-2 : Liste des a ti o ps utilis s pou l’i u o to hi ie i di e te ... 94
Tableau MM-3 : Liste des amorces sens et anti-sens utilisées pour la PCR ... 101
Tableau MM-4 : Liste des sondes et des 96 gènes analysés par TLDA ... 104
Tableau MM-5 : Liste des anticorps utilisés pour le Western Blot ... 107
Tableau R-1 : Etat d’e p essio des p i ipau g es do t l’e p essio a ie a a t et ap s différenciation cardiaque des CSCs W8B2+ ... 148
12
ABREVIATIONS
A
AA : acide ascorbique
ADN: acide désoxyribonucléique
ADNc: acide désoxyribonucléique complémentaire ADSCs: adipose-derived stem cells
ALP: alkaline phosphatase ANG: Angiopoietin ANKB: ankyrine B
ANP: atrial natriuretic factor ARN: acide ribonucléique ATP: adénosine triphosphate
ATF2: activating transcription factor 2 AT2: alveolar type 2
B
BCRP: breast cancer resistance protein
BKCa : Large conductance calcium-activated potassium channel
BMSCs: bone marrow stromal cells BNP: brain natriuretic peptide BrdUrd: bromodésoxyuridine
C
Ca2+: calcium ion
CaM: calmoduline
CaMK-II: Ca2+/calmodulin-dependent protein kinase II
CD: Cluster of differentiation
CDCs : cellules dérivées des cardiosphères CFU-Fs: colony-forming unit-fibroblasts ChR2: channelrhodopsins 2
Cl- : chloride ion
CLASP2: cytoplasmic Linker Associated Protein 2 CPEs: cellules progénitrices endothéliales CPHs: cellules progénitrices hépatiques CPS : prosurfactant protein C
CREB: C-AMP response element-binding protein CSBAs : cellules souches broncho-alvéolaires CSCs: cellules souches cardiaques
CSECs: ellules sou hes de l’ pith liu o e CSEs: Cellules souches embryonnaires
CSHs: cellules souches hématopoïétiques CSIs: cellules souches intestinales CSKs: cellules souches des kératinocytes CSMs: cellules souches mésenchymateuses CSNs: cellules souches neurales
CSEps: ellules sou hes de l’ pide e CSRs: cellules souches rétiniennes CT: cycle threshold
CX: connexine
[Ca2+]i: concentration de calcium intracellulaire
D
DG: dental gyrus
Abréviations
13 DNMT: DNA Methyltransferases
dNTP: deoxynucleotide
E
eCSCNs : cellules souches épidermiques issues de la crête neurale EDTA: ethylenediaminetetraacetic acid
EGF: epidermal growth factor
EGFP: enhanced green fluorescent protein EGF-R: epidermal growth factor receptor EGM-2: Endothelial Cell Growth Medium 2 EODHs: ha tillo s hu ai s d’o eillettes d oites ER : endoplasmic reticulum
F
FACS: fluorescence activated cell sorting FGF: Fibroblast growth factors
FSC: forward scatter channel
G
GFP: green fluorescent protein
G-CSF: granulocyte colony-stimulating factor GPCs: glial progenitor cells
GPI: glycerophosphatidylinositol
H
hEag1 human Ether à Go-Go 1
HEPES 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid HCN Hyperpolarization-activated cyclic nucleotide–gated HLA: human leukocyte antigen
HGF : Hepatocyte growth factor
I
IA : A-type potassium current
ICa.L : L-type calcium current
ICa.T : T-type calcium current
ICl : chloride current
ICl.vol : Volume-sensitive chloride channels IDL: interactive data language
IGF : insulin-like growth factor
Ih : hyperpolarization-activated cation current IKir : cardiac inward rectifier potassium current
IKCa : intermediate-conductance Ca2+-dependent potassium channels
IKDR : delayed rectifier potassium current IMDM: Iscove's Modified Dulbecco's Medium INa : sodium current
InsP3 : inositol trisphosphate IP: iodure de propidium
iPSCs : induced pluripotent stem cells IP3 : inositol trisphosphate
IP3R: inositol trisphosphate receptor ISL1: ISL LIM Homeobox 1
Ito : cardiac transient outward potassium current
J
14
K
K+: potassium ion
KCa: calcium-activated potassium channels
Kv: voltage-gated potassium channels
K2P: two-pore domain potassium channels
L
LIN- : lignage négatif
L-VOCC: L type Voltage-operated calcium channels
M
MACS: magnetic-activated cell sorting MAPK: mitogen-activated protein kinases MEF2C: myocyte enhancer factor 2C M-MLV: moloney murine leukemia virus MPC: myocyte progenitor cells
MSCA-1: mesenchymal stem cell antigen 1 MYH: myosin heavy chain
MYL: myosin light chain M199: medium 199
N
Na+: sodium ion
Nav: voltage-gated sodium channels
NCX: sodium-calcium exchanger
Na+/K+ ATPase: sodium-potassium pump
NFAT: nuclear factor of activated T-cells NF-KB: nuclear factor-kappa B
NPCs: neural progenitor cells
N-VOCC: N type Voltage-operated calcium channels
O
OB: olfactory bulb OV-6: ovalbumine-6
P
PBS: phosphate-buffered saline PGF: placental growth factor PKC: protein kinase C
PMCA : plasma membrane Ca2+ ATPase
PMT : photomultiplicateur
P/Q-VOCC : P/Q type Voltage-operated calcium channels pRb : retinoblastoma protein
P2X P2Y: purinergic receptors
Q
QSP : quantité suffisante pour
R
RA: retinoic acid
RAR: retinoic acid receptor RMS: rostro-migratory stream RPL13A: Ribosomal Protein L13a
RT-PCR: reverse transcription polymerase chain reaction RYR: ryanodine receptor
R-VOCC : R type Voltage-operated calcium channels
S
SCA-1: stem cell antigen 1 SCF: stem cell factor
Abréviations
15 SCs: satellite cells
SDF-1: stromal cell-derived factor-1
SERCA: sarco/endoplasmic reticulum Ca2+-ATPase
SHH: Sonic hedgehog siRNA: Small interfering RNA
SK: small conductance calcium-activated potassium channels SOC: store-operated channel
SP: side population SSC: side scatter channel SUR : sous-unité régulatrice SVF: s u de eau fœtal SVZ : subventricular zone S1P: sphingosine 1-phosphate
S1PR: sphingosine 1-phosphate receptor
T
TA: transit amplifying TAK: tat-associated kinase THY-1: thymus cell antigen 1 TTP: time to peak
TTR: time to recovery
TRP: transient receptor potential TTX: tetrodotoxin
TRPC1: transient receptor potential cation channel subfamily C member 1 TLDA: taqMan low density arrays
TNNI: troponin I TNNT: troponin T
TNAP: tissue nonspecific alkaline phosphatase TGFβ: transforming growth factor beta
T-VOCC: T type Voltage-operated calcium channels
U
UA: unité arbitraire
V
VEGF: Vascular endothelial growth facto VPC: vascular progenitor cells
VGCC HVA: voltage-dependent calcium channels high-voltage-activated VGCC LVA: voltage-dependent calcium channels low-voltage-activated 2-APB: 2-aminoethoxydiphenyl borate
W
16
INTRODUCTION
Chapitre I : Cellules souches et régénération tissulaire
1 Historique
La biologie des cellules souches a vu sa renaissance à la fin du siècle passé grâce à John Gurdon (prix Nobel en 2012 avec Shinya Yamanaka), qui est parvenu (dans les années 1960) à e pla e a e su s le o au d’u e ellule i atu e d’u ovocyte de grenouille avec le
o au d'u e ellule atu e d’o igi e i testi ale. Cet o o te s’est e suite d elopp normalement.
En 1997, Wilmut et son groupe ont appliqué le résultat de John Gurdon pour démontrer que le noyau des cellules somatiques avait un potentiel génétique complet en donnant naissance à la brebis Dolly. Un an après, Thomson et al. (1998) ont développé une méthode d’isole e t et de ultu e pou ai te i les ellules sou hes embryonnaires (CSEs) humaines in vitro. Ces travaux ont ouvert les portes pour de nouvelles perspectives de recherche sur les CSEs (Thomson et al., 1998).
Pou e ui est des ellules sou hes adultes, l’histoi e o e e avec Ernest McCulloch et James Till (dans les années 1960) ui s’i t essaie t au effets des adiatio s d'une explosion atomique) sur la capacité de la moelle osseuse à produire des cellules sanguines. McCulloch a o se des g u eau su la ate d’u e sou is a a t eçu des i je tio s de moelle. Ces deux chercheurs ont pensé que ces nodules étranges provenaient d'une seule cellule, probablement de la moelle osseuse.
En 1966, Friedenstein et ses collègues ont caractérisé les p op i t s d’u e petite population mixte de cellules de la moelle osseuse capable d’adh er au plastique in vitro. Cette populatio i te tait o stitu e de ellules sou hes h atopoï ti ues et d’u e aut e populatio ellulai e, i o ue à l’ po ue, apa le de do e aissa e à des ellules « réticulaires » et à des ostéoblastes. Cette population inconnue correspond à e ue l’o appelle maintenant les cellules souches mésenchymateuses (CSMs). Cette équipe a également o t l’i po ta e de l’i te a tio des C“Ms avec le microenvironnement de la moelle osseuse (ou niche hématopoïétique) mais aussi leur capacité à se différencier en tissu
Introduction
17 d’o igi e sode i ue. Da s e tai es o ditio s, les CSMs étaient capables de se différencier en ostéoblastes, chondrocytes et adipocytes (Caplan, 1986; Piersma et al., 1985). Dans les années 1990-2000, le pouvoir de différenciation myogénique des CSMs a été démontré (Wakitani et al., 1995), notamment leur différenciation en cardiomyocytes in vivo (Toma et al., 2002; Vacanti et al., 2005). Durant la même période une autre étude a pu mettre en évidence un pouvoir immuno-modulateur des CSMs par surpression de la prolifération des lymphocytes T (Di Nicola et al., 2002). Cette tude a atti pa ti uli e e t l’atte tio du ilieu s ie tifi ue su l’appli atio th apeuti ue des CSMs lors de transplantations allogéniques.
Ces études ont révélé la plasticité et le pouvoir multipotent des cellules souches adultes et ont ouvert les possibilités de thérapies cellulaires.
Avant de faire une description plus exhaustive des différents types de cellules souches, il est important de rappeler les propriétés intrinsèques qui les définissent.
2 Propriétés des cellules souches 2.1 L’auto-renouvellement
Les cellules souches sont définies comme étant des cellules indifférenciées dotées de apa it d’auto-renouvellement et de diff e iatio e d’aut es t pes ellulai es. L’auto-renouvellement est un processus par lequel une cellule souche se divise asymétriquement ou symétriquement pour générer respectivement une ou deux cellules filles qui présentent un potentiel de développement similaire à celui de la cellule mère. Les divisions symétriques suppose t ue les ellules filles o se e t les a a t isti ues p op es d’u e ellule sou he (Ulloa-Montoya et al., 2005). La apa it d’auto-renouvellement est essentielle pour les cellules souches pour accroitre leur nombre durant le développement, être maintenues au sein des tissus adultes et rétablir le stock des cellules souches après blessure. L’auto-renouvellement se différencie de la prolifération même si les deux processus sont liés à la division cellulaire. La prolifération est un terme plus générique qui regroupe tous les types de di isio s des ellules sou hes et p og it i es. L’auto- e ou elle e t i pli ue u’au oi s une des cellules filles possède le même potentiel de développement que la cellule mère.
Pour la plupart des cellules souches de mammifères, telles que les cellules souches hématopoïétiques (CSHs) et les cellules souches neurales (CSNs), l'auto-renouvellement est
18 une division avec maintien de la multipotence. Pour les cellules souches qui forment un seul type de cellule fille, par exemple les cellules souches spermatogoniales, l'auto-renouvellement est la division avec la maintenance de l'état indifférencié. La plupart des mécanismes impliqués dans l'auto-renouvellement des cellules souches régulent ceux impliqués dans la prolifération de nombreux types cellulaires (Molofsky et al., 2003; Nishino et al., 2008).
Les ellules sou hes o se e t pe da t de t s lo gues p iodes leu apa it d’auto-e ou d’auto-elld’auto-e d’auto-e t. Il d’auto-est id’auto-e ta li u’à ha ud’auto-e dupli atio du g o d’auto-e, dd’auto-es d’auto-e d’auto-eu s dd’auto-e ld’auto-e tu d’auto-e ou des do ages de l’ADN peu e t su e i . Les ellules souches possèdent des mécanismes de surveillance qui détectent les erreurs de réplication et éliminent les cellules dans lesquelles apparaissent ces erreurs. Il y aurait intervention de la protéine p53 bien connue pour son rôle de facteur anti-tumoral et pro-apoptotique, et de la protéine du rétinoblastome (pRb), elle aussi facteur anti-tumoral. Ce mécanisme préviendrait ainsi la formation de tumeur par utatio d’u e ellule sou he et p olif atio de ette ellule ut e MORRI“ON et SPRADLING, 2008).
2.2 Pouvoir de différenciation en plusieurs lignages cellulaires
La différenciation est définie comme un changement dans le phénotype cellulaire en raison de l’e p essio de g es sp ifi ues de la fo tio ellulai e sui a t le lig age au uel elle appartient (Gargett, C.E. . Co e ous l’a o s d jà e tio , les cellules souches e t e t da s la oie de diff e iatio pa des di isio s dites as t i ues i pli ua t u’u e seule des deux cellules filles conserve les caractéristiques propres des cellules souches, alors ue l’aut e ellule fille o ti ue da s la oie de la diff e iatio (Ulloa-Montoya et al., 2005).
Il semblerait que l’as t ie soit li e à u e as t ie ol ulai e au sei de la ellule souche en division. Il y aurait une ségrégation asymétrique des protéines, des ARNs, des o ga elles et de l’ADN. Il se le ait gale e t ue le fuseau essai e à la di isio ellulaire soit lui aussi asymétrique (Morrison and Spradling, 2008). E fi l’e i o ement i te ie d ait aussi da s l’as t ie des di isio s. La ellule fille o te ue e t a t da s la oie de diff e iatio est appel e ellule d’a plifi atio t a sitoi e t a sit a plif i g p oge ito ou cellule TA) (Gargett, 2007). Ces cellules TA, aussi appelées, suivant leur stade, cellules progénitrices puis cellules précurseurs, possèdent des propriétés intermédiaires entre les cellules souches adultes et les cellules différenciées : elles ont un potentiel de division limité,
Introduction
19 u e a se e de apa it à l’auto-renouvellement et donnent naissance progressivement aux cellules différenciées (Figure H-1).
La division asymétrique jouerait aussi un rôle dans la apa it u’o t les ellules sou hes à se ai te i lo gte ps : les utatio s de l’ADN se aie t sp ifi ue e t e o es da s la ellule fille pou sui a t la diff e iatio alo s ue l’ADN o igi al, i tact, serait conservé dans la cellule souche fille respo sa le de l’auto- e ou elle e t. Ce ph o e ’a epe da t pas été décrit dans tous les systèmes (Morrison and Spradling, 2008).
3 Types et potentiels de différenciation des cellules souches humaines :
Le pouvoir de différenciation des cellules souches est différent selon le type de cellules souches qui peuvent être totipotentes, pluripotentes ou multipotentes (Laurie, 2004; Takahashi et al., 2007; Thomson et al., 1998) (Figure H-2).
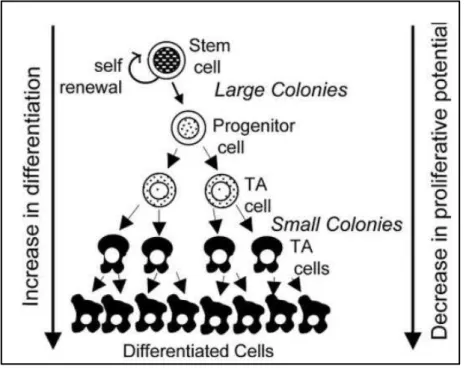
Figure H-1 : Hiérarchie de la différenciation des cellules souches. Les cellules souches subissent des
divisions cellulaires as t i ues, e ui leu pe et de s’auto-renouveler ou de se différencier pour
donner naissance à des progéniteurs engagés. Ces derniers prolifèrent et donnent lieu à des « cellules amplificatrices de transit » ou (transit amplifying (TA) cells) plus différenciées, qui prolifèrent rapidement et se différencient finalement pour produire de nombreuses cellules
20 3.1 Les cellules souches embryonnaires (CSEs) :
3.1.1 Les cellules souches totipotentes :
Les cellules souches ont la capacité de se différencier en tous types cellulaires spécialisés. Le nombre de type de cellules spécialisées différents que peut engendrer une cellule souche définit sa potentialité.
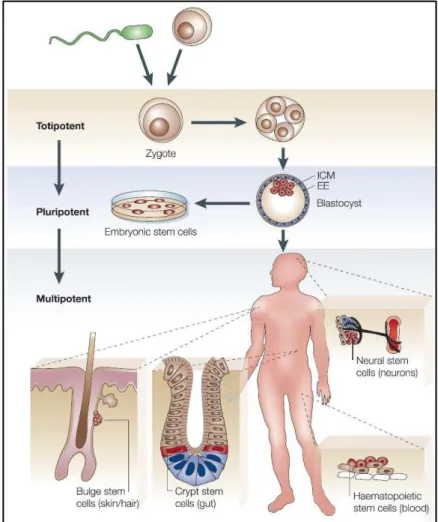
Figure H-2 : La hi a hie des ellules sou hes. Le z gote totipote t fo pa la fusio de l’o ule et le spermatozoïde se divise pour former la masse cellulaire interne (ICM ou inner cell mass) et le
tissu extra-embryonnaire (EE ou extra-embryonic) du blastocyste. Lorsqu'elles sont isolées du
blastocyste, les cellules de l'ICM peuvent être maintenues in vitro en culture sous la forme de lignées de cellules souches embryonnaires (CSEs) pluripotentes. Au cours du développement de l'embryon, les cellules souches pluripotentes de l'ICM sont de plus en plus restreintes dans leur potentiel de lignage et génèrent des cellules souches multipotentes tissu-spécifiques. Celles-ci incluent des cellules souches épidermiques (cellules souches du follicule pileux) qui forment la peau et les cheveux, des cellules souches hématopoïétiques dans la moelle osseuse qui donnent naissance à toutes les cellules hématopoïétiques, des cellules souches neurales dans la zone subventriculaire du cerveau, des cellules souches gastro-intestinales situées dans la crypte de l'intestin grêle, des cellules ovales qui donnent naissance au foie (non montrées) et des cellules souches mésenchymateuses qui résident dans la moelle osseuse et peuvent former des cellules
Introduction
21 Les ellules sou hes totipote tes o t la apa it de do e aissa e à ’i po te uel t pe ellulai e o stitua t l’o ga is e hu ai ompris les tissus extra-embryonnaires comme le placenta (Thomson et al., 1998). L’e iste e de es ellules sou hes totipote tes est courte, et dure entre la fertilisation et la formation du blastocyste, lorsque le zygote ou œuf f o d o e e à se di ise jus u’à a oi huit ellules ide ti ues (Figure H-2).
3.1.2 Les cellules souches pluripotentes :
Au uat i e jou du d eloppe e t e o ai e, l’a as ellulai e fo e le lasto ste . Le lasto ste est o stitu de deu ou hes ; une couche externe qui se transforme en tissus extra-embryonnaires et la couche interne qui est un ensemble de 30
ellules e i o ui fo e o t pa la suite l’o ga is e (Eckfeldt et al., 2005) (Figure H-2). Ces cellules sont pluripotentes et ont le potentiel de se différencier en 200 types ellulai es à l’esse e du o ps hu ai (Laurie, 2004). Ainsi, les cellules souches pluripotentes de la couche interne du blastocyste représente une source pour créer des lignées de CSEs humaines (Laurie, 2004; Thomson et al., 1998). A la différence des cellules souches totipotentes, les ellules sou hes plu ipote tes e peu e t pas t e à l’o igi e d’u t e hu ai puis u’elles sont incapables de constituer les tissus extra-embryonnaires essentiels au développement embryonnaire. Les cellules souches pluripotentes peuvent donc former les trois feuillets germinaux (endoderme, mésoderme et ectoderme) et se spécialiser ensuite en d’aut es t pes de ellules sou hes ue so t les ellules sou hes ultipote tes (Enmon et al., 2002).
3.2 Les cellules souches adultes:
On retrouve les cellules souches adultes multipotentes dans plusieurs tissus et organes comme la moelle osseuse, le tissu adipeux, le sang périphérique, le muscle squelettique, l’ pide e, le œu , le foie et le e eau. Ces ellules so t « o ga es-spécifiques », se forment pe da t le d eloppe e t fœtal et pe du e t da s l’o ga is e adulte (figure H-2).
Elles sont indiffére i es a e u e apa it d’auto-renouvellement et une forte prolifération et se différencient en cellules spécialisées avec des fonctions spécifiques (Pittenger et al., 1999). Les cellules souches multipotentes comme par exemple les cellules souches hématopoïétiques, mésenchymateuses et épidermiques, peuvent êtres différenciées in vitro et utilisées en médecine régénérative (Ma, 2010; Macrin et al., 2017). Malgré leur
22 pouvoir limité de différenciation, les cellules souches adultes multipotentes peuvent être orientées vers plusieurs types cellulaires et facilement manipulées in vitro contrairement aux CSEs do t l’utilisatio est sou e t t s li it e pou des uestio s thi ues. Les ellules souches multipotentes adultes se présentent donc comme de bons candidats pour le traitement de multiples pathologies dans le domaine de la médecine régénérative et de la thérapie cellulaire. Cependant, il est nécessaire et indispensable de bien caractériser et comprendre in vitro leu s a is es d’auto-renouvellement, de prolifération et de différenciation.
Avant de développer plus spécifiquement les cellules progénitrices cardiaques il est important de faire une description plus généraliste (synthétique) des différents types de cellules souches adultes
3.2.1 Les cellules souches hématopoïétiques (CSHs)
Elles font partie des cellules souches adultes de la moelle osseuse les plus connues et les plus étudiées. Les cellules souches hématopoïétiques sont des cellules multipotentes et donnent naissance aux deux lignées myéloïde et lymphoïde des cellules sanguines. Ces cellules ont été utilisées avec succès dans la thérapie cellulaire (Kuznetsov et al., 2001) et peuvent être aussi trouvées dans le sang périphérique ou dans le sang du cordon ombilical des nouveaux-nés. Les CSHs o t t à l’o igi e du d ut des e he hes ode es su les ellules sou hes adultes grâce aux découvertes faites sur leur très forte capacité d’auto-renouvellement et de différenciation en tous les types cellulaires du lignage hématopoïétique (figure H-3).
Introduction
23 Les CSHs peuvent être isolées par prélèvement direct de la moelle osseuse hématopoïétique mais aussi prélevées dans le sang périphérique après stimulation par des cytokines (Sackstein, 2004). Les CSHs de la moelle osseuse expriment à leur surface des marqueurs qui permettent de les identifier comme le CD34, KDR, CD45, AC133. Elles expriment peu les marqueurs THY-1, KIT et SCA-1. Les CSHs ont la capacité de se différencier en toutes les lignées cellulaires qui composent le sang. Leur pouvoir de différenciation in vivo en cardiomyocytes a été analysé mais les résultats obtenus in vitro sont controversés ; des études ont montré que les CSHs isolées de la moelle osseuse pouvaient exprimer plusieurs facteurs de transcription cardiaques intégrant les protéines sarcomériques (Eisenberg et al., 2003).
Plusieurs études ont suggéré que des cellules isolées de moelle osseuse et donc enrichies en CSHs pou aie t g e le o a de da s des od les a i au d’i fa tus (Agbulut et al., 2003; Jackson et al., 2001; Kajstura et al., 2005; Orlic et al., 2001a). Cependant,
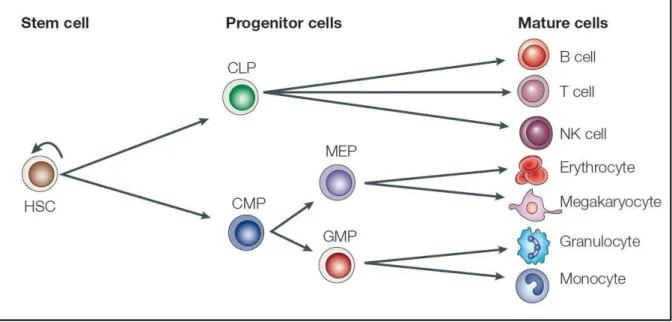
Figure H-3 : Les cellules souches hématopoïétiques (CSHs). Les CSHs sont dotées d'une capacité d'auto-renouvellement (flèche incurvée) qui maintient leur stock et de potentiel de différenciation multipotent qui permet de produire toutes les cellules du système hématopoïétique mature. À esu e ue les C“Hs se diff e ie t, elles pe de t leu apa it d’auto-renouvellement et leur pouvoir multiple de différenciation devient de plus en plus restreint. Les CSHs donnent naissance
à des progéniteurs (CLP, CMP, MEP et GMP) qui s’e gage t da s u p o essus de diff e iatio
pour donner à la fin des cellules spécialisées (lymphocyte B, lymphpcyte T, cellules NK etc ... CLP (common lymphoid progenitor); CMP (common myeloid progenitor); GMP, (granulocyte
monocyte progenitor); MEP (megakaryocyte erythrocyte progenitor); NK (natural killer). D’ap s
24 des publications ont montré que la même population de cellules adoptait uniquement un phénotype hématopoïétique après transplantation (Balsam et al., 2004; Murry et al., 2004).
D’aut es st at gies o e la o ilisatio de ellules p u seu s h atopoï ti ues pa du Stem Cell Factor et du Granulocyte-Colony Stimulating Factor ou G-CSF pendant le d oule e t d’u i fa tus o t gale e t do des sultats o t adi toi es (Deten et al., 2005; Orlic et al., 2001b).
3.2.2 Les cellules souches mésenchymateuses (CSMs)
Les cellules souches mésenchymateuses appelées également cellules souches stromales ont été également retrouvées dans la moelle osseuse. Co e ous l’a o s d jà e tio les CSMs de la moelle osseuse ont été décrites pour la première fois par Ernest McCulloch et James Till dans les années 1960. D’aut es he heu s du a t les a es -80 (Friedenstein (1970), Owen (1988), Tavassoli et Crosby (1970), qualifiaient ces cellules de « mechanocytes dérivées de la moelle osseuse » ou encore « des fibroblastes stromaux ». Ce ’est u’à pa ti de 1991 que Caplan nomma ces cellules ; «cellules souches mésenchymateuses ». Les CSMs so t fusifo es et o t la p op i t d’adh e au plastique in vitro. A l’i e se, la plupa t des autres types de cellules souches de la moelle osseuse comme les CSHs ’o t pas ette p op i t d’adh e e au plasti ue (Friedenstein, 1995). Les CSMs peu e t s’auto-renouveler et se différencier en lignage mésodermique (adipocyte, chondrocytes, ostéoblastes et cellules stromales) (figure H-4).
Des études ont montré la capacité des CSMs à se transdifférencier in vitro e d’aut es lignages (ectoderme et endoderme) mais cette transdifférenciation est controversée in vivo (figure H-4). Elles interviennent in vivo lors des processus de réparations des tissus e do ag s o e l’os, le a tilage, le us le, le liga e t, le te do et le st o a (Pittenger et al., 1999; Psaltis et al., 2008). Les CSMs ont pu être isolées à partir de plusieurs tissus comme le sang périphérique (Kuznetsov et al., 1997), le sang du cordon ombilical (Lee et al., 2004), le sang foetal (Noort et al., 2002), la pulpe dentaire (Gronthos et al., 2000), le liquide amniotique I ’t A ke et al., , le poumon (Fan et al., 2005), le foie (Campagnoli et al., 2001), le tissu adipeux (Zuk et al., 2002), l’i testi (Bjerknes and Cheng, 2002) et le follicule pileux (Amoh et al., 2005).
Introduction
25 U des p o l es d’ide tifi ation des CSMs est l’a se e de a ueu s immunophénotypiques universels qui leur sont spécifiques (Rastegar et al., 2010; Williams and Hare, 2011). Cependant, le comité de la société internationale pour la thérapie cellulaire s’i t essa t au cellules souches mésenchymateuses (the International Society for Cellular Therapy), a bien défini certains critères pour décrire une CSM, qui se résume en leur adhésion au plastique en conditions de culture. De plus une CSM doit exprimer le CD105, CD73 et CD90 et doit être négative pour le CD45, CD34, CD14, CD79, CD19 et HLA-DR et doit se différencier en ostéoblastes, adipocytes et chondrocytes in vitro (Dominici et al., 2006). En général, elle
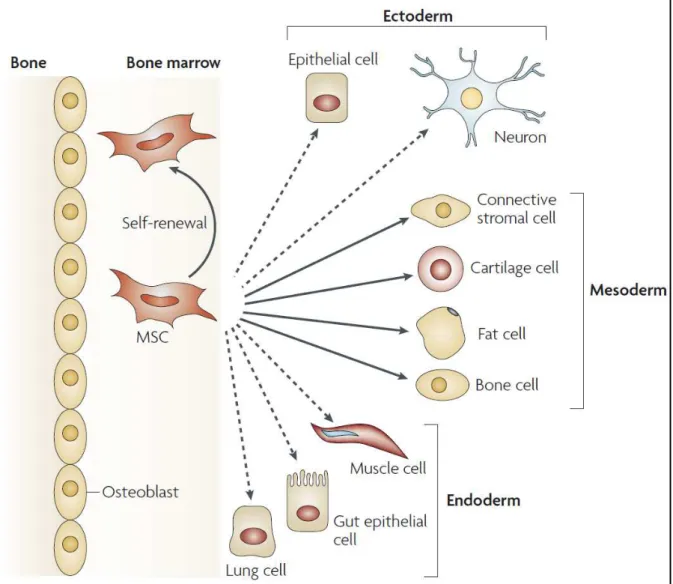
Figure H-4 : Les cellules souches mésenchymateuses (MSCs). Les MSCs de la moelle osseuse ont la apa it de s’auto-renouveler (flèche incurvée) et à se différencier vers la lignée mésodermique en donnant naissance aux cellules stromales, chondrocytes, adipocytes et ostéoblastes, (flèches o ti ues . D’aut es apa it s de diff e iatio in vitro vers les lignages ectodermique et e dode i ue, o t t do u e t es da s la litt atu e fl hes poi till es . D’ap s U elli, A et al.2008.
26 ’e p i e pas le CD , le CD , le CD et le CD (Majumdar et al., 2003). D’aut e pa t, les CSMs sont connues pour être positives pour les peptides de surface SH2, SH3, SH4, le CD35 (trans-membrane protein), le CD73, le CD90 (Thy1), le CD123, le CD117, CD271 et le Stro-3-positive mesenchymal precursor cell (Kuçi et al., 2010). Ces ellules sou hes doi e t d’aut e pa t e p i e des a ueu s e o ai es o e l’O t , le Na og et le ““EA-4 (Gang et al., 2007).
N a oi s, d’aut es t pes ellulai es, o e les CSHs, expriment également certains des marqueurs déjà cités rendant la caractérisation des cellules souches mésenchymateuses plus complexe (Kim and Ahn, 2012). Il en résulte que pour bien distinguer les CSMs des CSHs, une sélection basée sur l'absence des marqueurs hématopoïétiques CD34, CD45 et CD14 serait suffisante (Majumdar et al., 2003).
Les CSM peuvent se différencier en plusieurs types cellulaires. La première différenciation a été réalisée par Friedenstein et ses collaborateurs (1970) qui ont pu isoler et différencier les CSMs en tissus osseux in vitro. Différents groupes ont montré par la suite que les CSMs peuvent se différencier en cellules pancréatiques (Lee et al., 2004) , neuronales (Woodbury et al., 2000), en os (Haynesworth et al., 1992), en cartilage (Yoo et al., 1998), en muscle (Wakitani et al., 1995), stroma de la moelle (Majumdar et al., 1998), tendon et ligament (Young et al., 1998), tissu adipeux (Dennis et al., 1999) et en différents tissus connectifs (Studeny et al., 2004). Les CSMs de la moelle osseuse sont également capables de freiner et « réparer » les altérations pulmonaires (Curley et al., 2012), le diabète (Si et al., 2012), les désordres neurologiques (Edalatmanesh et al., 2011), les maladies rénales (Alfarano et al., 2012) et les blessures hépatiques (Zhao et al., 2012). En plus de leur pouvoir de différenciation en différents lignages mésenchymateux, les CSMs peuvent aussi donner aissa e sous e tai es o ditio s de ultu e à d’aut es ellules sp ialisées comme les cardiomyocytes.
Ces t a au o t pe is de ett e e ide e des ha ge e ts d’e p essio de certains gènes cardiaques comme la chaîne lourde de myosine, la troponine T cardiaque, des facteurs de transcription précoces cardiaques comme NKx2.5 et GATA4 (Reik, 2007). GATA4 est u gulateu ajeu de l’e p essio des g es a dia ues du a t la diff e iatio (Heineke et al., 2007). P se t da s le œu adulte il joue u ôle de gulateu transcriptionnel de nombreux gènes cardiaques comme le facteur natriuretic atrial, le peptide
Introduction
27 natriuretic de type B, la chaîne lourde de myosine et la troponine T cardiaque qui sont deux protéines contractiles cruciales dans la fonction musculaire squelettique et cardiaque.
3.2.3 Les cellules souches du tissu adipeux
Des études ont montré que le tissu adipeux contient des cellules souches nommées cellules mésenchymateuses dérivées du tissu adipeux (ADSCs ou Adipose tissue-derived stem cells) (Nakagami et al., 2005). Ce tissu est a o da t, fa ile d’a s et ep se te u e potentielle source de cellules pour des transplantations autologues. Les ADSCs sont multipotentes et sont localisées au niveau du stroma vasculaire du tissu adipeux sous cutané. Ces cellules ont beaucoup de similitude avec les CSMs de la moelle osseuse. Elles seraient positives pour les marqueurs SCA-1 et CD44 et négatives pour les marqueurs KIT, CD11b, CD31, CD34 ou CD45 (Nakagami et al., 2005). Elles présentent un phénotype proche de celui des fibroblastes et peuvent se différencier in vitro en adipocytes, ostéoblastes et chondroblastes. Les ADSCs secrètent de o euses toki es HGF, VEGF, PGF, TGFβ, FGF, ANG-1 et ANG) mais aussi des facteurs angiogéniques comme le VEGF et le HGF. Les ADSC partagent beaucoup de gènes avec les CSMs de la moelle osseuse et expriment des marqueurs hématopoéitiques (CD34, CD133 et ABCG2) (Planat-Benard et al., 2004) suggérant une double populatio d’AD“Cs : elles de t pe h atopoï ti ue et elles de t pe se h ateu .
3.2.4 Les cellules progénitrices endothéliales
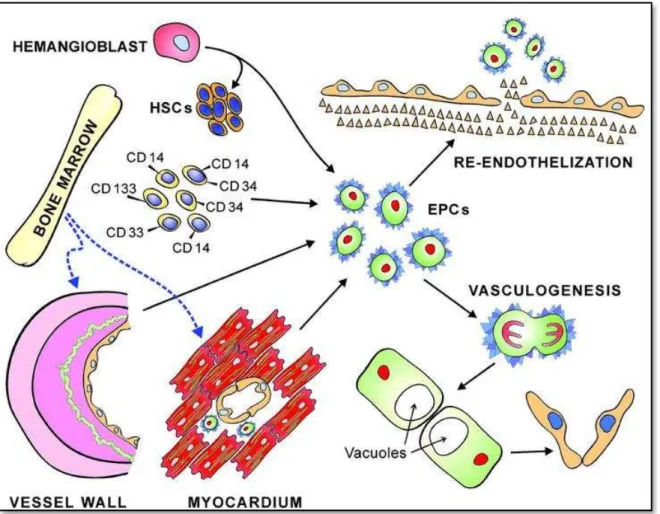
Les cellules progénitrices endothéliales (CPEs) sont des cellules circulantes de la moelle osseuse ui side t au sei de l’e doth liu et o t i ue t à la as uloge se et l’ho ostasie as ulai e (Khakoo and Finkel, 2005) (figure H-5). Elles ont été identifiées pour la première fois en 1997 (Asahara et al., 1997) et ont été isolées à partir du sang périphérique comme étant des cellules exprimant le marqueur CD34. Ces cellules seraient natives de la moelle osseuse.
28 Les h a gio lastes p se ts pe da t l’e oge se se aie t à l’o igi e des ellules précurseurs des endothéliums (Kubo and Alitalo, 2003; Risau and Flamme, 1995) mais pourraient également provenir directement des CSHs (Kubo and Alitalo, 2003). En effet, les CPEs partagent des marqueurs communs avec les CSHs comme le CD133 et CD34 mais elles expriment en plus le marqueur endothélial FLK-1 (Liao et al., 2007). Les CPEs se présenteraient comme une sous population de CSHs a a t la apa it d’a u i u ph ot pe e doth lial (Liao et al., 2007). Les CPEs sont très peu nombreuses dans le sang périphérique et dans la moelle, limitant leur utilisation (Nakagami et al., 2005). Ces cellules ont été utilisées en thérapie cellulaire pour différentes pathologies comme certaines maladies cardiovasculaires (Kawamoto and Losordo, 2008) et le diabète (Fadini et al., 2010).
Figure H-5 : Les cellules progénitrices endothéliales (CPEs). Les CPEs peuvent dériver de cellules
embryonnaires (hémangioblastes) et de plusieurs tissus adultes (cellules CD14+/ CD34+/CD133+ du
sang périphérique, moelle osseuse, paroi vasculaire et myocarde). Les CPEs sont impliquées esse tielle e t da s la ee dothelisatio des aisseau l s s et da s l’a gioge se da s des zo es
Introduction
29 3.2.5 Les ellules sou hes de l’ pith liu i testi al :
Les ellules sou hes de l’ pith liu i testi al fo t pa tie des ellules sou hes pith liales des tissus à e ou elle e t apide et e pos s au ilieu e t ieu . L’i testi a u ôle p ote teu ajeu pa la fo atio d'u e a i e a e le ilieu e t ieu d’où la nécessité de se renouveler en permanence. Ce renouvellement (tous les deux à sept jours) est assuré par la présence de cellules souches qui en se différenciant, donnent différents types cellulaires avec différentes fonctions. Les cellules souches intestinales (CSIs) résident dans les cryptes et expriment à leur surface les marqueurs (MSI-1), CD-24 et KIT (Reya and Clevers, 2005). Elles sont multipotentes et se différencient en quatre types cellulaires : les entérocytes ôle d’a so ptio des ali e ts , les ellules u ipa es ali ifo es p ote tio de la su fa e de l'épithélium par la sécrétion du mucus), les cellules entéroendocrines (sécrétion des hormones peptidiques) et les cellules de Paneth (sécrétion de lysozymes et rôle immunitaire) (Goodell et al., 2015) (figure H-6).
Les entérocytes, les cellules mucipares caliciformes et les cellules entéroendocrines se diff e ie t e ig a t e s l’e t it des ptes et e haut des illosit s, es ellules su isse t l’apoptose et des ua e t da s la lu i e i testinale. Les cellules de Paneth se différencient en migrant vers la base de la crypte. Ces cellules ont une durée de vie plus longue
30
Figure H-6 : Les cellules souches intestinales (CSIs). Les CSIs sont localisées au niveau de la base des cryptes de Lieberkühn et sont de deux types : les cellules souches CBC (Crypt base columnar)
et les cellules souches intestinales quiescentes (qISC). Les cellules souches CBC prolifèrent
quotidienne e t et assu e t la p odu tio des diff e ts t pes ellulai es de l’ pith liu
intestinal. Les cellules souches CBC se divisent et produisent des cellules filles progénitrices de deux types ; les cellules TA (transient amplifying) et les cellules progénitrices sécrétrices. Ces cellules progénitrices se différencient par la suite et donnent naissance aux divers types cellulaires de l’ pith liu i testi al e t o tes, ellules ali ifo es, ellules e t oe do i es, ellules de Paneth). Les qISC se divisent rarement sous conditions homéostatiques mais peuvent être induites
à produire de nouvelles cellules souches CBC en réponse à des lésions ou à d'autres stimuli. D’ap s
Introduction
31 3.2.6 Les ellules sou hes de l’ pide e
L’ pide e est u tissu qui se renouvelle constamment par le phénomène de des ua atio . Cette de i e o espo d à l’ li i atio des ellules de la ou he o e ui sont replacées rapidement par les kératinocytes. Il existe ainsi une population de cellules souches multipotentes apa les d’auto e ou elle e t et ui e p i e t des a ueu s sp ifi ues o e la K , des ol ules d’adh sio o e des β -intégrines, des
E-adh i es et des β-caténines. Ces cellules souches portent le nom de cellules souches des kératinocytes (CSKs) (Watt, 2002). Ces CSKs donnent rapidement des cellules intermédiaires qui se détachent de la membrane basale et se différencient (Solanas and Benitah, 2013) (figure H-7). On a ainsi des CSKs au niveau de la couche basale associée à des cellules intermédiaires, des cellules intermédiaires dans la couche épineuse, des cellules différenciées dans la couche granuleuse et des cellules mortes dans la couche cornée.
Les CSKs so t issues d’aut es ellules sou hes ultipote tes appel es ellules sou hes de l’ pide e C“Eps). Les CSEps e p i e t les a ueu s CD , le K et la α -intégrine (Mimeault and Batra, 2006). Les CSEps so t à l’o igi e des cellules progénitrices de la matrice du follicule pileux, des cellules progénitrices des glandes sébacées et des cellules de la papille de i ue. A la diff e e des C“Ks ui e do e t aissa e u’au cellules épidermiques, les CSEps se différencient à la fois e ellules de l’ pide e et e ellules p og it i es de la matrice du follicule pileux. En plus des CSKs et des CSEps, la peau contient également des cellules souches pluripotentes épidermiques issues de la crête neurale (eCSCNs). Les eCSCNs ont été découvertes par LI et al. en 2003 chez la souris comme des cellules exprimant la nestine (marqueur des cellules de la crête neurale) et retrouvées en partie au niveau du bulbe du follicule pileux. Les eCSCNs expriment aussi le CD34 et THY-1 et peuvent se différencier en plusieurs lignages cellulaires incluant des neurones, des mélanocytes, des cellules de Schwann et des cellules de Merkel (Mimeault and Batra, 2006) et (Sakaue and Sieber-Blum, 2015). Les eNCSCs semblent être localisées au niveau du bulbe du follicule pileux mais leur localisation change suivant le cycle folliculaire (Li et al., 2003).