KATHERINE M. GAVR1LCHUK
ETUDE DES NICHES TROPHIQUES DES
RORQUALS DU SAINT-LAURENT PAR
L'ANALYSE DES RAPPORTS ISOTOPIQUES DU
CARBONE ET DE L'AZOTE
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de maîtrise en Biologie
pour l'obtention du grade de Maître es science (M.Se.)
DEPARTEMENT DE BIOLOGIE FACULTÉ DES SCIENCES ET DE GÉNIE
UNIVERSITÉ LAVAL QUÉBEC
2012
Research on how similar species divide resources helps reveal the natural regulation of species diversity.
Résumé
Dans les environnements où les ressources sont limitantes, la compétition pour la nourriture est élevée chez les espèces sympatriques et évolutivement proches. Le nombre d'espèces cohabitant dans une communauté sera déterminé par leur capacité à se répartir les ressources disponibles dans le temps et l'espace. Quatre populations de rorquals coexistent de façon saisonnière dans le Golfe du Saint-Laurent au Québec avec un chevauchement spatial important. La présente étude avait deux objectifs principaux: (1) d'investiguer la différenciation de niche trophique entre ces espèces de rorquals, (2) d'examiner les patrons d'utilisation des ressources alimentaires à long terme afin de mieux comprendre la dynamique trophique de ces prédateurs marins peu étudiés. Malgré un chevauchement considérable de leurs niches trophiques, chaque espèce se distingue par la contribution relative de chaque type de proies au régime alimentaire. L'analyse de la dynamique temporelle des niches trophiques a révélé que les espèces ayant un régime alimentaire généraliste semblent incorporer une plus grande proportion de proies de niveau trophique supérieur depuis les années 1990. Ceci pourrait refléter une réponse aux modifications de l'écosystème, suite à l'effondrement des stocks de poisson de fond dans les années 1990. À l'opposé, l'espèce ayant un régime alimentaire spécialisé démontre aussi le plus faible degré de variation de la niche trophique dans le temps. Ce qui pourrait les rendre plus vulnérable à la compétition interspécifique et aux changements environnementaux.
11
Abstract
In resource-limited environments, competition for food sources is potentially greatest among closely-related, sympatric species. As such, the number of species coexisting in a community will be determined by their ability to partition available resources. Four populations of rorqual whales overlap in distribution in the Gulf of St. Lawrence, Québec, however it is unknown whether they partition their trophic niches. The present study had two primary objectives: (1) investigate whether these sympatric populations segregate the dietary axis of their ecological niche, and (2) assess long-term patterns in resource use to better understand the trophic dynamics of these under-studied populations. Despite a considerable degree of trophic niche overlap, each rorqual species differed with respect to the proportional contribution of different prey sources to diet. Examination of long-term resource use revealed that generalist species seem to have incorporated higher trophic level prey in their diet over time. This could be a response to shifts in prey abundance following the collapse of groundfish stocks in the early 1990s. In contrast, the species with a specialized diet demonstrated the lowest degree of trophic niche variation over time, which may render them more vulnerable to interspecific competition and environmental change.
Avant-propos
Ce mémoire comprend un article rédigé en anglais et conçu pour la soumission à une revue scientifique (type Oecologia ou Marine Ecology Progress Series) suite au dépôt final. Une introduction et une conclusion générale en français sont également incluses, offrant une perspective plus globale des concepts écologiques de ce mémoire. Je certifie que ce mémoire constitue mon écrit original et que plusieurs personnes et organismes ont contribué à ce travail. Les rôles de tous les intervenants sont décrits clairement ci-après.
Le soutien financier pour ce projet a été gracieusement offert par la Fondation J-Arthur Vincent, le Conseil de recherches en sciences naturelles et en génie du Canada, l'Institut Arctique de l'Amérique du Nord, Québec-Océan, Pêches et Océans Canada (Véronique Lesage) et la Station de recherche des îles Mingan.
Gwénaël Beauplet, directeur de recherche, a été l'une des personnes clés impliquée tout au long de mes études supérieures. Un mentor formidable, il a pris une jeune anglophone sous son aile et a su l'encourager à réaliser son plein potentiel académique en assurant le cheminement adéquat de ses études. Nos discussions étaient sans borne; elles passaient du nombre de décimales à inclure dans une valeur de p à des sujets plus profonds tels les tendances observées dans la nature, les principes écologiques et même l'éthique. Gwénaël a démontré un engagement, une accessibilité, un professionnalisme et un soutien impeccable à tous les niveaux de mes études supérieures.
Véronique Lesage, co-directrice de recherche et personne ressource clé de mes études supérieures. Sa contribution à ma réussite ne peut se décrire en quelques lignes. Elle englobe ses conseils indispensables durant les phases initiales de ce projet; la formation appropriée que j'ai reçue pour effectuer toutes les analyses en laboratoire et le soutien financier nécessaire pour analyser l'entièreté de mes données dans un laboratoire spécialisé. Elle a également fourni des données essentielles à ce projet. C'est avec générosité qu'elle a offert son expertise lors de l'analyse des données, de l'interprétation et de la discussion des résultats et qu'elle a fait des recommandations essentielles au cours
iv
de ma rédaction. Il n'y a aucun doute, l'expertise, la rigueur scientifique et la direction de Véronique étaient d'une importance vitale lors de mon projet de maîtrise.
Richard Sears, fondateur de la Station de recherche des Iles Mingan, peut être considéré comme le « père » du jeu de données de rorquals utilisées pour ce projet. Il a fondé la station en 1979 ainsi qu'un programme de recherche à long terme consacré à l'étude écologique et à la dynamique des populations de rorquals dans le Golfe du St-Laurent. J'ai débuté à la station comme interne en 2007 et j ' y suis retournée depuis, à chaque été, comme membre de l'équipe. Les principales sources de données utilisées pour ce projet étaient les catalogues de photo-identification et les échantillons de peau obtenus par biopsie depuis 1992. Ainsi, non seulement Richard a fourni des données essentielles pour entreprendre ce projet, mais il m'a également formé sur le terrain, a apporté un soutien financier et a été un mentor inoubliable.
Christian Ramp, biologiste à la Station de recherche des îles Mingan, a d'abord contribué à ma décision de poursuivre une maîtrise. Il a par la suite joué un rôle crucial dans le choix de la supervision académique essentielle à ce projet et m'a dirigé dans la recherche et l'obtention de subventions. C'est grâce à sa collaboration avec des scientifiques internationaux que j'ai présenté mes travaux à l'Université de St. Andrews en Ecosse, un institut de renommée mondiale pour la science des mammifères marins. Christian m'a également formée sur le terrain et m'a conféré un appui intellectuel lors de mes analyses et de l'interprétation de mes résultats.
Stuart Bearhop, et son groupe de recherche à l'Université d'Exeter en Angleterre.
Durant ma maîtrise, j'ai eu l'occasion de compléter un stage en recherche de trois mois à l'Université d'Exeter en Angleterre avec Stuart Bearhop et son groupe de recherche. L'opportunité de discuter avec les étudiants et les chercheurs internationaux poursuivant des projets similaires au mien a été une expérience des plus précieuses au cours de mes études. Ce groupe de recherche est à la source de conseils importants sur les techniques d'analyse de données et sur l'interprétation des parties fondamentales de ce projet.
Autres remerciements importants Membres du labo de Gwénaël Beauplet
Un gros merci au « Phoquing lab » - Geneviève Lambert, Joanie Van de Walle, Pierre-Etienne Lessard, Rae Couture, Caroline Sauvé - de m'avoir accepté, même si j'étudiais les baleines. Votre soutien moral et intellectuel a été grandement apprécié et je chéris les moments que nous avons passé ensemble.
Membres de la Station de recherche des îles Mingan
Merci à tous les membres qui ont contribué à cette base de données impressionnante. Vos efforts seront toujours reconnus et révérés.
Yves Morin, technicien au Ministère de Pêches et Océans Canada
Vous m'avez enseigné la patience et l'approche méticuleuse nécessaire à la préparation des tissus pour l'analyse des isotopes stables. Votre enthousiasme, votre efficacité et votre engagement ont fait du travail en laboratoire un plaisir absolu et une expérience exceptionnelle.
Thomas Doniol-Valcroze, biologiste au Ministère de Pêches et Océans Canada
Un merci tout spécial à Thomas qui a également travaillé à la Station de recherche des îles Mingan et qui a poursuivi ses études supérieures en utilisant la base de données de la Station de recherche. Les résultats de sa thèse ont déclenché mon projet et m'ont mise sur la piste de certaines de mes propres questions de recherche.
Jacques Larochelle et Jean-Éric Tremblay, professeurs-chercheurs à l'Université Laval
Vous avez été choisis en fonction de votre expertise et vous avez accepté de faire partie de mon comité d'évaluation. Je vous serai toujours reconnaissante pour votre évaluation et votre critique. Merci.
Table des matières
Résumé i Abstract ii Avant-propos iii Table des matières vi Liste des tableaux viii Liste de figures ix Introduction générale 1
Niche écologique 1 Facteurs favorisant la coexistence 2
Analyse des niches trophiques 4 Rorquals du Saint-Laurent 6 Perturbation de l'écosystème 7
Objectifs 9 Chapitre 1
Isotopic niche partitioning among four sympatric baleen whales in the
Gulf of St. Lawrence, Québec, Canada 10
Résumé 11 Abstract 12 Introduction 13 Materials and Methods 15
Rorqual and prey sampling 15 Stable isotope and gender analyses 17
Data analyses 18 Preservative and lipid-extraction effects 18
Interspecific trophic niche variation 19
Diet inference 20 Temporal and intraspecific effects 22
Results 23 Preservative and lipid-extraction effects 23
Interspecific trophic niche variation 25
Temporal effects 31 Intraspecific effects 37
Discussion 38 Niche partitioning among species 38
Interannual isotope and diet trends 39
Seasonal patterns 42 Intrapopulation variation 42
Acknowledgements 44
Appendix 45 Conclusion générale 49
vu
Importance et implication des résultats 49 Ségrégation des niches trophiques entre les espèces 50
Dynamique temporelle des niches trophiques 51 Ségrégation de la niche trophique au sein d'une espèce 53
Limites méthodologiques de l'étude 54
Perspectives de recherche 55
Liste des tableaux
Table 1. Parameter estimates of linear regressions (y = a + 0x) to predict 513C and 515N
values of rorqual skin stored without solution (y) from skin stored in sea water (x) for both lipid-extracted (LE) and bulk skin. SEM: standard error of the mean, CI: confidence
interval 24 Table 2. Mean (± SD) 513C and ô15N values (%o) and C:N ratios of bulk and lipid-extracted
(LE) skin of blue, minke, fin and humpback whales. Diff : Difference between bulk and LE
treatments 25 Table 3. Trophic niche metrics for blue, fin, humpback and minke whales. Total and core
trophic niche widths were quantified using total hull area (THA) and standard ellipse area (SEA [95 % CI]), respectively. The degree of intrapopulation isotope variation is represented by the mean distance to centroid (DC) and the mean nearest-neighbour
distance (NND) metrics 27 Table 4. Mean (± SD) 513C and 615N values (%o) for male and female blue, fin, humpback
and minke whales in the Gulf of St. Lawrence. Significant differences between males and
females are in bold. Sample sizes are indicated in parentheses 37
Appendix
Table A. Results from the pair-wise statistical comparisons of the location of the centroid (LOC), the mean distance to centroid (DC) and the mean nearest-neighbour distance (NND) for blue, fin, humpback and minke whales. Diff.: Absolute difference between metrics for each species pair. Significantly different contrasts at a = 0.05 are indicated in
Liste des figures
Figure 1. Ô13C - ô15N biplots for blue, fin, minke and humpback whales depicting (A) the
total isotopic niche of each species using convex hulls and (B) the core isotopic niche space occupied by each species represented by standard ellipses. Filled circles represent the
centroids, or the ô13C - 615N bivariate means for each species 27
Figure 2. Mean (± SD) 513C - 515N values of blue, fin, minke and humpback whales and
six potential prey sources (copepods, Arctic krill, Northern krill, American sand lance, capelin and Atlantic herring) in the Gulf of St. Lawrence. Prey are corrected for ô C trophic discrimination values of 0.5 %o in (A) and of 1.0 %o in (B) and for a Ô15N trophic
discrimination of 1.7 %o in both cases. Note that the four rorqual species are no longer included within prey isotope space if a trophic discrimination factor of 1.0 %o for ô C is
applied to prey sources 29 Figure 3. Overall diet composition estimated for blue, fin, minke and humpback whales in
the Gulf of St. Lawrence. The proportion of Arctic krill, copepods, Northern krill-sand lance and capelin-herring are presented as 50 % (inner box), 75 %, and 95 % (outer box)
credibility intervals 30 Figure 4. Mean and 95 % credibility intervals of the core trophic niche width (standard
ellipse area) for blue, fin and humpback whales from 1992/1995 to 2010 and for minke whales from 2007 to 2010 in the Gulf of St. Lawrence. Sample sizes are indicated above
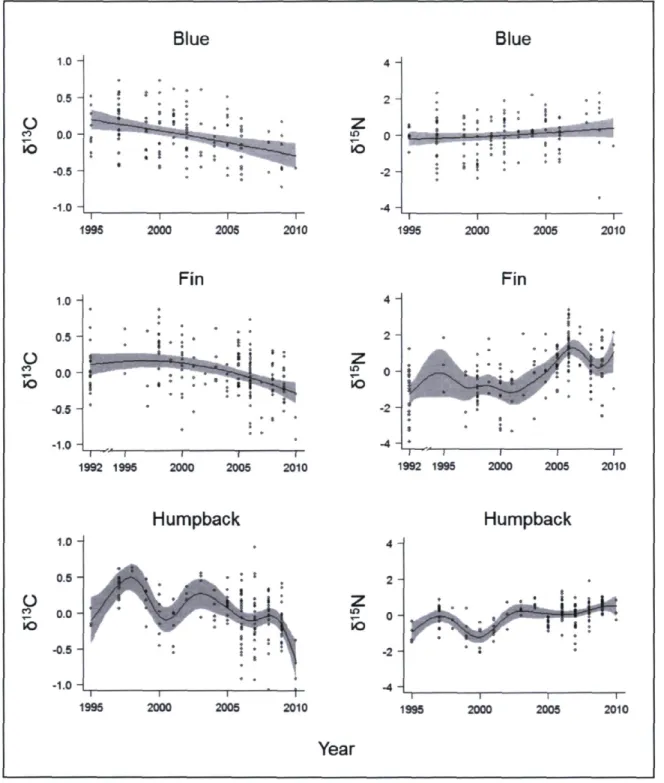
each year 31 Figure 5. Interannual ô13C and 815N trends for blue, fin, and humpback whales from
1992/1995 to 2010 in the Gulf of St. Lawrence. Thej-axis shows the predicted deviations from mean ô1 C and ô15N values. The shaded area represents the 95 % credibility interval
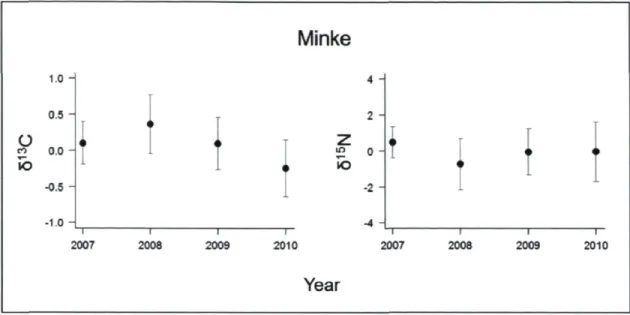
for the estimated non-linear relationship 33 Figure 6. Interannual 813C and ô15N deviations from the overall mean (± SD) for minke
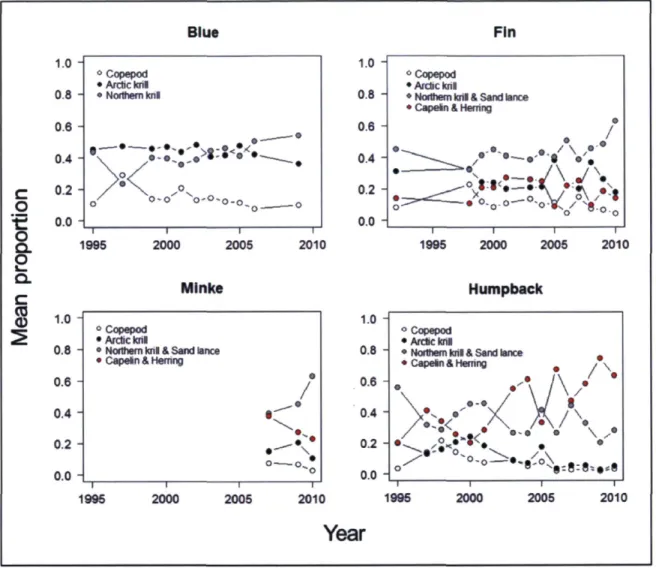
whales from 2007 to 2010 in the Gulf of St. Lawrence 34 Figure 7. Diet compositions for blue, fin and humpback whales from 1992/1995 to 2010
and for minke whales from 2007 to 2010 in the Gulf of St. Lawrence. The mean proportion of each dietary source is presented for each year and credibility intervals have been removed for clarity. Note that the capelin-herring group is not included in blue whale diet estimates as it constitutes a highly unlikely prey source, previously confirmed with the
Figure 8. Intraannual 513C and Ô15N trends for blue, fin, and humpback whales in the Gulf
of St. Lawrence during the summer period. The _v-axis shows the predicted deviations from mean isotope values. The shaded area represents the 95 % credibility interval for the estimated non-linear relationship. Julian days 180 - 260 correspond approximately to June
29 - September 17. Note the shorter Julian day scale for fin whales 36
Appendix
Figure A. Seasonal distribution of blue (Balaenoptera muscuius; filled circles, n = 27), fin (B. physalus; squares, n = 321), humpback (Megaptera novaeangliae; stars, n = 419) and minke (B. acutorostrata; filled triangles, « = 311) whale sightings in the northern Gulf of
St. Lawrence from 1996 to 2000. Extracted from Doniol-Valcroze (2008) 46 Figure B. Hypothetical example demonstrating the trophic niche metrics of two
populations (A and B) using isotope data. The metrics include: (1) the location of the centroid (LOC) indicated with black circles, (2) the total convex hull area (THA) encompassing all observations, (3) the standard ellipse area (SEA) within the convex hulls, (4) the mean distance of all observations to the population centroid (DC) and (5) the mean
nearest-neighbour distance (NND) 47 Figure C. Seasonal 5I3C and ô15N patterns of particulate organic matter (POM) and two
euphausiid species (Arctic and Northern krill) in the St. Lawrence Estuary in 2001. Julian
Introduction générale
NICHE ÉCOLOGIQUE
La niche écologique est un concept théorique central de l'écologie et de l'évolution des espèces. La niche fondamentale pouvant être définie comme l'ensemble de toutes les conditions et ressources qui procureraient un fitness maximum à l'espèce (Hutchinson 1957). Cependant, les interactions intra et interspécifiques tendent à réduire l'étendue de la niche fondamentale d'une espèce, la contraignant ainsi à sa niche réalisée (Hutchinson
1965). La persistance d'une espèce dans une communauté sera ultimement déterminée par sa capacité à exploiter les ressources disponibles malgré la présence de compétiteurs et ainsi maintenir une population viable (Schoener 1974). Selon le principe de Gause, deux espèces sympatriques ne peuvent occuper la même niche écologique de façon durable (Gause 1934). Par sélection naturelle, les espèces les mieux adaptées à une niche écologique particulière seront favorisées, menant à l'exclusion éventuelle des compétiteurs moins bien adaptés (Hardin 1960). De ce fait, le nombre d'espèces cohabitant dans une communauté sera déterminé par l'efficacité de répartir les ressources disponibles dans le temps et l'espace (MacArthur et Levins 1967), c'est-à-dire leur capacité de ségrégation de la niche écologique.
Cependant, des chevauchements dans les niches écologiques se produisent régulièrement dans la nature et exercent différentes pressions sur les espèces concernées selon leur degré de dépendance vis-à-vis de la ressource partagée (Pianka 1973, 1974). Ainsi, les espèces occupant des niches étroites dépendront d'un ensemble restreint de ressources (spécialistes), tandis que les espèces occupant des niches plus larges seront moins restreintes dans leur sélection de ressources (généralistes; MacArthur et Levins 1964, Pianka 1973). Les espèces spécialistes seront ainsi plus sensibles à un chevauchement de niche écologique, aux variations de la disponibilité de leurs ressources principales ou au nombre d'espèces exploitant les mêmes ressources (Pianka 1973, 1974).
La ségrégation de la niche écologique est un phénomène également important au sein d'une même espèce et elle comporte des implications pour l'écologie et l'évolution des populations (Van Valen 1965). En effet, au sein d'une espèce, il peut exister à la fois des spécialisations alimentaires selon le sexe et la classe d'âge (Smith et Skulason 1996). Dans le cas des espèces présentant un dimorphisme sexuel (Shine 1989) et chez lesquelles les besoins énergétiques diffèrent au cours de la vie (Polis 1984), une ségrégation interindividuelle dans l'utilisation de l'habitat ou des ressources alimentaires est souvent observée. Ces variations intraspécifiques peuvent également favoriser l'acquisition des ressources tout en diminuant l'importance de la compétition (Partridge et Green 1985, Bolnick et al. 2003).
FACTEURS FAVORISANT LA COEXISTENCE
Lorsque la ségrégation de la niche écologique constitue le mécanisme principal par lequel les espèces coexistent, quels sont les facteurs à la base de cette ségrégation? Les espèces sympatriques et apparentées sont souvent ciblées pour investiguer cette question en raison de leurs besoins écologiques similaires qui entraînent un risque de compétition potentiellement élevé (Harper et al. 1961). Il est bien établi que les facteurs abiotiques, tels que la température ou la précipitation ont une influence majeure sur la niche écologique des espèces en raison de différentes tolérances physiologiques (Hutchinson 1957, Dunson et Travis 1991). Par contre, les facteurs biotiques jouent un rôle également essentiel au niveau de la ségrégation écologique (Chesson 1986, Schoener 1986). Par exemple, les différences anatomiques entre espèces telles que la masse corporelle (Hutchinson et MacArthur 1959, Peters 1986), la forme corporelle (Gatz 1979) et la morphologie buccale (Newton 1965, Voeten et Prins 1999) peuvent influencer le type ou la densité des proies recherchées (Grant et Grant 2006). Effectivement, les études comparatives chez plusieurs groupes taxonomiques témoignent du fait que les différences morphologiques favorisent la ségrégation trophique ou par habitat parmi les espèces sympatriques, notamment chez les ongulés (Jarman 1974, Clutton-Brock et al. 1980), les primates (Clutton-Brock et Harvey 1977), les rongeurs (Brown et Zeng 1989), les canidés (Bekoff et al. 1981), les oiseaux
(Miles et Ricklefs 1984) et les poissons (Robinson et Wilson 1994). Lorsque les espèces sympatriques ne présentent pas de différences morphologiques évidentes, elles se distinguent souvent par leur comportement alimentaire. Par exemple, plusieurs espèces de passereaux (Fauvettes, Dendroica spp.) occupent des habitats forestiers similaires, ont des préférences de proies similaires et se ressemblent phénotypiquement. Par contre, elles affichent de subtiles différences de microhabitat et de synchronisation dans leur approvisionnement qui semblent suffisantes pour éviter l'exclusion compétitive (MacArthur 1958, Cody 1974, Alatalo 1982).
Les facteurs extrinsèques, tels que la variabilité de l'environnement et l'hétérogénéité spatiale facilitent également la coexistence. Par exemple, les fluctuations dans la disponibilité des ressources peuvent promouvoir la coexistence en entraînant un décalage continu dans l'équilibre de la compétition. En d'autres termes, la disponibilité instable des ressources fait en sorte qu'une seule espèce n'est pas favorisée de manière continue. Ce phénomène, connu comme le «paradoxe du plancton» (Hutchinson 1961) explique comment autant d'espèces de plancton coexistent sans ségrégation apparente de leurs niches écologiques. Finalement, les espèces cohabitant dans les écosystèmes hétérogènes ayant une répartition inégale des ressources peuvent éviter la compétition en occupant des parcelles ('patchs ') de ressources de différente qualité. Par exemple, si les compétiteurs supérieurs occupent les parcelles de bonne qualité, les compétiteurs inférieurs ont la possibilité d'exploiter les parcelles de moindre qualité qui demeurent inoccupées (Horn et MacArthur 1972, Hanski 1983, Atkinson et al. 2004).
Ainsi, la compréhension des mécanismes favorisant la coexistence et la ségrégation des niches écologiques est primordiale afin d'éclaircir les patrons d'assemblages des espèces qui nous entourent (Tokeshi 1999). Jusqu'à présent, l'analyse des conséquences écologiques et évolutives de la compétition et de la coexistence ont été largement basées sur des modèles théoriques (MacArthur et Levins 1967, May 1973, Abrams 1983). L'identification des conséquences de la compétition nécessite un dispositif expérimental qui permet la manipulation des populations (Begon et al. 2006). Les inconvénients de cette approche sont qu'elle peut rarement être adoptée avec la plupart des groupes taxonomiques
et que les résultats ne sont pas toujours représentatifs des processus retrouvés en nature (Werner 1998). Ainsi, étudier la coexistence des espèces en milieu naturel présente plusieurs avantages notables, tels que la réduction des biais liés aux expériences en milieu contrôlé et l'opportunité de détecter les effets des fluctuations des ressources sur la dynamique des niches écologiques.
ANALYSE DES NICHES TROPHIQUES
L'étude des niches trophiques vise à identifier les ressources alimentaires exploitées par des individus ou des populations. Ces études sont ardues lorsqu'il s'agit d'espèces cryptiques dans des environnements difficiles d'accès, tel que le milieu marin (Brown
1995). Pour mieux comprendre la ségrégation des niches trophiques dans ces environnements, il est utile d'identifier d'abord les espèces dans la communauté et les ressources exploitées par ces différentes espèces (Bowen 1997). Les preuves indirectes du niveau de chevauchement des niches deviennent donc des outils essentiels dans ces milieux difficiles d'accès (Bowen 1997).
Plusieurs techniques permettent d'étudier la sélection des ressources et les relations trophiques des espèces sauvages. Les méthodes traditionnelles s'appuient sur l'observation directe du comportement alimentaire (Caraveo-Patino et Soto 2005), ou des méthodes plus indirectes comme l'analyse des contenus stomacaux ou fécaux (Jonsgârd 1982, Ichii et Kato 1991, Smith et Whitehead 2000, Jarman et al. 2002). Or, ces approches comportent des limitations importantes avec les espèces aquatiques qui ne peuvent être capturées et qui passent la majorité de leur temps sous l'eau et au large des côtes, comme c'est le cas pour plusieurs cétacés. Ces méthodes ne proposent aussi qu'un aperçu à court terme des comportements alimentaires et des proies ingérées, ne fournissant pas une représentation adéquate de l'ensemble des ressources assimilées sur des périodes prolongées (Mann
1999). Les marqueurs biochimiques, tels que les isotopes stables du carbone et de l'azote ainsi que les profils d'acides gras, offrent une méthode indirecte pour identifier les composantes du régime alimentaire des animaux. L'avantage de ces marqueurs
biochimiques est d'intégrer la composition des ressources alimentaires assimilées à long terme (Hobson et al. 1996, Iverson 1997, Dalerum et Angerbjôrn 2005). L'intégration temporelle de la signature isotopique d'un tissu dépend du taux de renouvellement des protéines de ce tissu. Plus le taux de renouvellement est réduit, plus l'intégration temporelle est faible. Par exemple, les globules rouges nous donneront des indications à l'échelle du mois tandis que le plasma, à l'échelle de la semaine. D'autres tissus tels que les os ou les dents, refléteront une période précise de la vie de l'animal correspondant à la période de croissance du tissu (Koch 2007, Wolf er al. 2009).
Dans la nature, les éléments carbone et azote existent sous deux états stables qui diffèrent selon leur masse atomique (Hoefs 1980). Ces isotopes se comportent différemment dans les processus métaboliques, biochimiques et physico-chimiques, créant des patrons de distribution distinctifs dans les tissus des espèces vivantes et leur environnement (Broecker et Oversley 1976, Lajtha et Michener 1994). L'approche par analyse des isotopes stables en écologie permet d'observer que la composition isotopique des tissus animaux est dérivée de la composition isotopique des ressources assimilées (Peterson et Fry 1987). Les isotopes légers sont métabolisés et éliminés du corps plus rapidement que les isotopes lourds, produisant ainsi un enrichissement progressif de l'isotope lourd à travers la chaîne alimentaire (Fry et Sherr 1984, Minawaga et Wada 1984). L'enrichissement trophique varie selon les espèces mais est généralement plus faible (environ 0 à 1 %o par niveau trophique) pour le carbone que pour l'azote (environ 2—4 %o; Deniro et Epstein 1981, Peterson et Fry 1987, Post 2002). Pour cette raison, le Ô13C nous renseigne sur les
différentes sources en carbone des réseaux trophiques. Ainsi, Ô13C est utilisé pour
différencier des organismes côtiers/benthiques des organismes hauturiers/pélagiques (Rau et al. 1982, Tieszen 1991, Best et Schell 1996). Tandis que le rapport isotopique de l'azote (ô15N) s'enrichit systématiquement à chaque niveau trophique, permettant de situer les
organismes dans la chaîne trophique (Fry et Sherr 1984, Minagawa et Wada 1984). Donc, les signatures isotopiques de diverses espèces peuvent être comparées afin d'établir l'étendue relative des niches trophiques et d'inférer la composition des régimes alimentaires (Bearhop et al. 2004).
6
RORQUALS DU SAINT-LAURENT
L'estuaire et le golfe du Saint-Laurent se caractérisent par une faune marine riche et diversifiée. L'écosystème se distingue par une isolation partielle de l'Atlantique Nord, un apport d'eau douce de source terrestre, la présence d'une dépression profonde qui le traverse sur sa longueur, des glaces saisonnières, une couche intermédiaire froide et une faible profondeur (Therriault et al. 1990). Ces caractéristiques abiotiques dynamiques y engendrent la production d'une biomasse élevée d'organismes phytoplanctoniques (Therriault et al. 1990). Ces organismes, ainsi que détritus, forment la matière organique particulate, laquelle représente une source d'énergie cruciale pour le réseau trophique marin (Eppley et Peterson 1979). Les principales composantes de cet écosystème comprennent les macrophytes, le plancton, les invertébrés, les reptiles, les poissons, les oiseaux et les mammifères marins (DFO 2010). Parmi les mammifères marins, quatre espèces de baleines à fanons dont le rorqual bleu (Balaenoptera muscuius, ca. 100,000 kg; Lockyer 1976), le rorqual commun (B. physalus, ca. 45,000 kg; Lockyer 1976), le petit rorqual (B. acutorostrata, ca. 7,500 kg; Lockyer 1976) et le rorqual à bosse (Megaptera novaeangliae, ca. 35,000 kg) coexistent spatio-temporellement de manière saisonnière dans le Saint-Laurent (Mitchell 1975, Doniol-Valcroze 2008). A chaque été, les quatre espèces migrent de leurs aires de mise bas et d'hivernage vers l'estuaire et le golfe du Saint-Laurent afin de profiter des concentrations élevées de proies pour s'alimenter intensément (Lockyer et Brown 1981).
La niche trophique des rorquals, de même que les zones fréquentées durant la période d'alimentation, sont gouvernés par plusieurs paramètres environnementaux statiques et dynamiques (Croll et al. 1998). Notamment la profondeur de l'eau (Davis et al. 2002, Tynan et al. 2005), la topographie du fond marin (Davis et al. 2002, Ingram et al. 2007) ainsi que la température de l'eau à la surface (Hamazaki 2002, Doniol-Valcroze et al. 2007). Des fluctuations de température, ainsi que les activités anthropogéniques, pourraient influencer la distribution et la disponibilité de proies des rorquals. Or, afin de prédire les conséquences des changements environnementaux sur la niche écologique des rorquals, il
est essentiel d'obtenir une bonne compréhension de leur niche alimentaire et de la dynamique temporelle.
Les rorquals appartiennent à la famille des Balaenopteridae qui ont comme caractéristique commune l'utilisation du même mode d'alimentation, rengouffrement (Pivorunas 1979). Cette stratégie alimentaire leur permet d'engloutir d'énormes quantités de proies de petite taille, en étirant leur poche ventrale, augmentant ainsi le volume de leur cavité buccale (Pivorunas 1979). Les espèces zooplanctoniques et les petits poissons pélagiques constituent les proies principales des rorquals (Gaskin 1982). Étant donné leurs besoins énergétiques importants et la petite taille des espèces consommées, les rorquals requièrent des concentrations élevées de proies (Brodie et al. 1978, Tershy 1992, Wishner et al. 1995). Des études antérieures portant sur les contenus stomacaux des rorquals bleus ont démontré qu'ils se nourrissent presqu'exclusivement de zooplancton euphausiacé (Yochem et Leatherwood 1985), tandis que les rorquals communs, les rorquals à bosse et les petits rorquals ont un régime alimentaire légèrement plus varié, composé de zooplancton et de poissons pélagiques (Gaskin 1982). En effet, bien que les préférences alimentaires des quatre espèces de rorqual, de même que les densités de proies soient inconnues (Mitchell 1975), les connaissances actuelles suggèrent un chevauchement de leurs niches trophiques (Mitchell 1975, Borobia et al. 1995, Doniol-Valcroze et al. 2007). Toutefois, en l'absence d'information concernant la diète des rorquals dans le Saint-Laurent, une analyse approfondie des patrons d'utilisation de ressources alimentaires apparaît nécessaire afin de mieux connaître et comprendre les besoins écologiques de chaque espèce.
PERTURBATION DE L'ÉCOSYSTÈME
Au cours des deux dernières décennies, des changements notables de la structure trophique du Saint-Laurent ont été documentés (Hutchings et Myers 1995, Myers et Worm 2003, Frank et al. 2005). En particulier, la surpêche et l'effondrement subséquent de plusieurs stocks de poisson de fond commerciaux au début des années 1990 (Myers 1997) et l'accroissement concomitant de certains stocks de crustacés et de poissons fourrages
8
(Worm et Myers 2003, Frank et al. 2005). Alors que certaines populations de pinnipèdes se sont fortement accrues depuis les années 1970 et 1980 (Mohn et Bowen 1996, Hammill et Stenson 2005), les répercussions de ces changements écologiques sur les niches trophiques des rorquals sont incertaines. Il est notamment possible que ces changements aient modifié l'abondance ou la disponibilité de certaines de leurs proies (Savenkoff et al. 2007).
Parallèlement à ces changements dans l'abondance des poissons piscivores et de leurs proies, on a pu également détecter des changements dans les nombres d'observations de certaines espèces de rorquals dans le golfe du Saint-Laurent. Par exemple, entre 1980 et 1990, on pouvait observer les quatre espèces de rorquals dans le secteur de Mingan, au nord du golfe. Or, un déclin important du nombre d'observations des rorquals bleus a été noté depuis le début des années 1990, parallèlement à une augmentation du nombre d'observations des rorquals à bosse dans cette région (Comtois 2009). Bien que le rorqual bleu soit observé dans d'autres régions du golfe du Saint-Laurent, ces observations dans le secteur de Mingan pourraient être liées aux changements écosystémiques qui semblent avoir favorisé les autres espèces de rorqual, tout en ayant eu l'effet inverse sur les rorquals bleus (Comtois 2009). Il est possible que les rorquals bleus aient besoin d'une densité de proies supérieures aux autres espèces de rorqual et par conséquent, qu'ils se soient déplacés vers des habitats plus favorables. Une observation similaire a d'ailleurs été documentée dans la baie de Monterey en Californie, celle-ci ayant coïncidé avec un déclin de la biomasse du krill (Schoenherr 1991). En tenant compte de la nature sténophage des rorquals bleus, ces derniers pourraient être plus vulnérables face à un déclin majeur de leurs proies (Clapham et al. 1999). Les changements écosystémiques représentent donc une excellente occasion d'examiner la flexibilité des niches trophiques. En outre, en l'absence de données précises sur la dynamique des populations de proies, les rorquals eux-mêmes pourraient servir d'indicateurs de l'état des ressources qu'ils consomment (Brodie et al.
OBJECTIFS
Les principaux objectifs de cette étude sont : i) de mieux comprendre l'utilisation des ressources alimentaires et la ségrégation des niches trophiques parmi les quatre espèces de rorquals du Saint-Laurent, ii) d'examiner les relations trophiques au cours du temps afin de mieux comprendre la dynamique temporelle des niches trophiques face aux changements écosystémiques et iii) d'investiguer les facteurs démographiques influençant l'utilisation des ressources au sein d'une espèce.
Chapitre 1
Isotopic niche partitioning among four sympatric baleen whales
in the Gulf of St. Lawrence, Québec, Canada
Katherine Gavrilchuk,1'2 Véronique Lesage,3 Richard Sears,2 Christian Ramp,2 Gwénaël
Beauplet1
1 Department of Biology, Université Laval, Québec, Québec GIV 0A6, Canada
2 Mingan Island Cetacean Study, 378 bord de la Mer, Longue-Pointe-de-Mingan, Québec
GOG 1V0, Canada
3 Maurice Lamont
Mont-Joli, Québec G5H 3Z4, Canada
11
Résumé
Dans les environnements où les ressources sont limitantes, la forte compétition pour la nourriture entre les espèces écologiquement similaires, devrait favoriser une ségrégation de leurs niches écologiques. Dans le Golfe du Saint-Laurent, quatre populations de rorquals (le rorqual bleu Balaenoptera muscuius, le rorqual commun B. physalus, le rorqual à bosse Megaptera novaeangliae, et le petit rorqual B. acutorostrata) se chevauchent en distribution et partagent des besoins alimentaires similaires. Par contre, la ségrégation de leur niche trophique, ainsi que la dynamique temporelle dans l'utilisation des ressources est peu connue. La présente étude visait 1) de déterminer si ces espèces sympatriques se différencient au niveau de leur régime alimentaire, 2) d'évaluer les tendances à long terme de leurs utilisation des ressources en tenant compte des changements récents dans le structure trophique du Golfe du Saint-Laurent, et 3) d'investiguer la ségrégation de la niche trophique au sein d'une espèce, notamment en fonction du sexe, de l'âge et du statut reproducteur. Pour ce faire, nous avons analysé les rapports isotopiques du carbone et de l'azote dans des échantillons de peau de 626 rorquals entre 1992 et 2010. Ensuite nous avons déduit le régime alimentaire de chaque espèce de rorqual en fonction des proies potentielles avec des modèles de mélange isotopiques Bayésiens. Nos résultats révèlent que les quatre espèces se distinguent au niveau de la position trophique moyenne, avec les rorquals bleus occupant la plus basse position trophique relative, suivie des rorquals communs, des petits rorquals puis des rorquals à bosse. Ce décalage de position trophique correspond aux différentes contributions des proies de leur alimentation. L'accroissement graduel des valeurs de 515N au cours du temps, notamment chez les rorquals communs et
les rorquals à bosse, suggère une utilisation à la hausse des proies de niveau trophique supérieur, tel que le capelan, le hareng, le lançon et le krill nordique. Ceci pourrait refléter une réponse aux changements d'abondance des proies suite à l'effondrement des stocks de poisson de fond dans les années 1990. Nous n'avons trouvé aucune ségrégation trophique au sein des rorquals bleus et des rorquals à bosse. En revanche, les rorquals communs et les petits rorquals semblent utiliser des ressources différentes en fonction du sexe, ce qui mérite une étude plus poussée sur les mécanismes sous-adjacents. Cette étude représente la première évaluation à long terme de l'écologie trophique des populations de rorquals dans cette aire d'alimentation du nord-ouest de l'Atlantique.
12
Abstract
In resource-limited environments, increasing competition for food sources among ecologically similar species should promote dietary, habitat or temporal niche segregation. In the Gulf of St. Lawrence, Québec, four populations of rorqual whales (blue Balaenoptera muscuius, fin B. physalus, humpback Megaptera novaeangliae and minke B. acutorostrata) have similar foraging requirements and overlap in distribution, however little is known of their resource utilization patterns and how this behaves with time. The present study aimed to: 1) investigate whether these sister taxa segregate the dietary axis of their ecological niche; 2) assess long-term patterns in resource use, particularly in light of recent changes in the Gulf of St. Lawrence trophic structure and 3) explore intraspecific trophic niche partitioning, particularly between genders, age classes and reproductive stages. To do so, we analyzed carbon and nitrogen stable isotope ratios in skin biopsies of 626 rorqual individuals from 1992 to 2010 and reconstructed diet using potential prey sources. Our findings reveal that the four species do indeed differ in mean trophic position, with blue whales occupying the lowest relative trophic position, followed by fin, minke and humpback whales. This offset in trophic position corresponded to differences in the importance of shared prey to diet, providing evidence for trophic niche segregation. The interannual variability and overall increase in 515N values, particularly for fin and
humpback whales, suggests a progressive use of higher-trophic level prey, such as capelin, herring, sand lance and northern krill, which may be a response to shifts in prey abundance following the collapse of groundfish stocks in the early 1990s. We found no evidence of intraspecific trophic segregation within blue or humpback whales. In contrast, fin and minke whales do appear to segregate diet according to gender, which merits further exploration as to the underlying causal mechanisms. This study represents the first long-term assessment of trophic niche ecology among rorqual populations on this Northwest Atlantic feeding ground.
13 Introduction
The fundamental ecological niche describes a particular set of resources and environmental conditions required for a species to persist, and thus reflects part of its evolutionary history (Hutchinson 1965). This niche is further shaped by intra and interspecific interactions, constraining species to their realized niche (MacArthur 1972). Indeed, interspecific competition is considered one of the main driving forces of trophic, habitat and temporal segregation (Gause 1934, Pianka 1973, Rosenzweig 1987). Further, environments where resources fluctuate considerably in both space and time may facilitate coexistence among species with overlapping niches by continuously shifting the balance among competing species (Chesson 1994).
The Estuary and Gulf of St. Lawrence represents one of the largest and most productive marine ecosystems in Canada (Dickie and Trites 1983). Seasonal periods of high food abundance attract over a dozen marine mammal species, including four populations of Balaenopterid whales. These whales share unique morphological traits and a specialized feeding behaviour designed to exploit small, aggregating prey species (Pivorunas 1979). Use of similar food sources may have engendered a resource partitioning strategy to reduce negative impacts of competition (Clapham and Brownell 1996). From what is known, blue whales (Balaenoptera muscuius) feed predominantly on euphausiid zooplankton (krill; Kawamura 1980), while fin (B. physalus), minke (B. acutorostrata) and humpback (Megaptera novaeangliae) whales tend to have more diverse diets consisting primarily of krill and small schooling fish (Jonsgârd 1966, Mitchell 1975). Despite distributional overlap in the Gulf of St. Lawrence (Fig. A in Appendix), each rorqual species has been associated to a particular combination of dynamic habitat variables (Doniol-Valcroze et al. 2007), suggesting a finer-scale spatial partitioning than expected. However, it is unknown whether subtle differences in habitat use are sufficient to mitigate competition, or if trophic segregation is also at play.
Furthermore, we still do not understand how shifts in food web structure and prey abundance influences rorqual trophic ecology. This is rather important if we wish to
14
predict how removal of key ecosystem components cascades to other trophic levels. Over the last two decades, major changes have occurred in Northwest Atlantic ecosystems; notably, the collapse of several commercial groundfish stocks and the subsequent increase in abundance of respective prey populations (Myers et al. 1996, Worm and Myers 2003). Removing these important predators may well have altered prey availability for rorqual populations (Frank et al. 2005, Heithaus et al. 2008). Thus, a retrospective assessment of rorqual trophic ecology following this event will provide insight into the degree of trophic flexibility and the dynamics of resource sharing among these sister taxa in a changing environment.
Traditional methods to study animal trophic ecology have relied on gut or fecal content analyses or direct observation of feeding (Reynolds and Aebischer 1991, Deb 1997). Although highly informative, such methods are impractical or unfeasible with large, oceanic predators and may under-represent the extent of exploited dietary sources (Deb
1997). Alternatively, indirect approaches such as fatty acid or stable isotope analysis of tissues can be more achievable and reflect assimilated rather than ingested diet over various time frames (Iverson 1997, Hobson 1999, Kelly 2000). Stable isotope analysis has become one of the most sought-after techniques to investigate resource use due to the relatively predictable relationship between diet and consumer isotopic composition (Peterson and Fry 1987). By using diet reconstruction models in tandem with trophic niche metrics, we can test hypotheses regarding resource partitioning among coexisting populations (Bearhop et al. 2004, Layman et al. 2007, Jackson et al. 2011, Newsome et al. 2012).
The primary objective of this study was to test the prediction that coexistence among closely-related, sympatric taxa requires a certain degree of trophic niche segregation. To do so, we quantified the dietary axis of the niche of each rorqual species in the Gulf of St. Lawrence. Our second objective was to measure long-term patterns in resource use among the four rorqual species to better understand trophic niche consistency. We predicted resource use among blue whales to remain relatively stable over the study period; in contrast, we expected resource use among fin, humpback and minke whales to demonstrate
15
interannual variability and potentially reflecting the state of certain prey stocks in the St. Lawrence system following the collapse of groundfish populations. Our final objective was to evaluate trophic niche segregation among individuals within a species, particularly in relation to demographic factors known to influence feeding habits such as sex, age class and reproductive status.
Materials and Methods
RORQUAL AND PREY SAMPLFNG
Skin samples were collected from a total of 626 free-ranging rorqual individuals, comprising 143 blue, 195 fin, 207 humpback and 81 minke whales. Whales were sampled from May to October of 1992 to 2010 in the Estuary and northern Gulf of St. Lawrence, Québec, Canada (49° 36' 38", 64° 20' 09"), although the majority of samples (~ 85 %) were collected in July, August and September. Biopsies were performed from rigid-hulled, inflatable boats using a crossbow and hollow-tipped arrow system (Palsboll et al. 1991, Borobia 1995). The arrow tip, measuring 40 mm in length and 8 mm in diameter, contained three inner barbs to retain the tissue upon impact. Samples were taken mid-laterally, approximately 0.3-0.7 m below the dorsal fin. The pigmented layer of the skin (epidermis) was separated from the dermis and underlying fat using a sterile scalpel. All samples were stored in plastic vials and on ice immediately after collection, and subsequently at -20°C until analyses. Samples taken from 1992 to 2005 were originally destined for genetic analyses and preserved in a 20 % v/v dimethyl sulfoxide solution (DMSO) of deionized water saturated with NaCl (Seutin et al. 1991). In following years, samples were stored in sea water (2006-2008) or without solution (2009-2010). Effects of DMSO on isotope ratios have been assessed previously and are predictable (Lesage et al. 2010). However, the effects of sea water are uncertain, and thus potential bias was assessed by comparing isotope ratios between skin aliquots preserved in sea water and without solution for 10 to 33 weeks.
16
All sampled individuals, except minke whales, were photo-identified using pigmentation patterns, scars, and size and shape of the dorsal fin (Hammond 1990, Sears et al. 1990). Age class of humpback whales was determined using photo-identification records. Calves (< 1 yr) were identified by their unambiguous dependence on a mother; juveniles (1-5 yr) were defined as sexually immature individuals (Chittleborough 1965, Clapham 1992), and we considered individuals over the age of 5 as adults. Reproductive state of mature females was inferred by the presence of a calf (lactating). We then assumed pregnancy in the preceding year and 'resting' in the year following lactation (Chittleborough 1958). Although there have been reports of female humpbacks becoming pregnant immediately following lactation (Clapham and Mayo 1990), this phenomenon has not yet been observed in the Gulf of St. Lawrence (Ramp 2008).
Potential prey species were selected based on gut and fecal analyses (Nemoto 1959, 1970, Croll et al. 1998) and direct observation of rorqual feeding behaviour (Watkins and Schevill 1979). Specimens were collected primarily during summer months (May through September) of 1995, 1996, 2001-2004 and 2010 following methods outlined in Lesage et al. (2001). Briefly, zooplankton was collected by vertically towing Bongo nets (1 m diameter x 3 m length) with a 333 pm mesh size and kept alive overnight to allow gut clearance. Muscle tissue was excised from prey specimens for stable isotope analyses. In addition, particulate organic matter (POM) and euphausiid zooplankton were sampled weekly from May to September in 2001 at a fixed station in the St. Lawrence Estuary to monitor seasonal isotope shifts. POM was collected with 4 L Niskin bottles at a depth of maximum chlorophyll production ( 10-24 m) and obtained by filtering water through pre-combusted Whatman GF/C glass microfiber filters (Lesage et al. 2001). All samples were stored at -20°C until analyses.
Isotopic turnover rate for epidermal tissue is unknown for baleen whales, however is estimated at 70-75 d for belugas Delphinapterus leucas (St. Aubin et al. 1990) and bottlenose dolphins Tursiops truncatus (Hicks et al. 1985). Tissue turnover time will also be influenced by body size, tissue growth rate, and properties of the ambient environment such as water temperature and salinity (Tieszen et al. 1983, Hicks et al. 1985, St. Aubin et
17
al. 1990). Since it is difficult to estimate how these effects alter epidermal turnover rate for rorquals, we suggest that turnover time for skin may be at least 75 d and probably longer due to lower metabolic rates than delphinids (Ruiz-Cooley et al. 2004, Lockyer 2007). Therefore, by August, most of the rorquals should have integrated summer diet within their skin.
STABLE ISOTOPE AND GENDER ANALYSES
Since weak sexual dimorphism in rorquals hinders gender determination in the wild, gender was determined genetically for all individuals by collaborators at the University of Stockholm (Sweden) using standard polymerase chain reaction methods (PCR; Saiki et al. 1988) targeting sex-specific gene regions (Palsboll et al. 1992, Bérubé and Palsboll 1996). As for stable isotope analysis, rorqual skin samples preserved in sea water or without solution were rinsed three to five times with deionized water, cut into small pieces, transferred into aluminum cups and freeze-dried at -40°C to a constant mass. Dried samples (ca. 20 mg) were then homogenized to a fine powder and transferred into plastic or glass vials. Since variable lipid content within and between individuals can alter the carbon isotope ratio of bulk tissue (DeNiro and Epstein 1977, Focken and Becker 1998), a subset of samples preserved without solution were analysed with and without lipids to assess the effect of lipid-extraction on isotope ratios. This protocol is desired whenever possible, as the presence of tissue-lipids can bias isotope readings and their effects should be quantified to improve sample preparation methods (Sweeting et al. 2006, Mintenbeck et al. 2008). Samples stored in DMSO were rinsed three times and lipid-extracted since this procedure has the potential to remove DMSO from skin tissue (Lesage et al. 2010). Lipids were extracted from freeze-dried, homogenized samples using polar, organic solvent mixtures capable of removing most classes of intracellular and membrane lipids (Folch et al. 1957). Briefly, 5 mL of 2:1 chloroform:methanol solution was added to a sample, gently mixed for 1 h at room temperature, and centrifuged at 2500 rpm for 15 min. The supernatant was then removed, transferred to an aluminum dish and placed under a fume hood for solvent evaporation. This extraction was repeated three times. All samples were
18
then pre-weighed, sealed in tin capsules (sample mass ca. 0.28 mg) and analyzed for carbon and nitrogen isotope ratios using a Thermo Finnigan DELTA plus XL Continuous Flow Stable Isotope Mass Spectrometer coupled to a Carla Erba Elemental Analyzer (CHN EA1110; Isotope Tracer Technologies Inc., Waterloo, Ontario, Canada). The ratio of heavy to light isotope in the samples is presented in delta notation (ô) relative to reference standards, PeeDee Belemnite (PDB) for carbon and atmospheric N2 for nitrogen, such that ô1 C or 815N (measured in parts per thousand, %o) = [C/?sampi_/Rstandar_) - 1] x 1000, where
^sample is the C: C or ivf: Tsf ratio of the sample and i?standard is the ratio of the
appropriate standard. Duplicate isotopic measurements were made on a subset of samples (n = 115) to quantify repeatability and yielded an average absolute difference of 0.1 ± 0.2 %o for 613C and 0.2 ± 0.3 %o for 815N. Element-specific laboratory standards were
run every 10 samples to calibrate the system and compensate for any drift in isotope readings.
DATA ANALYSES
I. PRESERVATIVE AND LIPID-EXTRACTION EFFECTS
The effect of DMSO preservation on isotope values of Balaenopterid skin has been quantified (Lesage et al. 2010), and thus we applied these corrections factors to our DMSO samples post-lipid removal. The effect of sea water on ô13C and ô15N values was assessed
by comparing isotope values of samples stored in sea water with those stored without solution using paired Student's Mests (a = 0.05) and linear regressions. Levene's test of homogeneity was used to examine the effect of preservation method on sample variance. All subsequent analyses considered lipid-extracted C and bulk N (non-lipid-extracted) isotope ratios as the true or reference isotope values for tissues (Sotiropoulos et al. 2004, Sweeting et al. 2006, Mintenbeck et al. 2008).
19
II. INTERSPECIFIC TROPHIC NICHE VARIATION
A simple analysis of variance (ANOVA) was first performed to verify whether the four rorqual species differed in their 513C or ô15N values, and Levene's tests were used to test
for homogeneity of variance. Tukey's Honestly Significant Difference (HSD) tests were used for post-hoc comparison of means between species. Trophic niche characteristics were then determined with the position of isotope data points in bivariate space and expressed as Euclidean distances, which are essentially measures between Cartesian points. We chose five metrics (described below and see Fig. B in Appendix) to characterize and compare trophic niche space among rorqual species (Cornwell et al. 2006, Layman et al. 2007, Turner et al. 2010, Jackson et al. 2011). These area-based metrics were not baseline-corrected as we assume all four species belong to the same food web and have access to the same resources.
1) Location of centroid (LOC): Position of the 513C and ô15N bivariate mean in isotope
space. This metric provides fundamental information regarding average trophic position and exploited carbon sources of a species.
2) Total convex hull area (THA): Total area encompassing all 513C and S15N observations
in isotope space, providing a measure of the total niche space occupied by a species. This approach is valuable for quantifying trophic niche space as it includes all individuals from the sampled population, however it may be subject to sample size bias since hull area will either remain stable or increase with increasing sample size (Jackson et al. 2011).
3) Standard ellipse area (SEA): A metric derived from circular statistics (Batschelet 1981) describing bivariate data as standard deviation would in univariate cases, providing an representation of the core niche space occupied by a species. This measure is less sensitive to sample size than the THA since ellipses are built to contain ca. 40 % of the data (Jackson et al. 2011). Further, SEAs are computed under a Bayesian framework, allowing for a better integration of uncertainty associated with sampling (Ellison 2004).
20
4) Mean distance to centroid (DC): Average Euclidean distance of all isotope observations to the §13C-515N bivariate mean (centroid) of a particular species. This metric indicates
how dispersed individuals are from the population average and provides a measure of the overall trophic diversity within a species.
5) Mean nearest-neighbour distance (NND): Mean of the Euclidean distances to each observation's nearest-neighbour in isotope space for a given species. This gives an indication of how trophically similar individuals are to one another, and is complementary to the mean distance to centroid (DC).
The first three metrics reflect the relative position of each rorqual to one another in niche space and also indicate the degree of trophic overlap among rorquals. The two last metrics provide a measure of intrapopulation dietary variability for each rorqual species. In order to reduce interannual variability and still maintain large sample size, only 2006 to 2010 samples were used for the aforementioned interspecific analyses. We tested for differences in the LOC using a multivariate Hotelling's T2 test, appropriate for pair-wise comparisons
of means (Hotelling 1931). Differences in DC and NND were tested by generating null distributions from residual permutation procedures in order to evaluate probabilities associated with test statistics (Turner et al. 2010). The LOC, DC and NND metrics between any two species were considered significantly different if the difference between them was statistically greater than zero (Turner et al. 2010). All metrics were computed using the SIAR package (Parnell et al. 2008, 2010) available from the Comprehensive R Archive Network (http://cran.r-project.org/).
III. DIET INFERENCE
Diet composition was assessed using a multi-source, multi-isotope Bayesian mixing model (Parnell et al. 2010). This model explicitly accounts for uncertainty in input parameters, such as dietary sources and discrimination factors, and estimates probability distributions
21
of source contributions (Moore and Semmens 2008). An important prerequisite for the proper application of any isotope mixing model is that relevant dietary sources must be isotopically distinct (Phillips 2001). In cases where isotope values of two or more dietary sources overlap, the mixing model will have difficulty teasing out which source is contributing to diet (Phillips and Gregg 2001). One solution is to aggregate sources into biologically meaningful categories (e.g. functional groups; Phillips and Gregg 2003). In this study, prey sources were pooled if their isotope signatures were not statistically different and if the sources in question were biologically or functionally related. Sources were combined a posteriori by summing their respective posterior contributions for each iteration. The relative contribution of each potential prey group was then estimated for the four rorqual species.
Isotopic mixing models also require the definition of trophic discrimination factors (TDFs) between consumer tissue and diet. However, accurate TDFs (also expressed as A13C and
A15N), can only be established from controlled feeding experiments in which the isotopic
discrepancy between consumer and diet can be quantified (DeNiro and Epstein 1978, 1981, Tieszen et al. 1983). There appears to be a relatively predictable relationship between the C:N ratio of a dietary protein source and the A15N (Caut et al. 2008), which can be used to
better inform the ô N discrimination between consumer and diet. Our rorqual prey sources have C:N ratios between 4 and 5, thus we would expect a A15N of no greater than
1.5-2.0 %o. Gendron et al. (2001) reported TDFs of 1.3 %o for 513C and 1.7-1.9 %o for Ô15N
for blue whale skin, assuming a diet consisting exclusively of euphausiids. Borrell et al. (2012) report equivalent A13C values (1.3 %o) for fin whales also feeding on krill; however
their skin-diet A15N value (2.8 %o) is greater than that for blue whales. Abend and Smith
(1995) suggested pilot whales feeding exclusively on mackerel or squid would have TDFs for skin around 1.4-2.0 %o for ô15N, or a value in between (-1.7 %o) if feeding on an equal
mixture of both prey sources. Finally, Ruiz-Cooley et al. (2004) reported TDFs ranging from 0.4-1.8 %o for 513C and 1.6-3.5 %o for 8,5N for sperm whales feeding on jumbo
squid. Since the isotope mixing model we used allowed incorporation of uncertainty in TDF parameters, we used a value of 0.5 %o for A13C and of 1.7 %o for A15N, both bracketed
22
parameter. We also demonstrate how the rorqual-prey mixing space shifts by applying a TDF of 0.5 %o versus 1.0 %o for 513C.
The mixing model used, consisting of N measurements on J isotopes with K sources, can be expressed as follows (Parnell et al. 2010):
„ _ £fc=iPfc Qjk {sjk A- Cjk)
Lk=\ PkQjk
sjk ~N (Hjk, <»]k)
cjk~ N (A-jk'tjk)
e
irN(Q,af)
Where Xl} is the isotope value y of the consumer / and s]t\ is the isotope value of source k for
isotope j and is normally distributed with a mean \xjk and variance co2,*. The term cjk is the
trophic discrimination factor for isotope y on source k and follows a normal distribution with a mean X,* and variance n2^. The value of pk is the estimated proportion of source k in
the diet, q^ is the concentration of isotope j in source k, and e,y is the residual error term with a variance of a / (Parnell et al. 2010). We assigned uninformative priors to pk and ay .
The model then simulates, using a Markov Chain Monte Carlo algorithm, a posterior distribution of probable proportions for every dietary source.
IV. TEMPORAL AND INTRASPECIFIC EFFECTS
To examine interannual variations in trophic niche width, the standard ellipse area (SEA) was computed for each rorqual species for every year, as this method is unbiased with respect to sample size (Jackson et al. 2011). Regression splines (Hastie and Tibshirani 1986, 1990) were then used to assess intra and interannual patterns in rorqual ô13C and
515N values. Based on Wood's (2006) recommendations, we applied penalized cubic
23
amount of error. The optimal degree of smoothing, resulting in minimal residual deviance and maximal parsimony (lowest possible effective degrees of freedom; Hastie and Tibshirani 1986, 1990, Wood 2006), was determined using a robust cross-validation method to estimate the smoothing parameters (R package mgcv). Due to the limited number of years over which minke whale biopsies were collected, interannual effects were examined using general linear models (GLMs) rather than regression splines. Intraannual isotope trends within blue, fin and humpback whales were examined for years in which particulate organic matter and zooplankton species were sampled at regular intervals throughout the season to verify whether seasonal isotope variation in lower trophic levels is reflected in rorqual tissues. The effect of sex (for all species), age class (calf, juvenile, adult; for humpbacks) and reproductive status (pregnant, lactating, resting; for humpbacks) on isotope ratios was tested using a random effects model to control for interannual variability. All analyses were run separately for each species and isotope combination. Significance levels were evaluated at a = 0.05 and results are presented as 95 % confidence intervals unless otherwise stated.
Results
PRESERVATIVE AND LIPID-EXTRACTION EFFECTS
13 Correcting for DMSO preservation once lipids were removed resulted in slight mean 5 C and ô15N-enrichments of 0.09 %o and 0.07 %o, respectively. The effect of DMSO correction
on isotope values differed significantly according to rorqual species for ô T^ (F [3,449] = 311.62, p < 0.001), but not for Ô13C (F [3,449] = 0.56, p = 0.64). Following lipid
removal, skin preserved in sea water became marginally 13C-enriched (+0.1 ± 0.2 %o;
paired Mests: t = 2.17, df = 32, p = 0.04), but had similar 515N values (0.0 ± 0.3 %o;
t = 0.05, df = 32, p = 0.96) compared to lipid-free skin preserved without solution. Comparably, bulk skin stored in sea water showed minor I3C-enrichment (+0.1 ± 0.2 %o;
t = -2.05, df= 32, p = 0.05), and had 515N values similar to bulk skin preserved without
24
effect on ô13C and Ô15N variance or on C:N ratios of rorqual skin, whether lipids were
extracted or not (Levene's F tests, all p > 0.05). Although minimal, we still corrected for this effect using linear regression coefficients in order to report isotope values as if they had been stored without solution (Table 1). No relationship was found between the number of days samples were stored in sea water and 813C and ô15N values, whether lipid-extracted
or not (#2_djusted = -0.03 to 0.04, mean error 0.1 to 0.3 %o [0.4-0.7]).
Table 1. Parameter estimates of linear regressions (y = a + |3JC) to model Ô13C and ô15N
values of rorqual skin stored without solution (y) from skin stored in sea water (x) for both lipid-extracted (LE) and bulk skin. SEM: standard error of the mean, CI: confidence interval.
Coefficient ± SEM R2 Mean absolute 9 5 % CI of
a_j error (%o) residuals (%o)
513C LE a = 0.496 ±2.655 p = 1.022 ±0.141 Ô13C Bulk a = -2.237 ±2.124 P = 1.067 ±0.230 Ô15NLE a = 0.387 ±0.354 p = 0.972 ± 0.025 Ô15N Bulk a =1.790 ±0.568 p = 0.866 ±0.041 0.62 ±0.17 ±0.45 0.68 ±0.12 ±0.40 0.98 ±0.16 ±0.50 0.93 ± 0.24 ± 0.64
We quantified the effect of lipid-extraction on rorqual skin using a subset of samples stored without solution. Lipid-extraction resulted in significant ô13C enrichment (paired /-tests:
/ = 24.21, df= 154, p < 0.001) and 515N enrichment (/ = 4.86, df= 156, p < 0.001) relative
to bulk skin (Table 2). The effect of lipid removal differed significantly according to rorqual species for ô13C (F [3, i61] = 22.26, p < 0.001), but not for ô15N (F [3, i.ij = 2.72,
p = 0.08; Table 2). In general, the higher the lipid content, as inferred from C:N ratios, the greater the influence of lipid removal on ô13C values (/?2_dj ± mean absolute error = 0.32 ±
1.05 %o). No relationship between C:N ratios and S15N values was detected (/?2a_j - 0.0 ±
25
any of the four species (Levene's F-test, all p > 0.05). Homogeneity among C:N ratios following lipid extraction (3.1 ± 0.1) suggests lipids were adequately removed (Table 2).
Table 2. Mean (± SD) 513C and 815N values (%o) and C:N ratios of bulk and lipid-extracted
(LE) skin of blue, minke, fin and humpback whales. Diff : Difference between bulk and LE treatments.
Ô13C Ô15N C:N
Rorqual n Bulk LE Diff. Bulk LE Diff. Bulk LE Diff.
Blue 11 -20.4 -19.0 1.5 10.6 11.3 0.7 4.1 3.1 1.0 ±0.5 ±0.3 ±0.9 ± 1.1 ±0.3 ±0.1 Minke 50 -20.3 -18.6 1.7 13.1 13.3 0.2 4.5 3.1 1.4 ±0.7 ±0.4 ±1.4 ± 1.5 ±0.9 ±0.1 Fin 44 -20.0 -18.8 1.2 12.3 12.5 0.2 4.0 3.1 1.0 ±0.4 ±0.4 ±1.3 ±1.3 ±0.5 ±0.1 Humpback 67 -19.7 -18.8 0.9 14.4 14.7 0.3 3.7 3.1 0.6 ±0.3 ±0.4 ±0.6 ±0.9 ±0.3 ±0.1
INTERSPECIFIC TROPHIC NICHE VARIATION
:13,
All four rorqual species had comparable mean ô C values (ANOVA Fp 250] = 0.86,
p = 0.46) and variance about the mean (Levene's Fpy 250]= 0.27, p = 0.84). In contrast, the
four species differed significantly in their mean 815N values (ANOVA F [3> 240] = 106.4,
p < 0.001; Tukey's HSD, all p < 0.05) and variance about the mean (Levene's F[3, 240] = 9.94, p < 0.001). Blue whales were the least 815N-enriched (9.9 %_; n = 22),
followed by fin (12.4 %o; n = 69), minke (13.0 %>; n = 53), and humpback whales (14.3 %>; n = 97). 815N variance was greatest in fin whales (2.4 %o), followed by minke (2.2 %o), blue
26
The centroid location (LOC), or the combined S13C - 815N mean, was also significantly
different among rorqual species, resulting from their 815N differences (Hotelling's T2, all
pair-wise comparisons: p < 0.007; Table A in Appendix). The convex hulls and standard ellipses for each rorqual species in Figure 1 show the interspecific overlap in 813C values,
differences in 815N values, and the relative trophic niche position of each rorqual species in
isotope space. Convex hulls and standard ellipses differed in relation to the degree of interspecific niche overlap (Fig. 1). Niche overlap was consistently larger when estimated using convex hulls than with standard ellipses, although both methods indicated no overlap between blue and humpback whales (Fig. 1 ). The convex hulls of blue and fin whales overlapped considerably, while their standard ellipses showed only marginal overlap. Minke, fin and humpback whales all had overlapping total niches; however the core niches of fin and humpback whales did not overlap. Interspecific comparison of convex hull areas echoed prior 815N variance comparisons, with smaller hull areas being observed for blue
and humpback whales, and the larger hull areas observed in fin and minke whales (THA; Table 3). However, fin, minke and blue whales had comparable core niche widths (SEA; Table 3). The core niche width of humpbacks remained the smallest relative to the other species (Fig. 1). Mean distance to centroid (DC) for humpbacks was statistically shorter, and approximately half that of other species (Table 3 and Table A in Appendix). Mean nearest-neighbour distance (NND) was comparable among the four rorqual species, although also shortest for humpbacks (Table 3).
27 16 - A 16 - B 14 - 14 -A*X z 1 2 -z 1 2"
(\*J
IO 10 - s s » > IO 10 -( * ) 8 - ' - ♦ - Humpback - • - Mink» - * - Fin 8 - - • - Humpback - • - Minke -**- Rn 6 - - • - Bkja 6 - - • - Blue 6 -I -20 i -19 l l -18 -17 6 -I ■20 i -19 i i -18 -17 81 3C s"cFigure 1. 813C - 815N biplots for blue, fin, minke and humpback whales depicting (A) the
total isotopic niche of each species using convex hulls and (B) the core isotopic niche space occupied by each species represented by standard ellipses. Filled circles represent the centroids, or the 813C - 815N bivariate means for each species.
Table 3. Trophic niche metrics for blue, fin, humpback and minke whales. Total and core trophic niche widths were quantified using total hull area (THA) and standard ellipse area (SEA [95 % CI]), respectively. The degree of intrapopulation isotope variation is represented by the mean distance to centroid (DC) and the mean nearest-neighbour distance (NND) metrics.
Rorqual n THA SEA DC NND
Blue 22 5.5 2.1 [1.4-3.1] 1.1 0.3
Fin 69 8.1 1.9 [1.5-2.3] 1.1 0.2
Humpback 97 4.5 0.8 [0.7- 1.0] 0.6 0.1
Minke 53 9.1 1.9 [1.5-2.4] 1.1 0.2
We found a clear shift of the prey isotope space relative to the four rorqual species when varying the trophic discrimination factor for 813C from 0.5 to 1.0 %o (Fig. 2). Applying a
A13C of 1.0 %o to this system seemed to overly shift prey space relative to consumers. In
1 3