Synthèse et caractérisation de
poly[5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione
]
s pour la fabrication d’électrodes de
batteries lithium-ion
Mémoire
Amélie Robitaille
Maîtrise en chimie
Maître ès sciences (M.Sc.)
Québec, Canada
© Amélie Robitaille, 2015
iii
RÉSUMÉ
Le potentiel d’oxydoréduction des anodes utilisée dans un pile lithium-ion doit se trouver au-dessus de 0,75V vs Li/Li+ pour rester sécuritaire et ne doit pas excéder 2V vs
Li/Li+ pour conserver une puissance adéquate. Suite aux travaux effectués les
polythienopyrroledione (PTPD) ont démontré des potentiels d'oxydo-réduction de 1,6V vs Li/Li+ ce qui correspond aux critères établis ci-haut. De plus, ils ont une capacité théorique
de 215 mAh/g, ont obtenu une capacité expérimentale de 209 mAh/g. Cette capacité est toutefois inférieure à celle des matériaux d'anodes actuellement sur le marché. Par contre, étant donné que la capacité d'une pile est limitée par la capacité de l'électrode la plus faible, et qu'actuellement les piles lithium-ion sur le marché sont basées sur le LiFePO4 qui
possède une capacité de 170 mAh/g, il serait envisageable que les PTPD puissent potentiellement être des anodes commercialisables.
v
TABLE DES MATIÈRES
RÉSUMÉ ... iii
TABLE DES MATIÈRES ... v
LISTE DES TABLEAUX ET DES ÉQUATIONS... ix
LISTE DES FIGURES ... xi
REMERCIEMENTS ... xxi
Chapitre 1: INTRODUCTION ... 1
1.1 Les systèmes de stockage d’énergie ... 1
1.2 Les batteries lithium-ion ... 4
1.2.1 Composition des batteries Li-ion ... 4
1.2.2 Fonctionnement des batteries Li-ion ... 6
1.2.3 Les matériaux des électrodes... 6
1.3 Projet de maîtrise ... 10
1.3.1 L’influence des chaînes alkyle ... 11
1.3.2 Influence de la méthode de polymérisation ... 12
1.3.3 Influence du copolymère ... 13
1.3.4 Activité des fonctions carbonyle ... 14
Chapitre 2: MÉTHODES EXPÉRIMENTALES ET PRINCIPES ... 15
2.1 Méthodes expérimentales ... 15
2.1.1 La spectroscopie par résonance magnétique nucléaire en solution ... 15
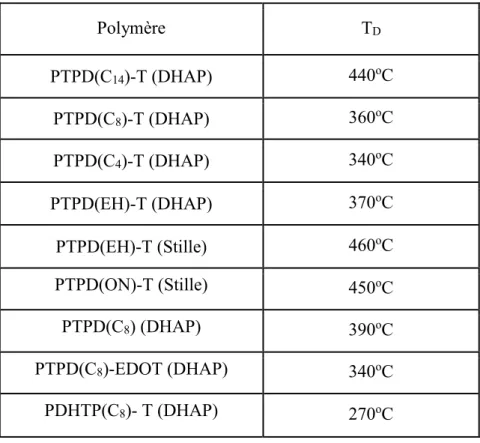
2.1.2 Les températures de dégradation ... 15
2.1.3 Les températures de transition vitreuse ... 15
2.1.4 La chromatographie d’exclusion stérique ... 16
2.1.5 La spectroscopie d’absorption UV-visible ... 17
2.1.6 La spectroscopie d’absorption infrarouge à transformée de Fourier ... 17
2.1.7 La spectroscopie photoélectronique à rayons X (XPS) ... 17
2.1.8 Méthodes électrochimiques. ... 18
2.2 Principes ... 19
vi
2.2.2 La chronopotentiométrie cyclique ... 22
Chapitre 3: SYNTHÈSE ET CARACTÉRISATION DES MONOMÈRES ... 25
3.1 Synthèse des 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-diones ... 26
3.1.1 5-tétradecyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 29 3.1.2 5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 30 3.1.3 5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione ... 30 3.1.4 5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 31 3.2 Synthèse de 2,8-dibromo-5-alkyl-thieno-[3,4-c]-pyrrole-4,6dione ... 31 3.2.1 2,8-dibromo-5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 33 3.2.2 2,8-dibromo-5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 33 3.2.3 2,8-dibromo-5-(2-octyl-1-nonyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 34 3.3 Synthèse du 5-octyl-4,6-dihydro-[3,4-c]-thienopyrrole ... 35
3.4 Synthèse des comonomères ... 35
3.4.1 2,5-bistriméthylstannylthiophène ... 35
Chapitre 4: SYNTHÈSE ET CARACTÉRISATION DES POLYMÈRES ... 39
4.1 Synthèse des polymères ... 39
4.1.1 : Poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 39 4.1.3 : Poly[5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène]... 40 4.1.4 : Poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (DHAP) ... 40 4.1.5 : Poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (Stille) ... 41 4.1.6 : Poly[5-(2-octyl-1-nonyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 41 4.1.7 : Poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione] ... 42 4.1.8 : Poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-(3,4-ethylènedioxythiophène)] ... 43 4.1.9 : Poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène] ... 43
4.2 Caractérisation des polymères ... 44
4.2.1 : Chromatographie d’exclusion stérique ... 44
4.2.2 : Analyses thermiques ... 45
4.2.3 : Spectroscopie d’absorption UV-visible ... 46
4.2.4 : Spectroscopie d’absorption infrarouge du PTPD(C8H17)-T et du PDHTP(C8H17)-T50 4.3 Fabrication et caractérisation des électrodes ... 51
4.3.1 : Poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 52
vii 4.3.3 : Poly[5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 58 4.3.4 : Poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (DHAP) ... 59 4.3.5 : Poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (Stille) ... 61 4.3.6 : Poly[5-(2-octyl-1-nonyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 62 4.3.7 : Poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione] ... 64 4.3.8 : Poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-(3,4-ethylènedioxythiophène)] ... 67 4.3.9 : Poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène] ... 68 4.3.10 : Résultats comparatifs ... 71
Chapitre 5: CONCLUSION ET PERSPECTIVES ... 79
5.1 Conclusion ... 79
5.2 Perspectives ... 80
BIBLIOGRAPHIE ... 83
Annexe 1 : Synthèse du 5-tétradecyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 87
Annexe 2: Synthèse du 5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 89
Annexe 3: Synthèse du 5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione ... 91
Annexe 4 : Synthèse du 5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 93
Annexe 5 : Synthèse du 2,8-dibromo-5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 95
Annexe 6 : Synthèse du 2,8-dibromo-5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 97
Annexe 7 : Synthèse du 2,8-dibromo-5-(2-octylnonyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 99
Annexe 8 : Synthèse du 5-octyl-4,6-dihydro-[3,4-c]-thiophène ... 101
Annexe 9 : Synthèse du 2,5-bistriméthylstannylthiophène ... 103
Annexe 10 : Synthèse du poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(C14)-T) ... 105
Annexe 11 : Synthèse du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(C8)-T) ... 107
Annexe 12 : Synthèse du poly[5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(C4)-T) ... 109
Annexe 13 : Synthèse du poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(EH)-T) par polyhétéroarylation directe ... 111
Annexe 14 : Synthèse du poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(EH)-T) par polycondensation de Stille ... 113
Annexe 15 : Synthèse du poly[5-(2-octyl-1-nonyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(ON)-T) ... 115
viii
Annexe 16 : Synthèse du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione] (PTPD(C8)) ... 117 Annexe 17 : Synthèse du
poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-(3,4-ethylènedioxythiophène)] (PTPD(C8)-EDOT) ... 119 Annexe 18 : Synthèse du poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène]
(PDHTP(C8)-T) ... 121 Annexe 19: Demi-pile de poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(C14)-T) ... 123 Annexe 20: Demi-pile de poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(C8)-T) ... 124 Annexe 21: Demi-pile de poly[5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(C4)-T) ... 125 Annexe 22 : Demi-pile de poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(EH)-T) par polyhétéroarylation directe ... 126 Annexe 23: Demi-pile de poly[5-(2-éthylhexyl) -thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(EH)-T) par polycondensation de Stille ... 127 Annexe 24 : Demi-pile de poly[5-(2-octyl-1-nonyl) -thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (PTPD(ON)-T) ... 128 Annexe 25: Demi-pile de poly[5-octyl -thieno-[3,4-c]-pyrrole-4,6-dione (PTPD(C8)) ... 129 Annexe 26 : Demi-pile de
poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-(3,4-ethylènedioxythiophène)] (PTPD(C8)-EDOT) ... 130 Annexe 27 : Demi-pile de poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène]
ix
LISTE DES TABLEAUX ET DES ÉQUATIONS
Tableau 1: Les différents types d’électrolytes ... 5 Tableau 2 : Températures de transition vitreuse et température de dégradation des polymères ... 46 Tableau 3 : Propriétés optiques des polymères en absorption (solution) ... 47 Tableau 4 : Propriétés optiques des polymères en absorption (film) ... 49
Équation 1 : Équation de la puissance d’une pile où P est la puissance de la pile, E est le potentiel de la pile et I est le courant de la pile ... 8 Équation 2: Équation de la capacité théorique d'un matériau où CT est la capacité théorique (mAh/g), n est le nombre d'ions lithium insérés, F est la constante de Faraday (96500 As/mole) et Mn est la masse molaire de l’unité de répétition ... 11
xi
LISTE DES FIGURES
Figure 1 : Prédiction de la consommation d’énergie 1 ... 1
Figure 2: Diagramme de Ragone 5 ... 2
Figure 3 : Charte des différentes batteries rechargeables. ... 4
Figure 4 : Décharge d’une batterie Li-ion ... 6
Figure 5: Formation de dendrites dans une pile Li-ion ... 7
Figure 6 : Comparaison des potentiels d’oxydoréduction des différents matériaux organiques : les organosulfure (vert) les radicaux (bleu) et les composés carbonylés (rouge) 23 ... 8
Figure 7:Représentation de deux organosulfures 26,27 ... 9
Figure 8: Exemple de polymères ayant des fonctions carbonyle 29, 30, 31 ... 10
Figure 9 : Les différents poly-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour l’évaluation de l’impact de la chaîne alkyle. ... 12
Figure 10 : Poly[5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] avec ramification sur le thiophène ... 12
Figure 11 : Les différents poly-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour vérifier l’influence de la méthode de polymérisation ... 13
Figure 12 : Les différents poly-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour l’évaluation de l’impact du comonomère sur le potentiel d’oxydoréduction... 13
Figure 13 : Les différents poly-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour l’évaluation de l’impact du comonomère sur le potentiel d’oxydoréduction... 14
Figure 14 : Instrumentation utilisée pour les études en voltampérométrie cyclique et en chronopotentiométrie cyclique. ... 18
Figure 15 : Variation du potentiel en voltampérométrie cyclique en fonction du temps où Eo est le potentiel de départ (potentiel d’équilibre du système étudié), Esup et Einf sont les bornes de potentiel imposées. ... 19
Figure 16: Voltampérogramme cyclique ... 20
Figure 17: Voltampérogramme d’une réaction de réduction réversible ... 21
Figure 18 : Intégration de la courbe d’oxydation d’un voltampérogramme ... 22
Figure 19 : Variation du courant en chronopotentiométrie cyclique ... 22
Figure 20 : Variation du potentiel en chronopotentiométrie cyclique... 23
Figure 21 : Chronopotentiogramme cyclique ... 24
xii
Figure 23 : Comonomères ... 26
Figure 24 : Synthèse des 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 26
Figure 25 : Étape i) de la synthèse du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione... 27
Figure 26 : Étape ii) de la synthèse du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 27
Figure 27 : Intermédiaire de chlorure d’acyle ... 28
Figure 28 : Étape iii) de la synthèse du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 28
Figure 29 : Les différents 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione synthétisés pour ce projet ... 29
Figure 30 : Synthèse du 5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 29
Figure 31 : Synthèse du 5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 30
Figure 32 : Synthèse du 5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione ... 30
Figure 33 : Synthèse du 5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 31
Figure 34 : Synthèse des 2,8-dibromo-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione... 31
Figure 35 : Les différents 2,8-dibromo-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione synthétisés pour ce projet... 32
Figure 36 : Synthèse du 2,8-dibromo-5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 33
Figure 37 : Synthèse du 2,8-dibromo-5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 33
Figure 38 : Synthèse du 5-octyl-4,6-dihydro-[3,4-c]thiophène ... 35
Figure 39 : Synthèse du 2,5-bistriméthylstannylthiophène ... 36
Figure 40 : Synthèse du poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 39
Figure 41: Synthèse du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 39
Figure 42: Synthèse du poly[5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 40
Figure 43: Synthèse du poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 40
Figure 44: Synthèse du poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 41
Figure 45: Synthèse du poly[5-(2-octyl-1-nonyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 42
Figure 46: Synthèse du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione] ... 42
Figure 47 : Synthèse du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-(3,4-éthylènedioxythiophène)] ... 43
Figure 48: Synthèse du poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène] ... 43
Figure 49 : Cause de la ramification des PTPD(R)-T lors de la polyhétéroarylation directe. ... 46
Figure 50 : Spectre d’absorption UV-Vis des PTPD(EH)-T (solution à gauche et film à droite) ... 48
Figure 51 : Spectre infrarouge du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] et du poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène] ... 50
xiii Figure 52 : Voltampérogramme cyclique du poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène]... 52 Figure 53 : Capacité du poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] déterminée par voltampérométrie cyclique. ... 53 Figure 54 : Chronopotentiogramme cyclique à C/10 du poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 54 Figure 55 : Capacité du poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] obtenues par chronopotentiométrie cyclique à C/10 ... 54 Figure 56 : Voltampérogramme cyclique du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène]... 55 Figure 57 : Capacité du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] déterminée par voltampérométrie cyclique. ... 55 Figure 58 : Chronopotentiogramme cyclique à C/5 du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 57 Figure 59: Capacité du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] obtenues par chronopotentiométrie cyclique à C/5 ... 57 Figure 60 : Voltampérogramme cyclique du poly[5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène]... 58 Figure 61 : Capacité du poly[5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] déterminée par voltampérométrie cyclique. ... 58 Figure 62 : Voltampérogramme cyclique du poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 59 Figure 63 : Capacité du poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] déterminée par voltampérométrie cyclique. ... 60 Figure 64 : Voltampérogramme cyclique du poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (Stille) ... 61 Figure 65 : Capacité du poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène](Stille) déterminée par voltampérométrie cyclique. ... 62 Figure 66 : Voltampérogramme cyclique du poly[5-(2-octyl-1-nonyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 62 Figure 67 : Capacité du poly[5-(2-ocyl-1-nonyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] déterminée par voltampérométrie cyclique. ... 63
xiv
Figure 68 : Voltampérogramme cyclique du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione] sur collecteur de courant en cuivre ... 64 Figure 69 : Capacité du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione]déterminée par voltampérométrie cyclique. sur collecteur de courant en cuivre ... 64 Figure 70: Chronopotentiogramme cyclique à C/10 du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione] sur collecteur de courant en cuivre ... 66 Figure 71 : Capacité du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione] obtenues par chronopotentiométrie cyclique à C/10 sur collecteur de courant en cuivre... 66 Figure 72 : Voltampérogramme cyclique du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-(3,4-ethylènedioxythiophène] ... 67 Figure 73 : Capacité du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-(3,4-ethylènedioxythiophène] déterminée par voltampérométrie cyclique. ... 67 Figure 74 : Voltampérogramme cyclique du poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène] ... 68 Figure 75 : Capacité du poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène] déterminée par voltampérométrie cyclique. ... 69 Figure 76:Chronopotentiogramme cyclique à C/10 du poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène] sur collecteur de courant en cuivre ... 70 Figure 77: Capacité du poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène] obtenues par chronopotentiométrie cyclique à C/10 sur CC en cuivre ... 70 Figure 78 : Comparatif des voltampérogrammes cycliques du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] et du poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène]... 71 Figure 79 : Résultats comparatifs des capacités du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] et du poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] ... 72 Figure 80 : Comparatif des voltampérogrammes cycliques de PTPD-T ayant différentes chaînes alkyle ... 73 Figure 81 : Résultats comparatifs des capacités de PTPD-T ayant différentes chaînes alkyle... 73 Figure 82 : Comparatif des voltampérogrammes cycliques de PTPD(C8) ayant différents comonomères ... 75 Figure 83 : Résultats comparatifs des capacités de PTPD(C8) ayant différents comonomères ... 75 Figure 84 : Comparatif des voltampérogrammes cycliques de PTPD(EH)-T fait par DHAP et par Stille ... 76 Figure 85 : Résultats comparatifs des capacités de PTPD(EH)-T fait par DHAP et par Stille ... 77
xv
Figure 86 : Exemple de polythienopyrroledione ayant plus de fonctions carbonyle ... 81
Figure 87 : Molécules pouvant être greffées sur le thienopyrroledione ... 81
Figure 88 : Synthèse du 1-(2-aminoethyl)-pyrrole-2,5-dione 52 ... 82
Figure 89 : Synthèse du 2-aminocyclohexa-2,5-diène-1,4-dione 53 ... 82
Figure 90 : Synthèse du 2-aminoalkyl-7-(2-aminoethyl)-benzo[Imn][3,8]phenanthroline-1,3,6,8(2H, 7H)-tetrone 54 ... 82
Figure 91 : Spectre RMN 1H du 5-tetradecyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 88
Figure 92 : Spectre RMN 1H du 5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione ... 90
Figure 93 : Spectre RMN 1H du 5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione ... 92
Figure 94 : Spectre RMN 1H du 5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 94
Figure 95 : Spectre RMN 1H du 5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 96
Figure 96 : Spectre RMN 1H du 5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione ... 98
Figure 97 : Spectre RMN 1H du 5-(1-octyl-1-nonyl)-[3,4-c]thienopyrrole-4,6-dione ... 100
Figure 98 : Spectre RMN 1H du 5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole ... 102
Figure 99 : Spectre RMN 1H du 2,5-bistriméthylstannylthiophène ... 104
Figure 100 : Spectres d’absorption UV-Vis du PTPD(C14)-T ... 106
Figure 101 : Spectres d’absorption UV-Vis du PTPD(C8)-T ... 108
Figure 102 : Spectres d’absorption UV-Vis du PTPD(C4)-T ... 110
Figure 103 : Spectres d’absorption UV-Vis du PTPD(EH)-T ... 112
Figure 104 : Spectres d’absorption UV-Vis du PTPD(EH)-T fait par Stille ... 114
Figure 105:Spectres d’absorption UV-Vis du PTPD(ON)-T ... 116
Figure 106:Spectres d’absorption UV-Vis du PTPD(C8) ... 118
Figure 107:Spectres d’absorption UV-Vis du PTPD(C8)-EDOT ... 120
Figure 108:Spectres d’absorption UV-Vis du PDHTP(C8)-T ... 122
Figure 109 : Voltampérogramme cycliques du PTPD(C14)-T selon différentes plages de potentiel et les capacités obtenues selon ces voltampérogrammes ... 123
Figure 110 : Voltampérogramme cycliques du PTPD(C8)-T selon différentes plages de potentiel et les capacités obtenues selon ces voltampérogrammes. ... 124
Figure 111 : Voltampérogramme cycliques du PTPD(C4)-T selon différentes plages de potentiel et les capacités obtenues selon ces voltampérogrammes ... 125
Figure 112 : Voltampérogramme cycliques du PTPD(EH)-T (DHAP) selon différentes plages de potentiel et les capacités obtenues selon ces voltampérogrammes. ... 126
xvi
Figure 113 : Voltampérogramme cycliques du PTPD(EH)-T (Stille) selon différentes plages de potentiel et les capacités obtenues selon ces voltampérogrammes. ... 127 Figure 114 : Voltampérogramme cycliques du PTPD(ON)-T selon différentes plages de potentiel et les capacités obtenues selon ces voltampérogrammes. ... 128 Figure 115 : Voltampérogramme cycliques du PTPD(C8) selon différentes plages de potentiel et les capacités obtenues selon ces voltampérogrammes. ... 129 Figure 116 : Voltampérogramme cycliques du PTPD(C8)-EDOT selon différentes plages de potentiel et les capacités obtenues selon ces voltampérogrammes ... 130 Figure 117 : Voltampérogramme cycliques du PDHTP(C8)-T selon différentes plages de potentiel et les capacités obtenues selon ces voltampérogrammes... 131
xvii
LISTE DES ABRÉVIATIONS
BHT Hydroxytoluène butylé C Capacité CT Capacité théorique CC Collecteur de courant CDCl3 Chloroforme deutérié VC Voltampérométrie cyclique d Doublet (RMN) DEC Diéthylcarbonate
DHAP Polyhétéroarylation directe
DMC Diméthylcarbonate
DSC Analyse enthalpique différentielle
E Potentiel
Eo Potentiel standard
Esup Borne inférieure de potentiel imposée
Esup Borne supérieure de potentiel imposée
EC Éthylène carbonate
eV Électronvolt
F Constante de Faraday
xviii IP indice de polydispersité IR Infrarouge J Constante de couplage Li Lithium Li+ ion lithium
Li-ion Pile lithium-ion
m multiplet (RMN)
mAh/g Milliampère heure par gramme
mmoles Millimoles
Mn Masses molaires moyennes en nombre
Mp Masses molaires moyennes en poids
n Nombre de lithium inséré
N État neutre d’une molécule
Na-ion Pile Sodium-ion
ppm Partie par million
PS Polystyrène
PDHTP(C8)-T Poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène] PTPD(C8) Poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione]
PTPD(C4)-T Poly[5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] PTPD(C8)-T Poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène]
xix PTPD(C8)-EDOT Poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-(3,4-ethylènedioxythiophène)] PTPD(C14)-T Poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] PTPD(EH)-T Poly[5-(2-étyl-1-hexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] PTPD(ON)-T Poly[5-(2-octyl-1-nonyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] q Quadruplet (RMN) quint Quintuplet (RMN) R Rendement
R- État réduit d’une molécule
Rédox Processus d’oxydoréduction
RMN 1H Résonnance magnétique nucléaire du proton
RMN 13C Résonnance magnétique nucléaire du carbone 13
s Singulet (RMN)
SEC Chromatographie d’exclusion stérique
sept Septuplet six Sextuplet (RMN) t Triplet (RMN) TCB 1,2,4-trichlorobenzène TD Températures de dégradation Tf Températures de fusion
xx
Tg Températures de transition vitreuse
TGA Analyse thermogravimétrique
THF Tétrahydrofurane
TMS Tétraméthylsilane
UV Ultraviolet
Vis Visible
XPS Spectroscopie photoélectronique à rayons X
λmax Longueur d’onde ayant un maximum d’absorption
xxi
REMERCIEMENTS
Je tiens d’abord à remercier mon directeur de rechercher, le Professeur Mario Leclerc, de m’avoir accepté dans son groupe de recherche en tant qu’étudiante à la maîtrise. Merci de m’avoir confié un projet aussi stimulant. Travailler dans votre groupe m’a, sans aucun doute, permis de développer mes aptitudes en tant que scientifique, mais aussi en tant que personne, je vous en serrai toujours reconnaissante.
Je me dois également de remercier mon codirecteur le Professeur Daniel Bélanger de l’UQÀM, sans qui le projet n’aurait pu autant se développer.
Merci M. Leclerc et M. Bélanger pour vos nombreux conseils, pour votre grande disponibilité ainsi qu’à votre compréhension.
Je tiens à remercier le Dr Alexis Perea de l’UQÀM pour ses conseils, son support, ses connaissances et sa grande disponibilité.
J’aimerais également remercier mes collègues de laboratoire de l’Université Laval: Jean-Rémi, Nicolas, Thomas, Pierre-Olivier, Serge, Mariane, Marie-Ève, François, Ahmed, Maxime, Mikaël, Martin et Réda. Ainsi que mes collègues de laboratoire de l’UQÀM : Alexis, Axel, Nicolas, Annaïg, Alban, Galina, Estelle, Aurélie, Benjamin, Alexandre et Birahnu. Merci pour leurs conseils qui ont contribué à la réalisation de ce travail et merci pour l’excellente ambiance de travail.
Finalement, je tiens à remercier toute ma famille, en particulier mes parents, pour leurs encouragements, leur soutien et leur amour. Sans leurs appuis, je ne me serais jamais rendue aussi loin. Merci!
1
Chapitre 1: INTRODUCTION
1.1 Les systèmes de stockage d’énergie
Depuis plusieurs décennies, une augmentation de la demande énergétique due à l’accroissement de la population et au développement des pays émergents est observée. À la Figure 1 est présenté un graphique de la consommation d’énergie par rapport aux ressources utilisées pour la production de celles-ci. Les sources énergétiques les plus accessibles, technologiquement, financièrement et physiquement étant les produits pétroliers, il n’est pas surprenant de les retrouver en haut de liste.
Figure 1 : Prédiction de la consommation d’énergie 1
Toutefois, de nombreux problèmes environnementaux causés par les gaz à effet de serre qui émanent de la combustion des produits pétroliers ont été observés.2, 3, 4 La
2
prometteuses afin de satisfaire à la demande d’énergie, toujours en croissance, pour minimiser l’utilisation des combustibles fossiles. Les énergies renouvelables, comme l’énergie solaire, éolienne et l’hydroélectricité, sont des méthodes de productions d’énergie prometteuses. Malheureusement, l’énergie générée par ces sources n’est disponible que dans certaines conditions géographiques et environnementales en plus d’éprouver une certaine variation dans la production d’énergie. Cela limite ainsi leurs attraits auprès des entreprises et des consommateurs. Il est donc essentiel de développer des systèmes efficaces pour emmagasiner le surplus d’énergie, mais aussi pour redistribuer l’énergie à des moments plus opportuns. L’utilisation de dispositifs de stockage d’énergie devient alors indispensable.
Il existe trois systèmes de stockage d’énergie, les condensateurs, les supercondensateurs et les batteries. Le diagramme de Ragone 5, présenté à la Figure 2,
classe ces trois systèmes selon deux caractéristiques soit, la densité d’énergie et la densité de puissance. La densité d’énergie peut être décrite comme étant la quantité d’énergie pouvant être stockée par un système par rapport à son poids. La densité de puissance, quant à elle, peut être décrite comme étant la quantité de puissance libérée par rapport au poids ou, plus simplement, la vitesse à laquelle le système peut redistribuer l’énergie.
3 D’après ce diagramme, il est possible d’observer que les condensateurs ont la capacité d’accumuler rapidement l’énergie (de l’ordre de quelques secondes), mais en faible quantité. Pour ce qui est des batteries, c’est l’inverse. C’est-à-dire qu’elles accumulent beaucoup d’énergie, mais le temps de charge est élevé (de l’ordre de plusieurs heures). Finalement, les supercondensateurs sont des systèmes intermédiaires, ils peuvent emmagasiner moins d’énergie que les batteries, mais la délivrer un plus rapidement (de l’ordre de plusieurs secondes).6, 7,8Il est important de comprendre qu’une batterie n’est pas
le meilleur système de stockage d’énergie, et vice versa, mais qu’ils visent simplement différentes applications.
Étant donné qu’au Canada 37% des émissions à effet de serre 9 proviennent du
secteur des transports, il serait bénéfique de développer un système de stockage d’énergie efficace capable d’alimenter une voiture. Pour que cela soit possible, il est nécessaire d’utiliser un dispositif ayant une densité d’énergie élevée, qui peut distribuer de l’énergie durant de multiples heures et, finalement, puisse être rechargée. D’après ces spécifications, les batteries rechargeables s’avèrent le choix le plus judicieux.
Depuis les années 70, plusieurs batteries rechargeables ont vu le jour et sont présentées à la Figure 3. En examinant ce diagramme, il est possible de remarquer que les piles lithium-ion sont celles qui, tout en étant sécuritaire, offrent les meilleures performances. En effet, les batteries rechargeables lithium-ion offrent une densité d’énergie élevée par rapport à leur poids et à leur taille. Cela faisant d’elles, les piles les plus puissantes, petites et légères. Elles s’avèrent alors le meilleur choix de dispositif de stockage d’énergie pour alimenter les voitures électriques et hybrides.
4
Figure 3 : Charte des différentes batteries rechargeables. 10
1.2 Les batteries lithium-ion
1.2.1 Composition des batteries Li-ion
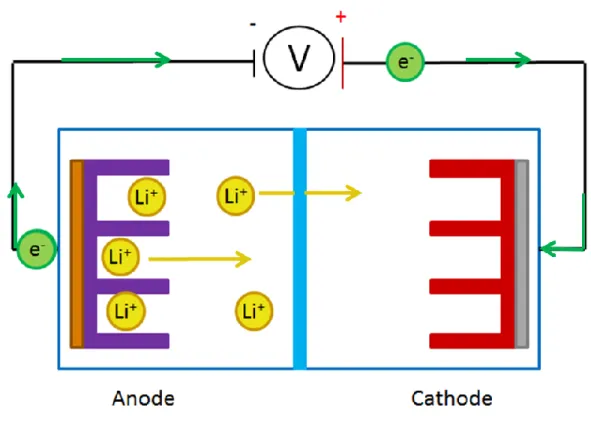
Comme toutes les piles électrochimiques, les piles Li-ion sont composées de deux électrodes, soit la cathode et l’anode. Ces électrodes sont constituées de matériaux pouvant subir des réactions d’oxydoréductions réversibles, appelés matériaux actifs, d’un matériau conducteur, d’un liant et d’un collecteur de courant. L’assignation de chacune des électrodes dépend de leur potentiel d’oxydoréduction, l’anode étant l’électrode possédant le potentiel le plus bas.
Une autre composante des batteries Li-ion est l’électrolyte. Une grande variété d’électrolyte est disponible pour les batteries Li-ion. Le tableau 1 présente les différentes classes d’électrolytes.
5
Tableau 1: Les différents types d’électrolytes 11, 12
Type d’électrolyte Conductivité ionique (S/cm) Fenêtre de potentiel (V) Solution aqueuse ~ 100 ~ 1 Solution non aqueuse ~ 1- 15 ~ 4,3 Liquides ioniques ~ 0,1- 30 > 5V Polymères ~ 0,1 > 4V Solides < 0,1 -
La densité d’énergie et la densité de puissance étant proportionnelles au potentiel de la pile, il est primordial de choisir un électrolyte qui ne limitera pas le potentiel de cette dernière. Donc, même si les électrolytes aqueux possèdent une conductivité ionique élevée, leur fenêtre de potentiel limité à 1 V fait d’eux de mauvais choix pour les piles Li-ion. Les liquides ioniques possèdent une fenêtre de potentiel ainsi qu’une conductivité ionique élevée. Par contre, ils sont généralement utilisés à des températures plus élevées que 0 OC.13
Sachant que les pays nordiques, comme le Canada, ont des températures sous zéro durant l’hiver, les voitures possédant des batteries contenant un liquide ionique comme électrolytes posséderaient un marché limité. L’électrolyte le plus utilisé sur le marché est l’hexafluorophosphate de lithium (LiPF6 1M dans un mélange de solvant non aqueux)14.
Cela est dû au fait que sa fenêtre de potentiel est élevée, sa conductivité ionique est adéquate et sa plage de température d’utilisation correspond à celle de l’application.
Finalement, la dernière composante des batteries Li-ion est la membrane séparatrice. Cette membrane doit être constituée d’un matériau isolant électrique, mais doit être perméable aux ions. De plus, les matériaux utilisés doivent pouvoir résister à certains stress mécaniques comme l’étirement lors de l’assemblage de la pile.15 Ces membranes
6
1.2.2 Fonctionnement des batteries Li-ion
Le fonctionnement d’une pile est plutôt simple. La Figure 4 représente le fonctionnement d’une batterie lors de la décharge. Durant ce processus, il y a oxydation de l’anode. Les électrons, qui ne peuvent pas traverser la membrane séparatrice isolante sont forcés à sortir de la pile pour se rendre à la borne positive qu’est la cathode, générant ainsi un courant pour alimenter, par exemple, la voiture. Pour contrebalancer les charges électroniques, les ions Li+ sortent de l’anode et passent à travers la membrane poreuse de
polypropylène pour, finalement, s’insérer à la cathode où le matériau actif a été réduit. Pour ce qui est de la charge, s’est simplement le contraire.
Figure 4 : Décharge d’une batterie Li-ion
1.2.3 Les matériaux des électrodes
Les matériaux utilisés pour les anodes sont généralement le lithium métallique, le graphite et les alliages de silicium qui possèdent des densités d’énergie élevée. 16, 17, 18
7 vs Li/Li+ pour le lithium, de 0 à 0,3 V vs Li/Li+ pour le graphite et de 0,09 à 0,5V vs Li/Li+
pour les alliages de silicium, ce qui mèneà des problèmes de sécurité.16, 17, 18 En effet, pour
ce qui est du lithium métallique, lorsqu’il y a réaction d’oxydoréduction le lithium passe de l’état métallique à l’état ionique et vice versa, cela fini par créer des dendrites, présentées à la Figure 5. Ces dendrites finissent par percer la membrane séparatrice conduisant à un court-circuit de la pile et même à l’explosion de la pile si elles atteignent la cathode. Pour le graphite et les alliages, lors des cyclages de la pile, il y a la formation de couche de passivation de l’électrolyte appelé ‟Solid Electrolyte Interface”. Il s’agit de la réduction de l’électrolyte à la surface de l’anode. Cette réduction est extrêmement exothermique et mène à l’explosion de la pile.
Figure 5: Formation de dendrites dans une pile Li-ion
Pour pallier ce problème, les scientifiques se dirigent vers les molécules organiques. Le potentiel d’oxydoréduction des petites molécules organiques peut aisément être modulé grâce à l’ajout de groupements électrodonneurs, qui diminuent le potentiel rédox, ou électroattracteurs, qui augmente le potentiel rédox. Cette possibilité de modulation de potentiel permet d’obtenir un matériau ayant un potentiel rédox suffisamment bas pour maximiser la puissance de la batterie, voir équation 1, tout en ayant un potentiel assez élevé pour éviter les problèmes de sécurité.
8
𝑷 = 𝑬 × 𝑰
Équation 1 : Équation de la puissance d’une pile où P est la puissance de la pile, E est le potentiel de la pile et I est le courant de la pile
La plage de stabilité de l’électrolyte est de 0,75 à 5V vs Li/Li+. 19, 20, 21, 22 Donc, pour
une anode, le potentiel doit être plus élevé que 0,75V vs Li/Li+ pour éviter la formation
d’une couche de passivation de l’électrolyte et ainsi éviter la réduction exothermique de l’électrolyte. De plus, il est nécessaire que le potentiel rédox de l’anode soit inférieur à 2V vs Li/Li+ pour maximiser le potentiel, donc la puissance, de la pile. En examinant la Figure
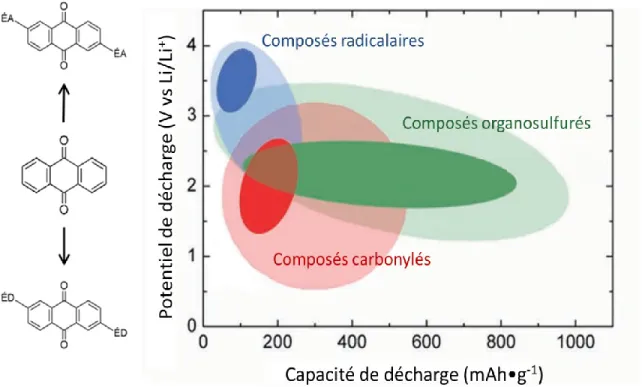
6, deux types de composés organiques seraient d’éventuels candidats comme matériau actif pour les anodes; les organosulfures et les composés carbonylés.
Figure 6 : Comparaison des potentiels d’oxydoréduction des différents matériaux organiques : les organosulfure (vert) les radicaux (bleu) et les composés carbonylés (rouge)23
9 Les organosulfures, malgré qu’ils possèdent une capacité élevée, ont certains inconvénients. Notamment, lors du cyclage, il y a bris de la liaison S-S menant à la dissolution des composés. Aussi, ils ont une conductivité électrique et ionique faible. Les conductivités peuvent être améliorées lorsque l’électrode est chauffée à des températures élevées, soit entre 50 et 90oC mais, généralement, la température d’utilisation des batteries
rechargeables se situe entre -30oC et 50oC.24, 25 Bref, pour les applications visées, les
organosulfures ne sont pas les molécules les plus adéquates.
Figure 7:Représentation de deux organosulfures 26,27
Pour ce qui est des composés carbonylés, ils possèdent une capacité élevée, sont stables à de multiples oxydations et réductions, mais ils ont tendance à se solubiliser dans l’électrolyte menant à l’arrêt du fonctionnement de la pile.28 Pour éviter la dissolution du
matériau actif, certains chercheurs ont synthétisé des composés carbonylés sous forme de polymères. À la Figure 8, deux exemples de polymères comportant des fonctions carbonyle ont été synthétisés et testés en piles lithium-ion ou sodium-ion. Les deux polymères ont non seulement conservé de bonnes capacités, mais sont aussi insolubles dans les électrolytes. De plus, ils sont des candidats potentiels pour les piles sodium-ion, l’avenir des piles rechargeables étant donné que la disponibilité du sodium est plus élevée que celle du lithium et que son prix est plus bas.29, 30, 31
10
Figure 8: Exemple de polymères ayant des fonctions carbonyle 29, 30, 31
Il est possible de remarquer que les polymères présentés à la Figure 8 n’ont pas de structure π-conjuguée. Une telle structure conférerait des propriétés électroniques aux polymères. En effet, ils deviennent des matériaux conducteurs lorsque dopés. 32, 33
L’avantage de cela, c’est qu’il y aurait possibilité de diminuer, voire éliminer les composantes conductrices de l’électrode, comme le carbone et le collecteur de courant, allégeant ainsi les batteries leur permettant d’atteindre des performances encore plus élevées. Cela a déjà été prouvé au niveau des électrodes à base de matériaux inorganiques, qui voyaient leurs propriétés améliorées grâce à un revêtement de polymères π-conjugués.34
Bref, des polymères π-conjugués comportant des fonctions carbonyle pourraient être des matériaux très prometteurs pour la fabrication d’électrode de batteries Li-ion.
1.3 Projet de maîtrise
Dans le cadre de ce projet, nous proposons le développement et la caractérisation de polymères π-conjugués comportant des fonctions carbonyle pour la fabrication d’anodes pour les batteries lithium-ion. Grâce à son squelette conjugué et ses fonctions carbonyles, nous avons identifié le thienopyrroledione comme matériau prometteur pour les électrodes de batteries Li-ion.
11
1.3.1 L’influence des chaînes alkyle
Lorsque vient le temps de concevoir des polymères dérivés du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour une application visée, dans ce cas-ci comme matériaux actifs dans les électrodes pour les batteries rechargeables lithium-ion, plusieurs facteurs doivent être pris en compte. Premièrement, la capacité, qui est la quantité de charges qu’un gramme de matériau actif peut fournir, occupe une grande importance. Comme cette caractéristique est inversement proportionnelle à la masse molaire, voir équation 2, il est important de synthétiser des dérivés ayant une masse molaire faible. Dans le cadre de ce projet, la seule partie de la molécule pouvant être modifiée pour réduire la masse molaire de l’unité de répétition du polymère est la chaîne alkyle. Des chaînes alkyle courtes seraient donc privilégiées.
𝑪𝑻 = 𝒏 × 𝑭
𝟑𝟔𝟎𝟎 × 𝑴𝒏
Équation 2: Équation de la capacité théorique d'un matériau où CT est la capacité théorique (mAh/g), n est le nombre d'ions lithium inséré, F est la constante de Faraday (96500 A•s/mole) et Mn est la masse
molaire de l’unité de répétition
Par contre, il est reconnu dans la littérature 35 que les propriétés électroactives des
polymères sont influencées par la masse molaire moyenne en nombre (Mn). Pour atteindre de hautes masses molaires, les monomères doivent posséder une bonne solubilité dans les conditions de polymérisation. Dans le cas de ce type de polymères, de longues chaînes alkyle seraient ajoutées pour augmenter la solubilité.
Étant donné que les deux propriétés recherchées, soit la capacité et la conductivité électronique, nécessitent des longueurs de chaînes alkyle différentes, il est nécessaire de synthétiser des dérivés du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione avec des chaînes alkyle de longueurs variables pour identifier le rapport optimal entre la légèreté et la solubilité du matériau. Quatre polymères, soit P1 à P4, ont été synthétisés à l’aide de la
12
polyhétéroarylation directe pour évaluer l’impact de la chaîne alkyle sur les performances en batterie.
Figure 9 : Les différents poly-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour l’évaluation de l’impact de la chaîne alkyle.
1.3.2 Influence de la méthode de polymérisation
Il a été démontré dans la littérature 36qu’il y a possibilité d’activation de liens C-H
sur le thiophène lors de la polymérisation par hétéroarylation directe. Toutefois, cette méthode pourrait mener à l'obtention de polymères ramifiés (voir Figure 10), ce qui pourrait avoir des répercussions sur la performance des polymères.
Figure 10 : Poly[5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] avec ramification sur le thiophène
Une étude de l’influence de la méthode de polymérisation a donc été effectuée. Pour cela, deux polymères (voir Figure 11) ont été synthétisés à l’aide d’une méthode plus traditionnelle, la polycondensation de Stille.
13
Figure 11 : Les différents poly-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour vérifier l’influence de la méthode de polymérisation
1.3.3 Influence du copolymère
Il a été mentionné précédemment, dans le chapitre 1.2.2, que l’ajout de groupements électroattracteurs ou électrodonneurs permettait de moduler le potentiel d’oxydoréduction. Pour étudier ce phénomène, deux polymères ont été synthétisés pour être comparés avec le polymère P2 (voir : Les différents poly-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour l’évaluation de l’impact du comonomère sur le potentiel d’oxydoréductionFigure 12 ). En effet, le fait de
copolymériser le thienopyrroledione sur lui-même (P6) permet d’éliminer l’effet électrodonneur du thiophène pour vérifier s’il y aura une augmentation du potentiel d’oxydoréduction. De plus, un thienopyrroledione a été copolymérisé avec de l’éthylènedioxythiophène (P7), qui est un groupement électrodonneur, pour vérifier si un tel groupement permettra de diminuer significativement le potentiel d’oxydoréduction.
Figure 12 : Les différents poly-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour l’évaluation de l’impact du comonomère sur le potentiel d’oxydoréduction
14
1.3.4 Activité des fonctions carbonyle
L’hypothèse de départ de ce projet est que la fonction carbonyle des polythienopyrrolediones serait la composante active dans le processus d’oxydoréduction dans les batteries lithium-ion. Pour vérifier cela, les fonctions carbonyle du thienopyrroledione ont été réduites pour former le dihydrothienopyrrole P8).
Figure 13 : Les différents poly-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour l’évaluation de l’impact du comonomère sur le potentiel d’oxydoréduction
Toutes ces études devraient, en premier lieu, nous permettre de vérifier notre hypothèse en démontrant que les fonctions carbonyle des polythienopyrroledione sont bien la composante active du matériau. De plus, ces travaux vont permettre de vérifier l’impact de la chaine alkyle et de la méthode de polymérisation sur les performances des matériaux. Finalement, l’étude des différents comonomères va permettre d’évaluer leur impact sur la modulation du potentiel d’oxydoréduction des polymères.
15
Chapitre 2: MÉTHODES EXPÉRIMENTALES ET
PRINCIPES
2.1 Méthodes expérimentales
2.1.1 La spectroscopie par résonance magnétique nucléaire en solution
Les spectres de résonnance magnétique nucléaire (RMN 1H et 13C) ont été
enregistrés sur un spectromètre Varian AS400 de 400 MHz. Les déplacements chimiques sont rapportés en partie par million (ppm) relativement à un standard interne de tétraméthylsilane (TMS). Le chloroforme deutérié fut le solvant utilisé dans tous les cas. Le logiciel SpinWorks 2.5.5 a été utilisé afin de traiter les spectres obtenus.
2.1.2 Les températures de dégradation
L’analyse thermogravimétrique (TGA) des polymères a été effectuée à l’aide de l’appareil TGA/SDTA 851e de Metler-Toledo. Les analyses ont été effectuées à une vitesse
de 10 oC/min sous argon entre 50 et 600 oC. Les températures de dégradation rapportées
(TD) correspondent à une perte de masse de 5%.
2.1.3 Les températures de transition vitreuse
L’analyse enthalpique différentielle (DSC) des polymères a été effectuée sous azote à l’aide d’un appareil de Mettler Toledo DSC 823e calibré avec de l’indium ultra pur. La
16
2.1.4 La chromatographie d’exclusion stérique
Afin de déterminer les masses molaires moyennes en nombre (Mn), les masses
molaires moyennes en poids (Mp) et les indices de polydispersité (IP), deux systèmes de
chromatographie d’exclusion stérique (SEC) ont été utilisés.
Premièrement, l’appareil Varian Polymer Laboratories GPC220 équipé d’un détecteur RI et d’un viscosimètre PL BV400 HT constitué de deux colonnes PLgelmixed C (300 x 7.5mm) et une colonne de grade PLgel mixed C a été utilisé. L’éluant utilisé est le 1,2,4-trichlorobenzène (TCB) de grade HPLC stabilisé avec 0,0125% d’hydroxytoluène butylé (BHT) à une température de 140 oC avec un débit de 1,0 mL/min. L’éluant avait été
préalablement filtré sur du verre d’une porosité de 0,7 µm. Pour ce qui est de la préparation des échantillons, les polymères ont été dissout à une concentration de 1mg/mL dans le TCB mentionné ci-haut puis placé dans le PL-AS MT GPC autosampler de Varian Polymer Laboratoies pour être agité et chauffé à 110 oC durant une heure. Ils ont par la suite été
filtrés à chaud à l’aide d’un filtre en acier inoxydable de 2 µm, puis replacés dans l’échantillonneur automatique. Pour la calibration, la méthode standard au polystyrène avec les étalons de polystyrène Easi-vials PS-M de la compagnie Varian Polymer Laboratories a été utilisée.
Le deuxième système utilisé consiste en une pompe HPLC de Waters modèle 515 avec un injecteur 7125 Rheodyne, de deux colonnes PLgel mixed C et de deux détecteurs à concentration. Le premier étant un réfractomètre Optilab 903 de Wyatt et le deuxième est le détecteur UV440 de Waters. L’éluant utilisé est du chloroforme de grade HPLC filtré sur un filtre de nylon de 0,2 µm de la compagnie Gelman Laboratory. L’évaluation des masses molaires moyennes ainsi que l’indice de polydispersité ont été obtenus grâce à une méthode comparative. Cette méthode consiste à la préparation d’une courbe d’étalonnage réalisé à l’aide d’échantillons standards de polystyrène monodisperses de la compagnie Shodex Co. puis de comparer les résultats des échantillons obtenus à la courbe d’étalonnage des standards.
17
2.1.5 La spectroscopie d’absorption UV-visible
Les spectres d’absorption UV-visible ont été enregistrés par un spectrophotomètre Varian Cary 500 UV-vis NIR. Les analyses ont été effectuées en solution dans le chloroforme à l’aide d’une cellule de quartz dont le parcours optique est de 1 cm. Le logiciel utilisé pour le traitement des spectres est OriginPro lab 8.
2.1.6 La spectroscopie d’absorption infrarouge à transformée de Fourier
Les spectres ont été enregistrés par un spectromètre infrarouge Magna-850 Nicolet à transformée de Fourier de la compagnie Thermo muni d’un détecteur MCT (mercure de tellure-cadmium) refroidi à l’azote liquide ainsi qu’une lame séparatrice en bromure de potassium. Un accessoire ATR diamant « le Golden-GateTM » de la compagnie Specac Ltd. a été utilisé. Le logiciel qui contrôle le spectromètre est OMNIC de la compagnie ThermoElectron. Les spectres étaient enregistrés à une résolution de 4 cm-1 et comptent
l’accumulation de 128 interférogrammes. Une adipozation Happ-Ganzel ainsi qu’un zero-filling de facteur 2 ont été appliqués sur chacun des spectres. Le logiciel utilisé pour le traitement des spectres est GRAMS/AI 8.0 de ThermoGalactic, ThermoElectron.
2.1.7 La spectroscopie photoélectronique à rayons X (XPS)
Les analyses ont été effectuées avec le spectrophotomètre XPS PHI 5600-ci de la compagnie Physical Electronics. Les anodes utilisées pour les spectres en survol sont Al standard (1486.6 eV) à 200W dans une première série d’analyse et l’anode Mg Kα (1253.6 eV) à 150 W pour la deuxième analyse. Aucune compensation de charge (neutraliseur) n’a été nécessaire. Les analyses ont été effectuées à un angle de 45o par rapport à la surface.
18
2.1.8 Méthodes électrochimiques.
La voltampérométrie cyclique (VC) et la chronopotentiométrie cyclique ont été effectuées sous forme de pile bouton CR2032 de la compagnie MTI Corp. Les piles sont assemblées en boîte à gants sous atmosphère d’argon à l’aide d’une presse hydraulique de la compagnie MTI Cor. Les piles boutons sont constituées d’une l’électrode de travail composé de matériaux actifs (cathode), d’une électrode de pseudoréférence (elle sert à la fois d’électrode de référence et d’électrode auxiliaire) composée de lithium métallique (anode), d’une membrane séparatrice de polypropylène Cellgard® 2400 et d’un électrolyte le LP71 de BASF composé de LiPF6 1M dans de l’éthylène carbonate (EC)/
diméthylcarbonate (DMC)/ diéthylcarbonate (DEC) 1 :1 :1 V/V. Les voltamogrammes ont été enregistrés à l’aide d’une station électrochimique VMP3 de Bio-logic Inc. Les données ont ensuite été traitées à l’aide du logiciel OriginPro lab 8.
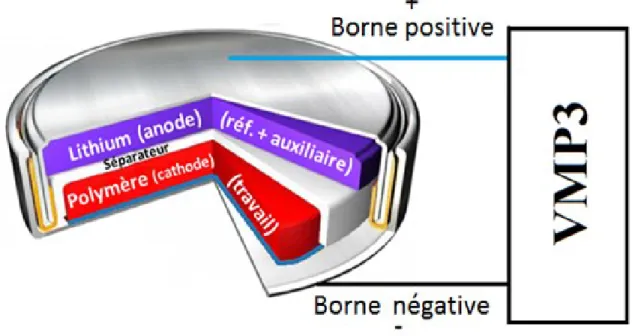
Figure 14 : Instrumentation utilisée pour les études en voltampérométrie cyclique et en chronopotentiométrie cyclique.
Dans la Figure 14, la cathode (l’électrode de travail) est présentée en rouge. Cette électrode se retrouve sur un collecteur de courant, présenté en bleu, qui sert de support
19 mécanique. Il doit être constitué d’un matériau conducteur (soit l’aluminium ou le cuivre dans le cadre de ces travaux). Le mauve désigne l’anode (l’électrode de référence servant aussi d’électrode auxiliaire). La membrane séparatrice Cellgard® 2400 gorgée de l’électrolyte LP71 de BASF est présentée en blanc. Finalement, les pièces argentées sont les boîtiers de la pile bouton et en jaune, on retrouve le joint scellant de la pile.
2.2 Principes
2.2.1 La voltampérométrie cyclique
La voltampérométrie cyclique permet d’étudier les propriétés électrochimiques de molécules ou de polymères. Elle consiste en l’application de potentiel (E) dans le temps entre deux bornes de potentiel imposées (Esup) et (Einf). Le balayage est ensuite inversé puis
répété alternativement à vitesse constante.
Figure 15 : Variation du potentiel en voltampérométrie cyclique en fonction du temps où Eo est le
potentiel de départ (potentiel d’équilibre du système étudié), Esup et Einf sont les bornes de potentiel imposées.
Lorsqu’un potentiel est appliqué sur une espèce électrochimiquement active, des réactions d’oxydation et de réduction se produisent et génère un courant (I). Les données obtenues à l’aide de cette technique permettent alors de générer un voltampérogramme cyclique présenté à la Figure 16.
20
Figure 16: Voltampérogramme cyclique
Le voltampérogramme permet d’obtenir plusieurs renseignements sur l’espèce électrochimiquement active. Tout d’abord, le potentiel de départ (Eo) représente le potentiel
d’équilibre du système étudié. Par la suite, lorsqu’on balaie le potentiel et qu’il y a production d’un courant (I) cathodique (négatif), il se produit une réaction de réduction. Donc, la molécule passe d’un état neutre (N) à un état réduit (R-). Dans le cas contraire où
un courant anodique (positif) est observé, c’est qu’il se produit une réaction d’oxydation. La molécule passe alors d’un état réduit (R-) à un état neutre (N). Les maxima et minima
21
Figure 17: Voltampérogramme d’une réaction de réduction réversible
À l’aide de la voltampérométrie cyclique, il est aussi possible de déterminer la réversibilité des réactions. En effet, si par exemple, un courant cathodique est obtenu, mais qu’aucun courant anodique n’est observé, il y a présence d’une réaction de réduction irréversible. S’il y a présence d’un courant anodique et cathodique, il y a alors présence d’une réaction réversible.
Avec cette méthode, il est possible d’approximer la capacité d’un matériau à emmagasiner des charges. En effet, il suffit d’intégrer l’aire sous la courbe d’un des mécanismes d’oxydoréduction, comme présenté à la Figure 18, et de le diviser par la masse de matériau utilisé lors de la voltampérométrie cyclique.
22
Figure 18 : Intégration de la courbe d’oxydation d’un voltampérogramme
2.2.2 La chronopotentiométrie cyclique
La chronopotentiométrie cyclique consiste en l’imposition d’un courant anodique suivi de l’imposition d’un courant cathodique de manière alternée comme illustré à la Figure 19.
23 Lorsqu’un courant est imposé, des réactions d’oxydoréduction se produisent et il en résulte l’observation d’un changement de potentiel. Une borne de potentiels (Esup et Einf) est
imposée. Lorsqu’une borne est atteinte, le courant est inversé.
Figure 20 : Variation du potentiel en chronopotentiométrie cyclique
Les limites de potentiels et les courants imposés sont déterminés à partir des résultats obtenus en voltampérométrie cyclique. Le courant imposé est généralement exprimé en xC où C est la valeur de la capacité théorique et x est généralement 1; 5; 10; 0,2 et 0,1. Une valeur de 1 C indique que la capacité théorique sera atteinte lors d'une décharge d'une heure, alors que 0,1 C indique une décharge en 10 heures.
24
Figure 21 : Chronopotentiogramme cyclique
La chronopotentiométrie permet d’évaluer la stabilité des réactions d’oxydoréduction, d’obtenir la capacité d’un matériau à emmagasiner des charges qui peuvent, par la suite, être converties en nombre de moles d’ions insérés dans le matériau étudié. De plus, en utilisant différents courants imposés (xC) il est possible de déterminer la vitesse maximale des réactions d’oxydoréduction des espèces étudiées.
25
Chapitre 3: SYNTHÈSE ET CARACTÉRISATION DES
MONOMÈRES
Les différents monomères dérivés du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione (2) ont été synthétisés à partir du thieno-3,4-dicarboxylique acide. Par la suite, il a été possible de synthétiser à partir des 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione deux autres monomères utilisés dans le cadre de ce projet soit le 2,8-dibromo-5-alkylthieno-[3,4-c]-pyrrole-4,6-dione (3) et le 5-alkyl-4,6-dihydro-thieno-[3,4-c]-pyrrole (4). Les détails de ces synthèses seront présentés dans les sections suivantes.
Figure 22 : Monomères
Les comonomères utilisés dans le cadre de ce projet sont le 2,5-dibromothiophène (5) de Sigma Aldrich, le 2,5-bistriméthylstannylthiophène (6) et le 2,5-dibromo-3,4-éthylènedioxythiophène (7) de Sigma Aldrich. (Figure 23). La voie de synthèse utilisée pour obtenir le dérivé stannylé du thiophène sera discutée à la section 3.4.
26
Figure 23 : Comonomères
3.1 Synthèse des 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-diones
Le protocole de la synthèse des 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione est tiré de la littérature.37
Figure 24 : Synthèse des 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione
Le thieno-3,4-dicarboxylique acide (1) acheté de la compagnie Frontier Scientific est tout d’abord recristallisé dans l’eau. Par la suite, il est possible d’effectuer l’étape i) de la synthèse qui consiste à la déshydratation du thieno-3,4-dicarboxylique acide pour former l’intermédiaire anhydride. Le thieno-3,4-dicarboxylique acide (1) est dissout dans l’anhydride acétique à une concentration de 0,232 mole par litre et chauffé à 140 oC durant
18h. Suite à l’évaporation du solvant sous pression réduite, l’intermédiaire anhydride (1.1) est obtenu.
27
Figure 25 : Étape i) de la synthèse du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione
Sans être purifié, l’intermédiaire anhydride (1.1) est dissout dans le toluène à une concentration de 0,1 mole par litre. Puis 1,5 équivalent d’une amine primaire avec la chaîne alkyle désirée est ajouté. La solution est chauffée à reflux durant 24 heures puis le solvant est évaporé à pression réduite menant à l’intermédiaire 4-alkylcarbamoylthiophène-3-carboxlylique acide (1.2).
Figure 26 : Étape ii) de la synthèse du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione
L’étape iii) consiste en une imidation assistée par le chlorure de thionyle SOCl2. En
effet, il y a formation d’un chlorure d’acyle (1.3) appauvrissant le carbone 1 de la Figure 27. Il y a alors possibilité d’une attaque nucléophile de l’amide sur le carbone et ainsi formé le dérivé thienopyrroledione (2).
28
Figure 27 : Intermédiaire de chlorure d’acyle
L’alkylcarbamoylthiophène-3-carboxlylique (1.2) acide non purifié est dissout dans le chlorure de thionyle à une concentration de 0,1 mole par litre. Puis la solution est chauffée à reflux durant quatre heures. Ensuite, le solvant est évaporé à pression réduite pour obtenir le 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione (2). Finalement, le produit est purifié par chromatographie liquide sur colonne avec une phase stationnaire de gel de silice et un éluant composé d’un mélange de dichlorométhane et d’hexane.
Figure 28 : Étape iii) de la synthèse du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione
Les rendements globaux de ces synthèses varient de 40 à 60% de rendement.
Dans le cadre de ce projet, plusieurs chaînes aminées ont été utilisées menant aux thienopyrrolediones correspondants.
29
Figure 29 : Les différents 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione synthétisés pour ce projet
3.1.1 5-tétradecyl-thieno-[3,4-c]-pyrrole-4,6-dione
Figure 30 : Synthèse du 5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione
Pour la synthèse de ce monomère(M1), l’amine utilisée est le tétradecylamine de la compagnie Sigma-Aldrich. Aucune purification supplémentaire n’a été effectuée suite à sa réception. Ce monomère a été synthétisé selon un protocole tiré de la littérature 38 et est
30
3.1.2 5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione
Figure 31 : Synthèse du 5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione
Pour la synthèse de ce monomère (M2), l’amine utilisée est l’octylamine de la compagnie Sigma-Aldrich. Aucune purification supplémentaire n’a été effectuée suite à sa réception. Le protocole complet est présenté à l’annexe 2.
3.1.3 5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione
Figure 32 : Synthèse du 5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione
Pour la synthèse de ce monomère (M3), l’amine utilisée est la butylamine de la compagnie Sigma-Aldrich. Aucune purification supplémentaire n’a été effectuée suite à sa réception. Le protocole complet est présenté à l’annexe 3.
31
3.1.4 5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione
Figure 33 : Synthèse du 5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione
Pour la synthèse de ce monomère (M4), l’amine utilisée est la 2-éthyle-1-hexylamine de la compagnie Sigma-Aldrich. Aucune purification supplémentaire n’a été effectuée suite à sa réception. Le protocole complet est présenté à l’annexe 4.
3.2 Synthèse de 2,8-dibromo-5-alkyl-thieno-[3,4-c]-pyrrole-4,6dione
Le protocole de la synthèse des 2,8-dibromo-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione est tiré de la littérature. 39
32
Le 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione synthétisé précédemment est solubilisé dans un mélange d’acide sulfurique/acide trifluoroacétique 1/3,35 à une concentration de 0,15 mole par litre. Étant donné que l’ajout de N-bromosuccinimide mène à une réaction exothermique, il est ajouté en trois parties pour éviter une augmentation brusque de la température qui pourrait mener à une bromation non sélective. La solution est, par la suite, agitée à température pièce durant 16 heures en absence de lumière pour, encore une fois, éviter des réactions radicalaires entraînant une bromation non sélective. Le rendement de cette réaction varie entre 70 et 80%.
Dans le cadre de ce projet, trois dérivés ont été utilisés. Soit le 2,8-dirbomo-5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione (M5), le 2,8-dibromo-5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione (M6) et le 2,8-dibromo-5-(2-octyl-1-nonyl)-thieno-[3,4-c]-pyrrole-4,6-dione (M7).
Figure 35 : Les différents 2,8-dibromo-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione synthétisés pour ce projet
33
3.2.1 2,8-dibromo-5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione
Figure 36 : Synthèse du 2,8-dibromo-5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione
La synthèse de ce monomère (M5) est présenté à l’annexe5. Pour la synthèse, le 5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione (M2) synthétisé précédemment a été utilisé.
3.2.2 2,8-dibromo-5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione
Figure 37 : Synthèse du 2,8-dibromo-5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione
La synthèse de ce monomère (M6) est présenté à l’annexe6. Pour la synthèse, le 5-(2-éthylhexyl)-[3,4-c]-thienopyrrole-4,6-dione (M4) synthétisé précédemment a été utilisé.
34
3.2.3 2,8-dibromo-5-(2-octyl-1-nonyl)-thieno-[3,4-c]-pyrrole-4,6-dione
Ce monomère (M7) (Figure 35) a été fourni par la compagnie Saint-Jean Photochimie Inc. Un spectre RMN 1H a été effectué pour vérifier la pureté de ce produit.
35
3.3 Synthèse du 5-octyl-4,6-dihydro-[3,4-c]-thienopyrrole
Le protocole de la synthèse du 5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole est tiré de la littérature. 39
Figure 38 : Synthèse du 5-octyl-4,6-dihydro-[3,4-c]thiophène
Le 5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione synthétisé et purifié précédemment est utilisé comme produite de départ lors de cette réaction. Le protocole complet est présenté à l’annexe 8.
3.4 Synthèse des comonomères
Les comonomères utilisés dans le cadre de ce projet sont le 2,5-dibromothiophène de Sigma Aldrich utilisé, le 2,5-bistriméthylstannylthiophène et le 2,5-dibromo-3,4-éthylènedioxythiophène de Sigma Aldrich présenté à la Figure 23.
3.4.1 2,5-bistriméthylstannylthiophène
Le protocole de la synthèse du 5-octyl-4,6-dihydro-[3,4-c]thiophène est tiré de la littérature.40 Le protocole complet est présenté à l’annexe 9.
36
39
Chapitre 4: SYNTHÈSE ET CARACTÉRISATION DES
POLYMÈRES
4.1 Synthèse des polymères
4.1.1 : Poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène]
Figure 40 : Synthèse du poly[5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène]
Le polymère P1 a été synthétisé par polyhétéroarylation directe à partir du 5-tétradécyl-thieno-[3,4-c]-pyrrole-4,6-dione (M1) et le 2,5-dibromothiopène (M9). Les conditions de polymérisations sont tirées de la littérature.41 L’annexe 10 décrit les étapes
détaillées de cette synthèse.
4.1.2 : Poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène]
40
Le polymère P2 a été synthétisé par polyhétéroarylation directe à partir du 5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione (M2) et le 2,5-dibromothiophène (M9). Les mêmes conditions de polymérisation que pour le P1 ont été utilisées. L’annexe 11 décrit les étapes détaillées de cette synthèse.
4.1.3 : Poly[5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène]
Figure 42: Synthèse du poly[5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène]
Le polymère P3 a été synthétisé par polyhétéroarylation directe à partir du 5-butyle-thieno-[3,4-c]-pyrrole-4,6-dione (M3) et le 2,5-dibromothiopène (M9). Les mêmes conditions de polymérisation que pour le P1 ont été utilisées. L’annexe 12 décrit les étapes détaillées de cette synthèse.
4.1.4 : Poly[5-(2-éthylhexyl)-thieno-[3,4-c]-pyrrole-4,6-dione-2-thiophène] (DHAP)
![Figure 9 : Les différents poly-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione pour l’évaluation de l’impact de la chaîne alkyle](https://thumb-eu.123doks.com/thumbv2/123doknet/6650382.181813/34.918.141.736.201.379/figure-alkyl-thieno-pyrrole-évaluation-impact-chaîne-alkyle.webp)
![Figure 26 : Étape ii) de la synthèse du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione](https://thumb-eu.123doks.com/thumbv2/123doknet/6650382.181813/49.918.226.740.134.327/figure-étape-ii-synthèse-alkyl-thieno-pyrrole-dione.webp)
![Figure 28 : Étape iii) de la synthèse du 5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione](https://thumb-eu.123doks.com/thumbv2/123doknet/6650382.181813/50.918.199.682.616.811/figure-étape-iii-synthèse-alkyl-thieno-pyrrole-dione.webp)
![Figure 35 : Les différents 2,8-dibromo-5-alkyl-thieno-[3,4-c]-pyrrole-4,6-dione synthétisés pour ce projet](https://thumb-eu.123doks.com/thumbv2/123doknet/6650382.181813/54.918.207.727.538.788/figure-dibromo-alkyl-thieno-pyrrole-dione-synthétisés-projet.webp)
![Figure 48: Synthèse du poly[5-octyl-4,6-dihydro-thieno-[3,4-c]-pyrrole-2-thiophène]](https://thumb-eu.123doks.com/thumbv2/123doknet/6650382.181813/63.918.170.800.705.893/figure-synthèse-poly-octyl-dihydro-thieno-pyrrole-thiophène.webp)
![Figure 69 : Capacité du poly[5-octyl-thieno-[3,4-c]-pyrrole-4,6-dione]déterminée par voltampérométrie cyclique](https://thumb-eu.123doks.com/thumbv2/123doknet/6650382.181813/84.918.247.609.698.996/figure-capacité-octyl-thieno-pyrrole-déterminée-voltampérométrie-cyclique.webp)