ANDRÉANNE BLANCHETTE
ADAPTATION LOCOMOTRICE SUITE À UNE
LÉSION DU SYSTÈME NERVEUX CENTRAL
Thèse présentée
à la Faculté des études supérieures et postdoctorales de l’Université Laval dans le cadre du programme de doctorat en Médecine expérimentale
pour l’obtention du grade de Philosophiæ doctor (Ph.D.)
FACULTÉ DE MÉDECINE UNIVERSITÉ LAVAL
QUÉBEC
2012
RÉSUMÉ
Les personnes présentant des déficits locomoteurs suite à une lésion du système nerveux central (SNC), deviennent, bien malgré elles, conscientes de toute la complexité que représente le contrôle de la marche. Malgré les efforts déployés lors de la réadaptation, il arrive que certains déficits locomoteurs persistent. La capacité à adapter la marche aux différentes variations de l’environnement, telles qu’un trottoir enneigé ou une plage de sable, est fréquemment affectée suite à une lésion du SNC. Le but général de cette thèse était d’utiliser un paradigme consistant à marcher en présence d’une perturbation pour évaluer la capacité d’adaptation résiduelle d’un muscle spécifique suite à une lésion du SNC. Par contre, avant l’atteinte de cet objectif, il était nécessaire de mieux comprendre les mécanismes neurophysiologiques impliqués dans l’adaptation et l’apprentissage locomoteur lors de la marche en présence d’une perturbation.
Les travaux inclus dans cette thèse ont, tout d’abord, démontré qu’il est possible de modifier le patron d’activation musculaire de personnes en santé sans déficit locomoteur en appliquant une perturbation sur le membre inférieur pendant la marche et que ces modifications peuvent persister temporairement suite au retrait de la perturbation, suggérant ainsi la présence d’une recalibration des commandes centrales (Étude 1). De plus, des évidences d’apprentissage locomoteur ont été constatées lors de sessions répétées de marche avec cette perturbation (Étude 2). Par la suite, nous avons validé qu’il est possible d’induire des modifications au niveau de l’activation des fléchisseurs dorsaux, pouvant avoir un impact fonctionnel lors de la marche, en appliquant une perturbation spécifique à la cheville à l’aide d’une orthèse robotisée (Étude 3). Ces modifications ont aussi été obtenues chez certaines personnes ayant subi une lésion médullaire (Étude 4) ou un accident vasculaire cérébral (Étude 5). Cette approche pourrait permettre l’évaluation de la capacité d’adaptation résiduelle des fléchisseurs dorsaux suite à une lésion du système nerveux central et, par conséquent, être utile à la prise de décision dans la sélection d’interventions optimales en réadaptation locomotrice.
Persons affected by walking deficits following a central nervous system (CNS) lesion are aware of how complex the neural control of walking can be. Indeed, walking deficits often persist even after rehabilitation. Among these deficits, adaptation of the walking pattern to meet varied environmental demands, such as walking on a sandy beach or in snow, becomes more difficult. The main goal of this thesis was to use a paradigm consisting of walking in a perturbing environment to evaluate the residual adaptive capacity of a specific muscle group in persons who have sustained a CNS lesion. To meet this goal, however, a better understanding of the neurophysiological mechanisms involved in locomotor adaptation and learning was first necessary.
The present thesis demonstrated that the muscle activation pattern of healthy subjects can be modified while walking with a perturbation applied to the lower limb and that these modifications persist temporarily after perturbation removal, suggesting the recalibration of central commands (Study 1). Furthermore, evidence of locomotor learning was observed when subjects were repeatedly exposed to a perturbation during walking (Study 2). The next study validated that it is possible to induce modifications in dorsiflexor activation of healthy subjects that may have a clinical impact on the walking pattern, by applying a specific perturbation at the ankle with a robotized ankle-foot orthosis during walking (Study 3). These modifications were also observed in some persons who sustained a spinal cord injury (Study 4) or a stroke (Study 5). Walking with a specific perturbation could be helpful to evaluate the residual adaptive capacity of ankle dorsiflexors in persons who have sustained a central nervous system lesion, and consequently, to guide decision-making for the selection of optimal rehabilitation interventions.
Je profite de cet avant-propos pour remercier quelques personnes sans qui, mes travaux de recherche auraient été impossibles ou simplement moins agréables! Tout d’abord, je désire offrir mes plus sincères remerciements à M. Laurent Bouyer, mon directeur de recherche, qui m’a guidé tout au long de ce parcours à obstacles que représentent les études supérieures. Laurent a su répondre à mes nombreuses questions, m’écouter lorsque j’en avais besoin et… me tenir tête lorsque j’avais tort. Mmes Hélène Moffet et Carol L. Richards ont, elles aussi, joué un rôle important dans la supervision de mes travaux de recherche. Elles se sont assurées que je me dirigeais dans le droit chemin tout en me laissant suffisamment d’autonomie pour me permettre de grandir en tant que future professeure-chercheure. Je tiens à remercier ces trois personnes de m’avoir transmis leur passion et d’avoir partagé leurs expertises respectives afin de me permettre de mener à bien mes projets de recherche.
Un énorme merci à M. Martin Noël qui m’a soutenu, aussi bien techniquement que moralement, tout au long de mon parcours. Je tiens aussi à remercier MM. Guy St-Vincent, Daniel Tardif et François Comeau, pour leur support technique, ainsi que Mmes Isabelle Argall et Murielle Côté, pour leur précieuse assistance d’un point de vue administratif. Mes remerciements vont également aux physiothérapeutes de l’Institut de réadaptation en déficience physique de Québec qui ont collaboré aux projets de recherche auxquels j’ai consacré mes études de 3e cycle, ainsi qu’à Mme France Pelletier, qui m’a été d’un grand secours lors du recrutement des participants. Je profite aussi de l’occasion pour adresser des remerciements aux sujets qui ont volontairement accepté de participer à mes études.
La réalisation de mes études supérieures fut grandement facilitée par le support financier qui m’a été offert sous forme de bourses d’études par le Centre interdisciplinaire de recherche en réadaptation et intégration sociale (CIRRIS) et par l’Équipe multidisciplinaire en réadaptation locomotrice. De plus, les travaux de recherche auxquels j’ai consacré mes études ont été financés par le Fonds de la recherche en santé du Québec, les Instituts de recherche en santé du Canada et l’Équipe multidisciplinaire en réadaptation locomotrice. Je tiens à remercier mes collègues du CIRRIS, à ceux qui sont partis et à ceux qui demeurent. Nos discussions et visites impromptues de bureau à bureau furent à l’occasion une source de distraction, mais bien plus souvent une source de motivation! Un merci tout spécial à Maude, ma partenaire de rédaction, avec qui j’ai partagé bonheurs et déceptions. Finalement, j’aimerais remercier ma famille et mes amis qui m’ont permis de maintenir une vie équilibrée tout au long de mon cheminement et qui m’ont encouragé à persévérer malgré les difficultés. Merci à Guillaume pour sa patience inébranlable, ses petites attentions et ses judicieux conseils tout au long de la rédaction de cet ouvrage.
Cet ouvrage contient le résultat de mes travaux de recherche effectués sous la direction de M. Laurent Bouyer et sous la codirection de Mmes Hélène Moffet et Carol L. Richards. Cette thèse sera présentée sous la forme de 5 manuscrits rédigés en anglais.
ÉTUDE 1 (CHAPITRE III)
Titre : Timing-specific transfer of adapted muscle activity after walking in an elastic force field.
Auteurs : Andreanne Blanchette1 and Laurent J. Bouyer1,2
Affiliations : 1Center for Interdisciplinary Research in Rehabilitation and Social Integration (CIRRIS), Université Laval, Quebec City, Canada; 2Department of Rehabilitation, Université Laval, Quebec City, Canada
Contributions de l’étudiante: Analyse des données, statistiques, rédaction du manuscrit sous la supervision du coauteur.
Cet article a été publié dans Journal of Neurophysiology, 102(1):568-77, 2009. Aucune modification n’a été apportée au manuscrit original.
ÉTUDE 2 (CHAPITRE IV)
Titre : Effects of repeated walking in a perturbing environment: a 4-day locomotor learning study.
Auteurs : Andreanne Blanchette1, Helene Moffet1,2, Jean-Sébastien Roy1,2, and Laurent J. Bouyer1,2
Affiliations : 1Centre for Interdisciplinary Research in Rehabilitation and Social Integration (CIRRIS), Université Laval, Quebec City, Canada; 2Department of Rehabilitation, Université Laval, Quebec City, Canada
Contributions de l’étudiante: Élaboration du protocole, collecte et analyse des données, statistiques, rédaction du manuscrit sous la supervision des coauteurs.
Cet article a été publié dans Journal of Neurophysiology, 108:275-84, 2012. Aucune modification n’a été apportée au manuscrit original.
ÉTUDE 3 (CHAPITRE V)
Titre : Walking while resisting a perturbation: effects on ankle dorsiflexor activation during swing and potential for rehabilitation.
Auteurs : Andreanne Blanchette1,2, Sebastien Lambert2, Carol L. Richards1,2,3,and Laurent J. Bouyer1,2,3
Affiliations: 1Multidisciplinary Team in Locomotor Rehabilitation, Montreal, Canada; 2Center for Interdisciplinary Research in Rehabilitation and Social Integration, Quebec City, Canada; 3Department of Rehabilitation, Université Laval, Quebec City, Canada. Contributions de l’étudiante: Élaboration du protocole, collecte et analyse des données, statistiques, rédaction du manuscrit sous la supervision des coauteurs.
Cet article a été publié dans Gait and Posture, 34:358–363, 2011. Aucune modification n’a été apportée au manuscrit original.
ÉTUDE 4 (CHAPITRE VI)
Titre : Evaluation of the adaptive capacity of the ankle dorsiflexor muscles during walking by means of an electrohydraulic ankle foot orthosis in persons with spinal cord injury: a feasibility study.
Auteurs : Andreanne Blanchette1,2, Martin Noel 2, Carol L. Richards1,2,3,and Laurent J. Bouyer1,2,3
Affiliations : 1Multidisciplinary Team in Locomotor Rehabilitation, Canadian Institutes of Health Research Team; 2Center for Interdisciplinary Research in Rehabilitation and Social Integration, Quebec City, Canada; 3Department of Rehabilitation, Université Laval, Quebec City, Canada.
Contributions de l’étudiante: Élaboration du protocole, collecte et analyse des données, statistiques, rédaction du manuscrit sous la supervision des coauteurs.
Ce manuscrit a été soumis au Journal of NeuroEngineering and Rehabilitation (13 avril 2012). Aucune modification n’a été apportée au manuscrit original.
ÉTUDE 5 (CHAPITRE VII)
Titre : Does application of a torque perturbation during walking lead to modifications in ankle dorsiflexor muscle activation in persons post-stroke?
Auteurs : Andreanne Blanchette1,2, Carol L. Richards1,2,3,Sylvie Nadeau1,4,5, and Laurent J. Bouyer1,2,3
Affiliations : 1 Multidisciplinary Team in Locomotor Rehabilitation, Canadian Institutes of Health Research; 2Center for Interdisciplinary Research in Rehabilitation and Social Integration, Quebec City, Canada; 3Department of Rehabilitation, Université Laval, Quebec City, Canada; 4Centre for Interdisciplinary Research in Rehabilitation of Greater Montreal, Montreal, Canada; 5School of Rehabilitation, Université de Montreal, Montreal, Canada. Contributions de l’étudiante: Élaboration du protocole, collecte et analyse des données, statistiques, rédaction du manuscrit sous la supervision des coauteurs.
Ce manuscrit sera soumis au Journal of Rehabilitation Research and Development.
RÉSUMÉ ... ii
ABSTRACT ... iii
AVANT-PROPOS ... iv
TABLE DES MATIÈRES ... vii
LISTE DES TABLEAUX ... xiii
LISTE DES FIGURES ... xiiii
LISTE DES ABBRÉVIATIONS ... xv
CHAPITRE I: INTRODUCTION ... 1
1.1 Introduction générale ... 1
1.2 La marche ... 2
1.2.1 Les divisions de la marche ... 2
1.2.2 La description de la marche ... 3
1.2.3 Le contrôle de la marche ... 7
1.3 La marche suite à une lésion du SNC ... 15
1.3.1 La marche: une priorité de la réadaptation ... 15
1.3.2 Quelques statistiques… ... 15
1.3.3 Les déficits locomoteurs suite à un AVC ... 16
1.3.4 Les déficits locomoteurs suite à une LM ... 19
1.4 La marche en présence d’une perturbation ... 20
1.4.1 Paradigme pour l’évaluation de la capacité d’adaptation ... 21
1.4.2 L’apprentissage en présence d’une perturbation ... 23
1.4.3 La capacité d’adaptation suite à une lésion du SNC ... 24
1.5 Objectifs et hypothèses de recherche ... 26
1.5.1 Objectifs ... 26
1.5.2 Hypothèses ... 28
CHAPITRE II: MÉTHODOLOGIE GÉNÉRALE ... 30
2.1 Paradigme expérimental: la marche en présence d’une perturbation ... 31
2.2 Participants et procédures de recrutement ... 31
2.2.1 Participants en santé sans déficit locomoteur ... 32
2.2.2 Participants ayant subi une LM ... 32
2.2.3 Participants ayant subi un AVC ... 33
2.3 Perturbations appliquées pendant la marche ... 34
2.3.1 Perturbation induite par un élastique ... 34
2.3.2 Perturbation induite par une orthèse de cheville robotisée ... 36
2.4 Acquisition et traitement des données ... 37
2.4.1 Variables descriptives du patron locomoteur ... 38
2.4.2 Variables descriptives de la perturbation ... 39
2.4.3 Variables personnelles ... 40
CHAPITRE III: TIMING-SPECIFIC TRANSFER OF ADAPTED MUSCLE ACTIVITY
AFTER WALKING IN AN ELASTIC FORCE FIELD. ... 41
3.1 Résumé ... 42 3.2 Abstract ... 43 3.3 Introduction ... 44 3.4 Methods ... 46 3.4.1 Subjects ... 46 3.4.2 General protocol ... 46
3.4.3 Force field generation ... 47
3.4.4 Recordings ... 48
3.4.5 Data analysis ... 49
3.4.6 Statistics ... 50
3.5 Results ... 50
3.5.1 Force intensity ... 50
3.5.2 Spatiotemporal gait parameters ... 51
3.5.3 Foot kinematics ... 51
3.5.4 Lower limb joint kinematics ... 53
3.5.5 EMG activity ... 53
3.6 Discussion ... 55
3.6.1 Initial exposure to the force field ... 55
3.6.2 Adaptation to the force field ... 56
3.6.3 Initial effects following force field removal ... 58
3.6.4 Recovery following force field removal ... 59
3.6.5 Timing-specific transfer of the adapted hamstring activation pattern ... 60
3.7 Conclusion ... 61
3.8 Acknowledgements ... 61
3.9 Grants ... 61
CHAPITRE IV: EFFECTS OF REPEATED WALKING IN A PERTURBING ENVIRONMENT: A 4-DAY LOCOMOTOR LEARNING STUDY. ... 72
4.1 Résumé ... 73
4.2 Abstract ... 74
4.3 Introduction ... 75
4.4 Materials and Methods ... 77
4.4.1 Subjects ... 77 4.4.2 General protocol ... 77 4.4.3 Recordings ... 79 4.4.4 Data analysis ... 80 4.4.5 Statistics ... 81 4.5 Results ... 82 4.5.1 Kinematics ... 82 4.5.2 Electromyographic activity ... 84 4.6 Discussion ... 85
4.6.1 Short-term effects of walking in a perturbing environment ... 86
4.6.3 No changes in final pattern with the perturbation across days ... 87
4.6.4 Neurophysiological mechanisms underlying locomotor learning ... 88
4.6.5 Clinical implications ... 89
4.7 Acknowledgements ... 90
4.8 Grants ... 90
CHAPITRE V: WALKING WHILE RESISTING A PERTURBATION: EFFECTS ON ANKLE DORSIFLEXOR ACTIVATION DURING SWING AND POTENTIAL FOR REHABILITATION. ... 98 5.1 Résumé ... 99 5.2 Abstract ... 100 5.3 Introduction ... 101 5.4 Methods ... 103 5.4.1 Subjects ... 103 5.4.2 General protocol ... 103 5.4.3 Torque perturbation ... 104 5.4.4 Recordings ... 104 5.4.5 Data analysis ... 104 5.4.6 Statistics ... 105 5.5 Results ... 106
5.5.1 Walking while resisting the torque perturbation ... 106
5.5.2 Walking after torque perturbation removal ... 107
5.6 Discussion ... 107
5.6.1 Walking while resisting the torque perturbation and after its removal ... 108
5.6.2 Clinical implications ... 108
5.6.3 Future directions ... 109
5.7 Acknowledgments ... 110
CHAPITRE VI: EVALUATION OF THE ADAPTIVE CAPACITY OF THE ANKLE DORSIFLEXOR MUSCLES DURING WALKING BY MEANS OF AN ELECTROHYDRAULIC ANKLE FOOT ORTHOSIS IN PERSONS WITH SPINAL CORD INJURY: A FEASIBILITY STUDY. ... 116
6.1 Résumé ... 117 6.2 Abstract ... 119 6.3 Introduction ... 120 6.4 Methods ... 122 6.4.1 Participants ... 122 6.4.2 General protocol ... 122 6.4.3 Torque perturbation ... 123 6.4.4 Recordings ... 124 6.4.5 Data analysis ... 125 6.4.6 Statistics ... 126 6.5 Results ... 126 6.5.1 Participants ... 126
6.5.2 Torque perturbation characteristics ... 127
6.5.3 The effects of walking with a perturbation: two subjects, two different scenarios ... 128
6.6 Discussion ... 130
6.6.1 Walking with the EHO ... 130
6.6.2 Torque perturbation settings ... 131
6.6.3 Evaluating the adaptive capacity of the ankle dorsiflexor muscles during walking... 132
6.6.4 Study limitations ... 135
6.6.5 Clinical implications ... 135
6.7 Acknowledgements ... 136
CHAPITRE VII: DOES APPLICATION OF A TORQUE PERTURBATION DURING WALKING LEAD TO MODIFICATIONS IN ANKLE DORSIFLEXOR MUSCLE ACTIVATION IN PERSONS POST-STROKE? ... 143
7.1 Résumé ... 144 7.2 Abstract ... 145 7.3 Introduction ... 146 7.4 Methods ... 148 7.4.1 Participants ... 148 7.4.2 General protocol ... 148 7.4.3 Data analysis ... 151 7.4.4 Statistics ... 152 7.5 Results ... 153
7.5.1 Ankle motor impairments and walking deficits in persons post-stroke ... 153
7.5.2 Movement error induced by applying a perturbation on the paretic ankle during walking... 155
7.5.3 Ankle dorsiflexor adaptive capacity to a perturbation during walking in persons post-stroke ... 156
7.5.4 The impact of ankle motor impairments and walking deficits on dorsiflexor adaptive capacity... 157
7.6 Discussion ... 158
7.6.1 Adaptive capacity to a perturbation during walking in persons post-stroke .... 158
7.6.2 The impact of ankle motor impairments or walking deficits on dorsiflexor adaptive capacity... 159
7.6.3 Clinical implications ... 160
7.7 Acknowledgements ... 161
CHAPITRE VIII: CONCLUSIONS GÉNÉRALES... 170
8.1 Contributions à l’avancement des connaissances ... 170
8.1.1 Contributions des mécanismes anticipatoires et réactifs à l’adaptation locomotrice ... 170
8.1.2 Évidences d’apprentissage locomoteur lors de sessions répétées d’exposition à une perturbation ... 172
8.1.3 Induire les modifications désirées dans l’activation musculaire en appliquant une perturbation spécifique lors de la marche ... 174
8.1.4 La capacité d’adaptation résiduelle suite à une LM ... 176
8.1.5 La capacité d’adaptation résiduelle suite à un AVC ... 178
8.2 Implications cliniques ... 180
8.3 Avenues de recherche futures ... 182
BIBLIOGRAPHIE ... 183 ANNEXE A ... 199 ANNEXE B ... 211 ANNEXE C ... 234 ANNEXE D ... 236 ANNEXE E ... 238 ANNEXE F ... 240 ANNEXE G ... 242
CHAPITRE III
Table 3.1: Subject characteristics (age, gender, weight, and height). ... 62 Table 3.2: Time courses of changes in peak foot velocity and hamstring EMG. ... 63 CHAPITRE VII
Table 7.1: Participant characteristics. ... 163 Table 7.2: Clinical and overground walking measurements characterizing motor
impairments and walking deficits (paretic ankle). ... 164 Table 7.3: Torque perturbation characteristics. ... 165
CHAPITRE I
Fig. 1.1: Positions angulaires, moments de force et puissances mesurés aux 3 articulations du membre inférieur lors de la marche au sol chez un groupe de participants en
santé, sans déficit locomoteur (n=30; 56.8±8.2 ans). ... 4
Fig. 1.2: Patron d’activation musculaire mesuré lors de la marche au sol chez un groupe de participants en santé, sans déficit locomoteur (n=30; 56.8±8.2 ans). ... 6
Fig. 1.3: Modèle théorique du contrôle moteur ... 21
CHAPITRE II Fig. 2.1: Méthodologie utilisée dans chacune des études de cette thèse. ... 30
Fig. 2.2: Photo du montage experimental avec l’élastique. ... 35
Fig. 2.3: Photo du montage expérimental avec l’orthèse de cheville robotisée ... 37
CHAPITRE III Fig. 3.1: Experimental set-up to produce the force field. ... 64
Fig. 3.2: Effect of force field exposure on peak foot velocity. ... 65
Fig. 3.3: Effect of force field exposure on relative angular displacement at the 3 lower limb joints. ... 66
Fig. 3.4: Effect of force field exposure on muscle activation pattern of the right lower limb. ... 67
Fig. 3.5: Effect of force field exposure on LH and MH EMG activity. ... 68
Fig. 3.6: Initial aftereffect for LH and MH EMG activity. ... 69
Fig. 3.7: Stride-by-stride aftereffects in MH EMG activity. ... 70
Fig. 3.8: LH and MH EMG activity comparisons between adapted state and initial aftereffect. ... 71
CHAPITRE IV Fig. 4.1: Modifications within daily sessions in absolute peak foot velocity error caused by walking in a perturbing environment. ... 91
Fig. 4.2: Stride-by-stride modifications in absolute peak foot velocity error caused by walking in a perturbing environment for each daily session. ... 92
Fig. 4.3: Modifications caused by walking with the perturbation on the lower limb joint angular displacements. ... 93
Fig. 4.4: Time course of adaptation and recovery in absolute peak foot velocity error. .... 94
Fig. 4.5: Modifications caused by walking with the perturbation on the muscle activation pattern of the right lower limb. ... 95
Fig. 4.6: Stride-by-stride modifications in MH mean amplitude caused by walking in a perturbing environment for each daily session. ... 96
Fig. 4.7: Modifications caused by repeated walking sessions with the perturbation on MH activation. ... 97
CHAPITRE V
Fig. 5.1: Electrohydraulic ankle-foot orthosis (EHO). ... 111 Fig. 5.2: Modifications in ankle and knee angles induced by walking while resisting the
perturbation. ... 112 Fig. 5.3: Modifications in muscle activation pattern induced by walking while resisting the perturbation. ... 113 Fig. 5.4: Modifications in muscle activation pattern observed after perturbation removal.
... 114 Fig. 5.5: Modifications in ankle and knee angles observed after perturbation removal. .. 115 CHAPITRE VI
Fig. 6.1: Representation of the Electrohydraulic ankle-foot orthosis (EHO). ... 137 Fig. 6.2: Torque perturbation applied at the ankle during walking. ... 138 Fig. 6.3: Effects of walking with a torque perturbation on the ankle/knee angular
displacements and lower limb muscle activations of Subject 1. ... 139 Fig. 6.4: Effects of walking with a torque perturbation on the ankle/knee angular
displacements and lower limb muscle activations of Subject 2. ... 140 Fig. 6.5: Effects of walking with the torque perturbation on TA mean amplitude. ... 141 Fig. 6.6: Effects of removing the torque perturbation on ankle angular displacements. .. 142 CHAPITRE VII
Fig. 7.1: Torque perturbation profile and deviation induced in ankle angular displacements during walking for one participant (S4). ... 166 Fig. 7.2: Effects of walking with the perturbation on ankle muscle groups for each
participant. ... 167 Fig. 7.3: Relationship between changes in TA mean amplitude observed with the
perturbation and after its removal. ... 168 Fig. 7.4: Effects of walking with the perturbation on maximal ankle dorsiflexion during
2D 2-dimensional 6MWT 6-minute Walk Test 10MWT 10-meter Walk Test
A1 Puissance maximale d’absorption des fléchisseurs plantaires au milieu de la phase d’appui
A2 Puissance maximale de génération des fléchisseurs plantaires à la fin de la phase d’appui
AE Aftereffects
AFO Ankle-foot orthosis ANOVA Analysis of variance
APIA-AVC Association des personnes intéressées à l’aphasie et à l’accident vasculaire cérébral
AS Adapted state
ASIA American Spinal Injury Association AVC Accident vasculaire cérébral
B Baseline
BP Baseline post
CIHR Canadian Institutes of Health Research
CIRRIS Centre interdisciplinaire de recherche en réadaptation et intégration sociale CNS Central nervous system
CPG Central pattern generator CV Coefficient of variation
D Delayed
EHO Electrohydraulic ankle-foot orthosis EMG Électromyographique; Electromyographic
F Female
FRSQ Fonds de la recherche en santé du Québec
H1 Puissance maximale de génération des extenseurs de la hanche au milieu de la phase d’appui
H2 Puissance maximale d’absorption des fléchisseurs de la hanche à la fin de la phase d’appui
H3 Puissance maximale de génération des fléchisseurs de la hanche en pré-oscillation
IE Initial effect
IRDPQ Institut de réadaptation en déficience physique de Québec IRED Infrared emitting diode
K1 Puissance maximale d’absorption des extenseurs du genou lors de la mise en charge
K2 Puissance maximale de génération des extenseurs du genou au milieu de la phase d’appui
K3 Puissance maximale d’absorption des extenseurs du genou lors de la phase initiale de l’oscillation
K4 Puissance maximale d’absorption des fléchisseurs du genou lors de la phase terminale de l’oscillation
L Left
LH Lateral hamstring
LM Lésion médullaire
M Male
MAS Modified Ashworth Scale
MaxDF Maximal dorsiflexion angular position during swing
MaxPF Maximal plantarflexion angular position at the beginning of swing MG Gastrocnemius medialis
MH Medial hamstring
Mmax Maximal plantarflexor moment during the stance phase MMT Manual Muscle Testing
MLR Mesencephalic locomotor region ND Non-delayed
NS Non significant
PID Proportional–integral–derivative
R Right
RF Rectus femoris SCI Spinal cord injury SD Standard deviation
SE Standard error of the mean
SENIAM Surface ElectroMyoGraphy for the Non-Invasive Assessment of Muscles
SNC Système nerveux central SOL Soleus
ST Semitendinosus TA Tibialis anterior
TMS Transcranial magnetic stimulation TS Triceps surae
CHAPITRE I:
INTRODUCTION
1.1 Introduction générale
Pour la majorité des individus en santé, la marche représente un moyen efficace de se déplacer ou une activité agréable permettant de maintenir une bonne forme physique. Nous percevons, à tort, cette tâche comme étant relativement simple, puisque rares sont les occasions lors desquelles nous devons réfléchir à comment mettre un pied devant l’autre. Par contre, les personnes présentant des déficits locomoteurs suite à une lésion du système nerveux central (SNC) deviennent, bien malgré elles, conscientes de toute la complexité que représente le contrôle de la marche. Pour ces personnes, la marche devient souvent une priorité de la réadaptation de façon à retrouver leur autonomie lors des déplacements. Cependant, malgré les efforts déployés lors de la réadaptation, il arrive que certains déficits locomoteurs persistent. Parmi ceux-ci, la capacité à adapter la marche aux différentes variations de l’environnement, telles qu’un trottoir enneigé ou une plage de sable, est fréquemment affectée. Nous croyons qu’un paradigme consistant à marcher en présence d’une perturbation pourrait être utile à l’évaluation de la capacité d’adaptation résiduelle suite à une lésion du SNC. Avant de valider le potentiel de cette approche, il est cependant nécessaire de mieux comprendre les mécanismes neurophysiologiques impliqués dans l’adaptation et l’apprentissage locomoteur lors de la marche en présence d’une perturbation.
Puisque la marche est au cœur de cette thèse, le premier chapitre débutera avec une description des évènements se produisant lors de l’exécution de cette tâche, ainsi que des bases neurophysiologiques connues du contrôle de la marche. Les déficits locomoteurs pouvant persister suite à une lésion du SNC seront ensuite discutés. Finalement, l’approche consistant à marcher en présence d’une perturbation sera présentée. Le chapitre II abordera, de façon succincte, la méthodologie permettant l’atteinte des différents objectifs spécifiques de cette thèse. Par la suite, 5 études seront présentées sous la forme de manuscrits dans les chapitres suivants, soit les chapitres III à VII. Ces études ciblent, tout d’abord, l’étude des bases neurophysiologiques qui sous-tendent le paradigme proposé et, par la suite, la validation du potentiel de ce paradigme pour l’évaluation de la capacité d’adaptation résiduelle de personnes ayant subi une lésion du SNC, plus précisément un accident
vasculaire cérébral (AVC) ou une lésion médullaire (LM). Finalement, le chapitre VIII viendra clore les résultats présentés dans cette thèse avec des conclusions générales.
1.2 La marche
La marche peut être définie comme étant une séquence répétée de mouvements des membres inférieurs permettant de propulser le corps vers l’avant, tout en maintenant une stabilité posturale adéquate (Perry 1992). Cependant, cette définition résume, de façon un peu simpliste, une activité maintenant connue comme étant beaucoup plus complexe. En effet, les tâches impliquées dans la génération et la modulation de la marche consistent à:
1. Positionner adéquatement le corps de façon à permettre l’initiation de la marche; 2. Initier et terminer la marche au moment et à l’endroit désirés;
3. Générer et coordonner le patron d’activation musculaire afin de propulser le corps dans la direction souhaitée;
4. Maintenir la stabilité dynamique du corps en combattant la force de gravité, ainsi que les autres forces impliquées;
5. Moduler le patron locomoteur de façon à modifier la vitesse de marche, éviter les obstacles, positionner adéquatement le pied, s’adapter à différentes surfaces et changer de direction;
6. Guider la marche vers le point d’arrivée, même si celui-ci n’est pas visible;
7. Utiliser le minimum d’énergie afin de maximiser la distance parcourue avant d’arrêter pour faire le plein de nutriments;
8. Veiller au maintien de la stabilité structurelle de l’appareil locomoteur pour minimiser les dommages.
(Traduction libre de Patla et al. 1996)
1.2.1 Les divisions de la marche
Le cycle de marche est l’unité principale de la division de la marche. La durée d’un cycle s’évalue à partir d’un évènement précis, habituellement le contact initial du pied avec le sol, jusqu’à la prochaine apparition de ce même évènement du côté ipsilatéral. Pour une personne ne présentant pas de déficit locomoteur, la marche sur une surface plane varie peu
d’un cycle à l’autre et, même, d’un jour à l’autre (Winter 1987). Chaque cycle de marche peut être divisé en 2 phases principales, soit la phase d’appui et la phase d’oscillation. La phase d’appui désigne la période lors de laquelle le pied est en contact avec le sol (environ 60% du cycle de marche), alors que l’inverse est vrai en ce qui concerne la phase d’oscillation (environ 40% du cycle de marche).
1.2.2 La description de la marche
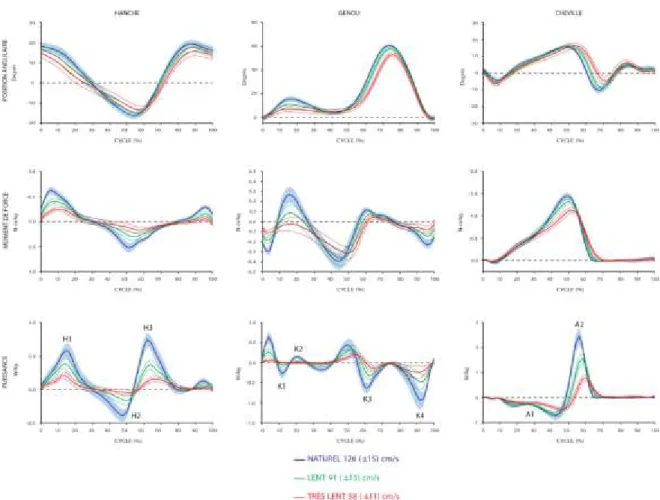
Dans la présente section, la marche sera décrite en terme de paramètres spatiotemporels, de cinématique, de cinétique et d’activité électromyographique (EMG). Les variables spatiotemporelles regroupent, comme leur nom l’indique, les mesures de temps et d’espace permettant de caractériser la marche. Les variables cinématiques documentent, entre autres, les mouvements se produisant à chacune des articulations (Fig. 1.1). D’autres variables, telles que la cinétique et l’activité électromyographique, permettent une analyse plus en profondeur du patron locomoteur, puisque celles-ci expliquent les mécanismes qui génèrent ces mouvements. Les variables cinétiques représentent les forces, les puissances et les énergies du mouvement (Winter 1987). La puissance est l’une des variables cinétiques les plus documentées dans l’étude de la marche. Celle-ci correspond au produit du moment de force (i.e. la force qui agit à une certaine distance d’un point de rotation; en Newtons-mètres) et de la vitesse angulaire du mouvement autour d’une articulation (en radians/seconde). Elle peut être interprétée en terme de génération ou d’absorption d’énergie. Lorsque les deux variables impliquées dans le calcul de la puissance sont de même signe, la puissance qui en résulte est positive. Cela signifie alors que les muscles autour d’une articulation génèrent de l’énergie (contraction concentrique). Inversement, si les signes sont opposés, la puissance est négative et les muscles autour de l’articulation concernée absorbent l’énergie (contraction excentrique). Au niveau des courbes de puissance musculaire (Fig. 1.1), il est possible d’identifier des phases d’absorption et de génération d’énergie qui ont un rôle primordial lors de la marche (Winter 1987). Quant aux variables électromyographiques, celles-ci indiquent le niveau de recrutement des unités motrices en permettant, par exemple, d’estimer le moment et l’amplitude d’activation de certains muscles. Lors de la marche, les différents muscles impliqués s’activent selon une
chorégraphie précise afin de former ce que l’on appelle un « patron d’activation musculaire » (Fig. 1.2).
Fig. 1.1: Positions angulaires, moments de force et puissances mesurés aux 3 articulations du membre inférieur lors de la marche au sol chez un groupe de participants en santé, sans déficit locomoteur (n=30; 56.8±8.2 ans).
Le cycle de marche débute au contact initial (de 0 à 2% du cycle de marche; Perry 1992) du pied avec le sol. À ce moment précis, la hanche est fléchie, le genou est étendu et la cheville est en position neutre. Chez une personne ne présentant pas de déficit locomoteur, le contact au sol s’effectue avec le talon. Cet évènement est suivi d’un léger mouvement de flexion plantaire à la cheville, sous le contrôle excentrique des muscles fléchisseurs dorsaux, permettant au pied d’entrer complètement en contact avec le sol. Le poids du corps est ensuite transféré au membre inférieur venant de prendre contact avec le sol. Cette phase de mise en charge (de 2 à 10% du cycle de marche) représente la première phase de
double-appui du cycle de marche. Au cours de celle-ci, le genou fléchit, sous le contrôle excentrique des muscles extenseurs du genou (K1), de façon à absorber le choc du contact avec le sol. La phase de double-appui prend fin lorsque le pied contralatéral décolle du sol. Le milieu de l’appui (de 10 à 30% du cycle de marche), est, par la suite, consacré à la progression antérieure du corps au dessus du pied en appui jusqu’à ce que celui-ci soit aligné avec l’avant-pied. Une flexion dorsale à la cheville, contrôlée en excentrique par les fléchisseurs plantaires (A1), ainsi que des mouvements d’extension à la hanche (H1) et au genou (K2), générés par les muscles extenseurs de la hanche et du genou, se produisent simultanément. Lors de la fin de la phase d’appui (de 30 à 50% du cycle de marche), la progression du corps se poursuit au-delà de l’avant-pied. Afin de freiner le mouvement d’extension à la hanche, l’énergie est alors absorbée par les fléchisseurs (H2). Une importante bouffée de génération d’énergie (A2) produite par les fléchisseurs plantaires débute vers la fin de la phase d’appui. Cette bouffée, communément appelée la poussée plantaire (push-off) se poursuit jusqu’à la fin de la phase de pré-oscillation (de 50 à 60% du cycle de marche). Winter (1983) ont démontré une association entre cette poussée plantaire (A2) et la progression du corps vers l’avant. Ces résultats s’opposent, cependant, à ceux de Perry et al. (1974) qui suggèrent que cette progression est plutôt due à un phénomène de chute contrôlée (roll-off). Quoi qu’il en soit, la phase de pré-oscillation contribue fortement à l’avancement du membre inférieur. Celle-ci correspond à la deuxième phase en double-appui du cycle de marche, lors de laquelle se déroule le transfert du poids du corps, mais cette fois-ci du côté contralatéral. En plus de la poussée plantaire, le mouvement de pendule du membre inférieur est induit par la puissance générée par les fléchisseurs de la hanche (H3), débutant en pré-oscillation et se poursuivant au cours de la phase d’oscillation. La phase initiale de l’oscillation (de 60 à 73 % du cycle de marche), qui suit le décollement des orteils du sol, se caractérise par des mouvements de flexion dorsale à la cheville, de flexion du genou et de la hanche afin de contribuer au dégagement des orteils du sol, ainsi qu’à l’avancement du membre inférieur. Les mouvements de flexion à la hanche et de flexion dorsale à la cheville sont assurés, respectivement, par les muscles fléchisseurs de la hanche et les fléchisseurs dorsaux, alors que la flexion du genou serait produite passivement par la poussée plantaire et contrôlée par les extenseurs du genou (K3). Cette phase se termine lorsque le pied en oscillation est aligné avec le pied en
appui. Par la suite, le déplacement du membre inférieur vers l’avant se poursuit lors de la phase du milieu de l’oscillation (de 73 à 87% du cycle de marche). Pour ce faire, la flexion de la hanche s’accentue davantage, le genou s’étend grâce à la gravité et la cheville poursuit son mouvement de flexion dorsale jusqu’à la position neutre afin de préparer le positionnement du pied au sol. L’action du genou ne se produit cependant pas grâce à l’énergie générée par le quadriceps, contrairement à ce que l’on pourrait croire. L’extension du genou est davantage causée par le mouvement de pendule du membre inférieur généré principalement par les fléchisseurs de la hanche (Winter 1987). Cette phase est complétée lorsque le tibia est en position verticale. Le cycle de marche se conclut avec la phase terminale de l’oscillation (de 87 à 100% du cycle de marche). Alors que les articulations de la hanche et de la cheville conservent leur position, le genou s’étend de façon à positionner le pied adéquatement pour le contact avec le sol. L’énergie est alors absorbée par les fléchisseurs du genou de façon à freiner ce mouvement (K4).
Fig. 1.2: Patron d’activation musculaire mesuré lors de la marche au sol chez un groupe de participants en santé, sans déficit locomoteur (n=30; 56.8±8.2 ans).
1.2.3 Le contrôle de la marche
La marche résulte d’un patron d’activation musculaire précis qui agit sur le système osseux de façon à induire des mouvements fluides et coordonnés au niveau des membres inférieurs (Carlsöö 1972). La génération de ce patron d’activation musculaire implique des interactions complexes entre différents niveaux de contrôle, soit les commandes d’origine centrale, provenant des centres supérieurs et de la moelle épinière, et les commandes d’origine périphérique, provenant des afférences sensorielles (Yang et al. 1991; Patla 1996; Dietz & Duysens 2000; Bo Nielsen 2002; Nielsen & Sinkjaer 2002; Grey et al. 2007). La présente section sera consacrée à l’étude des bases neurophysiologiques du contrôle de la marche chez l’humain. Il demeure toutefois nécessaire d’aborder quelques études ayant expérimenté sur des modèles animaux, afin de mieux comprendre certains phénomènes qu’il serait impossible de documenter chez l’humain.
Le contrôle spinal de la marche
Les toutes premières études questionnant le rôle de la moelle épinière dans le contrôle de la locomotion datent du début du 20e siècle, alors que des mouvements de pas (stepping) ont été constatés chez des animaux spinalisés (Sherrington 1906; Sherrington 1910). Ces observations suggèrent que des mouvements locomoteurs rythmiques de base sont possibles malgré l’absence d’influences supraspinales. Cependant, le doute demeurait quant à savoir si ces mouvements étaient générés par la moelle épinière ou s’ils résultaient d’une combinaison complexe de réflexes. Les études sur la contribution de la moelle au contrôle de la marche se sont poursuivies avec les découvertes de Graham Brown qui a constaté la présence de contractions alternées entre les muscles fléchisseurs et extenseurs de la cheville suite à une section de la moelle épinière chez des chats déafférentés. Basé sur cette observation, il a été suggéré que la moelle épinière est en mesure de produire, de façon indépendante (i.e. sans influences supraspinales ou sensorielles), un patron alterné d’activation musculaire (Brown 1911). De nombreuses études ont poursuivi leurs recherches sur ces réseaux d’interneurones situés dans la moelle épinière, suggérant que des générateurs de rythme (central pattern generator CPG) produisent un patron rythmique d’activation musculaire coordonnée (intra et inter-membre) induisant des mouvements
locomoteurs en réponse à un stimulus sans toutefois dépendre des afférences sensorielles (Grillner & Zangger 1975; Grillner & Zangger 1979; Hultborn & Nielsen 2007). Bien que le CPG puisse générer un patron rythmique d’activation musculaire indépendamment, les influences supraspinales et sensorielles ont un impact considérable sur le CPG et, par conséquent, sur la production de ce patron rythmique d’activation musculaire (voir les sections suivantes).
Les quelques expériences effectuées chez les primates n’ont pas démontré, de façon aussi convaincante, l’implication du CPG dans le contrôle de la marche (Fulton & Sherrington 1932; Eidelberg et al. 1981; Vilensky et al. 1992). Chez le primate, le CPG dépendrait donc davantage des influences provenant des centres supérieurs que chez le chat (Vilensky 1987).
L’utilisation de protocoles expérimentaux équivalents à ceux testés chez les modèles animaux est impossible chez l’humain. Ainsi, les évidences de la présence du CPG sont plus indirectes. Plusieurs chercheurs considèrent, cependant, que les indices sont suffisants pour confirmer que le CPG existe bel et bien aussi chez l’humain.
Chez le nouveau-né, alors que les influences supraspinales ne sont pas encore matures, il est possible d’induire un mouvement de pas (stepping) lorsque le poids de l’enfant est supporté et que la plante des pieds repose sur une surface stable (Forssberg 1985; Yang et al. 1998a). Ces études nous portent à croire que les systèmes impliqués dans la génération de mouvements rythmiques et alternés au niveau des membres inférieurs sont développés dès la naissance. Ces systèmes permettent aux enfants d’adapter la durée de leur cycle en fonction de la vitesse du tapis roulant (Yang et al. 1998a). Puisque les enfants anencéphaliques présentent des réponses similaires (Peiper 1963), ces mouvements de pas semblent être contrôlés principalement par le tronc cérébral (habituellement fonctionnel chez les nouveaux-nés atteintes d’anencéphalie) et la moelle épinière. Ces résultats sont compatibles avec ceux obtenus chez le chaton spinalisé à la naissance (Robinson & Goldberger 1986).
Bien que les lésions de la moelle épinière chez l’humain sont rarement aussi bien définies que celles induites chez les modèles animaux, plusieurs parallèles peuvent être tracés entre les évidences observées chez des animaux spinalisés et celles observées chez les personnes ayant subi une LM. Entre autres, quelques études de cas ont démontré la présence d’activité rythmique involontaire dans les membres inférieurs de personnes ayant subi une lésion complète de la moelle épinière (Bussel et al. 1988; Nadeau et al. 2010). Cette activation musculaire alternée des membres inférieurs peut aussi être induite lorsque les personnes atteintes sont placées sur un tapis roulant en marche et que leur poids est supporté (Dietz et al. 1994; Dietz et al. 1995). Ces résultats doivent être interprétés avec précaution puisque la possibilité que cette activité musculaire soit due à une réponse alternée de certaines voies réflexes ne peut être exclue. Des évidences plus directes de la contribution du CPG à la marche humaine ont été obtenues en stimulant électriquement la moelle épinière lombaire de personnes ayant une lésion complète (Dimitrijevic et al. 1998). Des bouffées d’activation musculaire au niveau des membres inférieurs produisant des mouvements similaires à ceux de la marche ont alors été observées.
Les influences supraspinales sur le contrôle de la marche
Les générateurs de rythme situés dans la moelle épinière ne sont, cependant, pas en mesure de produire une marche totalement indépendante et fonctionnelle. Les influences descendantes des centres supérieurs ont un impact considérable sur le contrôle de la marche. Le CPG doit, initialement, être activé par un stimulus de façon à produire un patron rythmique d’activation musculaire. La région locomotrice mésencéphalique (mesencephalic locomotor region [MLR]), située dans le tronc cérébral, est connue comme étant responsable de l’initiation de la locomotion et de la régulation du niveau d’activité du CPG via la voie réticulospinale. Chez l’animal, une augmentation de l’intensité de stimulation électrique de la MLR résulte en une augmentation de la vitesse de marche. On observe alors une transition de la marche au trot et ensuite au galop (Shik et al. 1969; Kandel et al. 2000). Chez l’humain, des évidences indirectes de l’implication de la MLR dans l’initiation de la marche ont récemment été démontrées. Les résultats de Snijders et al. (2011) ont mis en évidence des altérations structurelles et fonctionnelles dans la zone de la
MLR chez des personnes atteintes de la maladie de Parkinson ayant des problématiques d’initiation de la marche.
La majorité des voies descendantes projetant sur le CPG proviennent du tronc cérébral (voies vestibulospinale, rubrospinale, réticulospinale et tectospinale). Ces voies modulent le patron rythmique d’activation musculaire produit par le CPG afin de s’adapter à des changements dans l’environnement (obstacles, surface inégale, etc.). De façon générale, la voie réticulospinale (formation réticulée) et la voie vestibulospinale (noyaux vestibulaires) transmettent des afférences excitatrices, respectivement lors de la phase d’oscillation et lors de la phase d’appui de la marche (Patla 1996). La voie vestibulospinale a donc un impact important sur les muscles antigravitaires et, par conséquent, sur la stabilité posturale. Concernant la voie rubrospinale (noyau rouge), une étude effectuée chez le chat démontre que son implication ne se limite pas seulement à ajuster le niveau d’activité des fléchisseurs pendant l’oscillation, mais qu’elle aurait aussi un rôle important dans la coordination intra- et inter-membre et dans la régulation des cycles de marche, particulièrement lors de la marche en présence d’obstacles (Lavoie & Drew 2002). Par contre, cette fonction du noyau rouge est possiblement minimale ou absente chez l’humain, puisque le noyau rouge projette principalement sur le cervelet, et non pas sur la moelle épinière (Purves et al. 2011). La voie tectospinale (colliculus supérieur), quant à elle, est davantage impliquée dans le contrôle directionnel de la marche et l’orientation (Patla 1996).
Malgré que le cervelet ne projette pas directement sur le CPG, cette structure est tout de même importante dans le contrôle de la marche. En plus de recevoir des afférences visuelles et vestibulaires, une copie des efférences provenant des réseaux locomoteurs sont envoyées au cervelet via la voie spinocérébelleuse ventrale, ainsi que des informations sensorielles provenant des membres via la voie spinocérébelleuse dorsale (Bosco & Poppele 2001). Le cervelet est donc en mesure de faire une comparaison entre la trajectoire désirée et celle obtenue et d’apporter des corrections, au besoin, en modulant le patron d’activation musculaire généré par le CPG grâce aux différentes voies descendantes. Par ailleurs, le cervelet a un rôle primordial dans l’ajustement du réflexe vestibulo-oculaire, qui permet de maintenir l’image sur la rétine lors des mouvements de la tête (Barnes 1993). La
marche des personnes ayant une lésion cérébelleuse (maladie dégénérative ou autres lésions) est fréquemment caractérisée par des pas courts, des problèmes de coordination inter-articulation, ainsi qu’une augmentation de la variabilité entre les cycles (Palliyath et al. 1998; Morton & Bastian 2003).
Chez le chat, le cortex moteur semble davantage impliqué lors des tâches locomotrices nécessitant une certaine coordination visuomotrice, c’est-à-dire lorsque la marche doit être guidée grâce aux informations visuelles (Drew et al. 2008). Suite à une lésion du cortex moteur, l’animal présente des difficultés importantes à effectuer des tâches nécessitant de placer les membres à un endroit spécifique sur la surface, par exemple lors de la marche sur les barreaux d’une échelle placée horizontalement (Liddell & Phillips 1944; Drew et al. 2008).
Certaines évidences nous laissent croire que le développement de la marche bipède aurait eu comme conséquence une implication plus importante du cortex moteur au contrôle de la marche humaine (Capaday et al. 1999; Malouin et al. 2003; Barthelemy et al. 2011). En effet, le cortex moteur contribuerait de façon importante à l’activation des muscles pendant la marche sur une surface plane ou sur un tapis roulant, via des projections monosynaptiques aux motoneurones (Nielsen 2003). L’utilisation de la stimulation magnétique transcrânienne (Transcranial magnetic stimulation [TMS]) a permis de démontrer une relation importante entre la voie corticospinale et l’activation du muscle Tibialis anterior (TA) pendant la marche (Capaday et al. 1999). Par ailleurs, la présence d’une synchronicité (cohérence) entre les signaux électroencéphalographiques (EEG) mesurés au niveau de la région corticale responsable de la motricité du membre inférieur et l’EMG du muscle TA pendant la phase d’oscillation lors de la marche sur tapis roulant supporte l’hypothèse de l’implication du cortex moteur et de la voie corticospinale au contrôle de la marche humaine (Petersen et al. 2012).
Bien que le rôle des noyaux gris centraux dans le contrôle de la marche ne soit pas encore bien documenté, certains indices nous laissent croire à l’importance de cette structure dans l’initiation des mouvements provenant d’un stimulus interne. Effectivement, l’existence
d’une relation étroite entre les noyaux gris centraux et la MLR a été démontrée chez l’animal, suggérant ainsi une implication dans l’initiation de la locomotion (Garcia-Rill 1986). Chez l’humain, la contribution de cette structure à la marche peut être inférée en étudiant les personnes atteintes de la maladie de Parkinson, une pathologie affectant les noyaux gris centraux (substance noire). Une difficulté à initier la marche en l’absence de stimuli externes résulte fréquemment de cette pathologie (Browner & Giladi 2010).
Le cortex pariétal, quant à lui, participe à l’interprétation des informations sensorielles. Cette structure reçoit les informations visuelles ainsi que les informations reliées au mouvement locomoteur provenant, respectivement, du système visuel et du système somatosensoriel. Le cortex pariétal postérieur contribuerait, de façon importante, à la planification des tâches locomotrices qui nécessitent des modifications en se basant sur les informations visuelles (Lajoie & Drew 2007; Drew et al. 2008). En plus, de présenter de déficits au niveau de la coordination inter-membres, les chats ayant subi une lésion du cortex pariétal postérieur touchent fréquemment les obstacles en tentant de les franchir. Bien que peu d’études aient été publiées sur la contribution du cortex pariétal dans la marche humaine, certains indices nous portent à croire que celui-ci serait impliqué, tout comme chez l’animal, dans les tâches visuomotrices. En effet, une activation du lobe pariétal inférieur droit a été observée lors d’une tâche d’imagerie de la marche avec obstacle (Malouin et al. 2003).
Les influences sensorielles sur le contrôle de la marche
De façon générale, les informations sensorielles, provenant des systèmes visuel, vestibulaire et somatosensoriel, sont essentielles aux modifications anticipatoires et réactives du patron locomoteur face aux différentes contraintes de l’environnement. En plus de nous informer sur l’organisation et les caractéristiques de l’environnement, les afférences visuelles nous fournissent des informations sur l’orientation et le déplacement du corps et des segments dans l’espace. Pendant la marche, les afférences visuelles contribuent davantage lorsqu’un ajustement du placement du membre au sol doit être effectué avant le franchissement d’un obstacle (Patla & Greig 2006) ou lorsqu’une adaptation à différentes surfaces est nécessaire (Marigold & Patla 2008). Les afférences vestibulaires nous
fournissent, quant à elles, des informations sur l’accélération/décélération angulaire et linéaire de la tête, ainsi que sur l’orientation de la tête en fonction de la gravité (Patla et al. 1996). Le système vestibulaire est aussi bien connu pour son rôle dans le contrôle du système oculomoteur permettant ainsi d’ajuster le réflexe vestibulo-oculaire de façon à stabiliser l’image visuelle sur la rétine (Barnes 1993). Des études effectuées chez le chat ont démontré que la présence de déficits vestibulaires peut induire des problématiques au niveau de l’équilibre dynamique lors de la marche sur une surface étroite (Marchand et al. 1988). La contribution des informations vestibulaires au contrôle de la marche humaine a été étudiée à l’aide de la stimulation vestibulaire galvanique. Ainsi, il a été mis en évidence que la contribution des informations vestibulaires au contrôle des mouvements du corps est modulée en fonction de la phase du cycle de marche (Bent et al. 2005). Les auteurs suggèrent que, pendant la marche, les informations vestibulaires sont utilisées, entre autres, pour assurer un positionnement adéquat du pied et, par conséquent, prévenir les déséquilibres. De plus, les informations vestibulaires sont aussi impliquées au niveau de la navigation, puisque la trajectoire de marche de sujets ayant les yeux fermés dévie en présence d’une stimulation vestibulaire galvanique, suggérant ainsi une altération de la perception de la trajectoire (Fitzpatrick et al. 1999).
Le système somatosensoriel, qui recueille des informations grâce aux récepteurs cutanés, musculaires et articulaires, nous renseigne sur l’orientation relative des segments du corps, la position des membres, le mouvement des segments, la tension musculaire, l’orientation de la surface de support, ainsi que sur l’orientation du corps relativement à cette surface. Les informations sensorielles provenant des membres inférieurs contribuent significativement au contrôle de la marche (Patla et al. 1996; Rossignol et al. 2006; Frigon & Rossignol 2006; Hultborn & Nielsen 2007). Les fonctions principales de ces afférences sensorielles sont de: 1) contrôler le timing des différentes phases du cycle de marche via le CPG; 2) façonner la patron d’activation musculaire via les voies réflexes directement aux motoneurones; 3) contribuer à l’excitabilité des motoneurones et 4) contribuer à l’adaptation à long terme de la locomotion (Hultborn & Nielsen 2007).
La position de la hanche, ainsi que la charge (load) sur les muscles extenseurs semblent avoir un impact considérable sur le timing des phases dans le cycle de marche. Effectivement, il a été démontré que, chez le chat spinal, la transition entre l’appui et l’oscillation peut être effectuée plus tardivement si l’extension de la hanche est retardée manuellement (Grillner & Rossignol 1978). Chez l’humain adulte, l’ajout d’une charge ne modifie pas la durée du cycle ou la durée des phases (Stephens & Yang 1999; Noble & Prentice 2006). Une augmentation de la charge chez l’enfant lors de la marche avec un support de poids résulte toutefois en une augmentation de la durée de la phase d’appui et de la durée totale du cycle (Yang et al. 1998b). Étant donné l’aspect bipodal de la locomotion humaine et, par conséquent, l’importance des transitions entre les phases d’appui et d’oscillation sur le maintien de l’équilibre, certains auteurs suggèrent que ces transitions dépendent davantage des influences supraspinales que chez le chat (Stephens & Yang 1999).
L’existence de voies réflexes permettant de façonner le patron d’activation musculaire, et ce lors d’un même cycle de marche, a été documentée dans quelques études. Les organes tendineux de Golgi (afférences 1b), ainsi que les fuseaux neuromusculaires (afférences 1a) peuvent contribuer via des réponses à courte latence à augmenter l’activation des extenseurs de façon à permettre le support du poids et la propulsion vers l’avant (Angel et al. 1996).
Les informations sensorielles contribuent de façon importante à l’augmentation de l’activation des muscles fléchisseurs plantaires de la cheville durant la marche chez l’humain (Grey et al. 2004). En effet, lors d’une décharge rapide des fléchisseurs plantaires (unload), une diminution importante de l’activation du muscle soleus a été observée. Ces modifications ont été imputées aux afférences proprioceptives plutôt qu’aux afférences cutanées, puisque qu’en bloquant les informations cutanées provenant du pied et de la cheville, peu de changements ont été observés au niveau de l’activité EMG des fléchisseurs plantaires.
1.3 La marche suite à une lésion du SNC
La perte de l’intégrité du SNC, chez des personnes ayant subi un AVC ou une LM, peut induire des incapacités locomotrices. Ces incapacités diffèrent considérablement d’une personne à l’autre en fonction des déficiences à l’origine de celles-ci, ainsi que des compensations utilisées pour limiter l’impact de ces problématiques de marche sur l’individu.
1.3.1 La marche: une priorité de la réadaptation
Retrouver la capacité de marcher a été identifié comme étant une priorité de la réadaptation par les deux populations à l’étude. En effet, lorsque les personnes ayant subi un AVC sont questionnées à propos de ce qu’elles désirent accomplir au cours de leur réadaptation, retrouver la capacité de marcher fait généralement partie de leurs objectifs (Bohannon et al. 1988). De façon plus spécifique, toutes les variables suivantes ont été identifiées, dans l’étude de Bohannon et al. (1991), comme étant « importantes » ou « très importantes » chez une majorité de personnes ayant subi un AVC: l’indépendance à la marche (93.1%), la distance (86.2%), l’apparence (79.3%) et la vitesse (63.8%).
Chez les personnes ayant subi une LM, 14.2% des individus présentant une quadriplégie et 38.1% de ceux présentant une paraplégie considèrent la marche comme étant la fonction la plus importante ou la deuxième plus importante afin d’améliorer leur qualité de vie (Anderson 2004). Des comités d’experts constitués d’usagers et de professionnels de la santé soulignent aussi l’importance accordée au rétablissement de la capacité de marcher des personnes ayant une LM (Ditunno et al. 2008).
1.3.2 Quelques statistiques…
Au Canada, 300 000 personnes vivent actuellement avec les conséquences d’un AVC (Lindsay et al. 2010) et 85 000 personnes vivent avec celles d’une LM (Farry & Baxter 2010). Parmi ces conséquences, la présence de déficits à la marche peut avoir un effet dévastateur sur la capacité fonctionnelle et la qualité de vie des personnes qui en sont atteintes. Suite à un AVC, la proportion de personnes pouvant marcher de façon
indépendante (plus de 3 mois post-AVC) est estimée entre 50 et 85% (Skilbeck et al. 1983; Wade & Hewer 1987; Dam et al. 1993; Jorgensen et al. 1995). Bien que plusieurs personnes retrouvent la capacité de marcher de façon indépendante, cela ne signifie pas pour autant une absence de déficits locomoteurs. Viosca et al. (2005) ont démontré que, parmi les marcheurs considérés comme étant indépendants suite à un AVC, 12% sont classifiés comme « indépendant à la maison », 32% sont évalués comme étant « indépendant dans les environs de leur domicile, 32% sont considérés comme étant « indépendant dans la communauté » et seulement 16% retrouvaient une marche dite « normale ». Cette étude illustre très clairement le fait que certains déficits peuvent persister même chez des marcheurs indépendants. Suite à une LM, les proportions de marcheurs indépendant documentées dans les études varient aussi considérablement en fonction de la sévérité des déficits neurologiques. Par exemple, Kay et al. (2007) ont démontré qu’à la fin de la réadaptation, la proportion de marcheurs indépendants était de 28.3% et de 67.2%, respectivement, chez des personnes qui présentaient une LM de niveau neurologique ASIA C ou D (American Spinal Injury Association Impairment Scale; Marino et al. 2003) au moment de l’admission. Dans les sections suivantes, les différentes problématiques à la marche observées suite à un AVC ou une LM seront survolées.
1.3.3 Les déficits locomoteurs suite à un AVC
Tel que mentionné précédemment, la marche peut être décrite en terme de variables spatiotemporelles, cinématiques, cinétiques et électromyographiques. Les déficits locomoteurs des 2 populations à l’étude (AVC et LM) ont été identifiés en comparant ces variables avec celles d’individus en santé et ce, pour la majorité des études présentées ci-dessous.
Tout d’abord, concernant les variables spatiotemporelles, les personnes ayant subi un AVC présentent une vitesse de marche confortable plus lente que les personnes en santé de leur âge (Knutsson & Richards 1979; Brandstater et al. 1983; Lehmann et al. 1987; Burdett et al. 1988; Trueblood et al. 1989; von Schroeder et al. 1995; Goldie et al. 1996; Canning et al. 2006; Milot et al. 2007; Jonkers et al. 2009; Meijer et al. 2011). Bien que ces personnes
soient toujours en mesure d’augmenter leur vitesse de marche au-delà de leur vitesse confortable (Kim & Eng 2003; Milot et al. 2007; Jonkers et al. 2009), cette capacité demeure limitée (Turnbull et al. 1995). La vitesse de marche est connue comme étant un indicateur de choix pour quantifier les déficits locomoteurs suite à un AVC, ainsi que pour mesurer les changements qui se produisent au cours de la réadaptation (Goldie et al. 1996). Plusieurs groupes musculaires du membre parétique contribuent de façon importante à la détermination de la vitesse de marche; les principaux étant les fléchisseurs plantaires (Olney et al. 1991; Nadeau et al. 1999; Lamontagne et al. 2002; Kim & Eng 2003; Parvataneni et al. 2007; Jonkers et al. 2009), ainsi que les fléchisseurs (Olney et al. 1991; Nadeau et al. 1999; Kim & Eng 2003; Jonkers et al. 2009) et les extenseurs de la hanche (Olney et al. 1991; Parvataneni et al. 2007). Certains groupes musculaires du membre inférieur non-parétique influencent aussi la vitesse de marche (Lamontagne et al. 2000; Lamontagne et al. 2002; Kim & Eng 2004). En plus d’une réduction de la vitesse, la marche post-AVC est fréquemment caractérisée par une diminution de la longueur des pas/foulées (Knutsson & Richards 1979; Brandstater et al. 1983; Lehmann et al. 1987; Burdett et al. 1988; Trueblood et al. 1989; von Schroeder et al. 1995; Canning et al. 2006), une diminution de la cadence (Brandstater et al. 1983; Trueblood et al. 1989; von Schroeder et al. 1995; Canning et al. 2006), une augmentation de la largeur des pas (Burdett et al. 1988; Chen et al. 2005), une augmentation de la durée totale du cycle (Brandstater et al. 1983; Burdett et al. 1988; Trueblood et al. 1989; von Schroeder et al. 1995), ainsi qu’une asymétrie (Peat et al. 1976; Brandstater et al. 1983; Wall & Turnbull 1986; Lehmann et al. 1987; Chen et al. 2005; Meijer et al. 2011).
Concernant la cinématique, la marche hémiplégique est, tout d’abord, caractérisée par un contact au sol effectué avec le pied à plat (Knutsson & Richards 1979; von Schroeder et al. 1995). Au cours de la phase d’appui, le mouvement d’extension à la hanche est plus limité (Lehmann et al. 1987; Chen et al. 2003; Chen et al. 2005), ainsi que le mouvement de flexion plantaire à la cheville (Chen et al. 2003). Au genou, deux stratégies peuvent être observées, soit une flexion excessive (Trueblood et al. 1989; Richards et al. 2003) ou une hyperextension (Knutsson & Richards 1979; Trueblood et al. 1989). Lors de la phase d’oscillation de la marche, les excursions angulaires à la hanche (Chen et al. 2003), au
genou (Lehmann et al. 1987; Chen et al. 2003; Chen et al. 2005) et à la cheville (Lehmann et al. 1987; Chen et al. 2003) du membre inférieur parétique sont diminuées. De plus, au niveau de la cheville, une diminution de la flexion dorsale maximale pendant l’oscillation a été constatée chez plus de 45% des personnes évaluées (Lamontagne et al. 2002; Mulroy et al. 2003).
Au niveau de la cinétique, une diminution du moment de force et de la puissance en flexion plantaire a été constaté du côté parétique (Olney et al. 1991; Lamontagne et al. 2002). Le moment de force en extension du genou au milieu de l’appui est, quant à lui, plus élevé chez les personnes ayant subi un AVC que chez les personnes en santé (Lehmann et al. 1987). De plus, certaines études utilisant des « ratios d’utilisation musculaire » ont démontré que la contribution relative maximale des fléchisseurs plantaires, des fléchisseurs et des extenseurs de hanche à la marche est plus élevée chez des personnes ayant subi un AVC (Milot et al. 2006). Ces ratios sont en fait des proportions entre le moment de force produit par un groupe musculaire pendant la marche à un temps précis en fonction du moment de force maximal que ce groupe musculaire est en mesure de générer lors d’une contraction maximale volontaire en isocinétique (Nadeau et al. 1999; Milot et al. 2006).
Étant donné la variabilité importante des données EMG (intra- et inter- individu), il demeure difficile de dresser un portrait global du patron d’activation musculaire des personnes ayant subi un AVC (Knutsson et Richards 1979; Woolley et al. 2001). Knutsson et Richards (1979) ont proposé de classifier le patron d’activation musculaire des personnes hémiparétiques selon leur problématique d’activation musculaire pendant la marche. Les 3 catégories suivantes regroupent donc la majorité des déficits pouvant être observées dans le patron d’activation musculaire de personnes ayant subi un AVC. La catégorie I inclut les problématiques d’activation caractérisées par une faible amplitude d’activité EMG au niveau des muscles fléchisseurs dorsaux et fléchisseurs plantaires pendant la phase d’appui, ainsi qu’une activation prématurée des fléchisseurs plantaires. Les patrons d’activation musculaire incluent dans la catégorie II présentent une absence ou une réduction significative de l’activité EMG au niveau de 2 muscles ou plus du membre inférieur parétique. Finalement, le patron d’activation musculaire de la catégorie III se caractérise