ANNE GALLAGHER ^־־
LES EFFETS MOTEURS, COMPORTEMENTAUX ET COGNITIFS D’UNE EXPOSITION PRÉNATALE AU MERCURE MÉTHYLÉ (ME II G) CHEZ LA
SOURIS FEMELLE
Mémoire présenté
à la Faculté des études supérieures de l’Université Laval
pour l’obtention
du grade de maître en psychologie (M.Ps.)
École de psychologie
FACULTÉ DES SCIENCES SOCIALES UNIVERSITE LAVAL
MAI 2001
Résumé
Le mercure est une toxine environnementale pouvant p neurologiques marqués incluant dentaux chez les organismes exposés. La présente étude se propose d’étudier chez la souris les effets moteurs, cognitifs et comportementaux d’une exposition prénatale au mercure méthylé (MeHg). Des souris femelles exposées prénatalement au MeHg (jours 12 à 14 de la gestation) sont soumises à des épreuves faisant appel à un apprentissage moteur, à un apprentissage d’alternance spatiale suivi d’un test avec délais, aux qualités exploratoires spontanées, à la discrimination visuelle et à la mémoire de référence et de travail. Bien que l’exposition prénatale n’exerce aucun effet significatif sur la motricité et sur les habiletés visuelles, elle retarde !’apprentissage de l’alternance spatiale et entraîne une diminution de l’exploration qui explique probablement la faible
performance à la tâche de mémoire (labyrinthe radial). Ces résultats indiquent qu’une intoxication prénatale au MeHg, même relativement faible, a des effets durables sur le développement neurocomportemental.
Superviseur : François-Y. Doré
Je tiens à exprimer ma reconnaissance et remercier sincèrement mes directeurs de mémoire, M. François-Y. Doré et Mme Sonia Goulet, pour votre soutien et vos précieux conseils dans toutes les étapes de la réalisation de ce mémoire. Merci beaucoup pour votre très, très grande disponibilité et votre support moral et technique. Votre rigueur scientifique et votre passion pour la recherche m’ont aidé à devenir une meilleure chercheure.
Je voudrais également remercier M. Marc-Édouard Mirault, du CHUL, pour sa précieuse collaboration au projet. Merci aussi au SAR pour votre aide lors de mes analyses statistiques.
Un immense MERCI à ma famille, Hélène, Pierre, Geneviève et Julie qui ont toujours été là afín de me supporter moralement et m’encourager. Merci d’avoir cru en moi dans les moments où j’y croyais un peu moins. Vous avez été une source de motivation et un support, tant moral que financier, d’une
importance considérable. Encore une fois merci!!!
Finalement, je désire remercier du fond du cœur tous mes amis, spécialement Virginie, Marie-France, Anne-Marie, Steph, Nie, Martin, JeffBi, Gwili et Jeff, pour leurs nombreux encouragements, leur écoute constante dans les moments plus difficiles, leur compréhension quant à mon manque de
disponibilité et leur simple présence, qui fût pour moi une motivation constante. Un merci tout spécial à Phil qui a traversé les mêmes étapes que moi lors de ces deux dernières années. Nos « séances de potins » et ton « humour plutôt cru » m’ont permis de garder le sourire lors de tous ces moments de travail et
ii RÉSUMÉ.
AVANT-PROPOS... ...iii
TABLE DES MATIÈRES...iv
V
LISTE DES FIGURES
1 INTRODUCTION 19 .19 .19 .21 21 22 23 23 24 MÉTHODE... Sujets... Matériel... Procédure... Rotarod... Labyrinthe en T... Open field... Discrimination visuelle Labyrinthe radial... 25 25 26 28 34 35 RÉSULTATS... Rotarod... Labyrinthe en T... Open field... Discrimination visuelle Labyrinthe radial... 39 DISCUSSION RÉFÉRENCES BIBLIOGRAPHIQUES... 46 58 ANNEXEA
Figures
1. Latences moyennes de chute (sec) dans le rotarod à 20 rpm chez les groupes
exposés (4mg et 6mg) et non exposé (Omg) au MeHg,... .26 2. Nombres de sessions requises pour atteindre le critère lors de F apprentissage à 0
seconde dans le labyrinthe en T chez les groupes exposés (4mg et 6mg) et non
exposé (Omg) au MeHg... 27 3. Nombres d’essais réussis lors des deux dernières sessions de !’apprentissage à 0
seconde et lors du test avec délai de 30, 60 et 120 secondes dans la tâche du labyrinthe en T chez les groupes exposés (4mg et 6mg) et non exposé (Omg)
au MeHg,...28
4. Nombres de carrés (centraux et périphériques) traversés au cours des cinq sessions dans F open field chez les groupes exposés (4mg et 6mg) et non exposé (Omg) au MeHg... 29
5. Pourcentages de carrés périphériques traversés lors des cinq sessions administrées dans F open field chez les groupes exposés (4mg et 6mg) et non exposé (Omg) au MeHg... 30
6. Nombres de redressements lors des cinq sessions administrées dans F open field
chez les groupes exposés (4mg et 6mg) et non exposé (Omg) au MeHg... .31
7. Nombres de carrés totaux (périphériques et centraux) traversés lors des premières (période 1) et dès dernières (période 2) 5 minutes d’enregistrement pour le total des cinq sessions administrées dans F open field chez les groupes exposés (4mg
et 6mg) et non exposé (Omg) au MeHg... 32
8. Nombres de carrés périphériques traversés lors des premières (période 1) et des dernières (période 2) 5 minutes d’enregistrement pour le total des cinq sessions administrées dans F open field chez les groupes exposés (4mg et 6mg) et non
9. Nombres de redressements lors des premières (période 1) et des dernières (période 2) 5 minutes d’enregistrement pour le total des cinq sessions dans !’open field
chez les groupes exposés (4mg et 6mg) et non exposé (Omg) au MeHg...34
10. Nombres de sessions nécessaires à l’atteinte du critère lors de !’apprentissage de la discrimination visuelle chez les groupes exposés (4mg et 6mg) et non
exposé (Omg) au MeHg... 35
11. Nombres de réussites associés à chaque bloc de trois sessions dans le labyrinthe
radial chez les groupes exposés (4mg et 6mg) et non exposé (Omg) au MeHg...36
12. Nombres de choix de couloirs associés à chaque bloc de trois sessions dans le labyrinthe radial chez les groupes exposés (4mg et 6mg) et non exposé (Omg)
au MeHg... 37
13. Pourcentages d’erreurs de mémoire de référence associés aux cinq blocs de trois sessions dans le labyrinthe radial chez les groupes exposés (4mg et 6mg) et
non exposé (Omg) au MeHg... 38
14. Pourcentages d’erreurs de mémoire de travail associés aux cinq blocs de trois sessions dans le labyrinthe radial chez les groupes exposés (4mg et 6mg) et
non exposé (Omg) au MeHg... ד... 39
ANNEXE Al. Rotarod... ... _ .58
ANNEXE A2. Labyrinthe en T...58
ANNEXE A3. Open field... 59
ANNEXE A4. Discrimination visuelle . .. ... 59
59 ANNEXE A5. Labyrinthe radial
Introduction
mercure méthylé chez la souris femelle
Le mercure est un agent neurotoxique qui, même à faibles doses, peut produire des déficits neurologiques marqués ( Bennett & Finnell, 1998). Les effets
embryologiques et neurologiques du mercure sont attribués à sa composante méthylée (Hansen, Tarp & Bohm, 1990) qui affecte principalement le système nerveux central (Clarkson, 1976). Le but de ce mémoire est d’évaluer à l’aide d’un modèle animal (souris) les effets moteurs, comportementaux et cognitifs d’une exposition prénatale au mercure méthylé (MeHg).
Intoxication des populations humaines par le mercure
Accidents écologiques et populations à risque
Dans les années 1950 à Minamata, au Japon, une fuite industrielle de mercure a contaminé les cours d’eau et exposé la population consommatrice de fruits de mer et de poissons au MeHg (Chang & Guo, 1998). Le MeHg traverse facilement la barrière placentaire de sorte que les enfants nés de mères qui étaient enceintes au moment de ce déversement ont été beaucoup plus affectés que leur mère elle-même ou que la population adulte en général. Ces enfants souffraient de nombreux symptômes tels que le retard mental, l’ataxie, l’arthralgie, la myalgie, des troubles de mémoire et de langage, la
paralysie cérébrale, des troubles du système visuel tels que le strabisme, l’hémianopsie et la cécité totale, des troubles de l’audition, des tremblements, !’augmentation de la
salivation et de la transpiration et la microcéphalie (Bennett & Finnell, 1998; Chang & Guo, 1998; Direction générale des services médicaux, 1979; Schardein, 1998; Tsubaki & Irukayama, 1977). Trente-neuf des quatre-vingt-neuf cas d’intoxication rapportés chez
les jeunes enfants se sont soldés par un décès précoce (Matsumo, Koya & Takeuchi, 1965). Le terme « syndrome foetal de Minamata » fait référence à ces cas répertoriés.
Quelques autopsies pratiquées sur des enfants de 2 à 6 ans atteints du syndrome fœtal de Minamata, caractérisé par une exposition chronique au MeHg, ont révélé que ces enfants présentaient une hypoplasie et une atrophie cérébrales bilatérales pouvant aller jusqu’à 55% de la masse cérébrale, une hypoplasie et une atrophie cérébelleuses dues à
une réduction du nombre de couches de cellules granulaires, une anormalité
cytoarchitecturale tant au niveau des couches de cellules granulaires que pyramidales dans chacun des lobes, une hypoplasie du corps calleux, une démyélinisation de la matière blanche et de l’hydrocéphalie (Chang & Guo, 1998; Matsumo et al., 1965). De nombreux symptômes montrent qu’il y a eu perturbation au cours de la maturation, de la croissance et de la migration neuronales (Chang & Guo, 1998; Tsubaki & Irukayama,
1977). L’hypoplasie de la moelle osseuse, l’atrophie des ganglions lymphatiques, la dégénérescence graisseuse du foie et des reins et la nécrose des cellules gustatives ont également été diagnostiquées (Tsubaki & Irukayama, 1977).
Au cours des années 1970, un accident écologique similaire est survenu en Iraq. De jeunes enfants ont été exposés au MeHg par du blé contaminé ou par le lait maternel. Ces enfants ont souffert par la suite de déficits semblables à ceux observés chez les jeunes victimes de Minamata. Toutefois, contrairement à l’intoxication survenue au Japon qui était de nature chronique, l’intoxication en Iraq était de type aigu (Chang & Guo, 1998). Contrairement à l’intoxication chronique survenue à Minamata,
l’intoxication au MeHg en Iraq était de type aigu et les neuropathologies observées consistaient principalement en une atrophie cérébrale et en une cytoarchitecture anormale (Chang & Guo, 1998).
Suite à ces deux catastrophes écologiques, de nombreuses études ont tenté d’identifier les effets neurotoxiques du mercure chez l’humain. Grandjean et al. (1997) ont démontré qu’une exposition prénatale au MeHg engendre chez des enfants des
des déficits d’attention, de langage et de mémoire, particulièrement de mémoire de travail, ainsi que des déficits visuels. Des problèmes auditifs, tels que la surdité et un seuil de détection anormal des hautes fréquences, sont aussi mesurés chez l’humain (Rice, 1996).
Certaines populations minières font présentement l’objet d’études (Brabo, Santos, Jesus, Mascarenhas & Fatal, 2000; Falnoga, Tusek-Znidaric, Horvat & Stegnar, 2000; Hacon et al., 2000), mais les principales populations étudiées demeurent encore les habitants des régions côtières et les Inuits, ces populations étant exposées
continuellement au MeHg ainsi qu’à d’autres polluants environnementaux par leur
alimentation riche en poissons et en mammifères marins. Par exemple, les populations du Groenland (Hansen et al., 1990), de la Nouvelle-Zélande (Grandjean, Jorgensen &
Weihe, 1994), du Danemark (Grandjean et al., 1997) du Brésil (Brabo et al., 2000; Hacon et al., 2000) et du Canada (Clarkson, 1976; Comité d’étude et d’intervention sur le
mercure au Québec, 1976; Direction générale des services médicaux, 1979) consomment par le biais de leur alimentation quotidienne, des niveaux critiques de MeHg. La période biologique du mercure méthylé, période pendant laquelle un composé traverse les membranes cellulaires, s’unit aux protéines dans les tissus, résiste à la détérioration biologique et finit par s’éliminer, est de 7 jours chez la souris, 70 jours chez l’humain et 700 jours chez le poisson (Clarkson, 1976). Cette dernière donnée explique pourquoi un si grand nombre d’intoxications au MeHg sont dues à une consommation abondante de poissons.
Vulnérabilité du fœtus aux agents tératogènes et au mercure
Les effets plus marqués du MeHg chez les enfants tels qu’observés à Minamata et en Iraq ainsi que dans l’étude de Grandjean et al. (1997) s’expliquent par des processus généraux à tous les agents tératogènes et par des caractéristiques spécifiques au mercure. Lors d’une exposition périnatale, les agents tératogènes engendrent une perturbation des processus cellulaires, des malformations congénitales et des troubles cognitifs sévères
(Greene, Nugent, Pisano, Weston & Potchinsky, 1998). Ce phénomène se nomme la neurotoxicité développementale et se définit comme un changement défavorable dans la structure ou la fonction du système nerveux central ou du système nerveux périphérique suite à l’exposition à un agent physique, biologique ou chimique, tel que le mercure, lors du développement (Tilson, 1992). Les organismes en développement sont
principalement exposés au MeHg par les voies transplacentaire et mammaire.
Il y aurait certaines périodes de susceptibilité accrue à des substances telles que le MeHg au cours du développement (Bennett & Finnell, 1998; Choi, 1986). D’abord, une exposition lors des stades précoces du développement cause souvent la mort. Si
l’organisme survit à ce traumatisme, très peu de déficits pourront être observés suite à la naissance. Cette période est qualifiée de tout ou rien. Une seconde période de
susceptibilité est associée à l’organogenèse. Une intoxication au cours de cette phase de développement provoque des malformations structurales variables. Finalement, un traumatisme lors des derniers jours de la gestation, associés à l’histogenèse et à la maturation, causerait des déficits fonctionnels tels qu’un retard de croissance, un retard mental et une microcéphalie. Une diminution du nombre de cellules nerveuses en serait la cause. De plus, la migration cellulaire se produit au cours de ce stade et serait
particulièrement vulnérable aux agents tératogènes (Bennett & Finnell, 1998; Choi, 1986).
Les effets d’un agent tératogène comme le MeHg peuvent se manifester très tôt ou demeurer latents pour n’apparaître que plus tard dans le développement (Kimmel, 1998; Rice, 1996; Shigematsu, Yasuda, Goto, Tanaka, Tobimatsu et Kato, 2000; Spyker, 1975a; Tsubaki & Irukayama, 1977). Ces effets latents prennent la forme de troubles de
comportement, de déficits intellectuels ou de déficits fonctionnels variés (Spyker, 1975a).
La concentration de MeHg dans le sang à l’accouchement est significativement plus élevée chez le nouveau-né que chez la mère exposée (Burbacher, Sackett & Mottet, 1990) et ce, à cause de l’incapacité de l’embryon à déméthyler, donc à éliminer, le MeHg (Hansen et al., 1990). Cette incapacité du foetus serait due à l’absence d’une bactérie
déméthylante dans l’intestin (Grandjean et al., 1994). Ainsi, au cours de la première année de vie, l’élimination du MeHg serait peu efficace, parfois même non fonctionnelle (Chang et Guo, 1998). Finalement, Weiss et Simon (1975) expliquent la vulnérabilité du fœtus au MeHg par le fait que le processus de mort cellulaire est accéléré chez les
organismes en développement, ce qui provoquerait une diminution de la capacité cérébrale résiduelle et des déficits fonctionnels. Cela a d’ailleurs été observé chez les jeunes victimes nées de mères exposées au Japon et en Iraq (Chang et Guo, 1998).
Neurotoxicité du mercure méthylé
Distribution, accumulation et élimination
Le MeHg se distribue dans plusieurs organes tels que le cerveau, le foie, les reins, le pancréas, la glande thyroïde, le tube digestif, les cellules endothéliales, les vaisseaux sanguins, la peau et les cheveux (Tsubaki & Irukayama, 1977). Cette neurotoxine endommage sérieusement les cellules nerveuses causant parfois leur mort alors que l’effet est moins destructeur sur les cellules hépatiques et rénales (Tsubaki & Irukayama, 1977).
Le mercure est très sujet à la bio-accumulation qui est plus lente dans le cerveau que dans le foie et les reins dans les stades précoces d’exposition. Toutefois,
l’élimination du MeHg est également plus lente dans le cerveau que dans ces deux organes (Clarkson, 1976; Direction générale des services médicaux, 1979; Tsubaki & Irukayama, 1977), d’où les accumulations particulièrement importantes mesurées dans le cerveau. Les études en laboratoire montrent que !’accumulation de mercure dépend du type d’administration utilisé, !’administration intrapéritonéale conduisant à une bio- accumulation plus importante que !’administration orale (Mehra & Kanwar, 1980a,
Chez des singes écureuils exposés au MeHg par voie orale, les plus fortes concentrations de mercure dans le système nerveux central se retrouvent dans le cortex cérébral, le cortex cérébelleux et les ganglions de la base (Berlin, Nordberg & Hellberg, 1973). La concentration spécifique la plus prononcée se trouve dans le cortex occipital, particulièrement autour de la fissure calcarine, ce qui constituerait une cause possible des déficits visuels fréquemment observés chez les victimes d’intoxication au mercure.
Chez la souris exposée postnatalement au MeHg, la distribution des métabolites du MeHg dans les structures cérébrales se fait selon un ordre décroissant, le cervelet étant le plus touché, suivi du tronc cérébral et du cortex cérébral (Vandewater, Racz, Norris & Buncel, 1983). Par contre, les dommages observés affectent les régions cérébrales dans un autre ordre, le cortex cérébral situé au-dessus du corps calleux étant le plus affecté, suivi du cervelet, du cortex cérébral situé sous le corps calleux et du tronc cérébral. Ainsi, il n’existe pas de corrélation positive entre les structures lésées et la concentration de MeHg retrouvée dans ces structures. Cela s’explique par une vulnérabilité différente des régions cérébrales au MeHg (Vandewater et al., 1983).
La distribution et l’élimination du MeHg varient selon la souche de souris exposée (Doi, 1986; Doi & Kobayashi, 1982; Spyker & Smithberg, 1972; Yasutake & Hirayama, 1986). Ces différences entre les souches quant à la concentration de mercure dans les organes et dans le sang proviendraient d’une différence dans la structure de
l’hémoglobine (Doi & Kobayashi, 1982). Des différences entre les deux sexes sont également observées quant à l’élimination du mercure méthylé (Yasutake & Hirayama, 1988). En effet, les souris mâles exposées au MeHg montrent un taux d’excrétion du mercure significativement plus élevé et une concentration tissulaire de mercure
significativement plus basse, sauf dans les reins, que les femelles (Yasutake & Hirayama, 1988).
Perturbations neuroanatomiques et effets neurotoxiques du mercure méthylé
Chez les primates exposés au MeHg, F autoradiographie démontre que les
dommages morphologiques les plus précoces et les plus prononcés sont observés dans le cortex visuel (Berlin et al., 1973).
La majorité des études sur les perturbations consécutives à une exposition prénatale et postnatale au MeHg ont toutefois été faites sur les rongeurs (Bennett & Finnell, 1998; Berthoud, Garman & Weiss, 1976; Inouye, Murao & Kajiwara, 1985; Kakita et al., 2000; Kutscher, Sembrat, Kutscher & Kutcher, 1985; Mac Donald &
Harbisson, 1977; Spyker, 1975a; Stoltenburg-Didinger & Markwort, 1990; Vaderwater et al., 1983). L’étendue de ces dommages semble proportionnelle à la dose administrée.
Dans le cervelet, ces anomalies sont représentées par une hypoplasie (Inouye et al., 1985) due à une dégénérescence et à une perte neuronale de cellules de Purkinje et de neurones granulaires (Bennett & Finnell, 1998; Daré, Götz, Zhivotovsky, Mänzo & Ceccatelli, 2000; Mac Donald & Harbisson, 1977; Spyker, 1975a). Dans d’autres structures cérébrales, une dégénérescence des neurones du striatum et du putamen (Berthoud et ai, 1976; Inouye et al., 1985) ainsi que des neurones situés principalement dans le tronc cérébral et, de façon moins marquée, dans le cortex cingulé, le thalamus, Faire CAI de l’hippocampe, l’amygdale et l’hypothalamus est observée. Les altérations morphologiques de l’hippocampe et de l’amygdale pourraient être la cause les divers troubles d’apprentissage et problèmes mnésiques engendrés par l’exposition au MeHg
(Kakita et al., 2000). Plus précisément, des anomalies structurales au niveau des dendrites des neurones pyramidaux (couche laminaire V) chez des rats exposés prénatalement à 5 mg de MeHg/kg aux jours 6 à 9 de la gestation ont été mises en évidence et sont associées à des troubles comportementaux et à des problèmes
d’apprentissage (Stoltenburg-Didinger et Markwort, 1990). Une autre cause possible de ces troubles d’apprentissage serait la suppression des systèmes inhibiteur et excitateur des neurones hippocampiques situés dans Faire CAI (Fountain & Rowan, 2000).
Une exposition prénatale au MeHg peut engendrer d’autres altérations
neuroanatomiques chez des rats telles qu’une hypertrophie des ventricules (Inouye et al., 1985), une diminution de l’épaisseur du cortex pariétal et une augmentation de la taille de la partie caudale de l’hippocampe (Kutscher et al., 1985). De plus, on remarque une myélinisation incomplète, une diminution ou une absence de la densité post-synaptique dans plusieurs jonctions synaptiques (Kutscher et al., 1985) et une microcéphalie (Chang & Guo, 1998; Schardein, 1998). Tous ces dommages neurologiques engendreraient différents déficits fonctionnels. Finalement, Cagiano et al. (1990) ont mesuré une corrélation directe entre la présence de concentrations élevées de MeHg dans le cerveau et une augmentation de la densité de récepteurs dopaminergiques dans la région striatale. Toutefois, cette corrélation n’est pas encore expliquée.
Neurotransmetteurs et neurotoxicité
Le mécanisme par lequel le MeHg induit une neurotoxicité est très controversé (Bennett & Finnell, 1998) et différentes explications ont été suggérées. D’abord, selon Kobayashi, Yuyama, Matsukama, Takeno et Yanagiya (1980), le MeHg perturberait le système cholinergique en diminuant la concentration d’acétylcholine dans le cortex et le striatum, causant ainsi des changements importants dans les fonctions cérébrales. Selon Wootten et al. (1985), le MeHg engendrerait une baisse de la concentration
d’acéthylcholinestérase dans le cortex antérieur et le cervelet. Cette inhibition de
l’activité enzymatique et de la liaison des seconds messagers aux protéines kinases A et C pourrait constituer le mécanisme de la neurotoxicité associé au MeHg (Saijoh, Fukunaga, Katsuyama, Lee & Sumino, 1993). Sakamoto, Ikegami et Nakano (1996) affirment plutôt que les effets neurotoxiques du MeHg seraient engendrés par une augmentation de la concentration intracellulaire de Ca2+. Ainsi, !’administration de bloqueurs de canaux calciques pourrait protéger les organismes contre la neurotoxicité du MeHg.
L’accumulation de sélénium, combinée à celle du mercure méthylé, protégerait également les organes en détoxiquant le mercure (Kosta, Byme & Zelenko, 1975).
O’kusky et McGeer (1985) ont démontré qu’une exposition postnatale au MeHg produit une diminution de l’activité de l’acide glutamique décarboxylase (marqueur des neurones GABAergiques par sa localisation spécifique) dans le cortex occipital, le néostriatum et le cortex frontal entraînant une altération de la neurotransmission
GABAergique et l’apparition de déficits fonctionnels. La réduction la plus marquée de l’activité de l’acide glutamique décarboxylase est notée dans le cortex visuel.
Shigematsu, Yasuda, Goto, Tanaka et Tobimatsu (2000) corroborent ces résultats à l’aide d’une technique de localisation impliquant le glucose qui indique que suite à une
exposition postnatale chronique (85 jours) au MeHg, l’activité cérébrale diminue
significativement et sélectivement dans les aires visuelles et auditives. Cela pourrait être la cause des différents déficits visuels tels que la baisse de l’acuité visuelle et la
constriction du champ visuel fréquemment rapportées suite à une exposition au MeHg.
Les déficits moteurs parfois observés suite à une intoxication au MeHg
s’expliqueraient, quant à eux, par des altérations de la transmission GABAergique dans le cortex moteur et le néostriatum (O’kusky et McGeer, 1985). Des déficits
comportementaux tels que la baisse d’activité motrice, qui est le signe d’une intoxication au MeHg le plus souvent mesuré chez les rongeurs, pourraient être engendrés par une diminution de la neurotransmission dopaminergique (Rossi, Ahlbom, Ôgren, Nicotera & Ceccatelli, 1997) puisque l’activité motrice spontanée dépend, en partie, du
fonctionnement des systèmes dopaminergiques mésolimbique et nigrostriatal. La diminution de l’activité motrice pourrait aussi être la conséquence d’une perturbation du système cholinergique, puisque !’administration à long terme de MeHg produit une diminution de l’acéthylcholine dans le cortex cérébral et le striatum, ce qui entraîne une démarche chancelante (Kobayashi et al., 1980). Finalement, une diminution de l’activité fonctionnelle du système glutamatergique pourrait causer les déficits de mémoire et d’apprentissage observés chez les rongeurs exposés au MeHg (Cagiano et al., 1990).
La modélisation animale de Γ exposition périnatale au mercure méthylé
La recherche sur des modèles animaux, principalement des rongeurs, permet d’analyser systématiquement les effets tératogènes et neurotoxiques de l’exposition prénatale et postnatale au MeHg. Les modèles animaux permettent également de contrôler certaines variables telles que le sexe, la nature de l’agent toxique, la dose, le moment et la durée de !’exposition, variables qu’il est impossible de contrôler lors d’études impliquant des sujets humains. Il existe de nombreuses similitudes qualitatives et quantitatives quant aux effets neuropathologiques et neurocomportementaux du MeHg chez les humains et les animaux (Burbacher, Radier et Weiss, 1990). Ces effets
neurotoxiques similaires sont observés à fortes doses d’exposition, puisque des données sur les effets du MeHg à faibles doses ne sont disponibles que pour les animaux.
Selon Schardein (1998), l’animal qui représente le mieux l’être humain dans les études de neurotoxicité serait la souris, suivie du rat et finalement, des primates et des lapins à égalité. Cette grande affinité entre les souris et les humains serait due au fait que le ratio sang/cerveau serait le même chez ces deux espèces (Chang, 1977). Ainsi, la quantité de sang dans le cerveau comparativement à la masse cérébrale est la même chez la souris que chez l’humain.
Effets tératogènes
L’exposition prénatale au MeHg entraîne chez les rongeurs une réduction du nombre de rejetons par portée (Hughes et Annau, 1976), une diminution de la taille des fœtus (Chen, Body & Mottet, 1979), ainsi qu’un taux de mortalité anormalement élevé (Colombia, Sánchez, Albina, Domingo & Corbella, 1997; Goldey, O’Callaghan, Stanton, Barone & Crofton, 1994; Spyker, 1975a, 1975b; Spyker & Smithberg, 1972). Le taux de mortalité dépend de la dose et du jour d’exposition, les doses élevées et les derniers jours de la gestation étant les plus critiques (Spyker, 1975b), et peut varier en fonction du sexe et de la souche des animaux (Geyer, Butcher & Fite, 1985; Spyker, 1975b; Yasutake &
Hirayama, 1988). De nombreuses études (Colomina et al., 1997; Goldey et al., 1994; Hughes & Annau, 1976; Kim, Nakai, Kasanuma & Satoh, 2000; MacDonald & Harbisson, 1977; O’kusky & McGeer, 1985; Rice, 1996; Satoh et al., 1985; Spyker,
1975b; Yasutake & Hirayama, 1988) mettent en évidence un poids corporel à la naissance inférieur chez les souris et les rats exposés prénatalement au MeHg. Tout comme le taux de mortalité, cette diminution pondérale est proportionnelle à la dose et au jour
d’exposition (Spyker, 1975b). Le gain de poids mesuré en période postnatale (jours 1 à 63) est significativement plus bas chez des rats exposés prénatalement au MeHg que chez des rats contrôles (Geyer et al., 1985). Finalement, l’exposition prénatale au MeHg entraîne aussi un retard de développement (Spyker, 1975a; Spyker & Smithberg, 1972), des malformations congénitales (Spyker & Smithberg, 1972), une plus grande
susceptibilité aux maladies infectieuses (Spyker, 1975a, 1975b), ainsi qu’une espérance de vie plus courte (Spyker, 1975a).
Suite à une exposition postnatale chez les rongeurs, les effets toxiques observés sont une diminution pondérale, une perte de poils, une posture anormale, une diminution de l’élévation de la queue et de la fréquence respiratoire, ainsi qu’une augmentation du taux de mortalité (Berthoud et al., 1976; Mac Donald & Harbisson, 1977; O’Kusky & McGeer, 1985; Shigematsu, Yasuda, Goto, Tanaka & Tobimatsu, 2000; Vandewater et al., 1983). Cependant, un gain de poids est parfois observé suite à une exposition postnatale au MeHg (Dellinger, Malek et Beattie, 1995). Malgré les résultats contradictoires obtenus quant à l’effet du MeHg sur le poids, une perte et un gain pondéral consistent, dans un cas comme dans l’autre, en une manifestation de troubles métaboliques.
Effets neurocomportementaux
Les effets neurotoxiques de l’exposition périnatale à de faibles et à de fortes doses de MeHg se traduisent par des déficits perceptifs, sensoriels, moteurs, comportementaux et cognitifs.
Déficits perceptifs et sensoriels. Chez les primates, les déficits sensoriels et perceptifs causés par une exposition au MeHg sont importants. Effectivement, chez le singe, les déficits visuels consécutifs à une exposition périnatale au MeHg consistent en une diminution de la vision à basse luminosité (Rice, 1996), un trouble de la vision
spatiale (Rice, 1996), ainsi qu’une constriction sévère du champ visuel (Berlin et al., 1973; Rice, 1996). La vision spatiale est affectée à des doses plus faibles que celles qui produisent une constriction du champ visuel (Rice, 1996). Des déficits auditifs tels que la surdité et un seuil de détection anormal des hautes fréquences, ainsi que des altérations somatosensoriels tels que l’élévation du seuil de détection de vibrations, sont également observés chez les primates (Rice, 1996). De plus, ces divers déficits de nature sensorielle seraient permanents (Rice, 1996).
Chez les rongeurs, les déficits perceptifs et sensoriels ont été peu étudiés et peu de résultats sont concluants. Une performance inférieure à celle des rats contrôles est
enregistrée chez des animaux intoxiqués au MeHg postnatalement dans une tâche de discrimination visuelle (Elsner, 1986; Eisner et al., 1988). Toutefois, cette faible
performance des souris intoxiquées ne s’explique pas par un trouble sensoriel, mais plutôt par une passivité et une diminution du nombre de réponses, donc par la présence
d’hypoactivité. Un ralentissement des processus visuels cérébraux a cependant été mesuré (Dellinger et al., 1995). De plus, des troubles visuels sont présents chez des rats exposés à du MeHg de façon postnatale dans le test du précipice visuel et dans une tâche où l’animal doit éviter des obstacles dans un nouvel environnement (O’kusky, 1992; O’kusky & McGeer, 1985). Finalement, les potentiels évoqués visuels sont différents chez des rats exposés de façon prénatale et postnatale au MeHg que chez des rats contrôles puisque l’amplitude de PI-NI et N1-P2 est plus grande et que la latence des ondes NI, PI, N2 et P2 est plus courte chez les animaux intoxiqués (Dyer, Ecoles et Annau, 1978; Zenick, 1976). Selon Dyer et al.(1978), cela implique un déficit au niveau du système rétino-strié et un ralentissement de la conduction axonale. Au niveau auditif, Royalty, Taylor et Korol (1987) ont enregistré des réponses de sursaut à un son beaucoup plus importantes chez des rats exposés prénatalement au MeHg à de fortes doses
(6mg/kg) que chez des rats contrôles ou exposés à de faibles doses (2mg/kg).
Finalement, l’exposition prénatale au MeHg ne semble avoir aucun effet sur les habiletés de discrimination olfactive chez le rat (Goldey et al., 1994).
Déficits moteurs. Chez les primates, une exposition postnatale au MeHg engendre des troubles de la coordination motrice, de la coordination visuo-spatiale (ex : saisir un objet dans l’espace) et des mouvements fins (Berlin et al., 1973), tandis qu’une
exposition prénatale et postnatale chronique entraîne un ralentissement du développement des capacités sensorimotrices chez de jeunes singes (Burbacher, Grant et Mottet, 1986).
Contrairement aux déficits perceptifs et sensoriels, les déficits moteurs, chez les rongeurs, sont beaucoup plus étudiés. Des déficits des comportements moteurs précoces tels que de l’ataxie, des tremblements, une perte des capacités proprioceptives (Spyker,
1975b), des troubles du réflexe de redressement et de l’activité motrice spontanée (fiiouye et al., 1985) et des troubles de la posture (O’kusky, 1992; O’kusky & McGeer, 1985; Shigematsu, Yasuda, Goto, Tanaka & Tobimatsu, 2000; Shigematsu, Yasuda, Goto, Tanaka, Tobimatsu & Kato, 2000; Spyker, 1975a) ont d’ailleurs été observés suite à une exposition périnatale au MeHg. Un déficit neuromusculaire serait également présent chez des souris exposées au MeHg puisqu’une différence de performance significative apparaît dans une tâche de locomotion verticale mesurant les capacités de l’animal à grimper et descendre sur un grillage placé de façon verticale ou à différents angles entre un groupe de souris contrôles et un groupe de souris intoxiquées au mercure de façon prénatale (Spyker, 1975b). Aucune différence significative n’est cependant obtenue en comparant le même groupe contrôle à un groupe de souris exposées à la même dose, mais de façon postnatale.
Pour ce qui est des comportements moteurs apparaissant après le sevrage et requérant la coordination motrice, aucun déficit n’est présent suite à une exposition périnatale au MeHg mis à part un comportement de nage déficitaire (Elsner et al., 1988; Rice, 1996; Spyker, 1975a, 1975b; Spyker, Sparber & Goldberg, 1972; Stoltenburg- Didinger & Markwort, 1990). Ce trouble de la nage serait engendré chez les souris
exposées prénatalement par un manque de coordination, une inactivité, une position verticale et une incapacité à maintenir une orientation normale dans l’eau (Spyker, 1975a,
1975b; Spyker et al., 1972). Aucun problème n’est mesuré chez la souris exposée prénatalement au MeHg dans la tâche du rotarod (Colomina et al., 1997), épreuve permettant de mettre en évidence des déficits moteurs (Bogo, Holl & Young, 1981).
Certains déficits moteurs tel qu’un trouble de coordination motrice présent chez des rats exposés postnatalement au MeHg (Elsner, Suter, Ulbrich & Schreiner, 1986) pourraient par contre être expliqués par un autre facteur que !’exposition au MeHg. Effectivement, à l’âge adulte, les rongeurs exposés au MeHg ont tendance à être obèses (Spyker, 1975b) et cette obésité diminuerait leurs habiletés et leur coordination motrices (Dellinger et al., 1995; Rice, 1996). Ainsi, la perte de poids généralement observée suite à l’exposition au MeHg est par la suite remplacée par une prise de poids considérable.
Déficits comportementaux. Les déficits comportementaux se présentent souvent comme des altérations subtiles qui peuvent être présentes à faibles doses sans
!’observation de déficits fonctionnels importants ou de problèmes structuraux et qui, à plus fortes doses, peuvent survenir bien avant les symptômes classiques d’une
intoxication (Spyker et al., 1972; Su & Okita, 1976). Selon Weiss et Simon (1975), les altérations comportementales sont les indices les plus sensibles des effets toxiques du mercure méthylé.
La majorité des études démontrent que l’exposition prénatale au MeHg entraîne une baisse de l’activité motrice chez le rongeur (Cagiano et al., 1990; Colomina et al.,
1997; Danielsson et al., 1993; Dellinger et al., 1995; Elsner, 1986; Elsner et al, 1988; Kim et al., 2000; Morganti, Lown, Salvaterra & Massaro, 1976; Rossi et al., 1997;
Schalock, Brown, Kark et Menon, 1981; Stoltenburg-Didinger & Markwort, 1990; Su et Okita, 1976). D’autres auteurs (Geyer et al., 1985; Hugues & Annau, 1976; Yin,
Watanabe, Inaba & Satoh, 1997) montrent toutefois le contraire. Dans la tâche de l’open field, l’hypoactivité généralement observée se manifeste par une latence
1972; Su & Okita, 1976), une diminution du nombre de séances de toilettage (Su & Okita, 1976; Wooten et al, 1985), une fréquence moindre de défécation et de miction (indice de la réactivité émotionnelle) (Spyker, 1975a, 1975b; Spyker et al., 1972; Su & Okita, 1976), ainsi que par une diminution de la mobilité et du nombre de redressements verticaux (Cagiano et al., 1990; Kim et al., 2000; Morganti et al., 1976; Rossi et al., 1997; Schalock et al., 1981; Su et Okita, 1976). Chez la souris, le nombre de redressements verticaux est d’ailleurs inversement proportionnel à la quantité de mercure détecté dans le cortex cérébral et dans le cervelet (Morganti et al., 1976) et peut varier, tout comme le nombre de séances de toilettage, en fonction de la souche utilisée (Kim et al., 2000). Finalement, Su et Okita (1976) n’obtiennent un effet sur l’activité motrice spontanée que chez les souris exposées à une dose unique de 8 ou 12 mg et non chez celles pour qui la dose administrée est de 6 mg/kg. De plus, l’hypoactivité n’est que temporaire; après quelques semaines, les souris présentent une activité motrice normale (Su et Okita, 1976). Elle peut même se transformer en hyperactivité comme l’ont montré Danielsson et al. (1993) : l’hypoactivité présente chez des rats de 3 mois exposés au mercure se transforme en une hyperactivité à 14 mois.
Le comportement social est également perturbé par une exposition prénatale et postnatale au MeHg. Rice (1996) et Burbacher et al. (1990) démontrent que de jeunes singes exposés au MeHg produisent plus de comportements asociaux et passifs (ex : dormir) et moins de comportements ludiques et sociaux que les jeunes singes contrôles. Une augmentation des comportements agressifs envers les pairs chez des rats exposés prénatalement à 2 ou 6 mg de MeHg/kg comparativement à des rats contrôles a aussi été mise en évidence (Royalty et al., 1987).
Déficits cognitifs. De nombreuses études évaluent l’impact d’une exposition au MeHg sur les fonctions cognitives. D’abord, des primates exposés périnatalement au MeHg présentent des déficits d’apprentissage, de mémoire de reconnaissance visuelle et de mémoire de travail et de référence (Gunderson, Grant-Webster, Burbacher & Mottet, 1988; Rice, 1996), une altération de !’attention visuelle (Gunderson, Grant, Burbacher, Fagan ΠΙ et Mottet, 1986), ainsi que des troubles de permanence de l’objet (Burbacher &
al., 1986) et de la discrimination d’intervalles temporels (Gilbert, Rice & Burbacher, 1996). Toutefois, aucun effet du MeHg n’est observé sur le temps de réaction dans des tâches cognitives chez le singe (Rice, 1998).
Chez les rongeurs exposés prénatalement au MeHg, des déficits d’apprentissage et de mémoire de reconnaissance visuelle, de travail et de référence sont aussi mesurés (Hughes & Annan, 1976). Un déficit de l’habileté à s’adapter à de nouveaux stimuli est également présent chez des rats exposés prénatalement à des doses différentes de mercure (0,2 ou 0,07 mg de Hg/kg/jr) dans une tâche simple d’habituation à un nouvel
environnement (Danielsson et al., 1993).
Dans des tâches d’apprentissage appétitif, telles que la discrimination visuelle et l’alternance spatiale, on met en évidence chez des rats exposés de façon prénatale au MeHg un déficit d’apprentissage (Schalock et al., 1981). En effet, les sujets exposés prennent significativement plus de temps pour atteindre un critère de réussite, font moins de réponses lors de la phase d’acquisition, donnent un plus grand nombre de réponses au cours de la phase d’extinction et ont un comportement significativement plus passif que les sujets contrôles (Elsner, 1986; Elsner et âl., 1988). Cette passivité accrue des rongeurs exposés à différentes doses de mercure méthylé pourrait être le résultat de déficits d’apprentissage et de mémoire de référence, ainsi que d’une diminution de !’attention combinée à une augmentation de 1 ’instabilité comportementale (Elsner, 1986). Chez des souris intoxiquées, le comportement d’alternance spatiale dans le labyrinthe en T est supprimé par !’administration d’une dose de 6 mg de MeHg/kg pendant 7 jours consécutifs après la naissance (Koji, 1996). Ces observations suggèrent la présence de déficits d’apprentissage et de mémoire de travail chez les souris traitées. Néanmoins, ces déficits n’apparaissent pas lorsque des doses plus faibles (1, 2 et 4 mg/kg) sont
administrées prénatalement de façon aigue (Goldey et al., 1994). Des rats exposés prénatalement à du mercure présentent, dans un labyrinthe radial, un déficit
d’apprentissage spatial dépendant de la dose administrée (Danielsson et al., 1993). La dose de mercure méthylé est donc un facteur important à considérer dans l’induction des déficits cognitifs. Finalement, des déficits cognitifs peuvent survenir à un âge adulte
avancé, parfois même alors qu’aucun signe d’intoxication n’était présent auparavant. En effet, Newland et Rasmussen (2000) révèlent, dans une tâche de renforcement positif, que le vieillissement engendre chez les rats une baisse de la performance, mais qu’une
exposition prénatale au MeHg entraîne une accélération de cette détérioration et que celle-ci peut constituer le premier symptôme de l’exposition.
Des troubles d’apprentissage sont également mis en évidence dans des
apprentissages aversifs tels qu’une tâche d’évitement bidirectionnel (Hughes & Annau, 1976) et une tâche d’apprentissage instrumental avec renforcement négatif (choc) (Schalock et al., 1981) puisque les animaux exposés prénatalement au MeHg prennent significativement plus de temps pour atteindre le critère de réussite. Schalock et al. (1981) observent aussi une plus grande passivité chez les sujets exposés puisque les animaux exposés au MeHg prennent plus de temps pour atteindre le critère de réussite, émettent moins de réponses d’évitement avant que le critère de réussite ne soit atteint, produisent moins de réponses d’échappement et ont plus de comportements de figement dans l’appareil que les rats contrôles. Dans une tâche d’évitement passif, des rats
intoxiqués au MeHg de façon prénatale apprennent significativement moins bien que les rats contrôles (Kakita et al., 2000). Toutefois, certains auteurs, tels que Elsner et al. (1988), n’obtiennent aucune différence significative entre la latence d’évitement de choc des rats traités au MeHg et celle des rats contrôles à une tâche d’évitement passif.
Exposition prénatale et postnatale
Plusieurs auteurs tels que Spyker et Smithberg (1972) et Hugues et Annau (1976) ont étudié les effets d’une exposition prénatale et postnatale au MeHg chez la souris. Il semble que l’exposition prénatale engendre plus d’effets tératogènes et neurotoxiques (Grandjean et al., 1994; Spyker, 1975a; Spyker, Sparber & Goldberg,
1972). En général, un organe est plus susceptible lorsqu’il est en différenciation
cellulaire. Chez la souris, l’organogenèse se fait principalement du 5e jour au 15e jour de la gestation qui a une durée totale de 20 jours (Spyker, 1975b). Cela explique en partie
pourquoi une exposition prénatale a des effets toxiques plus importants qu’une exposition postnatale chez la souris.
Les symptômes des organismes exposés postnatalement et modérément atteints ont tendance à s’améliorer avec le temps, mais cela n’est pas mesuré chez les organismes exposés au MeHg de façon prénatale (Direction générale des services médicaux, 1979). Alors que les déficits moteurs et que le retard mental s’aggravent habituellement avec le temps, d’autres symptômes, comme les réflexes primitifs, peuvent se résorber avec l’âge (Chang & Guo, 1998). Shigematsu, Yasuda, Goto, Tanaka, Tobimatsu & Kato (2000) démontrent que, suite à une exposition postnatale chez le rat n’ayant engendré aucune altération histologique, une récupération complète des déficits peut survenir. Cette amélioration dans le temps de certains troubles ne s’explique pas par une réversibilité des dommages cérébraux, mais par une prise en charge des fonctions par des cellules non touchées lors de l’exposition (Weiss & Simon, 1975).
Objectif et hypothèses de la recherche
Bien que des déficits importants soient associés à une exposition postnatale au MeHg (Spyker, 1975b), les effets neurotoxiques les plus importants apparaissent à la suite d’une exposition prénatale (Grand)ean et al., 1994; Spyker, 1975a, 1975b; Spyker & al., 1972). Ainsi, l’objectif du présent mémoire est d’évaluer à l’aide d’un modèle animal (souris) les effets moteurs (coordination motrice), comportementaux (activité motrice spontanée) et cognitifs (apprentissage d’un comportement d’alternance spatiale, mémoire de travail et de référence spatiales) d’une exposition prénatale au mercure méthylé.
A la lumière des travaux déjà mentionnés et des recherches pilotes déjà réalisées dans notre laboratoire, les hypothèses suivantes peuvent être formulées. D’abord, les souris exposées au mercure méthylé devraient présenter un comportement exploratoire significativement plus passif que celui des souris contrôles. De plus, des déficits significatifs au niveau de !’apprentissage, de la mémoire de travail et de la mémoire de référence devraient être mesurés chez les souris exposées au mercure méthylé.
Finalement, les déficits observés dans les tâches comportementales devraient s’accentuer à mesure que la dose de mercure méthylé administrée augmente.
Méthode
Sujets
Trente souris C57BL/6 femelles âgées de 5 semaines et pesant entre 7,6 et 16,3 g sont placées dans des cages individuelles dans une salle d’hébergement dont la
température ambiante est maintenue constante. Les souris sont exposées à une
photopériode 12-12 heures, les tests étant administrés dans la phase diurne. Tout au long de !’expérimentation, les souris ont libre accès à l’eau. Par contre, en raison de
!’utilisation d’un renforçateur alimentaire dans les tâches d’apprentissage et de mémoire, la ration quotidienne de nourriture est contrôlée de façon à ce que le poids de chaque sujet se maintienne autour de 85% du poids normal. Aux jours 12, 13 et 14 de la
gestation, les mères de ces souris ont été exposées par gavage à de la nourriture (moulée pour rongeur Charles River # 5075) contenant 0, 4 ou 6 mg/kg de mercure méthylé (MeHg). Les souris, provenant de portées différentes puisqu’une souris par portée et occasionnellement deux ont été sélectionnées, sont assignées à l’un des trois groupes, chaque groupe correspondant à une dose spécifique d’exposition prénatale au MeHg. Les mères gestantes des souris d’un quatrième groupe ont été exposées à une dose de 8
mg/kg, mais ces souris n’ont pu être retenues dans cette expérience à cause d’un taux de mortalité à la naissance très élevé.
Matériel
Rotarod. Le rotarod (voir Figure Al, Annexe A) est composé d’un cylindre rotatif de 3 cm de diamètre qui est placé au centre d’une boîte en contreplaqué peint en noir et qui est relié à un moteur électrique à vitesse variable. Ce cylindre sur lequel la souris dor se maintenir est suspendu à 65 cm au-dessus d’un coussin de ouate qui sert à amortir la
chute éventuelle des souris. Le cylindre rotatif est divisé en deux parties égales au moyen d’un écran, permettant ainsi de tester deux souris à la fois.
Labyrinthe en T. Le labyrinthe en T (voir Figure A2, Annexe A) est un appareil en forme de « T » fait d’acrylique opacifié par l’ajout de cartons blancs sur la surface externe. Il se compose d’un compartiment de départ, d’un couloir central et de deux couloirs d’arrivée perpendiculaires au couloir central. Les murs de l’appareil ont une hauteur de 30 cm. Des portes à guillotine opaques placées à la sortie du compartiment de départ ainsi qu’à l’entrée de chacun des couloirs d’arrivée permettent de contrôler l’accès aux différentes zones du labyrinthe. À l’extrémité de chacun des compartiments
d’arrivée se trouve une mangeoire pouvant contenir un renforçateur alimentaire.
Open field. L’open field (voir Figure A3, Annexe A) est un champ ouvert de lm
X lm dont le plancher est divisé en 25 carrés égaux de 20 cm x 20 cm et dont les murs
(hauteur : 30cm) sont faits d’acrylique opacifiés au moyen de papier blancs posés sur la surface externe de l’appareil.
Discrimination visuelle. L’appareil (voir Figure A4, Annexe A) fait d’acrylique est composé d’un couloir de départ séparé par une porte à guillotine d’une aire centrale donnant sur deux couloirs parallèles, chacun de ces couloirs pouvant être fermé par une porte à guillotine. Une mangeoire est placée au bout de chacun des couloirs pour contenir le renforçateur. Des planchers amovibles noir et blanc sont insérés dans les couloirs ainsi que dans Faire centrale. Les murs de l’appareil ont une hauteur de 30 cm et sont opacifiés afin de réduire au minimum la quantité de distracteurs environnants et de prévenir !’utilisation d’indices externes.
Labyrinthe radial. Le labyrinthe (voir Figure A5, Annexe A) est fait de
contreplaqué peint en gris et est formé d’une plate-forme centrale octogonale (diamètre : 40 cm) et de huit couloirs disposés en rayon autour de la plate-forme centrale; au bout de chaque couloir se trouve une mangeoire. Une porte à guillotine opaque sépare chacun des couloirs de la plate-forme centrale. Les murs et les planchers qui entourent le labyrinthe comportent divers stimuli visuels fixes (affiches, cartons de couleur, un
grillage, etc), qui peuvent être vus à partir de plusieurs couloirs différents, évitant ainsi qu’ils ne soient associés à un couloir spécifique. Au-dessus du labyrinthe radial, une caméra vidéo reliée à un moniteur en circuit fermé permet à 1 ’expérimentateur d’observer les souris dans le labyrinthe tout en restant dissimulé derrière un écran. Les huit portes à guillotine sont actionnées à distance grâce à un système de filage.
Procédure
Tout au long de l’expérimentation, une procédure à l’aveugle est utilisée, si bien que T expérimentateur ignore le groupe ( 0, 4 ou 6 mg de MeHg/kg) auquel appartiennent les souris. L’administration des tâches commence alors que les souris sont âgées de six semaines. Les souris sont successivement soumises à la tâche du rotarod, à
l’entraînement au labyrinthe en T sans délai, au test du labyrinthe en T avec délais, à l’épreuve de !’open field, à la tâche de discrimination visuelle puis, à celle du labyrinthe radial.
Rotarod. L’épreuve du rotarod sert à mesurer les habiletés motrices de base et !’apprentissage d’une tâche de coordination motrice, fonctions généralement associés au cervelet. Elle dure 6 jours et est administrée à raison de cinq essais par jour. À chaque essai, la souris âgée de six semaines est placée sur le cylindre rotatif et elle doit s’y maintenir pendant une période de 120 secondes. Une chute est enregistrée comme un échec à moins qu’elle ne survienne dans les 10 premières secondes d’un essai; il s’agit alors d’un faux départ et l’essai est repris après une pause de 30 secondes.
Les deux premiers jours d’administration du rotarod servent à familiariser les souris avec l’appareil ainsi qu’à vérifier les habiletés motrices de base. Au jour 1, le cylindre rotatif est immobile (0 rotation/minute ou 0 rpm), tandis qu’au jour 2, il tourne à une vitesse constante de 3 rpm. Lors de chacune de ces deux sessions préliminaires, les souris doivent réussir au moins quatre essais sur cinq. Si ce critère n’est pas atteint, la session est reprise le jour suivant. Les jours 3 à 6 constituent la phase de test au cours de
laquelle le cylindre tourne à une vitesse de 20 rpm. Pour chaque essai réussi, la latence maximale de 120 secondes est enregistrée.
Labyrinthe en T. Cette tâche qui vise à mesurer !’apprentissage d’un
comportement d’alternance spatiale et la mémoire de travail spatiale est divisée en trois phases : la familiarisation, l’entraînement à 0 seconde et le test avec délais. Elle
commence alors que les souris sont âgées de sept semaines.
Dans la première phase (jour 1), les souris sont familiarisées avec l’appareil pendant une période de 10 minutes. Des morceaux de nourriture sont placés dans chacun des couloirs pour favoriser l’exploration. L’expérimentateur ouvre et ferme
régulièrement les portes à guillotine afin de familiariser les souris avec le mouvement et le bruit engendrés par la manipulation de ces portes.
La deuxième phase commence au jour 2 et sert à entraîner les souris à la tâche sans délai. Chaque session quotidienne comprend 11 essais. Lors du premier essai (essai 0), un renforçateur est placé dans la mangeoire de chacun des couloirs d’arrivée et la souris choisit librement l’un de ces couloirs. Au cours des 10 essais suivants, la souris doit apprendre à alterner spontanément entre les deux couloirs en choisissant le couloir d’arrivée opposé à celui visité lors de l’essai précédent. Si le sujet visite le même couloir lors de deux essais consécutifs, un échec est noté. La phase d’entraînement se termine lorsque le sujet a atteint un critère de 8 réussites sur 10 en moyenne sur deux jours consécutifs. Si la souris n’atteint pas ce critère à l’intérieur de 20 sessions, la phase suivante ne lui est pas administrée.
Au cours de cette troisième phase, la procédure est la même qu’au cours de l’entraînement sauf que les essais sont séparés par un intervalle de 30, 60 ou 120
secondes. Chaque délai est testé pendant deux sessions consécutives et la durée du délai est augmentée de façon croissante au fil des sessions. Les performances obtenues aux deux sessions de chacun des délais sont ensuite comparées avec celles mesurées dans les deux sessions critère de l’entraînement.
Open field. Cet appareil permet de mesurer Γ activité motrice spontanée dans un nouvel environnement (session 1) de même que !’habituation inter-sessions et
intrasession à ce nouvel environnement. L’épreuve de !’open field est administrée à des souris âgées de 10 à 11 semaines pendant cinq jours consécutifs, à raison d’une session de 15 minutes par jour. Seuls les comportements produits pendant les 5 premières et les 5 dernières minutes d’exploration sont notés par 1 ’expérimentateur pour fins d’analyse.
Au début d’une session quotidienne, la souris est placée dans Topen field face au coin inférieur gauche de l’appareil. Lors des deux périodes d’enregistrement, les mesures suivantes sont recueillies : le nombre total de carrés périphériques et de carrés centraux traversés (exploration horizontale) et le nombre total de redressements sur les pattes arrières (exploration verticale).
Discrimination visuelle. Dans cette tâche qui mesure les capacités
visuoperceptives et la mémoire de référence, la souris âgée de 11 à 12 semaines doit apprendre à discriminer entre un couloir recouvert d’un plancher noir qui est associé à un renforçateur (S+) et un couloir recouvert d’un plancher blanc qui est associé à l’absence de renforçateur (S-). Chaque session quotidienne comprend 20 essais séparés par un intervalle de 10 secondes. L’emplacement des planchers noir et blanc dans les couloirs de gauche et de droite varie aléatoirement d’un essai à l’autre.
Aux jours 1 et 2, une procédure de correction est utilisée. Lorsque l’animal choisit le couloir non renforcé (blanc), une erreur est enregistrée. La souris est alors ramenée dans le compartiment de départ afin que le même essai soit repris
immédiatement; cette fois, l’accès au couloir non renforcé est bloqué pour obliger l’animal à visiter le couloir approprié (choix forcé). À partir du jour 3, la procédure de correction est interrompue et chaque choix est enregistré comme une réussite ou un échec. L’apprentissage se poursuit jusqu’à ce que le sujet atteigne une moyenne d’au moins 17 réussites sur 20 essais pendant deux jours consécutifs.
Labyrinthe radial. La version du labyrinthe radial utilisée dans cette expérience permet de mesurer la mémoire de travail et la mémoire de référence spatiales. L’aspect de la mémoire de référence est généralement relié au striatum dorsal tandis que celui de la mémoire de travail est relié à la formation hippocampique. Le labyrinthe radial mesure la mémoire de travail spatiale tout comme le labyrinthe en T. Toutefois, ce dernier requiert la mémorisation d’une information spatiale égocentrique tandis que le labyrinthe radial requiert la mémorisation d’une information spatiale allocentrique.
La tâche du labyrinthe radial est d’une durée de 20 jours et comporte cinq jours de familiarisation (Jours 1 à 5) suivis de 15 jours d’apprentissage (Jours 6 à 20). Cette épreuve est administrée alors que les souris sont âgée entre 13 et 14 semaines.
Au premier jour de familiarisation, des morceaux de nourriture sont placés sur la plate-forme centrale ainsi que dans quatre des huit couloirs disponibles. L’animal doit explorer et se familiariser avec l’appareil pendant une période de 5 minutes. Si la souris visite les quatre couloirs contenant de la nourriture et consomme celle-ci, la session prend fin. Par contre, si trop peu de couloirs sont visités ou si tous les renforçateurs n’ont pas été consommés, l’expérimentateur place la souris au bout de chacun des quatre couloirs contenant de la nourriture et la force ainsi à rebrousser chemin jusqu’à la plate-forme centrale. Ensuite, 5 minutes supplémentaires de familiarisation sont accordées. Lors des jours 2 à 5 de familiarisation, la procédure est essentiellement la même, sauf pour le nombre de renforçateurs disponibles et le choix des quatre couloirs renforcés. D’une part, le nombre de renforçateurs alimentaires diminue de session en session jusqu’à ce qu’il n’y ait plus, à la session 5, qu’un seul renforçateur disponible dans le réceptacle localisé au bout des quatre couloirs pré-sélectionnés. D’autre part, les quatre couloirs appâtés ne sont pas les mêmes d’une session à l’autre et ils sont prédéterminés au hasard.
Une fois l’étape de familiarisation complétée, une série de 15 sessions
d’apprentissage débute. Cette phase dure 15 jours et un essai par jour est administré. Au début d’un essai, la souris est placée sur la plate-forme centrale et un morceau de
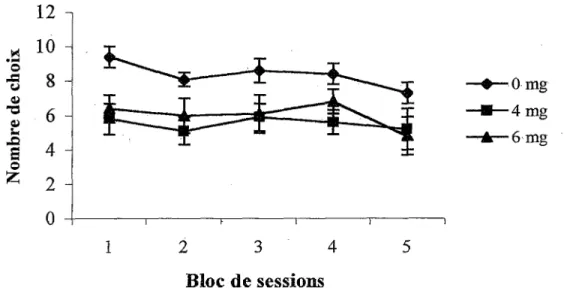
ces couloirs étant désormais toujours les mêmes d’un essai à l’autre. L’expérimentateur ouvre les huit portes de la plate-forme centrale pour permettre à la souris de visiter les couloirs. Chaque choix est séparé du suivant par un temps d’arrêt de 10 sec sur la plate- forme centrale afin de prévenir !’utilisation d’un algorithme dans la résolution de la tâche. Une erreur de mémoire de travail est enregistrée lorsqu’il y a revisite d’un couloir au cours d’un même essai et une erreur de mémoire de référence est enregistrée lorsqu’il y a visite de l’un des quatre couloirs qui ne sont jamais appâtés. Un essai se termine quand l’un des trois critères suivants est atteint : 1) les quatre couloirs contenant de la nourriture ont été visités, 2) 16 choix ont été effectués, ou 3) 10 minutes se sont écoulées depuis le début de l’essai. Au cours d’un essai, le nombre de réussites et le nombre de choix de couloirs fait par la souris sont notés par !’expérimentateur. Ces données permettront par la suite de calculer les pourcentages d’erreurs de mémoire de travail et de référence chez les différents groupes.
Résultats
Rotarod
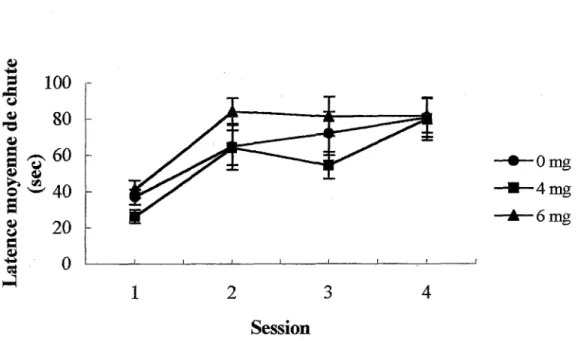
Lors des sessions préliminaires à 0 et à 3 rpm, toutes les souris réussissent à se maintenir sur le cylindre pendant 120 sec dans au moins 4 essais sur 5. Les habiletés motrices de base semblent donc intactes chez les souris exposées au MeHg. Comme le montre la Figure 1, les trois groupes de souris apprennent à acquérir la coordination motrice lors des quatre sessions quotidiennes au cours desquelles le cylindre tourne à une vitesse de 20 rpm. Une ANO VA Groupe x Session avec mesures répétées sur le second facteur indique que le facteur Session, F (3, 72)=18,63 p<,0001, est significatif, ce qui confirme qu’il y a eu apprentissage. Par contre, il n’y a aucune différence significative entre les groupes 0, 4 et 6 mg/kg puisque le facteur Groupe, F (2, 72)=1,40, et
-Omg 4־mg 6־ mg 100 80 1
i,-
q -40 20 08
1 SessionFigure 1. Latences moyennes de chute (sec) dans le rotarod à 20 rpm chez les groupes exposés (4mg et 6 mg) et non exposé (0 mg) au MeHg 1
Labyrinthe en T
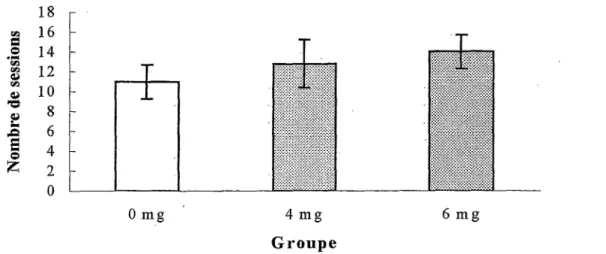
Dans le labyrinthe en T, les souris apprennent d’abord la tâche avec un délai de 0 sec entre les essais jusqu’à l’atteinte du critère de 8 essais réussis sur 10 en moyenne pendant deux jours consécutifs. Comme le montre la Figure 2, les souris exposées à une dose de 6 mg/kg de MeHg ont mis un plus grand nombre de sessions pouf atteindre le critère que les souris des deux autres groupes, le nombre de sessions excluant les deux sessions critère. Une ANO VA confirme qu’il y a une différence significative entre les trois groupes, F (2, 27)=5,55 p<,01. Un test de Newman-Keuls (p<0,05) démontre que le groupe 6 mg requiert un nombre significativement plus élevé de sessions pour atteindre le critère que le groupe 0 mg. Par contre, il n’y a aucune différence entre les groupes 0 et 4 mg et les groupes 4 et 6 mg.
Groupe 1 a
I
1 Ό U %Figure 2. Nombres de sessions requises pour atteindre le critère lors de !’apprentissage à 0 seconde dans le labyrinthe en T chez les groupes exposés (4mg et 6 mg) et non exposé (0 mg) au MeHg
La Figure 3 montre que lors du test avec délais de 30, 60 et 120 secondes, les nombres d’essais réussis diminuent en fonction de l’allongement du délai. De plus, le nombre d’essais réussis lors du test avec délais est moins élevé que dans les 2 dernières sessions d’entraînement à 0 sec. Une ANO VA Groupe x Délai avec mesures répétées sur le dernier facteur confirme que le facteur Délai, F (3, 72)=18,36 g<,0001, est significatif. Un test de Newman-Keuls (p<0,01) démontre qu’il y a des différences significatives entre le délai de 0 seconde et les délais de 30, 60 et 120 secondes. Cependant, cette baisse de performance est similaire chez tous les groupes puisque le facteur Groupe, F (2,
*—0 mg -H—4 mg S ΧΛ c8
B
g pfi % Délai (sec)Figure 3, Nombres d’essais réussis lors des deux dernières sessions de !’apprentissage à 0 seconde et lors du test avec délai de 30, 60 et 120 secondes dans la tâche du labyrinthe en T chez les groupes exposés (4mg et 6 mg) et non exposé (0 mg) au MeHg
Open field
La Figure 4 illustre le nombre total de carrés traversés au cours des cinq sessions administrées dans l’open field. Les souris non exposées visitent en moyenne plus de carrés que les souris des deux autres groupes. Une ANOVA Groupe x Session avec mesures répétées sur le dernier facteur montre effectivement qu’il y a une différence significative entre les trois groupes quant au nombre de carrés totaux traversés, F (2, 25)=13,63 p<,0001. Un test de Newman-Keuls (p<0.05) indique que les souris du groupe 0 mg visitent plus de carrés, donc sont plus actives, que celles des groupes 4 et 6 mg. Par contre, il n’y a aucune différence entre les groupes 4 et 6 mg. Cette ANOVA démontre également que l’exploration horizontale diminue au fil des sessions puisque le facteur Session, F (4, 100)=6,75 p<,0001, est significatif. Un test de Newman-Keuls (p<0,01) montre que les différences se situent entre la session 1 et les sessions 3, 4 et 5. Par contre, !’interaction Groupe x Session, F (8, 100)=1,63, n’est pas significative.
♦—Omg <—4 mg ־A—6 mg 1 2 3 4 5 Session î 400 &
!
350 * 300 t £ 250 o -S 200 £ ä 150S
% 100Figure 4, Nombres de carrés (centraux et périphériques) traversés au cours des cinq sessions dans Topen field, chez les groupes exposés (4mg et 6 mg) et non exposé (0 mg) au MeHg
Comme le montre la Figure 5, les pourcentages de carrés périphériques traversés en 10 minutes ne semblent pas différer significativement d’un groupe à l’autre, ni d’une session à l’autre. Une ANO VA Groupe x Session avec mesures répétées sur le dernier facteur n’indique effectivement aucune différence significative entre les groupes, F (2, 25)=1,14, entre les sessions, F (4, 100)=2,34, ou au niveau de !’interaction Groupe x Session, F (S, 100)=0,88.
1 2 3 4 5
Session
Figure 5. Pourcentages de carrés périphériques traversés lors des cinq sessions
administrées dans !’open field chez les groupes exposés (4mg et 6 mg) et non exposé (0 mg) au MeHg
Les nombres de redressements sur les pattes arrières chez les trois groupes de souris varient au fil des sessions, mais ne semblent pas différer d’un groupe à l’autre (Figure 6). Une ANOVA Groupe x Session avec mesures répétées sur le dernier facteur confirme que le facteur Session, F (4, 100)=4,74 p< 002, est significatif. Un test de Newman-Keuls (p<0,01) indique que les différences significatives se situent entre la session 1 et les sessions 3 et 5. Cependant, aucune différence significative n’est notée entre les trois groupes puisque le facteur Groupe, F (2, 25)=0,86, n’est pas significatif et il en va de même de !’interaction Groupe x Session, F (8, 100)=1,80.
# 60 S O -׳ -י -׳ ---׳ ---׳ ---׳ ---׳ ---׳ ---0 £ 1 2 3 4 5 Session
Figure 6. Nombres de redressements lors des cinq sessions administrées dans l’open field chez les groupes exposés (4mg et 6 mg) et non exposé (0 mg) au MeHg
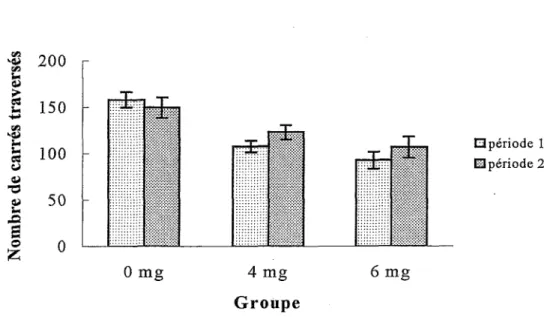
Comme il a été mentionné précédemment, le nombre de carrés totaux (périphériques et centraux) traversés lors des premières et des dernières 5 minutes d’ enregistrement lors des cinq sessions (voir Figure 7) est plus élevé chez les souris du groupe 0 mg que chez les souris des groupes 4 et 6 mg/kg de MeHg. Par contre, les souris des trois groupes ne semblent pas traverser plus de carrés lors de l’une ou l’autre des deux périodes d’enregistrement. Par ailleurs, une ANO VA Groupe x Période avec mesures répétées indique que le facteur Période, F (1, 25)=2,04, et !’interaction Groupe x Période, F (2, 25)=2,40, ne sont pas significatifs.
□ période 1 □ période 2 Groupe 1 U 1 SJ *3 Z Xt
Figure 7. Nombres de carrés totaux (périphériques et centraux) traversés lors des
premières (période 1) et des dernières (période 2) 5 minutes d’enregistrement pour le total des cinq sessions administrées dans !’open field chez les groupes exposés (4mg et 6 mg) et non exposé (0 mg) au MeHg
À première vue, la Figure 8 indique que les nombres de carrés périphériques traversés ne diffèrent pas de façon marquée en fonction des périodes d’enregistrement ou des groupes. Pourtant, une ANOVA Groupe x Période avec mesures répétées sur le dernier facteur démontre que le facteur Période, F (1, 25)=60,66, g< 0001, est significatif, alors que le facteur Groupe, F (2, 25)=1,39, et !’interaction Groupe x Période, F (2, 25)=0,37, né sont pas significatifs. Les souris traversent donc plus de carrés dans la période 1 que dans la période 2.
□ période 1
□ période 2
0 mg 4 mg 6 mg
Groupe
Figure 8. Nombres de carrés périphériques traversés lors des premières (période 1) et des dernières (période 2) 5 minutes d’enregistrement pour le total des cinq sessions
administrées dans !’open field chez les groupes exposés (4mg et 6 mg) et non exposé (0 mg) au MeHg
Finalement, les nombres de redressements enregistrés lors des premières 5
minutes de chaque session semblent inférieurs aux nombres de redressements enregistrés lors des dernières 5 minutes et ce, chez les trois groupes (voir Figure 9). Par contre, les trois groupes font sensiblement les mêmes nombres de redressements lors des deux périodes d’enregistrement. Une ANO VA Groupe x Période avec mesures répétées sur le dernier facteur indique effectivement que le facteur Période, F (1, 25)=41,42, p<,0001, est significatif, tandis que le facteur Groupe, F (2, 25)=0,86, et !’interaction Groupe x Période, F (2, 25)=1,91, ne sont pas significatifs.
□période 1 □ période 2 1 60
!
50 1 40 t <o 30 דכ S 20 S O 10 £ 0 GroupeFigure 9, Nombres de redressements lors des premières (période 1) et des dernières (période 2) 5 minutes d’enregistrement pour le total des cinq sessions dans !’open field chez les groupes exposés (4mg et 6 mg) et non exposé (0 mg) au MeHg
Discrimination visuelle
Tel qu’illustré à la Figure 10, le nombre de sessions nécessaires pour apprendre à discriminer entre un couloir recouvert d’un plancher noir (S+) et un couloir recouvert d’un plancher blanc (S-) varie très peu d’un groupe à l’autre. Une ANO VA confirme qu’il n’y a aucune différence entre les trois groupes, F (2, 25)-0,49.