OATAO is an open access repository that collects the work of Toulouse researchers and makes it freely available over the web where possible
Any correspondence concerning this service should be sent
This is an author’s version published in: http://oatao.univ-toulouse.fr/ 25817
To cite this version:
Hoyez, Marie . Infection à Encephalitozoon cuniculi chez le lapin : synthèse bibliographique et état des connaissances. Thèse d'exercice, Médecine vétérinaire, Ecole Nationale Vétérinaire de Toulouse – ENVT, 2019, 130 p.
ANNEE 2019 THESE : 2019 – TOU 3 – 4108
INFECTION A ENCEPHALITOZOON CUNICULI CHEZ
LE LAPIN : SYNTHESE BIBLIOGRAPHIQUE ET ETAT
DES CONNAISSANCES
_________________
THESEpour obtenir le grade de DOCTEUR VETERINAIRE
DIPLOME D’ETAT
présentée et soutenue publiquement devant l’Université Paul-Sabatier de Toulouse
par
Marie HOYEZ
Née, le 28 Mars 1993 à Seclin (59) ___________
Directeur de thèse : Mr Stéphane BERTAGNOLI
___________
JURY
PRESIDENT :
Mr Christophe PASQUIER Professeur à l’Université Paul-Sabatier de TOULOUSE
ASSESSEURS :
Mr Stéphane BERTAGNOLI Professeur à l’Ecole Nationale Vétérinaire de TOULOUSE
REMERCIEMENTS
À Monsieur le Professeur Christophe PASQUIER Doyen de la Faculté – Université Paul Sabatier
Faculté de sciences pharmaceutiques
Qui m’a fait l’honneur d’accepter la présidence de ce jury de thèse, Hommages respectueux.
À Monsieur le Professeur Stéphane BERTAGNOLI
Professeur de classe exceptionnelle de l’École Nationale Vétérinaire de Toulouse
Pathologie infectieuse
Pour avoir accepté de m’encadrer et de me guider durant la préparation de cette thèse, pour sa disponibilité, sa réactivité et sa gentillesse,
Sincères remerciements.
À Monsieur le Docteur Guillaume LE LOC’H
Maître de conférences à l’École Nationale Vétérinaire de Toulouse
Médecine zoologique et santé de la faune sauvage
Pour avoir accepté de participer à ce jury de thèse, pour avoir m’avoir grandement aidée dans la recherche de ce sujet de thèse,
TABLE DES MATIERES
TABLE DES ILLUSTRATIONS ...15
INTRODUCTION ...19
I. LE PARASITE ENCEPHALITOZOON CUNICULI ...21
1. CLASSIFICATION...21
2. MORPHOLOGIE ...23
3. CYCLE ...24
3.1. Phase infectieuse ...24
3.1.1. Activation et augmentation de pression au sein de la spore ...25
3.1.2. Éversion du tube polaire et passage du sporoplasme vers la cellule hôte……. ...26
3.2. La vacuole parasitophore ...29
3.2.1. Import d’énergie ...30
3.2.2. Phase proliférative : mérogonie ...31
3.2.3. Phase de différenciation : sporogonie ...32
II. EPIDEMIOLOGIE ET PHYSIOPATHOLOGIE DE L’INFECTION ...34
1. EPIDEMIOLOGIE...34
1.1. Prévalence d’Encephalitozoon cuniculi chez le lapin ...34
1.2.4. Mode de vie et alimentation ...37
2. MODE DE TRANSMISSION ...38
2.1. Transmission horizontale ...38
2.1.1. Inoculation et dissémination dans l’organisme ...38
2.1.2. Excrétion des spores d’Encephalitozoon cuniculi ...39
2.2. Transmission verticale ...39
3. INVASION DE L’ORGANISME ET DISSEMINATION ...40
4. REPONSE IMMUNITAIRE ...41
4.1. Rôle de l’immunité à médiation cellulaire ...41
4.1.1. Le rôle des cytokines ...42
4.1.1.1. Les cytokines Th1 ...42
4.1.1.2. Les cytokines Th2 ...42
4.1.2. Modulation de l’apoptose ...44
4.1.3. Types de lymphocytes T induits ...44
4.2. Réponse des lymphocytes T CD8+ ...45
4.2.1. Régulation des lymphocytes T CD8+ ...45
4.2.1.1. Rôle des lymphocytes CD4+ ...45
4.2.1.2. Rôle des lymphocytes T γδ ...46
4.2.1.3. Rôle des cellules présentatrices d’antigènes ...46
4.3. Rôle de l’immunité à médiation humorale ...48
5. AUTRES ESPECES CIBLES ET POTENTIEL ZOONOTIQUE ...48
5.1. Plusieurs souches d’Encephalitozoon cuniculi ...48
5.2. Encephalitozoon cuniculi chez les autres espèces ...49
5.2.1. Encephalitozoon cuniculi chez les autres animaux ...49
III. L’ENCEPHALITOZOONOSE CHEZ LE LAPIN...52
1. ALTERATIONS TISSULAIRES CAUSEES PAR ENCEPHALITOZOON CUNICULI ...52
1.1. Lésions du tissu nerveux ...52
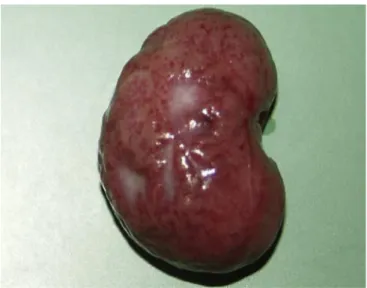
1.2. Lésions rénales ...53
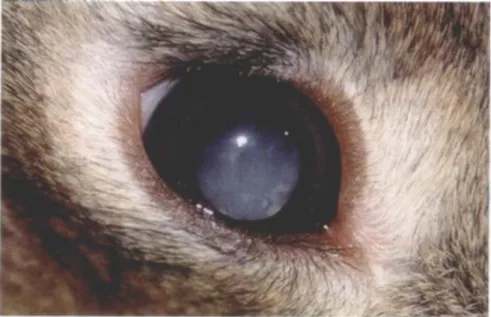
1.3. Lésions oculaires ...54
1.4. Autres lésions ...55
2. TABLEAU CLINIQUE DE L’ENCEPHALITOZOONOSE ...56
2.1. Signes cliniques associés à la forme neurologique ...56
2.2. Signes cliniques associés à la forme rénale...58
2.3. Signes cliniques associés à la forme oculaire ...58
3. PRONOSTIC ...60
4. DIAGNOSTIC DIFFERENTIEL ...61
4.1. Diagnostic différentiel de la forme neurologique ...61
4.1.1. Otite moyenne ou interne ...61
4.1.2. Méningoencéphalite bactérienne...62
4.1.3. Infections parasitaires ...63
4.1.3.1. La toxoplasmose ...63
4.1.3.2. Larva migrans cérébrale de Baylisascaris procyonis ...64
4.1.3.3. Otite externe à Psoroptes cuniculi ...64
4.1.4. Affections virales ...64
4.1.5. Masse intracrânienne ...65
4.3. Diagnostic différentiel de la forme oculaire...67
IV. DEMARCHE DIAGNOSTIQUE ...68
1. DIFFICULTE DU DIAGNOSTIC ANTE MORTEM ...68
2. SEROLOGIE ...68
2.1. La cinétique des anticorps dirigés contre Encephalitozoon cuniculi...69
2.2. Différentes méthodes de détection des anticorps IgG ...69
2.3. Interprétation d’une analyse sérologique ...70
2.3.1. Interprétation d’un test sérologique positif IgG ...70
2.3.2. Interprétation d’un test sérologique négatif ...73
2.3.3. Intérêt de la recherche des anticorps IgM ...74
3. DETECTION DES SPORES...75
3.1. Détection des spores dans les fluides corporels ...75
3.2. Mise en évidence histopathologique ...77
3.2.1. Histologie ...77
3.2.1.1. Modifications histologiques de l’encéphale ...77
3.2.1.2. Modifications histologiques des reins ...78
3.2.1.3. Modifications histologiques de l’œil ...78
3.2.2. Localisation des spores d’Encephalitozoon cuniculi ...78
3.2.2.1. Lors d’infection transmise horizontalement ...78
3.2.2.2. Cas particulier de la transmission verticale ...79
3.2.3. Observation des spores d’Encephalitozoon cuniculi ...79
3.2.3.1. A l’aide d’un microscope optique ...79
3.2.3.2. A l’aide d’un microscope électronique à transmission ...85
4. AMPLIFICATION PAR PCR...85
4.2. PCR sur liquide cérébrospinal (LCS) ...86
4.3. PCR sur urine ...87
5. AUTRES EXAMENS COMPLÉMENTAIRES POSSIBLES ...88
5.1. Détection d’anticorps dans les urines ...88
5.2. Électrophorèse des protéines ...88
5.3. Protéine C-réactive ...89 5.4. Analyses complémentaires ...89 5.5. Imagerie ...89 V. TRAITEMENT ET PROPHYLAXIE ...90 1. TRAITEMENT ...90 1.1. Traitement étiologique ...91 1.1.1. Études in vitro...91 1.1.2. Les benzimidazoles ...91 1.1.2.1. Albendazole ...91 1.1.2.2. Fenbendazole...92 1.1.2.3. Oxibendazole ...93 1.2. Traitement symptomatique ...94 1.2.1. Traitement anti-inflammatoire ...94
1.2.1.1. Une utilisation controversée ...94
1.2.1.2. Corticothérapie ...95
1.2.1.3. Anti-inflammatoires non stéroïdiens ...96
1.3.3.1. Adaptation de l’environnement ...99
1.3.3.2. Prise alimentaire ... 100
1.3.4. Traitement des éventuelles autres causes de syndrome vestibulaire... ... 101
1.4. Traitement en cas de troubles rénaux ... 101
1.5. Prise en charge adaptée en cas d’atteinte oculaire ... 102
1.5.1. Traitement conservateur ... 102 1.5.2. Traitement chirurgical ... 102 2.PROPHYLAXIE... 103 2.1. Prophylaxie sanitaire ... 103 2.2. Prophylaxie médicale ... 103 2.3. En pratique ... 104 CONCLUSION ... 106 RESSOURCES BIBLIOGRAPHIQUES... 110
TABLE DES ILLUSTRATIONS
TABLE DES FIGURES
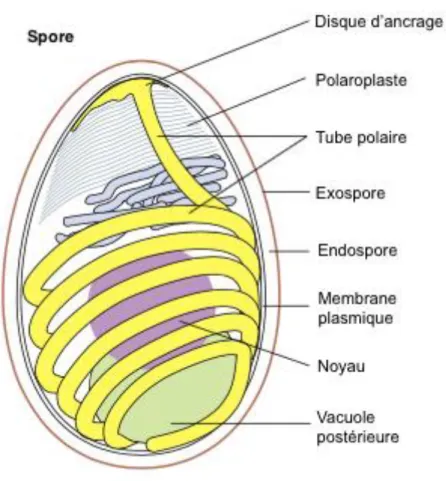
Figure 1: Schéma d’une spore de microsporidie ... 24
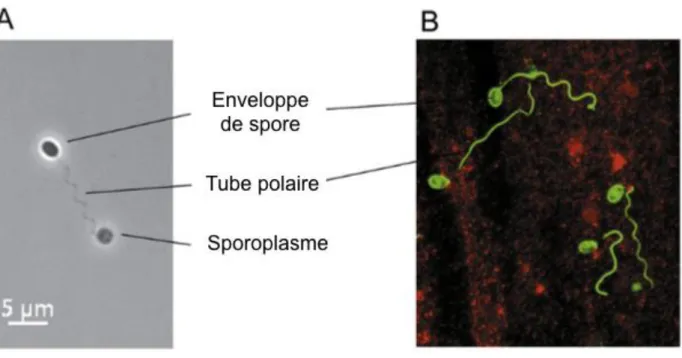
Figure 2 : Observation du tube polaire de spores d’Encephalitozoon cuniculi... 27
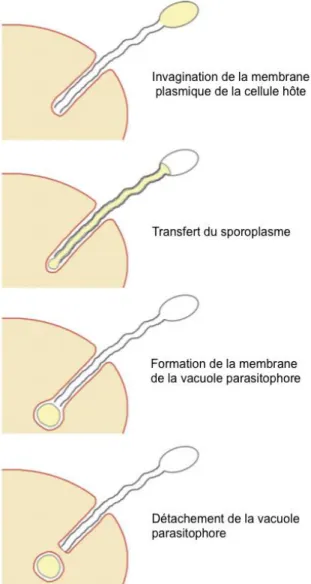
Figure 3: Transfert du sporoplasme lors de l’invasion de la cellule hôte par Encephalitozoon cuniculi ... 28
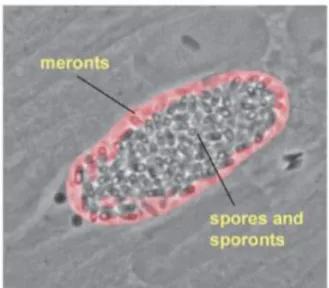
Figure 4 : Vacuole parasitophore comportant des spores et sporontes d’Encephalitozoon cuniculi et dont la membrane est bordée d’un anneau de mérontes ... 30
Figure 5 : Schéma récapitulatif de l’infection d’une cellule hôte suivie de la mérogonie et de la sporogonie .... 32
Figure 6: Activation et rôle des lymphocytes T CD8+ dans la réponse immunitaire contre les microsporidies ... 47
Figure 7 : Rein à la surface irrégulière et piquetée associée à une infection par Encephalitozoon cuniculi ... 54
Figure 8 : Cataracte chez un lapin infecté par Encephalitozoon cuniculi ... 55
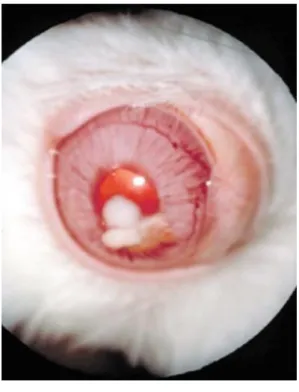
Figure 9 : Lapin présentant une tête penchée, principal signe clinique neurologique de l’encéphalitozoonose 57 Figure 10 : Lapin présentant une uvéite phacoclastique associée à une infection par Encephalitozoon cuniculi 59 Figure 11 : Lapin présentant une uvéite phacoclastique associée à une infection par Encephalitozoon cuniculi associée à une hyperhémie conjonctivale ... 60
Figure 12 : Schéma récapitulatif de la marche à suivre en cas de test séropositif ... 72
Figure 13 : Schéma récapitulatif de la marche à suivre en cas de test séronégatif ... 74
Figure 14 : Observation de microsporidies dans des échantillons de fécès au microscope optique, deux types de colorations... 77
Figure 15 : Tissu rénal de lapin infecté par E. cuniculi, coloration de trichrome modifiée ... 83
Figure 16 : Tissu rénal de lapin infecté par E. cuniculi, coloration au calcofluor-white ... 83
Figure 17 : Tissu rénal de lapin infecté par E. cuniculi, coloration de Gram ... 83
Figure 18 : Tissu rénal de lapin infecté par E. cuniculi, coloration trichrome de Masson ... 83
Figure 24 : Aménagement d’un enclos de lapin souffrant de syndrome vestibulaire ... 99
TABLE DES TABLEAUX
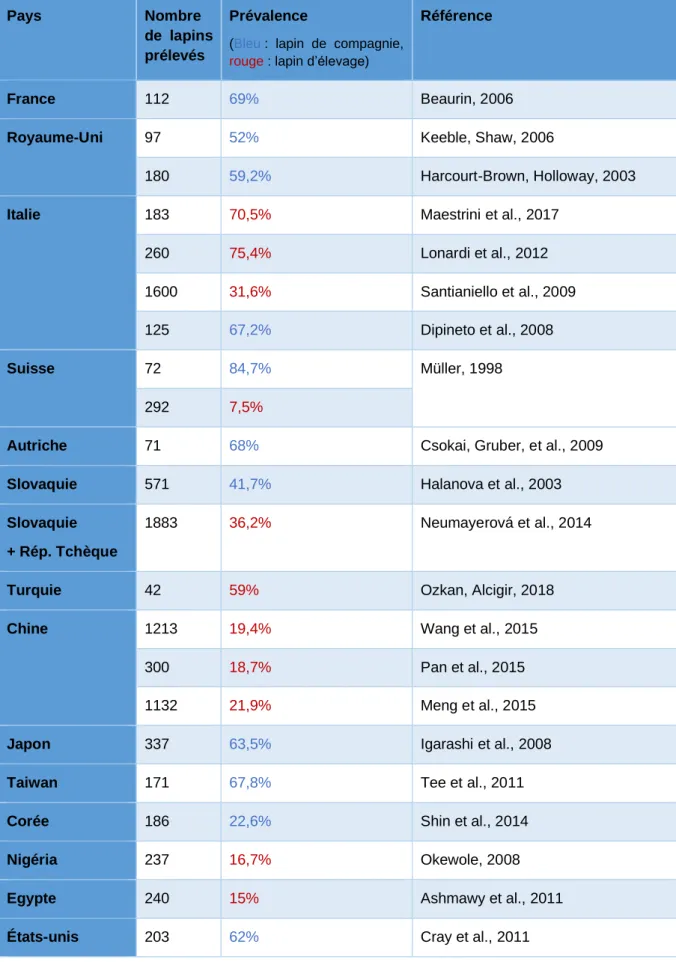
Tableau 1: Aperçu global de la séroprévalence d’Encephalitozoon cuniculi chez les lapins de compagnie et les lapins d’élevage ... 34 Tableau 2 : Pourcentage de lapins séropositifs à Encephalitozoon cuniculi en fonction de leurs signes cliniques
pour 3 études... 71 Tableau 3 : Synthèse des caractéristiques des colorations utilisées dans la détection histologique des
LISTE DES ABRÉVIATIONS
ADN : Acide DésoxyriboNucléique AVC : Accident Vasculaire Cérébral CIA : Carbon Immunoassay
CRP : Protéine C-Réactive
E. cuniculi : Encephalitozoon cuniculi
ELISA : Enzyme-Linked Immunosorbent Assay GALT : Gut Associated Lymphoid Tissue, soit tissu lymphoïde associé au tube digestif HHV : Human HerpesVirus
HSP : Heat Shock Protein, soit protéine de choc thermique
IFAT : Indirect Fluorescence Antibody Test IFI : Immunofluorescence Indirecte
IFN : Interféron
IgG : Immunoglobuline G IgM : Immunoglobuline M IL : Interleukine
IRM : Imagerie par Résonnance Magnétique LCR : Liquide Céphalo-Rachidien
LCS : Liquide Cérébro-Spinal NF : Numération Formule
NK : Natural Killer, soit tueur naturel PAS : Periodic Acid Schiff
PCR : Polymerase Chain Reaction, soit réaction en chaîne par polymérase
SCID mouse : Severe Combined Immunodeficiency mouse, soit souris immunodéficiente ou souris humanisée
SIDA : Syndrome d’Immunodéficience Acquise TNF : Tumor Necrosis Factor
VIH : Virus de l’Immunodéficience Humaine
Unités du système international cm : centimètre kDa : kilodalton kg : kilogramme L : litre Mb : mégabase mg : milligramme min : minute mL : millilitre mm : millimètre
INTRODUCTION
Encephalitozoon cuniculi est une microsporidie, parasite intracellulaire
obligatoire qui peut infecter diverses espèces de mammifères tels que les rongeurs, les lapins, les chevaux, les carnivores et l’Homme. Il a été décrit pour la première fois en 1922 dans une colonie de lapins de laboratoire atteints de paralysie par Wright et Craig (Wright, Craighead, 1922). Ce parasite pose problème par bien des aspects.
Tout d’abord, il a soulevé de nombreux débats quant à sa place dans la classification taxinomique. En premier lieu considéré comme une cellule procaryote de par ses caractéristiques morphologiques, Encephalitozoon cuniculi semble aujourd’hui trouver sa place dans le règne des Fungi.
D’un point de vue médical, les caractéristiques de l’infection par
Encephalitozoon cuniculi rendent son diagnostic difficile à réaliser. En effet, les signes
cliniques sont variables, non pathognomoniques et peuvent apparaître des mois voire des années après l’inoculation. Un lapin infecté par Encephalitozoon cuniculi peut ne jamais présenter de symptômes tout comme succomber suite à l’apparition de signes cliniques neurologiques associés ou non à une défaillance rénale. Des lésions oculaires peuvent également être observées en cas d’infection par ce parasite. De plus, les examens complémentaires de base ne permettent généralement pas d’obtenir un diagnostic de certitude ante mortem. En pratique vétérinaire, l’encéphalitozoonose est une cause fréquente d’atteinte neurologique chez le lapin et pose problème de par la difficulté de son diagnostic et l’absence de protocole de traitement efficace à mettre en place. En effet, à ce jour, seules quelques études ont été réalisées dans le but de mettre en place des options thérapeutiques pour les animaux malades (Suter et al., 2001 ; Sieg et al., 2012).
Bien que détecté la plupart du temps chez le lapin, Encephalitozoon cuniculi peut infecter de nombreux autres mammifères, dont l’Homme chez qui le pathogène cause des infections de manière opportuniste, notamment chez les patients immunodéprimés. Le rôle de réservoir des animaux de compagnie n’est à ce jour pas
surtout les différentes caractéristiques de son infection chez le lapin, les méthodes diagnostiques à disposition des praticiens vétérinaires et les traitements envisageables afin de permettre un rétablissement optimal des animaux atteints.
I.
LE PARASITE ENCEPHALITOZOON CUNICULI
1. C
LASSIFICATIONEncephalitozoon cuniculi est un pathogène microsporidien pouvant infecter
diverses espèces de mammifères, Homme inclus (Künzel, Fisher, 2018). Le phyllum Microspora compte environ 1300 espèces (160 genres) décrites dans le monde (Didier, Weiss, 2006). Cependant, cela ne représente probablement qu’une fraction de la diversité réelle des microsporidies car la plupart des lignées d’hôtes potentiels n’ont été que peu étudiées (Keeling, 2009). En effet, les microsporidies comptent parmi leurs hôtes non seulement des mammifères mais aussi des poissons et de nombreux invertébrés, la plupart d’entre elles infectant les arthropodes (Keeling, 2009 ; Didier et al., 2000). Seules 15 espèces de microsporidies sont aujourd’hui connues comme étant capables d’infecter les mammifères, Encephalitozoon cuniculi en fait partie (Didier et al., 2000).
Le génome d’Encephalitozoon cuniculi a pu être entièrement séquencé et montre une compaction importante du matériel génétique avec un génome de seulement 2,9 Mb, plus petit que la plupart des génomes bactériens (Katinka et al., 2001 ; Biderre et al., 1995 ; Bohne et al., 2011). Cette compaction est notamment permise par la réduction de l’espace inter-génique et par la petite taille des protéines en comparaison à celles des eucaryotes (Katinka et al., 2001).
Récemment classées dans le règne des Fungi (« champignons »), l’origine phylogénétique des microsporidies a longtemps fait débat. Elles possèdent en effet des caractéristiques qui les rendent difficiles à comparer à d’autres types d’organismes.
A l’origine, les microsporidies étaient considérées comme faisant partie des cellules eucaryotes les plus anciennes car elles ne possèdent pas de mitochondries,
microsporidies furent un moment considérées comme faisant partie du règne des archézoaires, regroupant les protistes supposés primitifs car dépourvus de mitochondries (Cavalier-Smith, 1991).
Depuis, des mitosomes (vestiges de mitochondries, de taille très réduite) ont été identifiés parmi les organites de ces cellules en nombre relativement abondant et sont maintenant un critère important de caractérisation de cet organisme (Didier, Weiss, 2006 ; Williams et al., 2002). La mise en évidence d’une protéine HSP70 dans le mitosome, habituellement liée au fonctionnement de la mitochondrie chez les mammifères et les levures, ainsi que l’identification de 5 gènes très probablement d’origine mitochondriale soutiennent l’idée que les microsporidies auraient en réalité évolué d’ancêtres qui possédaient des mitochondries (Hirt et al., 1997 ; Arisue et al., 2002 ; Germot et al., 1997 ; Katinka et al., 2001). Ainsi, les mitosomes des microsporidies seraient des dérivés de mitochondries, ne synthétisant pas d’ATP et ne comportant pas de génome, rendant les microsporidies entièrement dépendantes de leur cellule hôte (Keeling, 2009 ; Burri et al., 2006 ; Katinka et al., 2001).
Des analyses phylogénétiques de plusieurs séquences génétiques montrent une relation entre les microsporidies et les champignons, et plus spécifiquement aux clades Ascomycètes et basidiomycètes (Thomarat et al., 2004 ; Gill, Fast, 2006 ; Katinka et al., 2001). En effet, les microsporidies et les champignons possèdent plusieurs caractéristiques communes, dont la plus importante est leur capacité commune à produire des spores (Thomarat et al., 2004). De plus, les spores de microsporidies comportent des éléments en commun avec les champignons tels que des protéines fongiques (tréhalose, chitine) composant leur paroi et des alpha et béta tubulines avec une composition proche des tubulines fongiques (Bohne et al., 2011 ; Thomarat et al., 2004). Même si ces caractéristiques ne sont pas exclusives aux champignons et au microsporidies, elles soutiennent l’idée d’un lien très proche entre ces deux groupes (Thomarat et al., 2004).
Aujourd’hui, les microsporidies sont considérées comme étant hautement différenciées, très adaptées et sont des parasites spécialisés qui appartiennent au règne des Fungi. Leur relation exacte avec la branche des champignons reste cependant à déterminer (Didier, Weiss, 2006 ; Hirt et al., 1997 ; Keeling, 2009 ; Gill, Fast, 2006).
2. M
ORPHOLOGIELes microsporidies se développent uniquement en milieu intracellulaire et produisent des spores qui sont leur forme de résistance à l’environnement extérieur. Ces spores, mesurant 1,5 x 2,5 μm, sont protégées de l’environnement extérieur par une paroi comprenant une enveloppe externe (exospore) ondulée, dense aux électrons et composée de glycoprotéines, une enveloppe interne (endospore) transparente aux électrons, composée de polysaccharides et notamment de chitine et enfin une membrane plasmatique interne à 3 couches (figure 1) (Franzen, Müller, et al., 2005 ; Bohne et al., 2000 ; Wasson, Peper, 2000 ; Didier et al., 2000). L’exospore comporte de plus des molécules de surface probablement impliquées dans l’initialisation du processus d’infection, impliquant alors une spécificité d’hôte et de tissus (Bohne et al., 2000). Une spore d’Encephalitozoon cuniculi peut ainsi survivre plus de 4 semaines dans l’environnement extérieur, à température ambiante (Harcourt-Brown, Holloway, 2003).
Ces spores, unicellulaires, contiennent un noyau central monocaryote, une vacuole postérieure, un appareil de Golgi atypique appelé polaroplaste et un disque d’ancrage en zone antérieure sur lequel se fixe une structure propre au microsporidies : le tube polaire (ou filament polaire) (figure 1) (Didier et al., 2000). Ce tube, composé de protéines, est enroulé en spirale à l’intérieur de la spore de son centre jusqu’à la région postérieure et est lié au disque d’ancrage (figure 1) (Bohne et al., 2011 ; Didier et al., 2000). Le tube polaire a un diamètre de 0,1 à 0,2mm et peut atteindre une longueur de 50 à 150 mm selon l’espèce de microsporidie (Peuvel et al., 2002). Il s’agit d’une structure clé utilisée dans l’identification de la spore (Didier et al., 2000). En effet, le nombre de spirales formées par le tube polaire au sein de la spore peut renseigner sur l’espèce observée. Les spores matures d’Encephalitozoon cuniculi comportent un tube polaire qui s’enroule 5 à 6 fois sur lui-même (Rodríguez-Tovar et al., 2017).
Figure 1: Schéma d’une spore de microsporidie (D’après Franzen, 2004)
3. C
YCLE3.1. Phase infectieuse
L’invasion d’une cellule hôte par une spore de microsporidie se déroule généralement en plusieurs étapes, correspondant à la germination (Xu, Weiss, 2005): - Activation de la spore suite à un changement de pH ou de pression
osmotique dans le milieu extérieur
- Augmentation de la pression à l’intérieur de la spore - Éversion du tube polaire
Tout cela se déroule très rapidement. En effet, l’activation de la spore, l’éversion du tube polaire et le passage du sporoplasme vers la cellule hôte prend moins de 2 secondes (Frixione et al., 1992).
3.1.1. Activation et augmentation de pression au sein de la spore
L’activation de la spore survient dès qu’un changement de pH ou de pression osmotique intervient dans le milieu extérieur. Cela provoque l’entrée d’eau à l’intérieur de la spore au travers d’aquaporines (Bohne et al., 2011 ; Frixione et al., 1992 ; Didier et al., 2000).
Il existe de nombreuses théories pouvant expliquer l’augmentation de pression osmotique dans la spore, qui reste, aujourd’hui encore, un mécanisme assez flou (Xu, Weiss, 2005). Une des premières hypothèses suggérait que l’activation de la spore augmentait simplement la perméabilité de la paroi de la spore (Lom, Vavra, 1963). Une autre théorie impliquait la création d’un gradient de protons par l’alcalinité du milieu extérieur (Dall, 1983). Cela provoquerait un déséquilibre osmotique entre la spore et le milieu extérieur qui provoquerait l’entrée d’eau à l’intérieur de la spore (Dall, 1983). Cependant, toutes les espèces de microsporidies ne requièrent pas de pH alcalin pour infecter une cellule hôte (Xu, Weiss, 2005). Une autre hypothèse s’est fondée sur la découverte d’un taux de tréhalose diminué dans la spore déchargée de son contenu en comparaison au taux de tréhalose d’une spore intacte de Brachiola
algerae (Undeen, Vander Meer, 1994). Dans ce mécanisme, l’activation engendrerait
des changements à l’intérieur de la spore qui provoqueraient un contact entre le tréhalose et l’enzyme tréhalase, probablement suite à l’interruption de la compartimentation à l’intérieur de la spore (Undeen, Vander Meer, 1994). Le tréhalose est alors dégradé en un nombre important de molécules de petite taille, augmentant la pression osmotique à l’intérieur de la spore. Plus récemment, il a été supposé que la vacuole postérieure puisse fonctionner comme un peroxysome contenant de la
Des études in vitro sur Encephalitozoon hellem ont montré que l’extrusion du filament polaire peut être stimulée par la présence de calcium dans le milieu extracellulaire combiné à l’ajout d’H2O et semble inhibée par la cytochalasine D, la
démécolcine, la nifédipine et l’itriconazole, suggérant l’implication de canaux calciques et d’éléments du cytosquelette (microtubules, microfilaments) dans ce processus (Leitch et al., 1993 ; 1995). De plus, l’efficacité in vitro et in vivo de l’albendazole, inhibiteur des microtubules, dans la prévention d’une infection par Encephalitozoon spp. met en évidence le fait que les microtubules jouent un rôle important dans le processus d’extrusion du tube polaire (Wasson, Peper, 2000).
3.1.2. Éversion du tube polaire et passage du sporoplasme vers la cellule hôte
Ainsi, le gonflement de la vacuole postérieure de la spore a lieu. Ce processus augmente la pression mécanique à l’intérieur de la spore et conduit finalement à la rupture de sa paroi rigide suivie par l’éversion brutale du tube polaire en direction de la cellule hôte (figure 2) (Bohne et al., 2011). Le tube polaire forme un tube creux, restant attaché à l’apex antérieur de la spore par le disque d’ancrage, dans lequel le sporoplasme (le contenu cytoplasmique de la spore) peut circuler afin de rejoindre la cellule-hôte, poussé par le gradient osmotique (Xu, Weiss, 2005 ; Frixione et al., 1992). Ainsi, le tube polaire sert de « pont » pour délivrer le sporoplasme à la cellule hôte tout en protégeant le sporoplasme des conditions extracellulaires au moment de son transfert (figure 2) (Xu, Weiss, 2005). Ce mécanisme se met en place très rapidement (Keeling, 2009).
Figure 2 : Observation du tube polaire de spores d’Encephalitozoon cuniculi (Bohne et al., 2011)
A. Spore ayant germé en milieu extracellulaire. Le tube polaire est visible et le sporoplasme est libéré à l’extérieur de la spore. B. Détection par immunofluorescence de spores extracellulaires ainsi que leurs tubes polaires déroulés.
Pour la plupart des microsporidies, le déroulement brutal du tube polaire à l’extérieur de la spore perce la membrane plasmique de la cellule hôte et permet le transfert du sporoplasme au travers du tube polaire jusqu’au cytoplasme de la cellule hôte (Orlik et al., 2010).
Certaines études ont montré que l’infection des cellules hôtes peut également se faire par phagocytose de la spore (Franzen, Müller, et al., 2005 ; Pakes et al., 1975). Dans ce cas, la spore se trouvant dans le phagosome déploie son tube polaire et décharge le sporoplasme à l’extérieur du phagosome, dans le cytoplasme de la cellule ou dans une cellule adjacente (Bohne et al., 2011). Il a cependant été montré que la
poussée par la force mécanique du tube polaire (figure 3) (Rönnebäumer et al., 2008). Elle s’invagine alors pour former une vacuole parasitophore dans laquelle se trouve le sporoplasme infectieux et où Encephalitozoon cuniculi va passer l’intégralité de son cycle intracellulaire (figure 3) (Bohne et al., 2011). Lors de l’invagination, il est probable que les protéines du tube polaire interagissent avec les composants de surface de la cellule hôte, ce qui résulterait en une connexion étroite entre les deux membranes (celle du tube polaire et celle de la cellule hôte), stabilisant ainsi le tout, même après que la vacuole parasitophore se soit formée (Bohne et al., 2011).
Figure 3: Transfert du sporoplasme lors de l’invasion de la cellule hôte par
Encephalitozoon cuniculi (D'après Bohne et al., 2011)
Contrairement au modèle conventionnel suivi par la plupart des microsporidies, la membrane plasmique de la cellule hôte n’est pas percée mais invaginée par le tube polaire d’Encephalitozoon cuniculi, participant à la formation de la vacuole parasitophore.
L’un des intérêts de cette vacuole parasitophore est sans aucun doute la protection dont bénéficie alors le parasite d’une reconnaissance intracellulaire (et donc d’une interruption de son cycle) (Bohne et al., 2011). En effet, une étude a montré l’absence de marqueurs lysosomaux ou endosomaux sur la membrane de la vacuole parasitophore durant l’intégralité du cycle intracellulaire du parasite (Fasshauer et al., 2005).
Plusieurs vacuoles parasitophores peuvent être présentes au sein d’une même cellule hôte, elles peuvent se diviser et également fusionner entre elles (Lee, Heitman, 2017). Cela indiquerait alors que plusieurs isolats de microsporidies pourraient infecter une même cellule hôte et pourraient interagir suite à la fusion de deux vacuoles parasitophores (Lee, Heitman, 2017). Ces interactions pourraient donner lieu à des variations génétiques. Cela expliquerait notamment la présence de 4 transporteurs d’ATP chez Encephalitozoon cuniculi ayant une structure très similaires à ceux de
Chlamydia spp. ; en effet, on peut alors émettre l’hypothèse selon laquelle Encephalitozoon cuniculi aurait acquis horizontalement par Chlamydia spp. le matériel
génétique codant pour ces 4 transporteurs lors d’une de ces interactions. Cela s’est probablement produit suite à un échange de matériel génétique (Katinka et al., 2001 ; Lee, Heitman, 2017).
Même si des recombinaisons génétiques n’ont pas encore pu être observées au cours d’études, ces fusions et fissions de vacuoles parasitophores pourraient constituer la preuve que des interactions peuvent avoir lieu entre différents isolats de
Encephalitozoon cuniculi (Lee, Heitman, 2017).
3.2.1. Import d’énergie
La membrane de la vacuole parasitophore est le siège de nombreuses interactions. Deux caractéristiques remarquables caractérisent cette vacuole. Premièrement, la face interne de la membrane de la vacuole parasitophore est toujours soulignée par une seule couche de mérontes, et ce même lors de stades de développements plus avancés lorsque la lumière de la vacuole est totalement occupée par les spores (figure 4) (Sprague, Vernick, 1971 ; Pakes et al., 1975 ; Bohne et al., 2000). D’autre part, la face externe de la membrane de la vacuole parasitophore a tendance à s’associer étroitement avec les mitochondries de la cellule hôte (Scanlon et al., 2004). La proximité entre la vacuole parasitophore et les mitochondries de la cellule hôte pourrait amener à penser que cela favoriserait l’apport d’ATP pour le pathogène. Cependant, l’importation directe d’ATP mitochondrial n’a pas encore été démontré (Bohne et al., 2011).
Figure 4 : Vacuole parasitophore comportant des spores et sporontes d’Encephalitozoon cuniculi et dont la membrane est bordée d’un anneau de
mérontes (Bohne et al., 2011)
A première vue, la membrane de la vacuole parasitophore semble être une barrière supplémentaire à l’absorption de métabolites de la cellule hôte. Cependant, il a été démontré que cette membrane contient des pores permettant le passage de molécules comprises entre 3 et 10 kDa (Rönnebäumer et al., 2008). Ces pores sont
par conséquent suffisamment larges pour permettre la diffusion d’ATP et d’autres métabolites, tels que des acides aminés, du cytosol de la cellule hôte vers la lumière de la vacuole parasitophore (Bohne et al., 2011). Les pores de la membrane de la vacuole parasitophore peuvent alors être considérées comme les premiers composants du système d’importation de nutriments d’Encephalitozoon cuniculi (Bohne et al., 2011).
Encephalitozoon cuniculi possède un métabolisme énergétique réduit et n’est
pas capable de réaliser le cycle de Krebs ni la chaine respiratoire mitochondriale (Bohne et al., 2011). Ainsi, du fait du manque de voies anaboliques qui lui sont propres, le parasite nécessite un apport efficace de la cellule hôte, permis par la présence de transporteurs transmembranaires variés (Bohne et al., 2011). Des transporteurs transmembranaires ATP/ADP permettent notamment l’importation d’ATP de la cellule hôte vers le parasite (Tsaousis et al., 2008). L’ATP est ensuite importé vers le mitosome, vestige de mitochondrie, inversant ainsi le sens normal du transport d’énergie (Tsaousis et al., 2008 ; Williams et al., 2008).
3.2.2. Phase proliférative : mérogonie
Suite à la germination décrite précédemment et à la formation de la vacuole parasitophore, le cycle intracellulaire de Encephalitozoon cuniculi se met en place. Il se divise en deux phases : la mérogonie et la sporogonie (Bohne et al., 2000). La mérogonie correspond à la phase proliférative durant laquelle les mérontes, cellules de structure morphologique simple, se répliquent dans la vacuole parasitophore à l’intérieur de la cellule hôte (Bohne et al., 2011 ; Wasson, Peper, 2000). Elles se trouvent alors attachées à la membrane de la vacuole parasitophore (Künzel, Fisher, 2018 ; Bohne et al., 2011). Les mérontes ne comportent alors pas les structures typiques des spores matures telles que la paroi et le tube polaire (Bohne et al., 2011).
3.2.3. Phase de différenciation : sporogonie
La sporogonie correspond à la différenciation des mérontes en sporontes puis en sporoblastes pour finalement devenir des spores matures. Elle commence avec l’épaississement de la membrane plasmique puis la formation de la paroi, le développement du tube polaire, du disque d’ancrage et de la vacuole postérieure ainsi que la densification progressive du cytoplasme (Bohne et al., 2011 ; 2000 ; Wasson, Peper, 2000 ; Didier et al., 2000). Les spores matures ainsi formées dans la vacuole parasitophore sont métaboliquement en dormance (Bohne et al., 2011).
Avec le temps, la vacuole parasitophore (ou pseudokyste) devient surchargée et rompt, libérant les spores (Bohne et al., 2011) (voir schéma récapitulatif en figure 5). La cellule hôte se rompt ensuite, permettant à Encephalitozoon cuniculi de se disséminer dans l’organisme par l’infection des cellules se trouvant autour, par l’introduction dans le système vasculaire ou par ces deux méthodes (Wasson, Peper, 2000).
La rupture de la cellule hôte est associée à une réponse inflammatoire, et la plupart des lapins immunocompétents développent une infection chronique et subclinique dans une relation hôte-parasite équilibrée associée à la formation de lésions granulomateuses affectant en premier lieu le cerveau, les reins ou les yeux (Künzel, Fisher, 2018). Plusieurs autres tissus peuvent présenter des lésions morphologiques. Cependant, ces altérations histologiques ne sont pas associées à des signes cliniques (Künzel, Fisher, 2018).
Lorsque l’animal hôte vieillit et perd en compétences immunitaires, l’infection à
Encephalitozoon cuniculi peut devenir clinique, le plus fréquemment avec des signes
neurologiques.
Figure 5 : Schéma récapitulatif de l’infection d’une cellule hôte suivie de la mérogonie et de la sporogonie (d'après Franzen, 2004)
Le sporoplasme infectieux est transféré vers la cellule hôte par le biais du tube polaire. La vacuole parasitophore se forme alors. Le reste de la spore (vide) ainsi que le tube polaire sont par la suite dégradés. Se mettent alors en place les phases de prolifération et de différenciation. Le sporoplasme se transforme en méronte qui subit ensuite plusieurs cycles de reproduction asexuée : la mérogonie. Les mérontes se différencient ensuite en sporontes, puis en sporoblastes. Ainsi, plusieurs centaines de spores peuvent être créées au sein d’une même cellule hôte, qui finira par exploser et ainsi libérer les spores en milieu extracellulaire.
II.
EPIDEMIOLOGIE ET PHYSIOPATHOLOGIE DE L’INFECTION
1. E
PIDEMIOLOGIE1.1. Prévalence d’Encephalitozoon cuniculi chez le lapin
La prévalence est extrêmement variable selon le mode de vie et d’exploitation des lapins, ainsi que d’une étude à l’autre.
Le taux de séroprévalence d’Encephalitozoon cuniculi chez le lapin domestique est généralement élevé, avec une atteinte en Europe de 41,7% à 84,7% des populations de lapins de compagnie (tableau 1). Le parasite semble réparti dans le monde entier. Le tableau 1 montre une séroprévalence qui semble en moyenne moins importante chez les lapins d’élevage que chez les lapins de compagnie. Cependant, les lapins de compagnie sont, selon les études, prélevés lors de suivis ou de consultations vétérinaires donc souvent non sains, ce qui peut amener à une surestimation de la séroprévalence dans cette population.
Dans les populations de lapins sauvages, la prévalence du parasite est moindre, probablement du fait de la densité moindre de population (Künzel, Joachim, 2010).
Tableau 1: Aperçu global de la séroprévalence d’Encephalitozoon cuniculi chez les lapins de compagnie et les lapins d’élevage
Pays Nombre
de lapins prélevés
Prévalence
(Bleu : lapin de compagnie,
rouge : lapin d’élevage)
Référence
France 112 69% Beaurin, 2006
Royaume-Uni 97 52% Keeble, Shaw, 2006
180 59,2% Harcourt-Brown, Holloway, 2003
Italie 183 70,5% Maestrini et al., 2017
260 75,4% Lonardi et al., 2012 1600 31,6% Santianiello et al., 2009
125 67,2% Dipineto et al., 2008
Suisse 72 84,7% Müller, 1998
292 7,5%
Autriche 71 68% Csokai, Gruber, et al., 2009
Slovaquie 571 41,7% Halanova et al., 2003
Slovaquie + Rép. Tchèque
1883 36,2% Neumayerová et al., 2014
Turquie 42 59% Ozkan, Alcigir, 2018
Chine 1213 19,4% Wang et al., 2015
300 18,7% Pan et al., 2015 1132 21,9% Meng et al., 2015
Japon 337 63,5% Igarashi et al., 2008
Taiwan 171 67,8% Tee et al., 2011
1.2. Facteurs prédisposants
1.2.1. Sexe
Les avis diffèrent quant à l’existence d’une prédisposition sexuelle à l’infection par
Encephalitozoon cuniculi. L’étude d’Harcourt-Brown suggère l’éventualité d’une
prédisposition des lapins mâles en observant que 67% des cas séropositifs de leur étude sont des mâles alors que l’étude de Wang présente une majorité de femelles (62%) parmi les individus séropositifs (Harcourt-Brown, Holloway, 2003 ; Wang et al., 2018). Selon plusieurs études, il n’existerait pas de prédisposition sexuelle (Meng et al., 2015 ; Shin et al., 2014).
1.2.2. Âge
Plusieurs études suggèrent que le risque d’infection augmente avec l’âge (Santaniello et al., 2009 ; Wang et al., 2018 ; Meng et al., 2015). En effet, sur un total de 1213 lapins d’élevage, Wang et al observe des séroprévalences de 12,3% chez les individus de moins de 6 mois, de 19,5% chez les individus dont l’âge est compris entre 6 et 12 mois et de 29,8% chez les individus de plus de 12 mois (Wang et al., 2018). Dans l’étude de Lonardi, 59,3% des lapins âgés de moins de 2 ans sont séropositifs contre 80,1% des lapins de plus de 2 ans (Lonardi et al., 2012). Cela indique notamment que la transmission se fait plutôt horizontalement (Wang et al., 2018).
1.2.3. Race
Peu d’études évaluent la potentielle existence d’une prédisposition raciale. Les lapins nains sembleraient être plus sensibles à la maladie (Kunstýr, Naumann, 1985 ; Nast et al., 1996). L’étude de Kunstyr et Naumann montre que sur 19 lapins non nains présentant des symptômes neurologiques, aucun n’était séropositif à Encephalitozoon
Naumann, 1985). Il a cependant été supposé que cette différence soit plutôt liée à une exposition différente aux agents infectieux plutôt qu’à une sensibilité différente entre ces deux types de lapins (Kunstýr, Naumann, 1985).
Dans une étude plus récente regroupant trois races de lapins, les lapins Rex ont une plus haute séroprévalence que les lapins néo-zélandais et les lapins blancs japonais suggérant une possible prédisposition raciale à l’infection par
Encephalitozoon cuniculi (Pan et al., 2015).
Des études plus approfondies sont nécessaires afin d’explorer ces hypothèses.
1.2.4. Mode de vie et alimentation
Encephalitozoon cuniculi étant un parasite assez contagieux dont l’infection se fait
principalement par l’ingestion d’urine contaminée, l’hygiène joue un rôle important dans le processus de contamination des individus. Ainsi, comme le constatent plusieurs études, les lapins d’élevage issus d’exploitations agricoles familiales présentent une séroprévalence plus importante que ceux issus d’exploitations agricoles commerciales probablement plus strictes sur le plan sanitaire (Wang et al., 2018 ; Maestrini et al., 2017 ; Neumayerová et al., 2014). La vie en groupe pourrait par ailleurs favoriser la dissémination du parasite (Künzel, Joachim, 2010).
L’étude de Wang constate une séroprévalence plus élevée chez les lapins nourris avec des graines, des fruits et des légumes frais que chez les animaux nourris avec des granulés secs (Wang et al., 2018). L’auteur suggère une contamination des aliments frais au moment de leur production mais des études supplémentaires sont nécessaires afin de déterminer un lien entre le type d’aliment donné aux lapin et leur possible contamination (Wang et al., 2018).
2. M
ODE DE TRANSMISSION 2.1. Transmission horizontale2.1.1. Inoculation et dissémination dans l’organisme
Chez le lapin, la transmission post-natale a souvent lieu dans les 6 semaines suivant un contact avec un animal infecté (Künzel, Fisher, 2018).
L’infection est transmise horizontalement par contact direct ou par contamination de l’environnement (Harcourt-Brown, 2004 ; Mathis et al., 2005). Les spores sont soit ingérées soit inhalées au stade infectieux d’Encephalitozoon cuniculi (Künzel, Joachim, 2010).
Lors de transmission horizontale, l’infection débute le plus souvent dans les intestins après l’ingestion des spores (Ozkan et al., 2019 ; Csokai, Gruber, et al., 2009). Celles-ci infectent l’épithélium intestinal puis, via le GALT (tissu lymphoïde associé au tube digestif), atteignent le flux sanguin, leur permettant ainsi dans un premier temps de se disséminer dans les cellules réticuloendothéliales du cœur, des poumons, du foie et de la rate (Ozkan et al., 2019 ; Cox et al., 1979 ; Fisher, Carpenter, 2012). A ce stade, lorsque le développement du parasite atteint un équilibre avec la réponse immunitaire de l’animal, les spores d’Encephalitozoon cuniculi peuvent se loger dans les reins et l’encéphale qui sont leur site d’infection de prédilection, sans provoquer de signes cliniques chez le lapin infecté (Ozkan et al., 2019 ; Cox et al., 1979). Cependant, lorsque l’équilibre établi avec le système immunitaire se rompt, à la faveur d’un stress ou d’une immunosuppression par exemple, les lésions formées dans l’encéphale et les reins entrainent l’expression de signes cliniques chez le lapin et ce même plusieurs années après l’infection initiale (Maestrini et al., 2017 ; Jeklova, Jekl, et al., 2010 ; Künzel, Fisher, 2018 ; Ozkan et al., 2019).
Les spores sont ensuite excrétées principalement par l’urine pendant plusieurs semaines, par intermittence (Cox, Gallichio, 1978).
2.1.2. Excrétion des spores d’Encephalitozoon cuniculi
Durant les tout premiers stades d’infection, dans l’intestin, les spores peuvent être excrétées dans les fécès (Didier et al., 2000). Cependant, Encephalitozoon
cuniculi a rapidement tendance à se disséminer dans l’organisme et en particulier dans
les reins. L’excrétion se fait alors par les urines (Didier et al., 2000 ; Cox, Gallichio, 1978). L’excrétion des spores par l’urine est considérée comme étant le principal mode de dissémination de Encephalitozoon cuniculi dans l’environnement (Künzel, Joachim, 2010).
Les spores sont détectables dans les urines 3 à 5 semaines après la séroconversion (qui nécessite environ 20 jours) et sont excrétées en quantité importante jusqu’à 3 mois après l’infection (Wasson, Peper, 2000 ; Cox, Gallichio, 1978). L’excrétion des spores diminue considérablement 3 mois après l’infection avec une excrétion intermittente d’une petite quantité de spores par le lapin passé ce délai (Cox et al., 1979).
Une spore d’Encephalitozoon cuniculi peut survivre plus de 4 semaines dans l’environnement extérieur, à température ambiante (Harcourt-Brown, Holloway, 2003).
2.2. Transmission verticale
L’infection par Encephalitozoon cuniculi peut avoir lieu in utero chez le lapin (Baneux, Pognan, 2003 ; Hunt et al., 1972 ; Ozkan et al., 2019). En effet, l’étude de Baneux et Pognan, a démontré la présence du parasite Encephalitozoon cuniculi chez 9 lapines gravides ainsi que dans leur placenta et leur foeti à 28 jours de gestation (Baneux, Pognan, 2003). À l’aide de PCR sur différents tissus, la présence d’Encephalitozoon cuniculi majoritairement dans l’encéphale, ainsi que dans les reins et les poumons des foeti a pu être mise en évidence (Baneux, Pognan, 2003). Aucune recherche du parasite n’a été réalisée dans les yeux des animaux au cours de cette
Une étude récente a démontré la présence du parasite Encephalitozoon cuniculi dans les yeux de 63% des lapereaux issus de mères séropositives (Ozkan et al., 2019). La transmission par voie intra-utérine semble être la seule voie par laquelle une infection de l’œil peut avoir lieu (Ozkan et al., 2019 ; Ashton et al., 1976 ; Benz et al., 2011). Les symptômes indiquent que le cristallin est la structure de l’œil préférentiellement touchée, bien qu’il s’agisse d’un compartiment avasculaire et isolé et que les cellules épithéliales soient entourée d’une capsule épaisse empêchant le passage du parasite (Ozkan et al., 2019). Cependant, lors du développement embryonnaire, la capsule du cristallin est au contraire fine et très vascularisée ; de ce fait, il est possible à ce stade pour Encephalitozoon cuniculi d’envahir cette structure de l’œil (Ozkan et al., 2019 ; Ashton et al., 1976 ; Benz et al., 2011).
Des études plus approfondies pourraient être nécessaires afin de déterminer le moment exact d’infection des foeti par Encephalitozoon cuniculi au cours de la gestation.
3. I
NVASION DE L’
ORGANISME ET DISSEMINATIONLes premiers organes infectés, 30 jours suite à l’inoculation, sont ceux étant très irrigués tels que les poumons, le cœur, le foie et les reins alors que ce n’est que 98 jours suite à l’inoculation que l’infection des tissus nerveux a lieu (Cox et al., 1979 ; Fuentealba et al., 1992 ; Wicher et al., 1991). A ce stade d’évolution de la maladie, les reins et le cœur peuvent également être infectés (Cox et al., 1979 ; Fuentealba et al., 1992 ; Wicher et al., 1991). Il a été montré que les organes infectés ainsi que la sévérité de leur atteinte dépendaient du mode d’inoculation; ainsi, un lapin infecté par
Encephalitozoon cuniculi per rectum présentera majoritairement des lésions
hépatiques et rénales, contrairement aux voies classiques d’infection (per os ou respiratoire) qui provoquent principalement des atteintes rénales, pulmonaires puis cérébrales (Fuentealba et al., 1992 ; Wicher et al., 1991).
4. R
EPONSE IMMUNITAIRELes anticorps dirigés contre Encephalitozoon cuniculi sont produits et persistent sur le long terme du fait de la nature chronique de l’infection. Cependant, une réponse immunitaire humorale ne semble pas avoir de rôle protecteur, contrairement aux mécanismes cellulaires qui sont essentiels pour le contrôle du parasite et la survie de l’hôte (Khan et al., 2001).
La réponse immunitaire face à une infection par Encephalitozoon cuniculi a surtout été étudiée chez la souris et chez l’Homme (Khan et al., 2001 ; Didier et al., 1994 ; Moretto et al., 2001 ; Sak et al., 2006).
4.1. Rôle de l’immunité à médiation cellulaire
Les hôtes immunodéficients, telles que les souris athymiques (possédant une immunité à médiation cellulaire inhibée en raison d’un nombre très réduit de lymphocytes T) ou SCID, développent une maladie mortelle suite à une infection expérimentale par Encephalitozoon cuniculi (Koudela et al., 1993 ; Khan et al., 2001). Les souris SCID sont déficientes en lymphocytes T et B mais possèdent des lymphocytes natural killer (NK) (Khan et al., 2001). Alors qu’une activité des lymphocytes NK est rapportée lors de l’infection d’une souris par Encephalitozoon
cuniculi, ceux-ci ne semblent pas offrir de protection in vivo suffisante (Khan et al.,
2001).
Le transfert de cellules spléniques enrichies en lymphocytes T aux souris athymiques et SCID permet leur protection contre l’infection par Encephalitozoon
cuniculi (Schmidt, Shadduck, 1984 ; Hermanek et al., 1993). Une étude par Didier et
al. a en effet montré que les cytokines libérées par les lymphocytes T lors d’une infection permettaient l’activation des macrophages pour éliminer Encephalitozoon . Ces observations suggèrent que l’efficacité de la réponse
4.1.1. Le rôle des cytokines 4.1.1.1. Les cytokines Th1
Les cytokines Th1 telles que les IFN-γ et les IL-12 ont un rôle important dans la protection immunitaire contre de nombreuses infections intracellulaires virales, bactériennes et parasitaires (Khan et al., 2001).
En effet, des études concernant Encephalitozoon intestinalis, une microsporidie extrêmement proche d’Encephalitozoon cuniculi, ont montré que les souris ne comportant pas le gène codant pour IFN-γ étaient incapables de lutter contre l’infection (Ombrouck et al., 1996). Dans une étude de Khan et Moretto datant de 1999, un traitement visant à neutraliser les IFN-γ ou les IL-12 résultait en une augmentation de la mortalité des souris suite à une infection par Encephalitozoon cuniculi, montrant une fois de plus l’importance de ces cytokines dans la lutte contre cette infection (Khan, Moretto, 1999). Le traitement de macrophages infectés par des microsporidies avec des IFN-γ et des lipopolysaccharides (LPS) active leur métabolisme oxydatif, permettant de lutter contre la réplication des microsporidies (Didier, 1994 ; Franzen, Hartmann, et al., 2005 ; Fischer et al., 2008 ; Didier et al., 2010). Néanmoins, les microsporidies sont capables d’inhiber le métabolisme oxydatif des macrophages ainsi que la fusion du phagosome les contenant avec un lysosome (Monaghan et al., 2009 ; Franzen, Müller, et al., 2005).
Ainsi, les IFN-γ et les IL-12 jouent un rôle indispensable dans la réponse immunitaire contre l’infection par Encephalitozoon cuniculi.
4.1.1.2. Les cytokines Th2
Jusqu’à récemment, la production de cytokines Th2 était présentée comme étant minimale lors d’une infection par Encephalitozoon cuniculi (Khan, Moretto, 1999). Cependant, une étude datant de 2018 a montré la présence de IL-4 dans l’encéphale et dans les reins ainsi que de IL-10 dans l’encéphale chez le lapin infecté par
Encephalitozoon cuniculi (Nevárez-Garza et al., 2018). IL-4 et IL-10 sont des cytokines
jouent un rôle dans la régulation des cytokines Th1 lors de maladies infectieuses (Khan, Didier, 2004). IL-4 semble notamment réguler la production de TNF-α qui est un promoteur de réaction inflammatoire (Khan, Didier, 2004).
L’auteur avance alors 3 hypothèses pouvant expliquer le rôle de IL-4 et IL-10, présents en grande concentrations dans le cerveau et peu présents dans les reins, lors d’une infection par Encephalitozoon cuniculi :
1) L’effet régulateur de IL-4 et IL-10 protègerait le cerveau des effets nocifs d’une inflammation (Nevárez-Garza et al., 2018). Dans les reins, les macrophages subiraient un switch de leur phénotype induisant habituellement un rôle protecteur des reins vers un phénotype favorisant un état inflammatoire permettant la formation de granulomes au sein desquels se développerait le parasite (Lee et al., 2011 ; Nevárez-Garza et al., 2018).
2) Les spores d’Encephalitozoon cuniculi moduleraient le statut immunologique du cerveau en faveur d’une réponse Th2 (production d’IL-4 et d’IL-10) pour éviter une détection par l’hôte (Nevárez-Garza et al., 2018).
3) IL-4 et IL-10 contrôleraient la réponse immunitaire dans le cerveau en bloquant la production de TNF-α. Ainsi, IL-4 et IL-10 empêcheraient la dissémination d’Encephalitozoon cuniculi dans le cerveau par les phagocytes (Nevárez-Garza et al., 2018). La raison pour laquelle la production d’IL-10 reste faible dans les reins pourrait être expliquée par la production accrue de son antagoniste, TNF-α, produit par les macrophages (Nevárez-Garza et al., 2018).
Globalement, l’auteur suggère que l’expression augmentée d’IL-10 dans le cerveau induit une protection de cet organe en mettant en place un environnement permissif à l’infection pour Encephalitozoon cuniculi (Nevárez-Garza et al., 2018). A l’inverse, d’après l’auteur, dans les reins, la quantité augmentée de TNF-α probablement sécrétés par les macrophages serait responsable d’une diminution de production d’IL-10 (Nevárez-Garza et al., 2018). Il est alors plausible que l’induction de la réaction inflammatoire dans l’épithélium rénal favorise le relargage des spores
4.1.2. Modulation de l’apoptose
L’apoptose est une réponse immunitaire innée et spécifique qui contrôle et limite la prolifération des pathogènes intracellulaires (Delaguila et al., 2006). Cependant, les parasites sont capables de réguler l’apoptose en l’inhibant ou en l’induisant, lui permettant ainsi de se développer et de se propager chez l’hôte (Nevárez-Garza et al., 2018). Plusieurs études mettent en évidence l’inhibition du processus d’apoptose des cellules infectées par des microsporidies (Didier et al., 2009 ; Scanlon et al., 2000). Cependant, dans l’étude de Nevárez-Garza et al., une augmentation significative du nombre de cellules apoptotiques chez les lapins infectés par Encephalitozoon
cuniculi a pu être observée à l’intérieur et aux alentours des granulomes formés dans
le cerveau (Nevárez-Garza et al., 2018). Ainsi, il semblerait qu’Encephalitozoon
cuniculi modifie la réponse immunitaire de l’animal en stimulant l’apoptose des cellules
mononucléaires telles que les lymphocytes T, B et NK, permettant aux spores de survivre dans le cerveau notamment (Nevárez-Garza et al., 2018).
4.1.3. Types de lymphocytes T induits
Comme mentionné plus haut, les lymphocytes T sont primordiaux pour la protection de l’organisme contre l’infection par Encephalitozoon cuniculi. Une infection par ce parasite induit une forte réponse des lymphocytes T CD 8+ (Ghosh, Weiss, 2012). En effet, l’analyse phénotypique des cellules de rate d’animaux infectés montre une augmentation du nombre de lymphocytes T CD8+ dès le 10ème jour post-infection
(Khan et al., 1999). Cette augmentation se poursuit alors pendant 7 jours. L’analyse de marqueurs d’activation a suggéré que les lymphocytes T CD8+ étaient activés dès le 3ème jour post-infection (Khan et al., 1999). De plus, les souris déficientes en
lymphocytes T CD8+ ne survivent pas à une infection par le parasite Encephalitozoon
cuniculi, mettant ainsi en évidence le rôle primordial de ces lymphocytes lors de
l’infection (Khan et al., 1999).
Contrairement à cela, les lymphocytes T CD4+ ne semblent pas indispensables pour la protection contre l’infection ; en effet, les souris déficientes en lymphocytes T CD4+ infectées par Encephalitozoon cuniculi n’ont pas montré de signes cliniques et
ont toutes survécu (Khan et al., 1999 ; Salát et al., 2006). De plus, aucune augmentation significative en lymphocytes T CD4+ n’est observée au cours de l’infection par Encephalitozoon cuniculi (Khan et al., 1999).
4.2. Réponse des lymphocytes T CD8+
Les lymphocytes T CD8+ jouent un rôle important lors d’infections intracellulaires (Khan et al., 2001). L’effet protecteur des lymphocytes T CD8+ est régi par leur capacité de production de cytokines (Ramshaw et al., 1997). Par ailleurs, les lymphocytes T CD8+ sont capables de réduire la charge parasitaire en éliminant les cellules-hôtes infectées (Walsh et al., 1994). Cela est permis majoritairement par la création de pores transmembranaires (canaux à ions) dans un processus impliquant les perforines (Khan et al., 2001). Tout comme les souris déficientes en lymphocytes T CD8+, les souris ne comportant pas le gène codant pour les perforines ne survivent pas à une infection par Encephalitozoon cuniculi (Khan et al., 2001).
4.2.1. Régulation des lymphocytes T CD8+ 4.2.1.1. Rôle des lymphocytes CD4+
En temps normal, lors d’infections, les lymphocytes T CD8+ sont activés par les lymphocytes T CD4+ produisant de l’IL-2 (Smith, 1988). Cependant, on a pu voir que les souris déficientes en lymphocytes T CD4+ résistaient tout de même aux microsporidioses (Khan et al., 1999). Une réponse normale des lymphocytes T CD8+ est en effet alors observée. L’infection par Encephalitozoon cuniculi offre ainsi un exemple d’induction des lymphocytes T CD8+ en l’absence de lymphocytes T CD4+ (Khan et al., 2001). Le rôle des lymphocytes T CD4+ lors d’infection par
(Bevan, 2004). Ainsi, il est possible que le rôle des lymphocytes T CD4+ concerne plutôt les phases secondaires de l’infection (Ghosh, Weiss, 2012). Ces informations pourraient alors avoir un impact sur les individus asymptomatiques excréteurs de spores mais également, chez l’Homme, permettre une meilleure prise en charge des patients souffrant de stades avancés du SIDA (Ghosh, Weiss, 2012). De plus, une meilleure appréciation du rôle des lymphocytes T CD4+ permettrait une compréhension plus complète de la réponse immunitaire mise en place pour trouver des stratégie de survie à long terme (Ghosh, Weiss, 2012).
4.2.1.2. Rôle des lymphocytes T γδ
Les lymphocytes T γδ semblent être impliqués dans la mise en place de la réponse immunitaire primaire (Khan et al., 2001). Il a en effet été montré que l’augmentation du nombre de ces lymphocytes, produisant des IFN-γ, est suivie d’une augmentation du nombre de lymphocytes T CD4+ et CD8+ sécrétant à leur tour des IFN-γ (Skeen, Ziegler, 1993). Le nombre de lymphocytes T γδ augmente quelques jours après l’infection par Encephalitozoon cuniculi mais il a été montré que les souris n’en disposant pas, bien que plus sensibles, sont tout de même capables de survivre à l’infection (Moretto et al., 2001). Lors d’infection par Encephalitozoon cuniculi, il semblerait que les cytokines IFN-γ sécrétées par les lymphocytes T γδ jouent un rôle important dans l’activation des lymphocytes T CD8+, de par notamment leur mise en place rapide au début de l’infection (Moretto et al., 2001 ; Ghosh, Weiss, 2012). En effet, les souris déficientes en lymphocytes T γδ montrent une réponse moindre en lymphocytes T CD8+ et ces lymphocytes T CD8+ isolés puis transférés à des souris elles-mêmes déficientes en lymphocytes T CD8+ n’offrent pas de protection contre l’infection (Moretto et al., 2001).
4.2.1.3. Rôle des cellules présentatrices d’antigènes
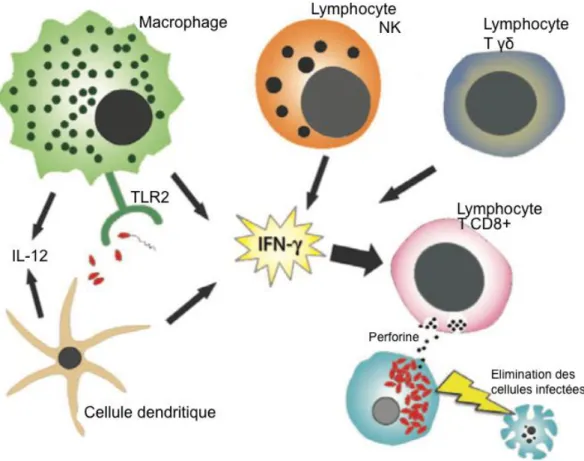
De par leur sécrétion d’IFN-γ , les cellules présentatrices d’antigènes telles que les cellules dendritiques et les macrophages jouent un rôle important dans l’activation des
lymphocytes T CD8+ (Ghosh, Weiss, 2012). Plus particulièrement, la production d’IFN-γ par les cellules dendritiques permet l’activation de la réponse des lymphocytes situés dans le tissu intraépithélial des intestins lors de l’infection par voie orale d’Encephalitozoon cuniculi (Moretto et al., 2007).
Un schéma récapitulatif des processus d’activation des lymphocytes T CD8+ ainsi que leur rôle est proposé en figure 6.
Figure 6: Activation et rôle des lymphocytes T CD8+ dans la réponse immunitaire contre les microsporidies (D'après Ghosh, Weiss, 2012)
Les lymphocytes T CD8+ jouent un rôle primordial dans le contrôle des infections in vivo, le plus probablement par la lyse des cellules hôtes infectées par un mécanisme impliquant la perforine.
T γδ, sécrètent des cytokines (IL-12, IFN-γ) nécessaires à l’activation des lymphocytes T CD8+ dans les premiers stades de l’infection (Ghosh, Weiss, 2012 ; Khan et al., 2001).
4.3. Rôle de l’immunité à médiation humorale
Le transfert de lymphocytes B activés ou de sérum hyperimmun à des souris athymiques ne les protège pas de la mort suite à une infection par Encephalitozoon
cuniculi (Enriquez, 1997 ; Schmidt, Shadduck, 1983). Néanmoins, lors d’une infection
par Encephalitozoon cuniculi, une forte réponse des anticorps se met en place et nombre d’entre eux font des réactions croisées avec d’autres microsporidies (Cox et al., 1979 ; Schmidt, Shadduck, 1983). De plus, il a été montré que les lapereaux nouveau-nés étaient protégés par les anticorps maternels pendant leurs 2 premières semaines de vie (Khan et al., 2001).
Ainsi, il semble que les anticorps limitent l’infection chez l’hôte, bien que clairement insuffisants pour le protéger de la mort ou pour éliminer l’infection (Khan et al., 2001 ; Sak et al., 2006). De plus, bien que les anticorps spécifiquement dirigés contre
Encephalitozoon cuniculi puissent persister dans l’organisme, ils ne protègent pas
l’hôte d’une éventuelle réinfection (Didier et al., 2000).
5. A
UTRES ESPECES CIBLES ET POTENTIEL ZOONOTIQUE 5.1. Plusieurs souches d’Encephalitozoon cuniculiParmi les microsporidies, Encephalitozoon cuniculi possède le panel d’hôtes le plus large chez les mammifères et plusieurs souches ont pu être isolées en se fondant sur une différence subtile au niveau de la région interne transcrite de l’ARN ribosomal : une séquence de 4 bases (5’-GTTT-3’) se répète plus ou moins souvent selon les souches (Didier et al., 2000 ; E. S. Didier et al., 1995).
À ce jour, quatre souches d’Encephalitozoon cuniculi ont ainsi pu être isolées : la souche I, infectant principalement le lapin, la souche II détectée chez la souris, la souche III associée au chien et une 4ème souche détectée en 2010 chez l’Homme lors
d’une greffe de rein (E. S. Didier et al., 1995 ; Didier et al., 2000 ; Talabani et al., 2010). Ces 4 souches peuvent infecter plusieurs espèces d’hôtes en plus de leur hôte principal : la souche I a été détectée chez la souris et l’Homme, la souche II chez le chat et le renard polaire et la souche III chez l’Homme (Didier et al., 2000 ; E. S. Didier et al., 1995).
Des souches indéterminées ont également été détectées dans un large panel de mammifères, dont le rat, le cobaye, le hamster, les bovins et les primates (Didier et al., 2000).
5.2. Encephalitozoon cuniculi chez les autres espèces
5.2.1. Encephalitozoon cuniculi chez les autres animaux
On pourrait supposer que ces différentes souches d’Encephalitozoon cuniculi soient à l’origine des divers degrés de signes cliniques que l’on peut observer chez les espèces hôtes.
En effet, chez le chien et le renard polaire, une infection par Encephalitozoon
cuniculi se manifeste par le développement d’une vasculite, d’une encéphalite
granulomateuse et d’une néphrite (E. S. Didier et al., 1995 ; Snowden et al., 2009). L’infection a le plus souvent lieu chez les chiots nés d’une mère infectée (Snowden et al., 2009). Ils présentent alors principalement des signes neurologiques caractérisés par de la dépression, de l’ataxie, une cécité, de l’hypermétrie et des crises convulsives (Jordan, 2005 ; Snowden et al., 2009). Les lésions rénales sont par ailleurs très marquées, consistant en un aspect anormal de la corticale et de l’architecture de la jonction corticomédullaire avec une accumulation de lymphocytes (Snowden et al., 2009). Des zones de nécrose ou hémorragiques ont parfois été observées (Snowden et al., 2009). Des lésions cérébrales sont également observables et consistent en une encéphalite lymphoplasmocytaire (Snowden et al., 2009). Dans une étude observant
sérologiques menées dans le monde entier ont montré la présence d’anticorps spécifiques à Encephalitozoon cuniculi chez les chiens dans 8 à 38% des cas (Jordan, 2005).
Encephalitozoon cuniculi peut également infecter le chat, des méningoencéphalites et des néphrites interstitielles y sont alors associées. Cependant, ces infections sont rares et peu documentées (Künzel, Fisher, 2018). Malgré tout, ces dernières années, plusieurs cas d’uvéite antérieure et de cataractes associées à la souche II d’Encephalitozoon cuniculi ont été détectés chez le chat (Csokai et al., 2010 ; Benz et al., 2011). Jusqu’à 23% des chats testés sont porteurs d’anticorps dirigés contre Encephalitozoon cuniculi (Jordan, 2005).
Ces différences dans l’expression des signes cliniques semblent plutôt refléter la capacité du système immunitaire de l’hôte à répondre à l’infection par
Encephalitozoon cuniculi qu’à une réelle différence biologique entre les différentes
souches du parasite (E. S. Didier et al., 1995). Par exemple, suite à une infection par la souche III d’Encephalitozoon cuniculi, des vervets adultes (une espèce de primate) ont développé une infection subclinique alors que chez les jeunes, les signes cliniques étaient plus importants et se sont atténués avec l’âge (Van Dellen et al., 1989). L’infection était persistante malgré tout et les lésions liées à Encephalitozoon cuniculi étaient visibles à l’autopsie (Van Dellen et al., 1989).
Contrairement à l’infection chez le lapin qui se révèle être la plupart du temps subclinique, l’infection par Encephalitozoon cuniculi chez le chien, le chat, le renard polaire et le singe est souvent sévère (Wasson, Peper, 2000).
Tout comme chez le lapin, l’infection chez les autres espèces, notamment le chien, semble être favorisée par la vie en groupe (Snowden et al., 2009).
5.2.2. Encephalitozoon cuniculi chez l’Homme
Quatre espèces de microsporidies sont reconnues comme pouvant infecter l’humain. La plus commune est Enterozytozoon bieneusi, atteignant principalement le système digestif, suivie de 3 espèces du genre Encephalitozoon: Encephalitozoon