© Martha Cecilia Alzate, 2018
Caractérisation des infections nosocomiales et
acquises dans la communauté dans certains hôpitaux
en Colombie
Mémoire
Martha Cecilia Alzate
Maîtrise en épidémiologie - avec mémoire
Maître ès sciences (M. Sc.)
CARACTÉRISATION DES INFECTIONS NOSOCOMIALES
ET ACQUISES DANS LA COMMUNAUTÉ DANS
CERTAINS HÔPITAUX EN COLOMBIE
Mémoire
MARTHA CECILIA ALZATE
Sous la direction de:
Yv Bonnier Viger, directeur
Rodica Gilca, codirectrice
Lynne Moore, codirectrice
iii
RÉSUMÉ
Introduction
: Le Ministère de la santé de la Colombie a rapporté l’existence d’un sous-enregistrement important des infections nosocomiales (IN). Cette étude-ci estime la fréquence des IN parmi les patients hospitalisés ; vérifie s’il y a des différences entre la fréquence estimée et celle rapportée au niveau national ; compare les patients selon l’origine d’infection (IN et infections acquises dans la communauté (IAC)) ; et mesure l’impact des types d’infection sur les durées de séjour.Méthodologie
: Cette étude rétrospective est basée sur une banque de données des adultes hospitalisés atteints des infections. Des comparaisons entre la proportion d’IN, estimée à partir de cette banque et celle rapportée au niveau national, et entre les patients atteints d’IN et ceux atteints d’IAC, ont été faites en utilisant le test de la normale et le Khi carré de Pearson. L’association entre la durée de séjours et différentes origines d’infection est estimée par une régression linéaire multiple. L’influence de la typologie d’infection sur les durées de séjour est vérifiée par le calcul de la moyenne et l’intervalle de confiance (IC) à 95 %.Résultats
: La proportion d’IN est estimée à 2,20% (IC: 2,06% à 2,34%) et le taux d’IN à 4,61 par 1000 patients/jour (IC: 4,32 à 4,91). Pendant plus de la moitié des périodes, les proportions d’IN estimées dans l’étude sont supérieures à celles du rapport au niveau national. Par rapport aux patients atteints d’IAC, les patients atteints d’IN sont plus âgés, ont plus de comorbidités, sont hospitalisés plus longtemps et sont plus souvent admis à l’unité de soins intensifs. Les moyennes de séjours sont plus élevées parmi les patients atteints des infections nosocomiales du site opératoire, liées à l’intubation, liées aux cathéters et sondes que parmi les patients atteints d’IAC, mais elle est faite sur une seule année et des biais potentiels auraient pu avoir influencé les résultats.Conclusion
: La participation différentielle des hôpitaux pendant les périodes de surveillance et lesdifférences dans les types de clientèle peuvent expliquer des différences entre cette étude et le rapport national. Les patients atteints d’IN ont présenté plus de facteurs de risque pour une infection par rapport aux patients atteints d’IAC. L’influence du type d’infection sur la durée du séjour doit être interprétée avec prudence.
iv
TABLE DES MATIÈRES
RÉSUMÉ ... iii
TABLE DES MATIÈRES ... iv
LISTE DE TABLEAUX ... vi
LISTE DES FIGURES ... vii
LISTE DES ACRONYMES ... viii
INTRODUCTION ... 1
OBJECTIFS ... 2
CHAPITRE 1 — ÉTAT DES CONNAISSANCES ... 3
1.1 Les infections nosocomiales ... 3
1.1.1 Impact des infections nosocomiales. ... 3
1.1.2 La surveillance globale des infections nosocomiales ... 7
1.1.3 Lignes directrices pour l'évaluation des systèmes de surveillance de la santé publique du CDC 11 1.1.4 Surveillance nationale des infections nosocomiales du Québec ... 13
1.1.5 La surveillance des infections nosocomiales en Colombie ... 16
1.2 Épidémiologie des infections ... 19
1.2.1 Infections acquises dans l’hôpital ... 19
1.2.2 Infections acquises dans la communauté ... 28
CHAPITRE 2 — MÉTHODES ... 31 2.1 Type d'étude ... 31 2.2 Population... 31 2.3 Collecte de données ... 32 2.4 Variables... 36 2.5 Mesure de variables ... 37 2.6 Analyse statistique ... 38 2.7 Éthique et confidentialité ... 42 CHAPITRE 3 – RÉSULTATS ... 43 3.1 Description de la population ... 43
3.2 L’estimation de la proportion d'infections nosocomiales et du taux d'infections nosocomiales ... 43
3.2.1 Proportion des infections nosocomiales selon les IPS et les services ... 45
3.2.2 Proportion des infections nosocomiales selon le site d’infection ... 49
3.2.3 Caractérisation des patients des cliniques del Rio (Buga) et Palmira ... 64
3.3 Différences entre la proportion des infections nosocomiales estimée par cette étude et la proportion des infections nosocomiales rapportée au niveau national. ... 65
3.4 Comparaisons des caractéristiques des adultes hospitalisés atteints d’infection nosocomiale et des adultes hospitalisés atteints d’infections acquises dans la communauté ... 71
v
CHAPITRE 3 – DISCUSSION ... 81
CONCLUSIONS ... 95
ANNEXES ... 96
vi
LISTE DE TABLEAUX
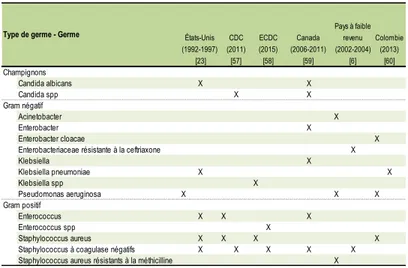
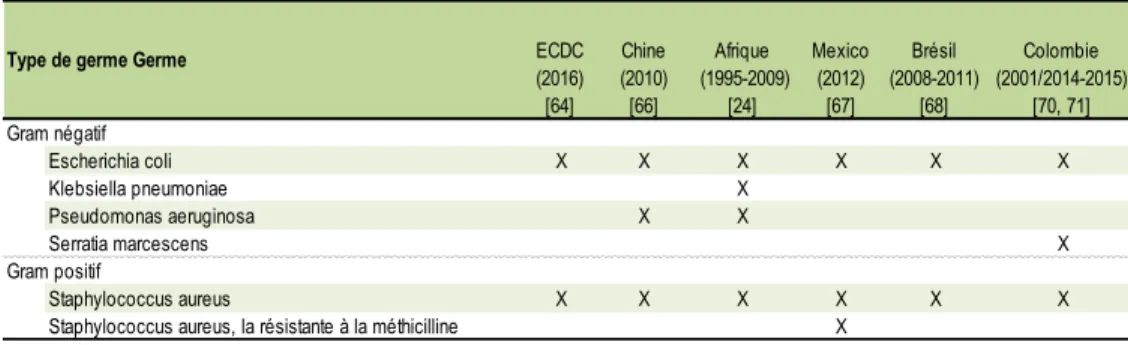
Tableau 1 Germes les plus fréquemment impliqués dans les bactériémies liées aux cathéters, selon la littérature scientifique consultée ... 23 Tableau 2 Germes les plus fréquemment impliqués dans les infections des voies urinaires associées aux cathéters, selon la littérature scientifique consultée ... 24 Tableau 3 Germes les plus fréquemment impliqués dans la pneumonie associée au respirateur, selon la littérature scientifique consultée ... 26 Tableau 4 Germes les plus fréquent impliqués dans les infections du site opératoire, selon la littérature scientifique consultée ... 28 Tableau 5 Données à partir des sources primaires selon les IPS incluses ... 34 Tableau 6 Données à partir des sources secondaires selon les IPS incluses ... 35 Tableau 7 Proportion et taux d’infections nosocomiales chez les patients adultes dans certains IPS de la province de Valle-del-Cauca en Colombie (2006 -2013) ... 44 Tableau 8 Proportion des infections nosocomiales et le taux d’infections nosocomiales pour des patients adultes dans certains IPS de la province de Valle-del-Cauca en Colombie, selon IPS et service (2006 à 2013) ... 46 Tableau 9 Proportion des infections nosocomiales et le taux d’infections nosocomiales pour des patients adultes dans certains IPS de la province de ValledelCauca en Colombie, selon le site de l'infection (2006 -2013) ... 49 Tableau 10 Proportion et taux des infections des voies respiratoires pour des patients adultes dans certains IPS de la province de Valle-del-Cauca en Colombie, selon les IPS et les services (2006 -2013) ... 52 Tableau 11 Proportion et le taux des bactériémies pour des patients adultes dans certains IPS de la
province de Valle-del-Cauca en Colombie, selon les IPS (2006 -2013) ... 55 Tableau 12 La proportion et le taux d’infections des voies urinaires pour des patients adultes dans certains IPS de la province de Valle-del-Cauca en Colombie, selon les IPS (2006 -2013) ... 58 Tableau 13 Proportion et taux d’infections du site opératoire pour des patients adultes dans certains IPS de la province de Valle-del-Cauca en Colombie, selon les IPS (2006 -2013) ... 61 Tableau 14 Moyenne de la proportion des infections nosocomiales rapportée au niveau national par cette étude ... 67 Tableau 15 Comparaison des caractéristiques des patients atteints d’infections nosocomiales avec les patients atteints d’infections acquises dans la communauté ... 72 Tableau 16 Présence des maladies sous-jacentes chez les patients atteints d’infections nosocomiales et les patients atteints d’infections acquises dans la communauté ... 73 Tableau 17 Présence des agents pathogènes chez les patients atteints d’infections nosocomiales et chez les patients atteints d’infections acquises dans la communauté ... 74 Tableau 18 Fréquences d'agents pathogènes isolés selon le nom du site de l'infection ... 75 Tableau 19 Association entre différentes variables et la durée des séjours hospitaliers ... 77 Tableau 20 Durées des séjours hospitaliers pour les infections rapportées dans cette étude, selon les catégories de la typologie des infections ... 79
vii
LISTE DES FIGURES
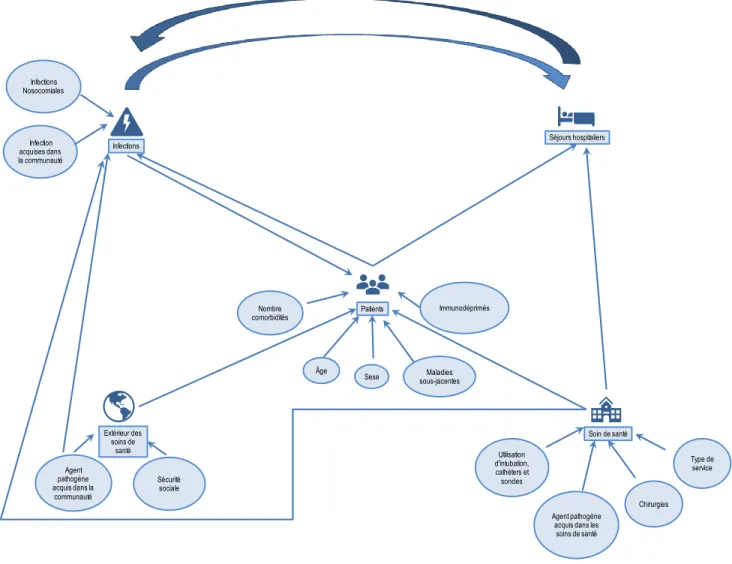
Figure 1 Variables potentiellement confondantes pour l’association entre les infections et les séjours
hospitaliers ... 41
Figure 2 Le processus de sélection des patients pour cette étude ... 44
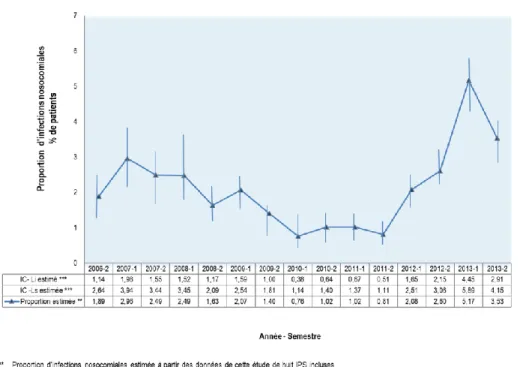
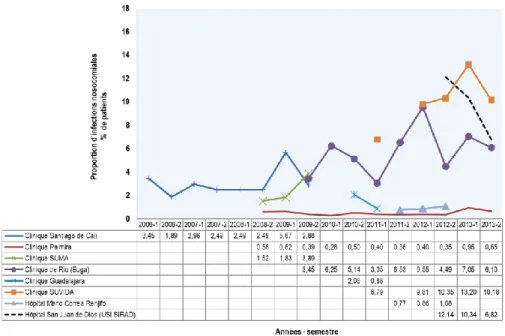
Figure 3 Proportion des infections nosocomiales estimée à partir des données de cette étude (2006-2013) ... 45
Figure 4 Proportion des infections nosocomiales globale estimée à partir des données issues de cette étude, selon les IPS ... 47
Figure 5 Proportions des infections nosocomiales estimées à partir des données issues de cette étude dans les USI, selon les IPS ... 48
Figure 6 Proportion des infections nosocomiales estimée à partir des données issues de cette étude dans les services d’hospitalisation, selon les IPS ... 48
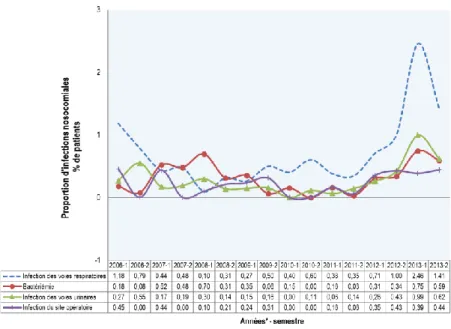
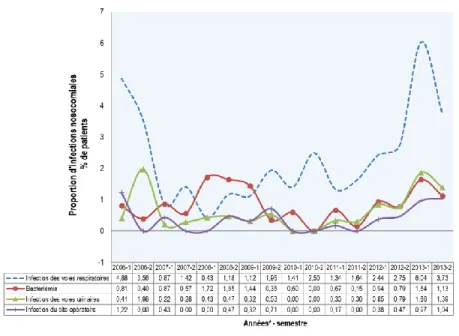
Figure 7 Proportions des infections nosocomiales selon le site d'infection ... 50
Figure 8 Proportions des infections nosocomiales dans le service d’hospitalisation, selon le site d'infection51 Figure 9 Proportions des infections nosocomiales dans le service d’USI, selon le site d'infection ... 51
Figure 10 Proportions des infections des voies respiratoires, selon les IPS ... 53
Figure 11 Proportions des infections des voies respiratoires dans le service d’hospitalisation, selon les IPS ... 54
Figure 12 Proportions des infections des voies respiratoires dans les USI, selon les IPS... 54
Figure 13 Proportions des bactériémies selon les IPS ... 56
Figure 14 Proportions de bactériémies dans les services d’hospitalisation, selon les IPS ... 57
Figure 15 Proportions de bactériémies dans les USI, selon les IPS ... 57
Figure 16 Proportions des infections des voies urinaires globale selon les IPS ... 59
Figure 17 Proportions des infections des voies urinaires dans les services d’hospitalisation, selon les IPS 60 Figure 18 Proportions des infections des voies urinaires dans les USI, selon les IPS... 60
Figure 19 Proportions globales des infections du site opératoire, selon les IPS ... 62
Figure 20 Proportions des infections du site opératoire dans les services d’hospitalisations, selon les IPS 63 Figure 21 Proportions des infections du site opératoire dans les USI, selon les IPS ... 63
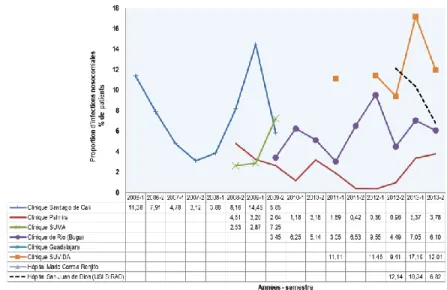
Figure 22 Proportion des infections nosocomiales estimée à partir des données de la présente étude contre celles rapportée au niveau national (2006-2013) ... 66
Figure 23 Proportions des infections nosocomiales rapportées au niveau national par les IPS incluses en comparaison à celle estimée par les données de cette étude (2011-2013) ... 68
Figure 24 Proportions des infections nosocomiales rapportées au niveau national et par cette étude, par les IPS incluses, dans la même période d’analyses (2011-2013) ... 69
Figure 25 Proportions des infections nosocomiales rapportées au niveau national par rapport à l’estimation par les données de cette étude dans la même période d’analyses, parmi les IPS (2011-2013)... 70
Figure 26 Moyenne des séjours hospitaliers parmi les typologies des infections ... 80
viii
LISTE DES ACRONYMES
AMMIQ : Association des médecins microbiologistes et infectiologues du Québec BACC-USI : Bactériémies nosocomiales sur cathéters centraux aux soins intensifs BAC-HD : Bactériémies associées aux accès vasculaires en hémodialyse BAC-SA : Bactériémies à Staphylococcus aureus résistant à la méthicilline BACTOT : Bactériémies nosocomiales pan hospitalières
BGNPC : Bacilles à Gram négatif producteur de carbapénémases CDC : Centers for Disease Control and Prevention
CIM-10 : Classification internationale des maladies version 10 CINQ : Comité sur les infections nosocomiales du Québec DACD : Diarrhées à Clostridium difficile
ECDC : European Centre for Disease Prevention and Control EPS : Entités de la promotion de la santé
ERV : Infections à entérocoques résistants à la vancomycine IAC : Infections acquises dans la communauté
IASS : Les infections associées aux soins de santé IC : Intervalles de confiance
IN : Infections nosocomiales
INS : Institut national de la santé de la Colombie INSPQ : Institut national de santé publique du Québec
IPS : Instituciones Prestadoras de Servicios de Salud-Institutions offrant des services de santé tels que les hôpitaux et les cliniques
MG : Moyenne géométrique
MinSalud : Ministère de la Santé et de la protection sociale de la Colombie MSSS : Ministère de la Santé et des Services sociaux
OMS : Organisation mondiale de la santé OPS : Organisation panaméricaine de santé RMG : Rapports de moyennes géométriques SH : Séjour hospitalier
SPIN : Comité central de surveillance provinciale des infections nosocomiales USI : Unités de soins intensifs
1
INTRODUCTION
Une infection associée aux soins de santé, aussi appelée infection nosocomiale ou hospitalière, est une infection survenant chez un patient pendant le processus de soins dans un hôpital ou un autre établissement de santé [1]. Les infections associées aux soins de santé sont responsables de maladies et de décès, potentiellement évitables, et représentent les événements indésirables les plus fréquents. Leurs impacts, leurs causes et leurs fréquences ont été bien documentés par plusieurs pays [2-9]. Dans les dernières années, leurs impacts ont motivé des organismes internationaux et nationaux à développer des programmes de surveillance pour arriver à les prévenir. À titre d’exemple, en 2005, l’Alliance mondiale pour la sécurité des patients de l’Organisation mondiale de la santé (OMS) a souligné que la surveillance des infections liées aux soins de santé est un élément fondamental pour l’assurance de la sécurité des patients [10]. Parfois, les infections associées aux soins de santé sont retenues comme l’indicateur clé pour évaluer la qualité et la sécurité des soins [4, 10-13].
En Colombie, à partir de l’application de la loi 100 en 1993 [14], plusieurs mandats, circulaires, décrets et lois ont été imposés. Ils ont provoqué des changements importants dans les processus reliés aux soins de santé et de la gestion des institutions offrant des services de santé tels que les hôpitaux et les cliniques, en espagnol IPS (Instituciones Prestadoras de Servicios de Salud). L’indicateur de la proportion des infections nosocomiales, entre autres indicateurs, est devenu une mesure de la détermination de la qualité des soins [15]. Les IPS ont mis en place des stratégies pour développer la surveillance d'infections rapportées chez les patients hospitalisés. Certains IPS effectuent une surveillance avec leurs ressources propres, d’autres demandent l'intervention d'experts dans ce domaine. Cette stratégie a contribué à l'amélioration de la qualité des soins et de la sécurité des patients conformément aux exigences des règlements du pays. Cependant, en 2010, Le Ministère de la Santé et de la Protection sociale de la Colombie (MinSalud) a présenté un rapport diagnostic de la situation actuelle des infections nosocomiales en Colombie dans lequel il a démontré, qu'en dépit de l'actuelle règlementation en ce qui concerne les normes de qualité et d'autonomisation des soins de santé, il existe encore dans le pays un sous-enregistrement important. Les données globales officielles sur la proportion des infections nosocomiales est de 1,6 %, tandis que les différentes études menées dans certains établissements révèlent des chiffres beaucoup plus élevés entre 3,8 % et 4,9 % [8, 9]. En conséquence, notre étude va répondre à deux questions de recherche : 1 – Dans certains IPS en Colombie, quelle est la proportion des infections nosocomiales estimée ? 2 - Y a-t-il une
2
différence significative entre l'estimation de la proportion des infections nosocomiales de certains IPS par rapport aux données nationales ?
La participation d'experts dans le domaine de la surveillance des infections (soit infections nosocomiales ou des infections acquises dans la communauté) dans certains IPS, a généré des bases de données historiques riches en informations. Des données sur les caractéristiques démographiques des patients, le type d’infection, les comorbidités ainsi que les séjours hospitaliers, entre autres, sont prêtes à être explorées. Ces bases sont la source de rapports descriptifs qui ont permis la mise en place de mesures de contrôle ainsi que d’une meilleure connaissance de la gestion des patients. Cette étude-ci va profiter de la base de données de huit IPS situées dans les principales villes du Département du Valle Del Cauca en Colombie, pour répondre aux questions suivantes : 3 - Quelles sont les différences entre les patients adultes atteints des infections nosocomiales par rapport aux patients adultes atteints des infections acquises dans la communauté ? 4- Est-ce que les infections du site opératoire, les infections liées à l’intubation, les infections liées aux cathéters et sondes ont une influence sur les séjours hospitaliers ?
Les résultats de notre étude devraient fournir une base pour améliorer le rapport des indicateurs des IPS jusqu’au niveau national et augmenter la connaissance des patients dans certains IPS de Colombie.
OBJECTIFS
• Estimer la proportion des infections nosocomiales et le taux des infections nosocomiales des patients adultes hospitalisés dans certaines institutions hospitalières en Colombie.
• Vérifier s’il y a des différences entre la proportion des infections nosocomiales estimée par cette étude et la proportion des infections nosocomiales au niveau national en Colombie.
• Comparer les caractéristiques des adultes hospitalisés atteints des infections nosocomiales et des adultes hospitalisés atteints des infections acquises dans la communauté.
• Mesurer l’influence de la typologie d’infection (infections du site opératoire, infections liées à l’intubation, infections liées aux cathéters et sondes) sur les durées de séjour.
3
CHAPITRE 1 — ÉTAT DES CONNAISSANCES
1.1 Les infections nosocomiales
1.1.1 Impact des infections nosocomiales.
L’OMS définit une infection associée aux soins de santé (IASS), aussi appelée infection nosocomiale ou hospitalière, comme une infection survenant chez un patient pendant le processus de soins dans un hôpital ou un autre établissement de santé, une infection qui n'est pas présente ni en incubation au moment de l’admission [1]. Ces infections surviennent pendant un traitement pour des conditions médicales ou chirurgicales. En fait, les IASS sont un processus localisé ou systémique résultant d'une réaction indésirable à la présence d'un agent infectieux ou de ses toxines, qui n'est pas présent ou en incubation lors de l'admission dans l’établissement [3]. Les IASS sont le résultat d’une interaction complexe entre une personne qui reçoit des soins, son environnement de soins et les interventions que ces soins nécessitent [16]. Les IASS sont responsables de maladies et de décès, sont potentiellement évitables et représentent l'événement indésirable le plus fréquent [2, 3]. Lors des dernières années, les IASS ont été documentées dans le monde entier. Leurs impacts ont motivé des organismes internationaux et nationaux à développer des programmes de surveillance pour arriver à les prévenir. Souvent, les IASS sont retenues comme indicateur clé pour évaluer la qualité des soins [4, 10-13].
Les impacts des IASS sont habituellement évalués selon leur fréquence, en raison du grand nombre de patients affectés. Leurs impacts sont aussi mesurés par la mortalité attribuable, les séjours hospitaliers prolongés, les coûts excessifs et d'autres conséquences comme la résistance bactérienne aux antimicrobiens [2, 16, 17]. L’OMS, dans son rapport « Fardeau des IASS dans le monde », décrit les données issues des revues systématiques publiées dans la littérature et portant sur les IASS entre 1995 à 2010. Il ressort de ces résultats que, dans les pays à revenu élevé, l’information dans le domaine national est régulièrement fournie par plusieurs systèmes nationaux et internationaux de surveillance. En revanche, dans les pays à revenu faible ou intermédiaire, seules quelques études nationales sont disponibles, souvent limitées à des établissements isolés. Les données ne sont pas disponibles dans de nombreux pays et certaines régions sont globalement peu représentées. Cette absence d’indicateurs limite les comparaisons
4
interhospitalières et internationales [2]. Au niveau mondial, une enquête de prévalence réalisée sous les auspices de l'OMS dans 55 hôpitaux dans 14 pays a montré qu'une moyenne de 8,7 % des patients hospitalisés contractaient une infection nosocomiale [4]. Le Fonds du « Commonwealth 2011 » a révélé que 8,9 % des patients hospitalisés ont présenté une infection, ce pourcentage variant selon le pays : aux États-Unis 5,3 %, au Canada 9,3 % et en Nouvelle-Zélande 11,9 % [5]. Dans les pays à revenus élevés, la prévalence des IASS parmi les patients hospitalisés variait de 3,5 % à 12 % alors que, dans les pays à revenu faible et intermédiaire, la prévalence des IASS variait de 5,7 % à 19,1 % [2]. En Colombie, des études ont rapporté une proportion des infections nosocomiales entre 3,8 % et 4.9 % [9].
Entre 1995 à 2010, l'OMS a constaté que, dans les pays développés, le taux brut de mortalité associée aux IAAS, a fluctué selon la population et les conditions des patients. Par exemple, en 2007 une étude internationale de prévalence est réalisée dans plusieurs pays (Europe occidentale, Europe de l’Est, Amérique centrale, Amérique du Sud, Amérique du Nord, Océanie, Afrique et Asie). Le taux de mortalité à l’unité de soins intensifs (USI) des patients infectés est plus de deux fois supérieur à celui des patients non infectés (25 % et 11 %, respectivement) [18]. Entre 1990 à 1995, dans deux unités d’USI parisiens (France), les taux de mortalité sont significativement plus élevés chez les patients atteints de bactériémies liées au cathéter, par rapport aux patients sans infections (50 % et 21 %, respectivement) [2, 19]. Selon les résultats d’une étude de prévalence menée dans 17 pays d’Europe occidentale en 1992, le risque de décès en soins intensifs est significativement augmenté en présence d’une pneumonie acquise en USI (Rapport de cote [RC], 1,91, intervalle de confiance [IC] à 95 %, 1,6 à 2,29), d’une septicémie clinique (RC, 3,50; IC à 95 %: 1,71 à 7,18) et de bactériémies (RC, 1,73; IC à 95 %, 1,25 à 2,41) [20]. Entre 2002 à 2004, les auteurs d’une étude réalisée dans des pays à faible revenu (Amérique latine, Asie, Afrique), ont rapporté une mortalité plus élevée chez les patients adultes, principalement à cause des infections des voies urinaires liées au cathéter (38,4 %), des bactériémies liées au cathéter (35,2 %) et de la pneumonie associée à un ventilateur (44,9 %) [6] .
Les coûts économiques attribués aux IASS sont expliqués par les séjours hospitaliers prolongés, les coûts indirects dus à la perte d’emploi, l'augmentation de l'utilisation des médicaments, le besoin d'isolement et l'utilisation de plus de tests de laboratoires et d'autres investigations à des fins de diagnostic [4]. En 2007, dans les pays européens, les IASS ont généré de 15 960 à 201 600 jours d’hospitalisation supplémentaires en USI causés par les bactériémies liées au cathéter et ont augmenté la durée de séjour de 4 à 14 jours [21]. En 2007, au Canada, une hospitalisation prolongée de plus de 7 jours est décrite parmi les patients atteints d’IASS [22]. En 1999, aux États-Unis, la durée moyenne des séjours aux USI est fortement corrélée
5
avec l’incidence des IASS [23]. Entre 1995 à 2010, l’OMS a constaté que, dans les pays à faible revenu, l’augmentation de la durée de séjour associée aux IASS est de 5 à 29,5 jours [2]. En 2001, d’autres études rapportent qu’en Afrique, la durée des séjours hospitaliers est en moyenne de 10 jours plus élevée chez les patients atteints d’IASS [24]. En 2006, au Pérou, les IASS ont été l'un des facteurs les plus influents dans la prolongation des séjours hospitaliers [25]. Entre 2007 à 2008, à Bogota en Colombie, la durée moyenne d'hospitalisation associée à une septicémie développée en milieu hospitalier est en moyenne 20 jours. La durée de séjours variait selon le statut du patient. Pour les patients atteints de septicémie, elle est de 16 jours, pour les patients atteints de septicémie grave elle est de 22 jours et pour les patients ayant présenté un choc septique, elle est de 28 jours [26].
Selon l’OMS, aux États-Unis en 2004, les coûts pour les IASS ont représenté environ 6500 millions de dollars et la pneumonie associée à un ventilateur a coûté entre 10 000 à 25 000 dollars par patient [2]. En 2009, en Europe, les coûts des IASS ont été d’environ 7 000 millions d'euros par an et les bactériémies liées au cathéter ont engendré un coût supplémentaire par épisode évalué entre 4 200 et 13 030 € [2]. Dans les pays en développement en 1992, à Belo Horizonte, au Brésil, le coût des IASS est estimé à 18 millions de dollars [27]. En 2007, dans les USI au Mexique, le coût moyen global d'un épisode d'IASS est de 12 155 de dollars [2]. En 2005, dans les USI en Argentine, les surcoûts globaux des bactériémies liées au cathéter et des pneumonies associées aux soins de santé ont été respectivement de 4 888 et 2 255 de dollars par cas [2]. En 2008, en Argentine, les coûts annuels attribuables à IASS sont de 123 3751 à 1 741 872 dollars. En Équateur les coûts annuels sont de 40 500 dollars. Au Paraguay et Uruguay, les coûts annuels sont de 443 300 dollars et 607 200 dollars respectivement. Ces chiffres représentent entre 10 % et 35 % du coût total de fonctionnement des USI dans les hôpitaux participants [28].
Un autre impact des IASS habituellement évalué est la résistance bactérienne aux antimicrobiens [2, 16, 17]. Les infections résistantes aux antimicrobiens entraînent une augmentation des risques d'invalidité, de décès et une augmentation des coûts considérables. Dans la plupart des cas, les infections résistantes aux antimicrobiens nécessitent des traitements coûteux et entrainent des séjours hospitaliers prolongés et des visites médicales supplémentaires [29]. En 2014, l’OMS produit un premier rapport portant sur la résistance aux antibiotiques, basé sur des données provenant de 114 pays. Il a montré que la résistance au traitement de dernier recours (les carbapénèmes) contre les infections potentiellement mortelles causées par une bactérie intestinale courante, Klebsiella pneumonie, s’est propagée à toutes les régions du monde. De plus, la résistance à l’un des médicaments antibactériens les plus largement utilisé pour le traitement des infections des voies urinaires dues à Escherichia coli – les fluoroquinolones – est très répandue. L’échec du
6
traitement de dernier recours contre la gonorrhée – les céphalosporines de troisième génération – est confirmé en Afrique du Sud, en Australie, en Autriche, au Canada, en France, au Japon, en Norvège, au Royaume-Uni, en Slovénie et en Suède. Le risque de décès est supérieur de 64 % chez les personnes atteintes du Staphylococcus aureus résistant à la méthicilline, comparativement au risque pour les personnes atteintes d’une forme non résistante de l’infection [30].
En 2013, aux États-Unis, le Centers for Disease Control and Prevention (CDC) a estimé que, chaque année, au moins 2 millions de personnes contractent des infections graves en lien avec des bactéries résistantes. Ces infections ont causé au moins 23 000 décès cette année-là. La seule infection à Clostridium difficile a affecté près de 250 000 personnes, 14 000 d’entre elles sont décédées. Les coûts économiques attribués à la résistance aux antibiotiques ont été estimés à 20 milliards de dollars [29]. Aujourd’hui, aux États-Unis, le CDC considère le Clostridium difficile, l’Entérobactériacée résistante au carbapénème et le Neisseria gonorrhoeae résistant aux médicaments, comme de graves menaces pour la santé [29] . Au Canada, le Staphylococcus aureus résistant à la méthicilline, les Entérocoques résistants à la vancomycine et les Entérobactéries productrices de carbapénémases figurent parmi les agents pathogènes de plus en plus courants pouvant causer des infections multirésistantes associées aux soins de santé [31]. Au Canada, entre 1998 à 2005, plus de 3 000 nouveaux cas d’entérocoques résistants à la vancomycine ont été rapportés. En 2009, plus de 2 000 cas confirmés d’infection et plus de 4 500 cas confirmés de colonisation par le Staphylococcus aureus résistant à la méthicilline ont été déclarés au Programme canadien de surveillance des infections nosocomiales. Selon une étude menée au Canada en 2006, les infections causées par le Staphylococcus aureus résistant à la méthicilline coûtent de 42 à 59 millions de dollars par année en frais d’hospitalisation [31].
En Europe, L’European Centre for Disease Prevention and Control (ECDC) a estimé en 2015 que les infections causées par des bactéries résistantes aux antimicrobiens entraînent chaque année environ 25 000 décès [32]. L’ECDC a observé une augmentation de la résistance aux antimicrobiens pour l’Escherichia coli, de 12,6 % en 2013 à 13,1 % en 2015, spécifiquement liée aux céphalosporines de troisième génération et à la résistance combinée (céphalosporines de troisièmes génération, fluoroquinolones et aminoglycosides). Plus de la moitié des isolats d’Escherichia coli sont résistants à au moins un des groupes antimicrobiens sous surveillance régulière, spécifiquement aux aminopénicilliness (57,4 %) [33, 34]. Pendant la même période, le pourcentage de Staphylococcus aureus résistant à la méthicilline est de 13,7 %. La surveillance du Staphylococcus aureus résistant à la méthicilline, reste une priorité de santé publique en Europe. De grandes différences dans les pourcentages nationaux de résistance ont été observées, de
7
1,2 % à 50,5 %. Huit pays sur trente ont signalé des pourcentages de 25 % [33, 34]. La Klebsiella pneumoniae, est la bactérie résistante la plus commune au cours des quatre dernières années (2012-2015) ; plus d'un tiers (34,5 %) des isolats de Klebsiella pneumoniae sont résistants à au moins un des groupes antimicrobiens sous surveillance régulière (céphalosporines de troisièmes génération (25,7 %), fluoroquinolones (24,6 %), aminosides (19,0 %) et carbapénèmes (6,1 %)) [33, 34].
En Amérique du Sud, une étude est effectuée, entre 2001 à 2004, basée sur des données portant sur la résistance aux antibiotiques des laboratoires de référence de huit pays : Argentine, Brésil, Chili, Colombie, Costa Rica, Mexique, Pérou et Venezuela. Selon les résultats de cette étude, la résistance du Staphylococcus aureus à l'oxycilline est passée de 33,6 % en 2000 à 45,2 % en 2004, mettant en garde contre le développement croissant du Staphylococcus aureus résistant à la méthicilline [35]. La résistance du Pseudomonas aeruginosa à la gentamicine est passée de 36 % en 2000 à 40% en 2004, cependant, sa résistance à un autre aminoglycoside, reste stable autour de 25 % [35]. La résistance d’Escherichia coli à la ciprofloxacine est de 17,3 % en 2000 et a augmenté à 33,23 % en 2004 ; sa résistance à la gentamicine est passée de 12,1 % en 2000 et a augmenté à 25 % en 2004. Ces antibiotiques ne sont donc plus suggérés pour le traitement empirique des infections nosocomiales dans lesquelles l'implication d'Escherichia coli est suspectée [35]. La résistance à l'ampicilline-sulbactam de l’acinetobactera est passée de 37,44 % en 2000 à 40,17 % en 2004, et la résistance à pipéracilline-tazobactam de 44,56 % en 2002 à 49,44 % en 2004 [35].
1.1.2 La surveillance globale des infections nosocomiales
Les impacts importants des infections nosocomiales sur les soins aux patients ont motivé les organisations de santé dans le monde à mettre sur pied des lignes directrices sur la surveillance des infections nosocomiales. En 2003, l’OMS a créé le document « Prévention des infections nosocomiales Guide pratique 2e édition», avec l’objectif principal la réduction du nombre d'infections nosocomiales et de leur coût [4]. Au départ, le guide a défini les infections nosocomiales comme étant des infections acquises lors d'un séjour à l'hôpital qui ne se sont pas manifestées ou ne sont pas en période d'incubation au moment de l'hospitalisation du patient. En fait, les infections qui se produisent plus de 48 heures après l’entrée à l’hôpital sont souvent considérées comme nosocomiales [4]. Cependant, selon l’OMS, les changements dans la prestation de services de santé ont entraîné des périodes d'hospitalisations plus courtes et des soins ambulatoires élargis [4]. La définition des infections nosocomiales devient donc plus complexe.
8
Actuellement, la définition des infections nosocomiales proposée par l’OMS est la suivante, « Une infection contractée à l'hôpital, par un patient hospitalisé pour une raison autre que cette infection ; une infection qui survient chez un patient hospitalisé dans un hôpital ou un autre établissement de soins de santé, où l'infection ne s'est pas manifestée ou n'est pas dans la période d'incubation au moment de l'hospitalisation. Les infections contractées à l'hôpital, mais qui se manifestent après la sortie de l'hôpital et les infections professionnelles du personnel de l'établissement »[4]. Finalement, pour arriver à une surveillance opérationnelle des infections, le guide a suggéré des critères de diagnostic simplifiés pour des types des infections qui peuvent être utiles à certains établissements qui n’ont pas accès à des techniques de diagnostic complètes. Ces critères ont été définis pour les infections au site d'une intervention chirurgicale, l’infection urinaire, l’infection respiratoire, l’infection du site d'insertion du cathéter vasculaire et la septicémie [4].
Pour arriver à définir le but principal de la surveillance des infections nosocomiales, l’OMS a d’abord conseillé de sensibiliser tout le personnel hospitalier à la nécessité des actions préventives pour contrer les infections nosocomiales et la résistance aux antimicrobiens ; de surveiller les tendances d’incidence, de prévalence et d’incidence ajustée en fonction du risque des infections nosocomiales ; de créer de nouveaux programmes de prévention ; d’indiquer les points à améliorer lors de la prise en charge du patient; enfin, de mener d'autres études épidémiologiques [4]. D’autre part, l’OMS dans le guide pratique de 2002 a proposé que les systèmes de surveillance des infections nosocomiales répondent à certains critères, comme la simplicité, la flexibilité, l’acceptabilité, la qualité des données, la cohérence, la sensibilité et la spécificité [4]. En effet, la définition de ces critères et la méthodologie à utiliser pour les évaluer ont été publiées, en 1998, et mises à jours en 2001 par le CDC dans leurs lignes directrices pour l'évaluation des systèmes de surveillance [36].
Selon l’OMS, la surveillance est une tâche difficile. Elle nécessite une expertise particulière pour obtenir des données épidémiologiques, évaluer la qualité de l'information produite, interpréter le sens et adapter l'intervention selon les objectifs qui ont été établis au début de la surveillance [2]. Des activités comme l'évaluation des preuves cliniques à partir de la fiche du patient, la réalisation de tests microbiologiques, l'observation directe du site d'infection, l’évaluation plus approfondie des informations cliniques par un médecin spécialiste, entre autres, s’avèrent parfois nécessaire [2]. Toutefois, dans les contextes où les dossiers électroniques des patients et les systèmes automatisés existent, la combinaison de ces informations avec l'utilisation de logiciels ou de bases de données spécifiques simplifie grandement la surveillance. Les dossiers médicaux et infirmiers sont souvent mal organisés et l'accès aux données des
9
laboratoires et des installations radiologiques sont très limités et souvent de faible qualité. En outre, dans les pays à faible et moyen revenu, le manque d'expertise dans le domaine de la prévention et du contrôle des infections, le manque de personnel, le surpeuplement et les ressources financières limitées constituent de réelles contraintes à la performance de la surveillance [2].
L’OMS a suggéré des méthodes de surveillance comme la surveillance passive basée sur les données de laboratoire, l’information extraite du dossier médical après la sortie de l'hôpital et la notification des infections par les médecins ou les membres du personnel infirmier [4]. Cependant, cette méthodologie nous informe seulement du nombre de patients infectés et ne fournit que des informations limitées qui peuvent être difficiles à interpréter [4]. La surveillance passive est moins exigeante, mais peut être la seule possibilité en fonction des ressources disponibles dans l'institution [2].
Une autre des méthodes recommandées est la surveillance active des infections, effectuée par un personnel formé, généralement des professionnels du contrôle des infections. Ceux-ci recherchent des preuves pour répondre aux critères de diagnostic normalisés de l'infection, en utilisant une variété de sources de données [2]. La surveillance active prospective surveille des indicateurs présélectionnés chez les patients hospitalisés, selon un protocole spécifique. Dans certains cas, elle peut être étendue à la période suivant la sortie du patient. La surveillance active rétrospective repose sur des données de routine préalablement enregistrées après la sortie du patient et, par conséquent, des informations pertinentes peuvent être manquantes et certains critères diagnostiques non remplis [2]. La surveillance active peut être orientée vers les infections fréquentes avec un grand effet sur la mortalité, la morbidité et les coûts. Les champs de priorité communs sont la pneumonie associée à l'utilisation d'un respirateur, les infections du site d'une intervention chirurgicale, les bactériémies liées aux cathéters ainsi que le suivi des bactéries résistantes qui est effectué principalement par le laboratoire. La surveillance active peut être orientée vers les unités selon le risque, telles que les soins intensifs, l'intervention chirurgicale, l'oncologie, les brûlures, la néonatologie, entre autres [4].
Les études de prévalence et d’incidence font également partie de la surveillance active. Les études de prévalence nécessitent l'observation de tous les patients en une seule journée pour identifier les patients infectés. En fait, une équipe de chercheurs rend visite à chaque patient de l'hôpital, examine l'historique clinique, interroge le personnel clinique et recueille des données sur les facteurs de risque. D’autre part, les études d’incidence nécessitent l'observation de tous les patients sur une période donnée. Ce type de
10
surveillance fournit les taux d'attaque, les incidences cumulées et les taux d'incidence. Toutefois, cette surveillance active nécessite une plus grande charge de travail, prend plus de temps et coûte plus cher [4].
Le taux des infections nosocomiales chez les patients d'un établissement devient un indicateur de la qualité et de la sécurité des soins [4]. À cet effet, en 2005, l'Alliance mondiale pour la sécurité des patients de l’OMS a proposé à tous les pays le « Défi mondial pour la sécurité des patients 2005-2006 » [10]. En fait, les objectifs de l’initiative consistent à sensibiliser à l'impact des infections nosocomiales sur la sécurité des patients et à promouvoir des stratégies de prévention dans tous les pays du monde [10]. En conséquence, l’OMS a développé plusieurs initiatives sur la sécurité des patients : décrire la taxonomie de la sécurité des patients ; définir un programme de recherche global ; développer des systèmes de notification et trouver des solutions [10]. Ainsi, la surveillance active est privilégiée comme méthode de surveillance des infections associées aux soins de santé. Par exemple, en 2010 l’Organisation panaméricaine de santé (OPS) a publié le document «Surveillance épidémiologique des infections associées aux soins de santé » dans l'intention de renforcer la capacité des services de santé et des gouvernements locaux et nationaux à identifier les épidémies et à connaître le fardeau de la maladie générée par les infections associées aux soins de santé [37]. Une surveillance active, sélective et prospective centrée sur le patient est proposée. Les infections visées ont été les infections associées aux soins intensifs et celles associées à des procédures invasives, les infections hospitalières associée à un appareil, c’est-à-dire, les pneumonies associées à un ventilateur mécanique, les infections d'un cathéter associé à un tractus urinaire et les bactériémies liées aux cathéters [37].
En 2011, l’OMS a publié le « Rapport sur le fardeau des infections endémiques liées aux soins de santé dans le monde ». Ce rapport présente les preuves disponibles dans la littérature scientifique sur le fardeau endémique des différents types des infections liées aux soins de santé, ainsi qu’une évaluation des différences épidémiologiques entre les pays selon les revenus [2]. Les types des infections visées ont été l’infection des voies urinaires associée aux soins de santé, l’infection du site opératoire, la pneumonie associée au respirateur et les bactériémies liées aux cathéters. Les données présentées dans le rapport ont été compilées à partir des revues systématiques d'études publiées dans la littérature scientifique de 1995 à 2010 [2]. Ce rapport a trouvé que, dans les pays à revenu élevé, des systèmes nationaux de surveillance existent et les données sont généralement disponibles dans des rapports nationaux ou des études multicentriques publiées dans la littérature scientifique [2]. Selon ce rapport, l’ECDC a signalé que 46,4 % (13/28) des pays européens disposaient de systèmes de surveillance. Aux États-Unis, plus de 3 000 établissements de santé rapportent régulièrement des données sur les infections contractées en soins
11
intensifs au Réseau national de sécurité des soins de santé. D'autres pays à revenus élevés, tel que l'Australie, la France, l'Allemagne et le Japon ont une surveillance coordonnée au niveau national. La revue de la littérature a aussi identifié 55 études de portées nationales, menées pour la plupart dans des pays où un système national de surveillance est en place [2]. Par contre, dans les pays à revenus faibles et intermédiaires, l’absence de systèmes de surveillance nationaux empêche considérablement toute tentative d'estimation du fardeau de l’infection associée aux soins de santé au niveau national ou régional. Seulement 15,6 % (23/147) des pays en développement ont rapporté un système de surveillance national fonctionnel en 2010 ; 66 % (97/147) des pays en développement n’ont publié aucune donnée sur la surveillance des infections liées aux soins de santé [2]. De plus, la plupart des études ont été menées dans des hôpitaux (144/276), qui représentent un type spécifique de contexte et non le large éventail de milieux de soins en place dans ces pays [2].
1.1.3 Lignes directrices pour l'évaluation des systèmes de surveillance de la santé publique du CDC
En 1998, le CDC a publié des lignes directrices pour l'évaluation des systèmes de surveillance, dans le but de promouvoir une meilleure utilisation des ressources de la santé publique [36]. En 2001 ces lignes directrices ont été mises à jours pour permettre d’intégrer les systèmes d’information sanitaires, d’établir des normes sur la collecte des données et de faciliter la réponse de la santé publique aux menaces sanitaires émergentes [36]. Selon ces lignes directrices, la collecte, l'analyse, l'interprétation et la diffusion systématique de données liées à un événement de santé doivent être documentées par la santé publique. Cette surveillance permet la mise en place d’activités de santé publique pour réduire la morbidité et la mortalité de la population [36]. Par exemple, la surveillance des maladies infectieuses, chroniques ou zoonotiques ; l'exposition aux blessures et aux substances toxiques ; et d'autres événements supervisés associés à une action de santé publique [36].
La méthodologie d’évaluation d'un système de surveillance de la santé publique, proposée par le CDC, commence par un engagement des parties prenantes dans l'évaluation. Par exemple, les personnes ou organisations qui utilisent des données pour la promotion de modes de vie sains, la prévention et le contrôle des maladies, etc. [36]. Deuxièmement, il faut indiquer l'importance du système dans la santé publique, le but, le fonctionnement et les ressources. Par la suite, il faut indiquer l'évaluation qui est la description de l'objectif de l'évaluation, l’identification des parties intéressées, les résultats, l’utilisation des résultats et les
12
questions à répondre. La dernière étape est de déterminer les normes d'évaluation des performances du système, afin de clarifier les rôles et les responsabilités parmi ceux qui mettent en œuvre l'évaluation [36].
Selon le CDC, une évaluation des systèmes de surveillance de la santé publique devrait inclure une évaluation des attributs du système, comme : la simplicité, la flexibilité, la qualité des données, l'acceptabilité, la sensibilité, la valeur prédictive positive, la représentativité, la ponctualité, et la stabilité [36]. Les trois premiers attributs visent l’évaluation de la fonctionnalité du système. Les systèmes de surveillance devraient être aussi simples que possible, tout en respectant leurs objectifs (simplicité). Par exemple, un système de conception simple est un système qui a une définition de cas facile à appliquer et dans lequel la personne qui identifie le cas sera également celle qui analyse et utilise l'information[36]. Un graphique schématique du système qui décrit les lignes de réponse dans un système de surveillance peut donc être pratique pour évaluer la simplicité ou la complexité du système [36]. La flexibilité fait référence à un système qui peut être adapté à l'évolution des besoins d'information ou aux conditions d'exploitation avec peu d’heures supplémentaires, de personnel ou de fonds attribués. Par exemple, des systèmes flexibles peuvent s'adapter à de nouveaux événements liés à la santé, à des changements dans les définitions de cas ou de technologie et à des variations dans les sources de financement ou les rapports. De plus, les systèmes qui utilisent des formats de données standard peuvent être facilement intégrés à d'autres systèmes. L’évaluation du système peut être rétrospective en documentant comment le système a répondu aux nouvelles demandes [36]. La qualité des données réfère à l'intégrité et à la validité des données enregistrées dans le système de surveillance. Par exemple, la fréquence de non-réponses ou de valeurs manquantes est une mesure simple pour évaluer le système. Toutefois, une évaluation complète de la qualité des données du système demande parfois des études spécialisées [36].
Les trois prochains attributs visent l’évaluation de la précision du système. L'acceptabilité est un attribut largement subjectif qui englobe la volonté des personnes qui fournissent au système des données précises, cohérentes, complètes et opportunes. Les points d'interactions entre le système et ses participants doivent être pris en compte pour l’évaluation de l’acceptabilité. Des mesures comme : le pourcentage de formulaires complets, le pourcentage de questions rejetées ou incomplètes, l’évaluation de l'intégrité des formulaires, le taux de rapport du médecin, du laboratoire ou de l'hôpital, la rapidité à laquelle les rapports des données sont soumis, entre autres, sont souvent utilisés [36]. La sensibilité peut être considérée, comme la proportion de cas détectés par le système. Elle peut référer à la capacité de détecter les épidémies et les changements dans le nombre de cas au fil du temps [36]. La mesure de la sensibilité du système de surveillance exige une collecte ou un accès à des données généralement externes au système pour
13
déterminer la fréquence réelle de la maladie dans la population sous surveillance. Une revue de la littérature peut être utile pour déterminer les mesures de sensibilité [36]. La valeur prédictive positive est la proportion de cas déclarés qui sont réellement liés à l'événement de santé sous surveillance. L’accent de l’évaluation est donc mis sur la confirmation des cas. Il est nécessaire d'enregistrer le nombre d'enquêtes sur les cas rapportés et la proportion de personnes déclarées qui ont réellement eu l'événement lié à la santé sous surveillance. Cependant, un examen des données externes au système, comme les dossiers médicaux et de laboratoire et les certificats de décès, entre autres, peut être nécessaire pour confirmer les cas [36].
Les trois derniers attributs visent l’évaluation de la fiabilité du système. La représentativité est la capacité du système à décrire la survenue d'un événement lié à la santé en fonction du temps et de sa répartition dans la population selon le lieu et la personne. La représentativité peut être examinée au moyen d'études spéciales visant à identifier un échantillon de tous les cas [36]. La ponctualité reflète la rapidité à déployer les étapes d'un système de surveillance. La ponctualité doit être évaluée en termes de disponibilité de l'information pour le contrôle d'un événement lié à la santé [36]. La stabilité fait référence à la capacité de collecter, gérer et fournir les données correctement sans défaillance et la capacité du système à être opérationnel lorsque cela est nécessaire. Une approche utile de l'évaluation pourrait consister à évaluer la stabilité en fonction du but et des objectifs du système [36].
1.1.4 Surveillance nationale des infections nosocomiales du Québec
Qu’en est-il du système de surveillance des infections nosocomiales et des risques infectieux dans les milieux de soins au Québec ? En 1997, l’Association des médecins microbiologistes et infectiologues du Québec (AMMIQ) a mis sur pied un réseau de surveillance des infections nosocomiales appelé Comité de surveillance provinciale des infections nosocomiales (SPIN). Puis, en 1999, l’AMMIQ participa avec le Ministère de la Santé et des Services sociaux (MSSS) à la création du comité sur les infections nosocomiales du Québec (CINQ) [16]. Le groupe SPIN alors est devenu un sous-comité du CINQ. Le CINQ a pour mandat de fournir une expertise scientifique sur la prévention et le contrôle des infections acquises en milieu hospitalier [16]. Depuis 2001, le CINQ est rattaché à l’Institut national de santé publique du Québec (INSPQ). Dans la même année, la nouvelle Loi sur la santé publique confirmait les maladies infectieuses comme une menace à la santé de la population. La responsabilité a donc été assignée au ministre de la santé et aux directeurs de santé publique d’assurer la surveillance des infections
14
nosocomiales dans le cadre de leurs responsabilités de protection [16]. Pendant un certain temps la responsabilité de la surveillance des infections nosocomiales n’est pas précisée comme telle. Il y a donc eu un flou et les activités de surveillance des infections nosocomiales par la santé publique sont effectuées de façon variable dans les diverses régions du Québec. Puis, en 2003, le Programme national de santé publique 2003-2012 publié par le MSSS, a défini des objectifs pour les infections nosocomiales, soit de réduire de 15 % l’incidence moyenne annuelle des infections nosocomiales, d’empêcher la transmission des bactéries ayant une résistance multiple aux antibiotiques et de réduire la résistance aux antimicrobiens en ce qui concerne les infections à Staphylococcus aureus résistant à la méthicilline (SARM) [16].
En 2004, l’éclosion de Clostridium difficile au Québec est l’élément déclencheur au niveau du ministère, du directeur national de santé publique, ainsi que des directeurs régionaux, d’une prise de conscience de la vulnérabilité du réseau face aux infections nosocomiales, en lien avec un manque de ressources humaines compétentes dans le domaine et des carences dans la surveillance, la prévention et le contrôle des infections [16]. Ainsi, au début de l’année 2005, le ministre de la Santé annonçait un soutien financier et mettait en place un Comité d’examen sur la prévention et le contrôle des infections nosocomiales. Dans le rapport « Aucoin » publié en 2005 par ce Comité, on trouve des recommandations qui ont été formulées pour clarifier les responsabilités des différents acteurs du système de santé, de même que leur autorité et leur imputabilité face à la prévention et au contrôle des infections nosocomiales [16].
Le MSSS, suite aux recommandations issues du rapport Aucoin, a mis en marche des plans d’action pour la promotion et le contrôle des infections nosocomiales pour les années 2006 à 2009, 2010 à 2015 et 2015 à 2020 [13, 38]. Chaque nouveau plan d’action est ajusté en fonction des expériences et des connaissances acquises à la suite de l’application des actions de surveillance des infections du plan précédent. En effet, le plan d’action de 2015 à 2020, publié en 2015, propose comme première étape de poursuivre, consolider et développer la surveillance des infections nosocomiales à l’aide d’un programme national structuré. Ce plan propose comme deuxième étape de documenter périodiquement les facteurs pouvant expliquer les variations de l’incidence des infections nosocomiales [39], établir des critères de priorisation des infections, maintenir à jour des indicateurs, définir et mettre en place les mécanismes d’assurance qualité des données et mener des études sur les facteurs associés aux établissements, etc. [39].
Au niveau plus opérationnel, pour l’ensemble des établissements de santé et de services sociaux du Québec, en 2017, le MSSS a présenté un document de mise à jour du Cadre de référence sur la prévention
15
et le contrôle des infections nosocomiales qui est publié en 2006 [40]. Le Cadre a pour but de soutenir l’ensemble des établissements de santé dans l’élaboration et la mise en œuvre de la prévention et du contrôle des infections nosocomiales. Il est conçu afin d’orienter les établissements tout en respectant leur autonomie et leur responsabilité dans le choix des priorités d’action et des structures nécessaires à la concrétisation ou à l’actualisation d’un tel programme. Ainsi, les activités du programme de prévention et de contrôle des infections nosocomiales peuvent différer de façon assez importante selon les établissements [40]. Des attentes en surveillance envers les équipes sont d’adhérer au volet obligatoire des programmes de surveillance nationaux, de répondre à leurs exigences définies dans les protocoles et d’assurer la mise en place des recommandations du CINQ. Les attentes envers les gestionnaires sont de s’assurer de connaître les coûts annuels et l’impact des infections sur les services, afin de prévoir les investissements nécessaires à la prévention et au contrôle des infections, etc. [40].
À ce jour, il existe deux comités d’experts autonomes rattachés à l’INSPQ, le CINQ et le SPIN. Le CINQ est un comité d’experts qui a pour champ d’intérêt tout dossier dans le domaine de la prévention et du contrôle des infections nosocomiales [41]. Le CINQ a défini les infections nosocomiales comme des « infections acquises au cours d’un épisode de soins administrés par un établissement du réseau de la santé, quel que soit le lieu où ils sont administrés ». Ces infections touchent ainsi les patients de tous les milieux de soins [41]. En bref, le mandat du CINQ est de discuter, commenter et recommander tout ce qui est en lien avec les activités de prévention et de contrôle de la surveillance des infections nosocomiales. II a pour mission d’identifier les priorités, d’émettre des recommandations et des avis scientifiques, d’identifier des sujets de recherche, de soutenir le développement des programmes, de collaborer à l’analyse des données et de collaborer à la formation continue des équipes [41]. Le SPIN soutient l’INSPQ dans l’élaboration et le maintien du programme. Le SPIN a reçu le mandat de discuter, commenter et recommander tout ce qui a trait à la surveillance des infections nosocomiales au Québec, comme de suivre l’incidence des infections nosocomiales; déterminer les principales causes, les facteurs de risques et les principaux agents pathogènes; offrir une méthodologie commune et des outils de surveillance et d’analyse normalisés ; évaluer les mesures actuelles ou nouvelles de prévention ; planifier les priorités pour la surveillances nationale ; renseigner les professionnels en prévention des infections ; et promouvoir la surveillance des infections nosocomiales [42].
L’INSPQ a développé sept programmes provinciaux obligatoires de surveillance pour les établissements ciblés. Ses programmes assurent respectivement la surveillance des bactériémies nosocomiales panhospitalières (BACTOT), la surveillance des bactériémies nosocomiales sur cathéters centraux aux
16
soins intensifs (BACC-USI), la surveillance des bactériémies associées aux accès vasculaires en hémodialyse (BAC-HD), la surveillance des bactériémies à Staphylococcus aureus résistant à la méthicilline (BAC-SA), la surveillance des diarrhées à Clostridium difficile (DACD), la surveillance des infections à bacilles à Gram négatif producteur de carbapénémases (BGNPC) et la surveillance des infections à entérocoques résistants à la vancomycine (ERV) [42]. Des protocoles et des rapports de surveillance périodiques pour chacun des programmes sont disponibles sur le site web de l’INSPQ. Il s’y trouve également un accès pour la saisie de données à partir d’un Système d'information pour la surveillance provinciale des infections nosocomiales qui permet l’entrée des données reliées à la surveillance des cas dans les centres hospitaliers du Québec [42].
1.1.5 La surveillance des infections nosocomiales en Colombie
En 1993, la loi 100 de la République de la Colombie créa le système général de sécurité sociale (SGSSS). Le but principal visait « à garantir les droits inaliénables de la personne et de la communauté à obtenir une qualité de vie en accord avec la dignité humaine, en la protégeant des contingences qui l'affectent »[14]. Cette loi a provoqué des changements importants dans les processus reliés aux soins de santé. Par exemple, la loi 100 de 1993 a permis la mise en œuvre du système général de sécurité sociale en santé où les centres hospitaliers ont la possibilité d'avoir une personnalité juridique, une autonomie administrative et un patrimoine indépendant [14]. La Loi attribue le nom d’Instituciones Prestadoras de Servicios de Salud (IPS) aux établissements offrant des services de santé tels que les hôpitaux et les cliniques. Cette autonomie permet aux IPS d’établir des contrats avec les entités de la promotion de la santé (EPS) pour les soins de santé de leurs membres ; les EPS sont les entités chargées de l'affiliation et de l'inscription des membres et de recueillir leurs primes [14]. Les EPS peuvent couvrir l'affiliation de la population au régime contributif ou subventionné. Les membres du régime contributif sont les personnes qui sont embauchées par contrat de travail, les fonctionnaires du système public, les retraités, les travailleurs indépendants et leurs groupes familiaux [14]. Les membres du régime subventionné sont des personnes pauvres et vulnérables et leurs groupes familiaux sont incapables de contribuer [14]. Un autre exemple, l’application du décret 2309 de 2002 et de la résolution 1446 de 2006 a eu comme résultat la mise en place du système obligatoire d'assurance de la qualité des soins de santé, ainsi que du système d'information pour la qualité des soins de santé. Dès lors, plusieurs indicateurs ont été définis, pour faciliter le suivi du système, comme le taux d’infections hospitalières, entre autres [15]. Le taux d’infections hospitalières est défini comme «
17
l'incidence des infections qui apparaissent à l'intérieur de l'hôpital ou du milieu de soins, qui compliquent les processus de soins ambulatoires ou hospitaliers » [43].
D’autre part, dans les années 90, certaines institutions de santé renforcent leurs comités d'infection, ainsi que la surveillance locale des infections associées aux soins de santé (IASS) et la résistance aux antimicrobiens. En fait, l'Institut national de la santé (INS), en 2004, a commencé la surveillance des microorganismes résistants ayant un fort impact dans la communauté [12] . En 2006, Minsalud, par le décret 3518, a créé et réglementé le système de surveillance de la santé publique (Sivigila), pour fournir de manière systématique et opportune des informations sur la dynamique des événements qui affectent ou peuvent affecter la santé de la population, afin de guider les politiques et les planifications de la santé publique. Ce décret a doté d’outils les institutions pour développer des systèmes de surveillances des événements internes en santé [44]. Puis, en 2008, MinSalud a commencé un processus de documentation et de gestion pour renforcer la surveillance avec le développement du «Modèle de surveillance de la santé publique des médicaments et la résistance bactérienne» qui a intégré les IASS comme événements d'intérêt national [12]. Ainsi, en 2009, l'Université nationale de Colombie a conçu la proposition d'un «Plan stratégique pour la création du Réseau national de surveillance, de prévention et de contrôle des IASS et de la résistance aux agents antimicrobiens, 2010-2014» qui a pour but de soutenir la formulation de politiques nationales pour la prévention et le contrôle de ces événements [12].
En 2011, MinSalud a défini un système d'information pour la qualité et a mis en place des indicateurs obligatoires d'assurance qualité des soins de santé [43]. Dans la même année, l'Observatoire de la qualité des soins de santé est créé. Sa gestion est basée sur un travail conjoint entre agences et institutions pour faciliter l'accès et l'échange d'informations. L'observatoire de la qualité organise, structure et génère des informations pour gérer les connaissances et diffuser les résultats [45]. Les années suivantes plusieurs règlements ont été adoptés, pour intégrer l’information générée par les registres, les observatoires et les systèmes de surveillance nationaux (Sivigila), avec l'observatoire national de la santé du INS et le Système d'information sur la santé et la protection sociale (SISPRO) [45]. À partir de l’année 2016 avec l’application de la Résolution 256 émise par MinSalud, les indicateurs pour le système obligatoire d'assurance de la qualité des soins de santé qui touchent les infections nosocomiales deviennent plus spécifiques comme : la discrimination du taux d’infection par la pneumonie associée à un ventilateur mécanique, l’infection d'un cathéter urinaire et la bactériémie associée au cathéter [46].
18
En conséquence, les infections nosocomiales ont commencé à devenir une priorité dans la gestion administrative du service de santé. De plus, la République de Colombie a mis en place le décret 4109 en 2011, par lequel la nature juridique de l'Institut national de la santé de la Colombie (INS) est modifiée. Il est devenu un Institut scientifique et technique, doté d’une personnalité juridique, d’une autonomie administrative et d’un patrimoine propre, rattaché au MinSalud [47]. L’INS, en 2011, a mis en place une étude pilote sur la mise en œuvre des stratégies de surveillance des infections associées aux dispositifs, de la résistance et de la consommation d'antibiotiques, dans 10 établissements de santé de haute complexité du pays [3] . L’INS a trouvé que le degré de développement des programmes de prévention et de contrôle des infections associées aux soins de santé est hétérogène [3]. La connaissance du problème de ces infections et de la résistance bactérienne est considérée comme sectorisée et liée aux investigations des groupes de travail indépendants situés dans les régions les plus peuplées du pays, ce qui rend difficile une réelle approche de la situation nationale [3]. En bref, les données présentées dans l’étude reflètent la nécessité de mettre en œuvre la surveillance au niveau national. Cette étude a cependant permis une amélioration des outils pour suivre les IASS qui renforceront le Système national de surveillance de santé publique (Sivigila), la détection en laboratoire de microorganismes émergents d'importance hospitalière, ainsi que l'adoption d'actions gouvernementales et institutionnelles pour la prévention et le contrôle des infections, la prévention de la résistance et la promotion de l'utilisation prudente des antibiotiques [3].
Ainsi, MinSalud avec l’application de la circulaire 45 de 2012, a demandé à l’INS et à toutes les autres institutions de services de santé d’appliquer des stratégies de surveillances des infections associées à des soins de santé (IASS), de la résistance et de l’utilisation d'antimicrobiens. MinSalud a défini les IASS comme « des infections que le patient acquiert pendant qu'il reçoit un traitement médical ou chirurgical, sans que l'infection ne se soit manifestée ou soit dans la période d'incubation au moment de l'admission dans l'établissement. Ces infections peuvent survenir dans n'importe quel milieu hospitalier, de soins ambulatoires, milieu de soins chroniques et centre de réhabilitation, entre autres » [48]. MinSalud a déterminé que l’INS est l’unique institution autorisée pour la collecte des informations nécessaires au développement des stratégies de la surveillance des IASS et de la mise en place des protocoles [48].
En 2012, l'INS a basé sa stratégie de surveillance sur les événements prioritaires associés aux IASS, comme l’infection associée aux dispositifs, la résistance aux antimicrobiens et la consommation d'antibiotiques. Cette stratégie se déploie dans les USI adulte, pédiatrique et néonatale [49]. Les infections associées aux dispositifs comprennent la pneumonie associée à un ventilateur mécanique, l’infection d'un cathéter urinaire et la bactériémie associée à un cathéter [50]. La résistance aux antimicrobiens est définie
19
selon les protocoles distribués par l’INS [17]. Les antibiotiques sous surveillance sont: Ceftriaxone, Ciprofloxacin, Imipenem, Meropenem, Piperacillin, Tazobactam et Vancomycin [51].
Les événements sous surveillance sont les infections associées aux procédures chirurgicales, en particulier l’herniorraphie avec maille, l’appendicectomie, la césarienne, la revascularisation myocardique, la cholécystectomie. Les IPS visées sont de complexité faible, moyenne et élevée [52]. L’INS en coordination avec MinSalud a mis en œuvre les normes pour la surveillance des IASS en Colombie. Ils ont développé des protocoles pour chacun des événements prioritaires de surveillance. De plus, ils ont développé une application web pour la notification des cas d’IASS, ainsi que l’intégration des sources d’information du système de surveillance SIVIGILA et la base de données de microbiologie WHONET [49].
En Colombie, la mise en place du système d’information en santé avance lentement, dans un premier bilan de la qualité du système d’information national est effectué entre 2006 et 2009, la proportion d’institutions qui rapportent au système de surveillance national est passée de 16,2 % au 2e semestre de 2006 à 25,5 % au 1er semestre de 2009 [53]; Il a apporté une amélioration dans la qualité des données nationales, le pourcentage d'incohérence étant passé de 9,2 % au 2e semestre de 2007 à 5,5 % au 1er semestre de 2009 [53]. de plus, en 2011, les auteurs d’une étude sur le Système d'information dans le secteur de la santé en Colombie concluaient que le système d'information sanitaire colombien est fragmenté et qu’il a besoin de mécanismes de capture de l'information simples et standardisés [54].
1.2 Épidémiologie des infections
1.2.1 Infections acquises dans l’hôpital
Comme nous l’avons discuté, au début de ce document, les IASS sont le résultat d’interactions complexes entre une personne qui reçoit des soins, son environnement de soins et les interventions que ces soins nécessitent [16]. De nombreux facteurs favorisent l'infection chez les patients hospitalisés : la diminution de l'immunité des patients, la variété de procédures médicales, la transmission de bactéries résistantes aux antibiotiques et la mauvaise pratique de contrôle des infections [4]. Les facteurs liés à l’hôte sont